서 론
최근 건강한 삶에 대한 욕구가 증가함에 따라 식품의 웰빙화, 건강 기능성 식품의 소비 증가와 같은 식생활 문화가 변화하고 있어 기능성 식품산업에 대한 수요와 시장이 확대되고 있다(Woo et al., 2017). 또한, 현대인들 이 건강 및 자가면역에 대한 관심이 증가하면서 인체독 성을 가지고 있는 합성물질보다 식물성 식품에서 유래된 천연 색소물질, 폴리페놀류, 미네랄 등 건강관리 식품에 대한 수요 또한 높아지고 있다(Han et al., 2004;Rho et al., 2013;Kim et al., 2020).
치커리(Cichorium intybus L.)는 국화과에 속하며 전세 계에서 재배되고 있다(Perovića et al., 2021). 고대 이집 트에서는 치커리는 약재나 커피대체제 등으로 재배되었 고, 우리나라에서는 치커리 잎은 쌈채소, 뿌리는 차로 섭 취해왔다(Hong et al., 1998;Wang & Jian, 2011). 치커 리에는 쓴맛을 내는 인티빈이 혈관을 강화해주고 소화를 촉진해준다고 알려져 있으며, 치커리 잎에는 비타민 A와 C, 칼륨, 칼슘, 인 등이 함유되어 있어 비타민과 무기질 의 좋은 공급원으로 보고되었다(Khalaf et al., 2018;Choi et al., 2020). 치커리에는 항염증, 항고지혈증, 항당 뇨, 항암, 항균, 면역증진 효과 등이 있다고 보고되어 의 학적으로 중요성이 크다고 알려져 있다(Bahmani et al., 2015;Al-snafi, 2016). 또한, 치커리는 강장작용이 있으 며 구토 증상 등에 효과가 있다고 알려져 있어 다양한 약리작용으로 활용되고 있다(Hong et al., 1998).
항산화활성의 주요 요인인 활성산소종(reactive oxygen species: ROS)은 주로 호기성 대사의 결과로 생성되고 약물, 스트레스 혹은 오염물질이나 바이러스 등과 같은 요인으로 생성된다. ROS는 화학적 활성이 매우 높고 불 안정한데, 세포막을 이루는 지질이나 단백질 등 생체분 자를 공격하여 정상적인 기능을 상실하면 노화로 인한 질환을 유발할 수 있다(Ahn et al., 2022;Kwon et al., 2022). 따라서, 생체 내 ROS를 효율적으로 조절하고 산 화적 스트레스를 경감시킬 수 있는 부작용이 없고 항산 화 활성이 뛰어난 천연 항산화제의 개발이 필요하다 (Nam et al., 2015).
당뇨병의 주요 증상은 비정상적으로 높은 혈당치인 대 사성 질환으로 환자 수는 전세계적으로 급증하고 있는 추세이다(Yoon & Pyo, 2020). 당뇨병은 기전에 따라 1 형과 2형으로 나뉘는데 제1형 당뇨병은 췌장 베타세포 파괴로 인슐린 생성 자체에 문제가 생겨 발생하고 주로 사춘기나 유년기에 발생되어 소아 당뇨병이라고도 부른 다. 제2형 당뇨병은 노화나 비만 등의 이유로 인슐린 분 비가 부족해지거나 그 기능이 떨어져 발생하며 우리나라 당뇨병의 대부분을 차지한다. 당뇨병은 심각한 만성 합 병증을 초래하는데 주로 혈관 손상과 관련되어 망막병 증, 심근경색증, 족부 궤양 등 신체 어느 곳에서 합병증 을 발생시킬 수 있는 병이다(Ahn & Nutrition, 2016). 당의 효율적인 관리 중 하나는 소화기관에서 탄수화물 분해와 관련된 효소 중 α-glucosidase 및 α-amylase를 억 제하여 포도당의 흡수를 지연시켜 식후 혈당 상승을 억 제하고, 인슐린 분비반응을 감소시키는 것이다(Ji et al., 2020a). 당뇨병의 치료 방법은 식이요법, 운동요법, 인슐 린 투여 방법 등이 있는데 metformin, acarbose, miglitol 등과 같은 경구용 혈당강하제를 사용하기도 한다. 이 약 물들은 복부팽만, 설사 등 부작용을 동반하여 사용을 제 한하기 때문에 천연 소재를 대상으로한 억제제 개발이 요구되고 있다(Kim et al., 1996;Ji et al., 2020a;Yoon & Pyo, 2020).
치커리 항산화, phytochemical, 항균활성, 페놀산, 일반 성분 연구(Abbas et al., 2015;Khalaf et al., 2018;Zeb et al., 2018), 치커리 뿌리의 기능성연구(Hong et al., 1998) 등의 선행연구에서 다양한 기능성과 생리활성이 보고되었다. 따라서, 적치커리에도 우수한 생리활성 물질 을 함유하고 있을 것으로 예상되나 적치커리의 항산화 및 당대사 관련 효소 활성에 대한 연구는 미비한 실정이 다. 이에 본 연구는 동결건조 된 적치커리 분말의 일반 성분 및 phytochemical을 측정하고 추출용매를 달리하여 항산화 및 당대사 관련 효소 활성을 분석하였다.
재료 및 방법
본 실험에 사용한 적치커리는 2022년 2월 경기도 이천 에서 수확한 것으로 구입하여 사용하였다. 적치커리는 세 척한 후, 동결 건조(MCFD 8508, Ilshin Bio Base, Yangju, Korea)하였다. 건조된 적치커리는 분쇄기(EV-GB 8000 model, Everhome, Seoul, Korea)로 분쇄하고 30mesh 로 체를 친 후 -40°C 이하 deep freezer (New Brunswick Scientific Co., Edison, NJ, USA)에서 보관하고 사용하 였다.
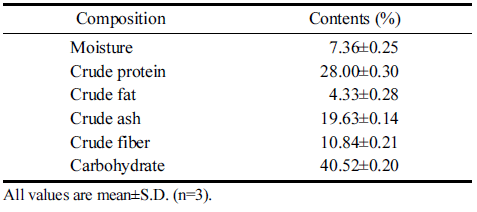
적치커리 분말의 일반성분 분석은 식약처 고시법에 준 하여 측정하였다. 동결건조 된 적치커리 가루의 수분함 량은 상압가열건조법(MB45 Moisture Analyzer, Ohaus Co., Zurich, Switzerland)으로 측정하였다. 조단백질은 마이크로킬달법 질소정량법을 이용하여 자동증류 및 분 석장치(Kjeltec 8400, Foss Co., Slangerupgade, Hillerod, Denmark)로 측정하였고, 조지방은 조지방 추출장치를 (Soxtec 8000, Foss Co., Slangerupgade, Hillerod, Denmark) 이용한 에테르(소트렛) 추출법으로 분석하였다. 조회분은 회로분석법을 통해 분석하였고, 조섬유는 조섬유 추출기 (Fiber 2000 Ankom technology, Macedon, NY, USA)로 측정하였다. 탄수화물 함량은 100에서 수분, 조단백질, 조지방, 조회분의 함량을 제외하는 차감법을 이용하여 구하였다.
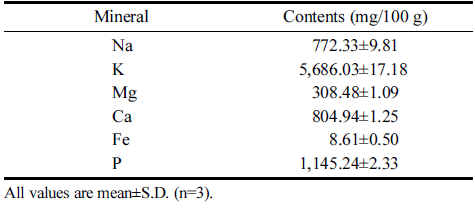
적치커리 분말의 무기질 함량은 건강기능식품공전 및 AOAC (1990)에 따라 측정하였다. 나트륨, 칼륨, 마그네 슘, 철, 인 및 칼슘의 함량은 건식분해법으로 실험하였 다. 동결건조된 시료 0.7 g을 정량하여 500°C에서 회화한 후, 회분에 염산과 증류수로 희석한 희석액 10mL를 더 하여 6시간 상온 분해하였다. 여과지로 여과한 다음 증 류수로 50 mL까지 mass up 하여 시험용액으로 사용하였 고, 공시험도 같은 방법으로 처리하였다. 시험 용액에 ICP (Inductively Coupled Plasma, 유도결합플라즈마)법 으로 분석하였고, 원소별 분석 파장은 나트륨 589.592 nm, 칼륨 766.490 nm, 마그네슘 285.213 nm, 철 238.204 nm, 인 213.617 nm, 칼슘 317.933 nm로 하여 방출분광분 석기(Perkin Elmer, Optima 8300, Waltham, MA, USA)를 사용하여 측정하였다.
적치커리 분말의 클로로필 및 총 카로티노이드 함량은 Chappelle et al. (1992)의 방법을 이용하여 측정하였다. 적치커리 분말 1 g에 DMSO (dimethyl sulfoxide) 20 mL 를 가하여 30°C의 암조건에서 24시간 동안 색소를 추출 한 후, 10분 간 원심분리(Hanil, Combi-514R, Gimpo, Korea)를 하여 사용하였다. 각 664, 648, 471 nm에서 흡 광도(T60UV, PG Instruments, Wibtoft, England)를 측정 하였고, 아래의 식을 이용하여 계산하였다.
적치커리 분말의 안토시아닌 함량은 Hosseinian et al. (2008)의 방법을 이용하여 측정하였다. 분말 1 g에 70% 에탄올 20 mL를 가하여 24시간 색소를 추출한 후, 10분 간 원심분리(Hanil, Combi-514R, Gimpo, Korea)를 하 여 사용하였다. 각 추출물 0.5mL에 pH1.0의 0.025 M potassium chloride 완충액과, pH 4.5의 0.4 M sodium acetate 완충액을 더하여 최종부피를 1mL로 하였다. 흡 광도는 510 nm 및 700 nm에서 각각 측정하였다. 총 안 토시아닌의 함량은 cyanidin-3-glucoside의 몰 흡광계수(ε = 26,900 M-1cm-1)를 이용해 아래의 식을 이용하여 계산 하였다.
적치커리 분말 10 g에 중량 20배의 증류수와 70%에탄 올 용매를 각각 가하여 초음파(KUS-650, KBT Co., Seoungnam, Korea)로 25°C, 300W에서 20분간 3회 반 복 추출하여 여과지로 여과하여 사용하였다. 추출물을 갑압 농축(N-1200A, EyELA Co., Shanghai, China)하여 dry extracts을 제조하여 각 실험에 사용하였다.
총 폴리페놀 함량은 Folin-Ciocalteau 방법(Swain & Hillis, 1959)을 이용하여 측정하였다. 추출물 150 μL을 증류수 2,400 μL와 2 N Folin-Ciocalteau용액 50 μL를 넣 어 교반한 뒤 3분간 반응시켰다. 이 용액에 1N sodium carbonate (Na2CO3) 300 μL를 가하여 2시간 동안 암소에 방치한 후 725 nm에서 흡광도(T60UV, PG instruments, Wibtoft, England)를 측정하였다. Total polyphenol 함량 은 gallic acid (Sigma, USA)를 표준물질로 사용하여 검 랑선을 작성한 후 계산하였다.
총 플라보노이드 함량은 Davis법(Chang et al., 2002) 을 응용하여 측정하였다. 추출물 100 μL에 99% diethyleneglycol 1 mL와 1 N NaOH 100 μL를 넣어 교반하고 37°C water bath (Jeong Bio Tech., WBT-10, Incheon, Korea)에서 1시간 동안 반응시킨 후 420 nm에서 흡광도 를 측정하였다. Total flavonoid 함량은 rutin (Sigma- Aldrich Co., USA)을 표준물질로 사용하여 검랑선을 작 성한 후 계산하였다.
2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거 활 성은 Blois (1958)의 방법을 이용하여 측정하였다. 추출 물 900 μL에 DPPH solution (1.5×10-4 M) 300 μL를 더 하여 교반한 다음 실온에서 30분간 암실에서 방치하여 517 nm에서 흡광도를 측정하였다. 시료를 첨가하지 않은 대조구의 흡광도를 이용하여 다음 식에 의해 DPPH 라 디칼 소거활성을 계산하였다. 물 추출물은 250, 500, 750 μg/mL 농도에서 측정하였고, 70%에탄올 추출물은 50, 100, 125 μg/mL 농도에서 측정하였다. 각 실험군의 항 산화능을 비교하기 위해 라디칼 소거가 50%를 나타내는 농도인 IC50 (The half maximal inhibitory concentration)을 각각 계산하였다.
2,2-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) ABTS 라디칼에 대한 소거 활성은 Re et al. (1999)의 방법을 이 용하여 측정하였다. ABTS 7.0 mM와 potassium persulfate 2.45 mM를 증류수에 더하여 12시간 동안 반응시켜 라디 칼을 생성시켰다. 이 용액을 734 nm의 흡광도를 이용하여 0.70±0.02가 되도록 PBS buffer로 희석하였다. ABTS+ solution 900 μL와 희석한 추출물 100 μL를 넣어 교반하 여 1분 간격으로 흡광도를 측정하였다. 물 추출물은 750, 1,000, 2,000 μg/mL 농도에서 측정하였고, 70%에탄올 추 출물은 250, 500, 1,000 μg/mL 농도에서 측정하였다. 각 실험군 항산화능을 비교하기 위해 라디칼 소거가 50%를 나타내는 농도인 IC50을 각각 계산하였다.
환원력은 Oyaizu (1986)의 방법을 이용하여 측정하 였다. 증류수에 용해한 추출물 1mL에 0.2 M sodium phosphate buffer (pH 6.6) 1 mL와 1% potassium ferri cyanide 1 mL를 가한 다음 50°C water bath에서 20분간 반응시켰다. 10% Trichloroacetic acid 1 mL 첨가하고 상 등액 1mL와 증류수 1mL와 혼합한 다음 0.1% Ferric chloride 0.2 mL를 가하였다. 700 nm에서 흡광도(T60UV, PG instruments, England)를 측정하여 환원력을 나타내었 고, 추출물 및 양성대조군은 500, 1,000, 2,000 μg/mL 농도에서 측정하였다.
α-Glucosidase 저해 활성 측정은 Zhu et al. (2008)의 방법을 이용하여 측정하였다. 효소는 효모로부터 얻어진 α-glucosidase를 사용하였고 기질은 p-NPG를 사용하여 p-nitrophenol 생성량을 측정하였다. 농도 1 unit/mL로 제 조된 효소 α-glucosidase 10 μL에 시료 200 μL를 첨가하 여 37°C에서 5분간 보관한 후 1mM p-NPG를 200 μL 가하여 혼합한 다음 37°C에서 20분간 반응시켰다. 1 N NaOH 500 μL를 넣어 반응을 중지시키고 50 mM phosphate buffer (pH 6.8)로 최종 부피를 1,500 μL가 되도록 가하여 405 nm에서 흡광도를 측정하였다. 양성대조군은 acarbose를 사용하였으며, 5, 7.5, 10 mg/mL 농도에서 측정하였다. 효소의 저해 활성은 시료 용액의 첨가구와 무첨가구 간의 흡광도 차이를 백분율로 나타내어 IC50 값으로 산출하였다.
α-Amylase 저해 활성 측정은 Bhandari et al. (2008)의 방법을 통해 측정하였다. Pancreatin 유래 α-amylase 저 해활성은 1 unit/mL의 효소농도를 가진 α-amylase을 사 용하였고, 기질은 starch를 사용하여 측정하였다. 0.01 M CaCl2를 함유하는 0.5M tris HCI buffer에 starch azure 를 현탁 시켜 100°C에서 5분간 끓여 제조한 기질 용액 을 37°C에서 보관하여 실험에 사용하였다. 증류수에 용 해한 시료 0.2 mL와 α-amylase 0.2 mL를 가한 후 기질 starch azure용액 0.3mL를 가하고 반응을 종결시킨 후 원심분리(4°C, 3,000 rpm, 5 min)하여 595 nm에서 상층 액의 흡광도를 측정하였다. 양성대조군은 acarbose를 사 용하였으며, 물 추출물은 50, 100, 125 mg/mL, 70%에 탄올은 12.5, 20, 25 mg/mL의 농도에서 측정하였다. 모 든 효소의 저해 활성은 시료 용액의 첨가구와 무첨가구 간의 흡광도 차이를 백분율로 나타내어 IC50 값으로 산 출하였다.
모든 실험은 SPSS program (Statistical Analysis Program, version 25, IBM Co., Armonk, NY, USA)를 이용하여 평균과 표준편차를 나타냈다. 각 실험군 간의 유의성을 확인하기 위해 one-way ANOVA를 실시하여 분석하였 다. 유의성이 있는 경우 사후검증을 통해 다중범위검정 (Duncan's multiple range test)을 실시하였다(p<0.05). 모 든 실험은 3회 반복 측정한 뒤 평균과 표준편차로 나타 냈다. 상관관계 분석은 Pearson 계수로 유의성을 검증하 여 분석하였다.
결과 및 고찰
동결 건조한 적치커리 분말의 일반성분 함량을 조사한 결과는 Table 1과 같다. 수분함량은 7.36%, 조단백은 28.00%, 조지방은 4.33%, 조회분은 19.63%, 조섬유는 10.84% 탄수화물은 40.52%였다. 쌈채소의 일반성분 중 조단백은 15.26-28.33%, 조지방은 2.38-12.23%, 조회분 은 15.37-20.65%, 탄수화물 36.3-65.42%으로 나타나 적 치커리의 일반성분도 이와 유사한 구성성분으로 나타났 다(Kim & Kim, 2004). 총 식이섬유는 32.61-41.22%로 나타났으며, 비십자화과 쌈채소 11종 중 치커리의 총 식 이섬유가 가장 많다고 보고되었다(Kim & Kim, 2004). 국내산 식물성 식품연구에서 건조된 분말의 조섬유 함량 은 각각 신선채소류 0.35-2.61%, 가공채소류 0.97-20.96%, 과일류 0.10-0.79%여서 적치커리 분말의 조섬유는 다른 채소 및 과일류와 비교하였을 때 식이섬유 함량이 높은 편임을 알 수 있었다(Lee & Lee, 1993). 치커리 종류 중 하나인 건조된 treviso의 일반성분은 조단백 20.61%, 조지방 5.48%, 조회분 16.74%로 보고되어 본 연구에서 사용된 적치커리와 비교하였을 때 조단백 함량이 더 높 았고 비교적 비슷한 함량을 보였다(Kim & Kim, 2004).
동결건조한 적치커리 분말의 무기질을 분석한 결과는 Table 2와 같다. 나트륨 772.33 mg/100 g, 칼륨 5,686.03 mg/100 g, 마그네슘 308.48 mg/100 g, 칼슘 804.94 mg/ 100 g, 철 8.61 mg/100 g, 인 1,145.24 mg/100 g의 함량 으로 그 중 칼륨을 가장 많이 함유하고 있었다. Kim (2022)에 따르면 동결건조한 자색케일의 무기질 함량은 100 g당 나트륨 179.99 mg, 칼륨 1,269 mg, 마그네슘 362.04 mg, 칼슘 1897 mg, 철 7.98 mg, 인 483.06mg으 로 함유되어 있었다. 건조한 고려 엉겅퀴 연구에서 무기 질 함량은 100 g 당 칼륨 3 401mg , 마그네슘 4 01.56mg , 칼슘 1,476 mg, 철 27.42 mg, 인 205.47mg로 다른 식품 과 비교하였을 때 칼륨과 인 함량이 높았고, 적치커리의 무기질 함량이 대체로 높은 것을 확인할 수 있었다(Lee et al., 2014). 칼륨은 에너지 대사, 혈압유지, 산과 알칼 리 평형유지, 세포막의 운반작용 등의 역할을 하고 인은 체내에서 인지질 구성, 인산화 과정, 세포의 성장, 조효 소 구성 요소 등에 관여해 인체 중요한 생리작용 역할을 담당하고 있다(Suter 1998;Lee et al., 2012).
식품 고유의 색을 나타내는 페놀화합물은 클로로필계 색소인 녹색계열, 카로티노이드계 색소인 적색계열, 안토 시아닌계 색소인 적자색과 흑색계열 및 플라보노이드계 색소인 황색계열로 나눌 수 있으며 인체에 해로운 자유 라디칼을 환원시켜 천연 항산화제 역할을 한다(Kühnau, 1976). Phytochemical은 식물이 외부환경으로부터 자신을 보호하려는 목적에서 생성하는 물질을 말하는데, 색이 화려하고 짙을수록 많이 함유되어 있다(Son, 2012).
클로로필은 식물에 분포하는 녹색의 천연색소로 카로 티노이드와 함께 단백질, 지방질, 지단백질과 결합한 상 태로 존재한다(Bowers, 1992). 적치커리의 클로로필 함 량과 총 카로티노이드 함량은 Table 3와 같다. 클로로필 은 녹색 색소로 채소나 과일의 신선함을 나타내는 지표 이고 식욕증진, 상처치료, 조혈기능, 간 기능 증진작용 등이 있다(Lee et al., 2005). 육지식물 내에는 클로로필 a, b 두 종류로 존재하고 클로로필 a는 청록색, 클로로필 b는 황록색을 나타낸다(Lee et al., 2005). 적치커리의 클 로로필 a는 793.80 mg/100 g이고, 클로로필 b는 363.06 mg/100 g 함량으로 나타나 총 클로로필 함량은 1,156.86 mg/100 g으로 나타났다. 클로로필이 다량 함유되었다고 보고된 부추의 총 클로로필 함량은 762.54-798.00 mg% 로 보고되었고, 시금치의 클로로필 a는 698 mg%, 클로로 필 b는 2 49mg %, 총 클로로필은 9 47mg %로 적치커리 는 다량의 클로로필이 함유한 것으로 나타났다(Schwartz & Lorenzo, 1990;Kwak et al., 1998).

|
카로티노이드는 자연에 널리 분포되어 있는 노란색, 주황색, 빨간색을 나타내는 지용성색소이다. 주로 식물에 서 카로티노이드는 chloroplast속에 존재하고 피부노화, 안과질환 예방, 항암효과 등이 있으며 강력한 활성산소 소거제 중 하나로 알려져 있다. 카로티노이드는 인체에 서 생합성 하지 못해 음식물을 통해 얻어야하고 카로티 노이드 색소 중 β-carotene 등은 체내에서 비타민 A로 전환되는 provitamin A로 알려져 있다(Jo & Jung, 2000;Park et al., 2015). 적치커리의 총 카로티노이드 함량은 171.82 mg/100 g으로 나타났다. Zeb et al. (2018)의 연구 에 의하면 치커리에 있는 카로티노이드는 neoxanthin, violaxanthin, lutein, β-carotene 등이 있는데 β-carotene 함량이 가장 많다고 보고되어 적치커리도 카로티노이드 중 β-carotene 성분이 가장 다량으로 함유할 것으로 예상 된다. Raju et al. (2007)의 연구에 따르면 총 카로티노 이드 함량은, 인디언 시금치는 191.64 mg/100 g, 고수는 166.32 mg/100 g, 인디언 상추는 164.68 mg/100 g, 비트 그린 잎은 52.4 mg/100 g, 브로콜리는 10.32 mg/100 g로 나타나 본 연구에 사용된 적치커리의 카로티노이드 함량 은 대체로 높은 편임을 확인할 수 있었다.
안토시아닌 색소는 자연계에 존재하는 수용성 색소 중 가장 큰 그룹을 이루고 있으며 고등식물에 함유되어 붉 은색, 자주색, 푸른색 등을 띠고 있다(Park et al., 2015). 강한 항산화 활성과 항 돌연변이 활성 등의 효과로 보고 되어 있다. 적치커리 안토시아닌 함량은 Table 3와 같다. 적치커리의 안토시아닌 함량은 79.49 mg/100 g으로 나타 났다. 치커리 종류 중 treviso 치커리의 안토시아닌 함량 은 43.68-72.77 mg/100 g으로 보고되어 본 연구에서 사용 된 적치커리의 안토시아닌 함량이 더 많은 것으로 나타 났다(Migliorini et al., 2019). Lavelli (2008)의 연구에 따르면 이탈리아산 적치커리의 안토시아닌 함량은 564- 1,354 mg/kg으로 보고되어 본 연구에서 사용된 적치커리 의 안토시아닌 함량과 비슷한 수준을 나타냈다. 치커리 마다 안토시아닌 함량에 차이가 있는 것은 품종, 계절적 변화, 성숙 단계 등과 같은 요인과 관련이 있을 것으로 예상한다(Migliorini et al., 2019). Mulabagal et al. (2009)의 연구에서 치커리 잎이 함유하고 있는 주요 안 토시아닌은 cyanidin-3-O-(6-malonyl-β-glucopyranoside)으 로 보고되어 적치커리 또한 같은 안토시아닌 계열이 구 성되어 있을 것으로 생각된다. 국화과에 속하는 적치마 상추의 안토시아닌 함량은 37.3 mg/100 g을 함유하고 있어 적치마 상추보다 적치커리의 안토시아닌 함량은 더 높은 것으로 확인되었다(Park et al., 2015).
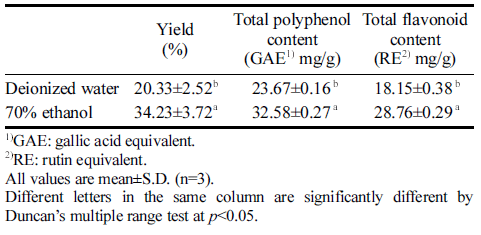
적치커리 추출물의 추출 수율을 측정한 결과 적치커리 물 추출물의 추출 수율은 20.33%로 나타났으며, 70%에 탄올의 추출 수율은 34.23%로 나타나 물 추출물 보다 70%에탄올 추출 수율이 더 높게 나타났다(p<0.001, Table 4). 이는 추출 용매의 극성이 높을수록 추출 수율 이 비교적 높은 것을 볼 수 있는데, 이는 순수한 물을 용매로 사용할 때 보다 에탄올이 첨가될 경우 지용성 성 분이 추가로 용출되어 나타난 결과로 보고되었다(Lee et al., 2008).
|
총 폴리페놀 함량 실험은 폴리페놀의 강력한 산화력 을 가지는 산화, 환원 반응을 이용한 것으로 환원된 청 색으로 색이 변하는 현상을 이용한 것이다(Park et al., 2022). 식물계에 널리 분포되어 있는 페놀성 화합물은 phenolic hydroxyl기를 가지고 있는 방향족 화합물들의 총칭으로 단백질 및 거대분자들과 쉽게 결합할 수 있고, 산화, 항균, 항암 작용 등의 다양한 생리활성을 나타낸다 (Joo, 2013). 적치커리 물과 에탄올 추출물의 총 폴리페 놀 함량과 총 플라보노이드 함량은 Table 4와 같다. 물 추출물의 총 폴리페놀 함량은 23.67 mg GAE/g이고, 70%에탄올 추출물에서는 32.58 mg GAE/g로 물 추출물 보다 70%에탄올 추출물에서 높은 함량을 나타냈다 (p<0.001, Table 4). 물 추출물의 총 플라보노이드 함량은 18.15 mg RE/g이고, 70%에탄올 추출물은 28.76 mg RE/g 로 물 추출물보다 높은 함량을 나타냈다(p<0.001, Table 4). 치커리의 총 폴리페놀 함량은 85.00 mg GAE/g으로 적치커리보다 다소 높은 함량을 나타냈고, 총 플라보노이 드 함량은 6 .82mg RE/g DW로 적치커리가 치커리와 비 교하여 다량 함유하고 있는 것으로 나타났다(Abbas et al., 2015). 국화과에 속하는 식물의 총 폴리페놀과 총 플 라보노이드 함량은 국화(21.93 mg GAE/g, 28.35 RE mg/ g), 민들레(11.52 mg GAE/g, 24.26 RE mg/g), 엉겅퀴 아재 비(16.85 mg GAE/g, 26.91 RE mg/g)로 본 연구에서 사용 된 적치커리와 비슷함 함량을 나타냈다(Liu et al., 2008). 치커리 잎에는 chicoric acid 성분이 약 3 70mg /kg으로 풍부하게 들어있고, gallic acid, caffene, e-vanillic acid, ellagic acid 등의 페놀산, rutin, hyperoside, luteolin 등의 플라보노이드가 함유되어 있다고 보고되었다(Perovic et al., 2021;Yan M et al., 2022). Kenny et al. (2014) 연 구에 따르면 국화과에 속하는 8종의 식물의 총 폴리페 놀을 비교한 결과 모두 물 추출물 보다 에탄올 추출물 이 약 3-11배 더 높은 함량을 나타내 본 연구와 유사한 결과를 나타냈다. 70%에탄올 추출물의 총 폴리페놀 및 플라보노이드 함량이 높게 나타난 것은 폴리페놀 성분 은 분자 내에 여러 개 페놀 수산기를 가진 식물성 성분 으로 극성을 띠고 있고 에탄올 또한 극성을 띠고 있는 용매여서 더 용이하게 추출된 것으로 생각된다(Li et al., 2017).
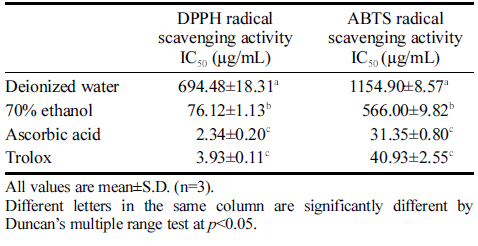
DPPH 라디칼 소거 측정은 DPPH가 항산화 활성을 가진 물질에 의해 환원되어 자색이 없어지는 정도를 측 정하는 방법이다(Blois, 1958). IC50값은 DPPH 라디칼 을 50% 소거하는 농도로, IC50값이 낮을수록 DPPH와 ABTS 라디칼 소거 활성이 높다고 평가한다. 적치커리의 물과 70%에탄올 추출물의 DPPH 라디칼 소거 활성 IC50 은 694.48 μg/mL, 76.12 μg/mL으로 에탄올 추출물이 더 높은 라디칼 소거 활성을 보였다(p<0.001, Table 5). 적 치커리의 물과 70%에탄올 추출물의 ABTS 라디칼 소거 활성 IC50은 1154.90 μg/mL, 566.00 μg/mL으로 에탄올 추출물이 더 높은 라디칼 소거 활성을 보였다(p<0.001, Table 5). 양성대조군인 ascorbic acid와 trolox의 DPPH 라디칼 소거 활성 IC50은 2 .34 μg /mL, 3 .93 μg/mL으로 나타났고, ABTS 라디칼 소거 활성 IC50은 3 1.35 μg /mL, 40.93 μg/mL으로 나타났다(p<0.001). Abbas et al. (2015) 연구에서는 치커리의 hydroalcoholic 추출물에서 DPPH IC50은 67.27 μg/mL로 본 실험과 비슷한 결과를 나타냈 다. 국내 유통 채소류 275건에 대한 DPPH 라디칼 소 거 활성 IC50은 0 -2.43 mg /mL으로 측정되어 적치커리의 높은 항산화 활성 확인할 수 있었다(Suh et al., 2013). Denev et al. (2014)의 연구에 따르면 치커리 뿌리의 DPPH & ABTS 라디칼 소거활성 결과도 물보다 에탄올 추출물이 활성이 더 높은 것으로 나와 본 연구결과와 유 사한 결과를 보였다. 국화과에 속하는 식물 8종의 DPPH 라디칼 소거 활성 IC50은 물 추출물과 에탄올 추출물에 서 각각 0.483-2.458 mg/mL, 0.029-0.161 mg/mL의 결과 를 보여 에탄올 추출물이 높은 라디컬 소거 활성을 보 였고, IC50을 비교하였을 때도 본 연구에 사용된 적치커 리가 항산화 활성이 비교적 높은 편임을 확인하였다 (Kenny et al., 2014). Lee (2021)의 연구에 따르면 쌈채 소 중 하나인 참당귀잎의 ABTS 라디칼 소거활성은 1 mg/mL 농도에서 물 추출물에서 12.70%, 70%에탄올 추 출물에서 28.73%의 소거활성을 나타냈다. 물 추출물보다 70%에탄올 추출물의 ABTS 라디칼 소거 활성이 더 높 은 것으로 확인되어 본 연구와 유사한 결과를 보였다. DPPH와 ABTS 라디칼 소거 활성 측정법에는 차이가 있 는데, DPPH는 자유 라디칼이고, ABTS는 양이온 라디칼 이어서 이들과 결합하는 페놀물질 종류에도 차이가 있어 실험결과 값에도 차이가 있는 것으로 보인다(Wang et al., 1998).
|
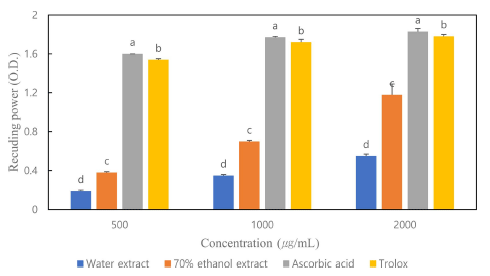
환원력은 체내에 생성된 활성산소와 과산화지질을 제 거하여 성인병을 예방하고, 환원반응을 통한 체내 항상 성을 유지하는 능력이 높을수록 그 이용 가치가 크다. 환원력은 활성산소종과 유리기에 전자를 공여하는 능력 을 말하며, ferric-ferricynaid (Fe3+) 혼합물이 수소를 공 여하여 ferrous (Fe2+)로 환원력을 측정하여 시료의 환원 력이 강할수록 진한 녹색에 가깝게 발색되어 높은 흡광 도 값을 나타내는 방법이다(Sa et al., 2010). 물과 에탄 올의 농도별 환원력 측정 결과는 F ig . 1과 같으며, 대조 구는 ascorbic acid와 trolox를 사용하였다. 적치커리 물 추출물, 70%에탄올 추출물, ascorbic acid와 trolox의 500 μg/mL 농도에서 환원력의 흡광도(O.D) 값은 0.19, 0.38, 1.6, 1.54였고, 1,000 μg/mL농도에서 O.D 값은 각 각 0.35, 0.7, 1.77, 1.72이였고, 2,000 μg/mL에서의 O.D 값은 0.55, 1.18, 1.83, 1.78로 보였다. 적치커리의 환원 력은 농도가 증가할수록 환원력이 증가함을 확인할 수 있었다(p<0.001). 국화과인 떡쑥 연구에서도 모든 건조 및 추출 방법에서 물보다 에탄올 추출물에서 더 높은 환 원력 결과를 보였다(Kim et al., 2015). 환원력은 총 폴 리페놀과 플라보노이드 함량과 유사한 경향을 보였는데 식물로부터 추출된 페놀류의 화합물은 산화방지 활성을 가지고, 이는 주로 산화 환원력에 의한 것이라고 보고하 였다(Osawa, 1994).
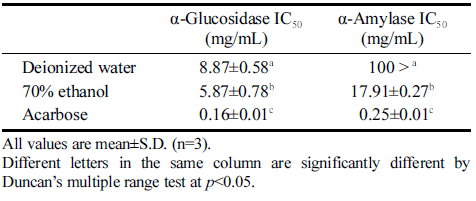
당의 분해에 α-glucosidase와 α-amylase는 관여하는 효 소이고 전분과 글리코겐 소화에 중요하며 식후 포도당 농도를 조절하는데 중요한 역할을 한다. 전분은 α- amylase에 의해 maltose와 dextrin으로 분해되며, 이후에 α-glucosidase가 포도당으로 전환시켜 혈당 수준을 높인 다(Tan et al., 2017). 제2형 당뇨병 치료에서 α-glucosidase 및 α-amylase의 억제는 식후 혈당을 조절하는 효과적 인 방법이다(Ji et al., 2020a) 적치커리 추출물의 α- glucosidase 및 α-amylase 저해활성을 측정한 결과는 Table 6와 같다. 적치커리 물과 70%에탄올 추출물의 α- glucosidase IC50은 각각 8 .87, 5 .87mg /mL였고 α-amylase IC50은 100 mg/mL 이상, 17.91 mg/mL의 결과를 보였다. Ji et al. (2020a)은 α-glucosidase 및 α-amylase 저해활성 은 배초향의 물 추출물 보다 70%에탄올 추출물에서 저 해활성이 더 높다고 보고하였고 농도 의존적으로 저해활 성 또한 높아진다고 하였다. Dalar & Konczak (2014) 연구에 따르면 치커리 에탄올 추출물 α-glucosidase 및 α-amylase 저해활성은 각각 4.25, 18.3 mg/mL로 본 연구 결과와 비슷한 결과를 보였다. 치커리의 chicoric acid 성 분이 α-glucosidase 저해활성과 관련이 있고, 전통적으로 치커리는 당뇨병을 조절하기 위해 사용하였다고 보고하 였다. 국화과인 선씀바귀 추출물 연구에서도 물 보다 70%에탄올 추출물의 활성이 높아 본 연구와 유사한 결 과를 보였다(Ji et al., 2020b). 고추 중에 α-glucosidase 활성이 높고 식사 후 혈당이 급격히 상승하는 것을 방지 하여 당뇨병 예방하는데에 도움이 된다고 보고된 당조고 추와 미인고추의 α-glucosidase 저해활성 IC50은 각각 25.0, 13.6 mg/mL으로 적치커리의 α-glucosidase 저해활 성이 더 높은 것을 확인할 수 있었다(Kye et al., 2020).
|
적치커리 추출물의 폴리페놀 및 플라보노이드 함량, 항산화 및 당대사 관련 효소 활성 간의 상관관계가 있는 지 보았다(Table 7). DPPH & ABTS 라디칼 소거 활성, α-glucosidase & α-amylase 저해 활성 측정은 IC50으로 분석하였다. 총 폴리페놀 함량과 총 플라보노이드 함랑 과 환원력은 각각 r=1.000, 0.986 (p<0.001)로 높은 양의 상관관계를 나타내었고, 총 폴리페놀과 DPPH & ABTS 라디칼 소거 활성, α-glucosidase 및 α-amylase 저해활성 은 모두 -0.998, -0.998, -0.923, -0.991 (p<0.01, p<0.001) 로 높은 음의 상관관계를 보였다. Katsube et al. (2004) 의 연구에서도 폴리페놀 함량은 라디칼 소거와 높은 상관관계를 보인다고 하였는데 본 실험에서도 폴리페놀 과 모든 항산화 실험들 간에 유의적으로 매우 높은 상 관관계를 보여 총 폴리페놀과 플라보노이드 함량이 항 산화 활성에도 영향을 미치는 것으로 확인되었다. 총 플라보노이드와 DPPH & ABTS 라디칼 소거 활성, α- glucosidase 및 α-amylase 저해활성은 모두 -0.997, -0.997, -0.919, 0.988 (p<0.01, p<0.001)로 높은 상관관계를 보 였다. Tadera et al. (2006)의 연구에서 플라보노이드 함 량과 α-glucosidase 저해활성이 상관관계가 있으며, 특히 페놀 함량과 α-amylase은 상관관계가 높게 난다고 하여 본 연구와 비슷한 결과를 나타냈다. DPPH 라디칼 소거 활성 IC50과 ABTS 라디칼 소거 활성 IC50, 환원력 α- glucosidase 및 α-amylase 저해활성은 1.000, -0.978, 0.944, 0.997 (p<0.01, p<0.001)로 높은 상관관계를 띠었고, ABTS 라디칼 소거 IC50과 환원력, α-glucosidase 및 α-amylase 저해활성은 -0.976, 0.945, 0.995 (p<0.01, p<0.001)로 높 은 상관관계를 띠었다. 결과적으로 적치커리 추출물은 항산화활성과 항당뇨 저해활성 간에 모두 높은 상관관계 를 나타냈다.

|
요 약
본 연구는 추출용매를 달리하여 적치커리의 생리활 성을 알아보고자 항산화 및 당대사 관련 효소 활성을 측정하였다. 또한, 적치커리의 일반성분, 무기질 및 phytochemical을 분석하여 식품소재 로서의 이용가능성을 알아보고자 하였다. 쌈채소 중 국내 활용가치가 높은 채 소 국내 활용가치가 높은 채소인 적치커리의 고부가가치 를 만들고 가공식품으로 기초자료로 삼고자 하고 본 연 구를 진행하였다.
적치커리의 일반성분 함량은 수분 7.36%, 조단백, 28.00%, 조지방 4.33%, 조회분 19.63%, 조섬유 10.84%, 탄수화물 40.52%로 나타났다. 적치커리의 무기질 함량은 100 g 당 나트륨 772.39 mg, 칼륨 5,686.03 mg, 마그네슘, 307.48 mg, 칼슘 8 04.94 mg , 철 8 .61 mg , 인 1,145.24mg 을 함유하고 있었다. 적치커리의 클로로필 a, 클로로필 b 및 총 클로로필 함량은 각각 793.80, 363.06, 1,156.86 mg/ 100 g, 총 카로티노이드는 171.82 mg/100 g, 안토시아닌 함량은 79.49 mg/100 g으로 나타났다. 적치커리의 물과 70%에탄올 추출물의 항산화 활성은 총 폴리페놀은 각각 23.67, 32.58 GAE mg/g, 총 플라보노이드 함량은 18.15, 28.76 RE mg/g을 함유하고 있었다. DPPH & ABTS 라디 칼 소거 활성 IC50은 물 추출물에서 각각 694.48, 1,154.90 μg/mL였고, 70%에탄올 추출물에서는 각각 76.12, 566.00 μg/mL의 활성을 보였다. 환원력에서는 농도가 증가할수록 환원력이 높은것으로 나타났으며, 70%에탄올 추출물이 더 높은 환원력을 보였다. α-Glucosidase와 α-amylase 저 해활성 IC50에서는 물 추출물에서 8.87 mg/mL, 100 mg/ mL 이상 에탄올 추출물에서는 5.87 mg/mL, 17.91 mg/mL 의 결과를 보였다.
따라서, 모든 항산화와 당대사 관련 효소 저해활성 실 험에서 물보다 70%에탄올 추출물이 더 높은 활성을 보 였고, 적치커리의 생리활성이 우수하여 천연 색소 및 항 산화 소재로 활용가능한 자원임을 확인하였다. 이로써 본 연구는 기초 연구 자료로 적치커리의 기능성 식품개 발 및 특산물 발전 등의 이용가능성을 증진시킬 수 있는 기초 자료가 될 수 있을 것으로 기대한다. 이를 토대로 적치커리를 활용한 다양한 식품모델 연구와 세포주 모델 을 활용한 항당뇨, 항암, 항균 연구가 추가적으로 필요할 것으로 생각된다.