서 론
귀리(Avena sativa L.)는 벼과 작물로서 서아시아 지역이 원산지이며, 쌀과 밀에 비해 소비는 적지만 주요 식량작물 로서 오래전부터 오트밀 형태로 섭취되어왔다(Lee et al., 2018). 귀리는 다른 곡물에 비해 단백질과 지질이 풍부하 고, 필수 아미노산이 균형 있게 함유되어 영양학적으로 우 수한 작물로 알려져 있다(Rasane et al., 2013). 특히 귀리는 수용성 식이섬유인 베타글루칸(β-glucan)을 풍부하게 함유 하고 있으며, 귀리의 베타글루칸은 혈중 콜레스테롤 함량 을 저하시키고, 당류의 소화 흡수를 억제하여 혈당 농도를 낮추며, 대장암 예방, 면역기능 촉진 등 다양한 생리활성 효과가 보고되고 있다(Newman et al., 1989;Daou & Zang, 2012;Wang & Ellis, 2014). 또한 귀리의 주요 폴리페놀 성분으로 ferulic acid, caffeic acid, sinapic acid, coumaric acid가 보고되고 있으며, phenolic amide인 avenanthramides 는 다른 곡류에는 없는 성분으로 항산화와 항염증 활성이 우수한 것으로 알려져 있다(Boz, 2015;Soycan et al., 2019). 귀리는 종실에 붙어있는 껍질의 유무에 따라 껍질 이 붙어있는 겉귀리와 껍질이 분리된 쌀귀리로 구분되며, 껍질 제거가 용이한 쌀귀리가 영양성, 기호성 및 가공적성 에서도 우수한 것으로 평가되고 있다(Lee et al., 2016).
발아는 수분을 충분히 흡수한 종자에서 뿌리가 나오는 과정으로 씨눈과 배젖에 있는 각종 효소의 활성 및 영양소 가 증가하여 최대의 영양상태가 갖추어진다(Bartnick & Szafranska, 1987). 씨눈 부분이 발아되면서 γ-oryzanol, arabinoxylane, γ-aminobutyric acid (GABA), vitamin E 등 의 생리활성 성분들이 증가하고, 종자 내의 효소가 활성화 되면서 영양성분들의 체내 흡수가 증대되며(Lee et al., 2007), 곡립의 연화로 거친 조직감을 개선하여 곡류의 가 공 적성이 개선되는 장점이 있는 것으로 알려져 있다(Kim et al., 2001). 곡류의 발아에 관한 연구는 현미, 보리, 조, 기장, 수수, 팥, 밀, 귀리 등의 작물에 대하여 발아 조건에 따른 성분의 변화, 이화학적 품질 특성 및 항산화 활성에 대한 연구가 진행되어 왔다(Kim et al., 2001;Kim et al., 2010;Ko et al., 2011;Cha et al., 2012;Woo et al., 2015). 그러나 곡류의 발아에서 장기간의 수침과 발아는 이취를 생성시키거나 부패를 일으킬 수 있으므로 식품 소재로 이 용하기 위해서는 적절한 발아 조건의 선정이 중요하다(Cha et al., 2012).
세계 10대 슈퍼푸드로 선정된 귀리의 건강기능성이 알려 지면서 국내에서도 귀리의 소비가 증가하고 있으나 귀리를 이용한 가공 연구는 미흡한 실정이며, 특히 귀리의 발아 조건에 대한 연구는 소수에 불과하다(Kim et al., 2019;Lee et al., 2021). 본 연구에서는 국내 육성 쌀귀리 중 ‘조 양’ 품종을 이용하여 발아 온도 및 시간에 따른 발아 특성, 기능 성분 및 항산화 활성 변화를 조사하여 기능성 식품 소재로서 발아 귀리의 산업적 활용을 위한 기초 자료를 제 공하고자 한다.
재료 및 방법
본 실험에 사용된 쌀귀리는 2021년 강진군에서 재배 생 산된 조양 품종의 쌀귀리를 강진된장영농조합법인(Gangjin, Korea)으로부터 제공받아 실험에 사용하였다. 발아 조건에 따른 발아귀리의 제조는 세척한 쌀귀리 30 g에 증류수 100 mL를 가하여 실온(25°C)에서 4시간 동안 수침한 후 새싹 재배용기(Chungnong INC, Bucheon, Korea)에 도말하여 각 온도별 배양기(LBI-250M, Daihan Labtech Co., Seoul, Korea)에서 발아를 진행하였다. 발아 온도 및 시간에 따른 발아귀리는 20°C, 25°C, 30°C 조건에서 각각 24, 48, 72시간 동안 발아시켜 제조하였다. 발아 조건에 따른 싹의 길이는 calipers (CD-15APX, Mitutoyo Co., Kawasaki, Japan)를 이 용하여 길이를 측정하였으며, 부패정도는 부패취의 강도에 따라 - (none), + (weak), ++ (medium)으로 측정하였다. 발아 조건에 따른 발아귀리는 동결건조(PVTFD 10R, IlShin Lab Co., Ltd., Dongducheon, Korea)한 후 분쇄하여 -20°C 냉동고에 보관하면서 분석용 시료로 사용하였다.
발아귀리의 베타글루칸 함량은 베타글루칸 분석키트(KBGLU, Megazyme, Wicklow, Ireland)를 사용하여 분석하 였다. 발아귀리 건조 분말 100mg에 50% 에탄올 200 μL 를 첨가 및 교반한 후 20 mM sodium phosphate buffer (pH 6.5) 4.0 mL를 가하고 100°C에서 3분간 반응시켰다. 반응액에 lichenase 200 μL를 첨가하여 50°C에서 1시간 반 응시킨 다음, 200 mM sodium acetate buffer (pH 4.0) 5 mL를 첨가한 후 원심분리하여 상등액을 취하였다. 상등액 0.1 mL에 동량의 β-glucosidase를 첨가하여 50°C에서 10분 간 반응시킨 다음, glucose oxidase/peroxidase 시약 3mL 를 첨가하여 50°C, 20분간 반응시킨 후 510 nm에서 흡광 도를 측정하였다. 베타글루칸 함량은 glucose 표준용액(1.0 mg/mL)을 이용하여 계산하였다.
발아 조건에 따른 발아귀리 건조 시료 3 g에 증류수 27 mL를 첨가하여 초음파 추출기(JAC-4020, KODO, Seoul, Korea)로 1시간 동안 추출하였다. 발아귀리 추출액은 원심 분리(8,000 rpm, 10 min)한 다음 상등액을 여과(Whatman No. 4)하여 추출물을 제조한 후 분석용 시료로 사용하였다.
발아귀리의 총 폴리페놀 함량은 Folin-Ciocalteu 방법 (Singleton et al., 1999)으로 측정하였다. 발아귀리 추출물 100 μL에 2% Na2CO3 용액 2mL와 50% Folin-Ciocalteu 시약 100 μL를 가하여 실온에서 30분간 방치한 다음 750 nm 에서 흡광도를 측정하였다. 표준곡선은 gallic acid (Sigma- Aldrich, St. Louis, MO, USA)를 사용하여 작성하였으며, 총 폴리페놀 함량은 시료 100 g당 mg gallic acid equivalents (GAE, dry basis)로 나타내었다. 발아귀리의 총 플라보노이 드 함량은 Davis 방법(Davis, 1947)을 일부 변형하여 측정하 였다. 발아귀리 추출물 100 μL에 diethylene glycol (Sigma- Aldrich) 1 mL와 1 N NaOH 100 μL를 차례로 혼합하여 37°C에서 1시간 동안 반응시킨 후 420 nm에서 흡광도를 측정하였다. 표준곡선은 quercetin (Sigma-Aldrich)을 사용 하여 작성하였으며, 총 플라보노이드 함량은 시료 100 g당 mg quercetin equivalents (QE, dry basis)로 나타내었다.
발아귀리 추출물 40 μL에 0.1 mM DPPH (2,2-diphenyl- 1-picrylhydrazyl, Wako Pure Chemical Industries, Ltd., Osaka, Japan) 360 μL를 혼합하여 상온에서 30분간 반응시 킨 후 spectrophotometer를 이용하여 517 nm에서 흡광도를 측정하였다. 각 시료의 DPPH 라디칼 소거능은 아래의 식 으로 계산하여 백분율로 나타내었다.
7 mM ABTS(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), Wako Pure Chemical Industries)와 2.45mM potassium persulfate를 암소에서 16시간 동안 반응시켜 ABTS 양이온 을 형성시킨 후 사용 직전 734 nm에서 흡광도가 0.80±0.02 가 되도록 조정하였다. 발아귀리 추출물 10 μL에 ABTS 용액 190 μL를 혼합하여 실온에서 10분 동안 반응시킨 후 spectrophotometer를 이용하여 734 nm에서 흡광도를 측정하 였다. 각 시료의 ABTS 라디칼 소거능은 아래의 식으로 계산하여 백분율로 나타내었다.
FRAP 시약은 300 mM acetate buffer (pH 3.6) 25 mL, 40mM HCl에 용해한 10mM 2,4,6-tripyridyl-s-triazine (TPTZ) 2.5 mL및 20 mM ferric sulfate 2.5 mL를 혼합한 후 37°C 에서 안정화시켜 제조하였다. 발아 조건별 발아귀리의 환 원력 측정을 위해 FRAP 시약 0.9mL에 발아귀리 추출물 30 μL와 증류수 90 μL를 넣고 37°C에서 10분 동안 반응시 킨 후 spectrophotometer를 이용하여 593 nm에서 흡광도를 측정하였다. FRAP value는 FeSO4·H2O를 표준물질로 하여 얻은 표준 검량 곡선을 통해 계산하였다.
결과 및 고찰
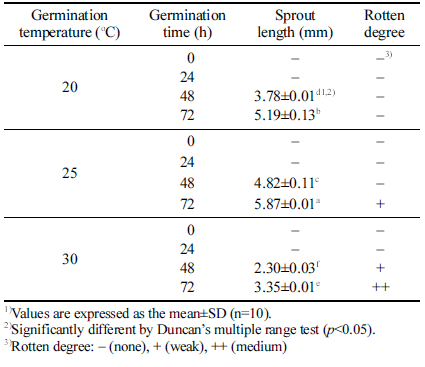
발아 온도 및 시간에 따른 발아귀리의 싹 길이와 부패발 생 정도를 측정한 결과는 Table 1과 같다. 모든 발아 온도 에서 발아귀리의 싹은 발아 48시간부터 관찰되었으며, 동 일한 발아 시간에서 25°C 온도 조건의 싹 길이가 가장 길 게 나타났으며, 30°C 온도 조건의 싹 길이가 가장 짧은 결 과를 나타내었다. 발아 72시간 후 20°C와 25°C에서 발아 된 싹의 길이는 각각 5.19 및 5.87mm로 비교적 유사하게 측정되었으나, 30°C에서 발아된 싹의 길이는 3.35mm로 측정되어 20°C와 25°C 발아 싹에 비해 낮은 성장률을 나 타내었다. Lee et al. (2021)의 연구에서 귀리의 발아 온도 (15, 18, 21, 24°C) 및 생육 일수(7일, 13일)에 따른 싹 길 이를 비교한 결과 생육 7일과 13일 모두 발아 온도와 비 례하여 싹이 길어지는 결과를 보였다. 귀리, 밀, 보리 등 맥류의 발아 최적 온도는 25°C 전후로 알려져 있다(Han et al., 2012). 곡류의 장기간 발아는 이취를 생성시키거나 부패를 일으킬 수 있으므로(Cha et al., 2012), 식품 소재로 이용하기 위한 발아귀리의 제조는 부패가 발생하지 않으면 서 발아가 신속하게 이루어질 수 있는 조건이 중요하다. Table 1과 같이 발아 온도 조건별로 72시간까지 쌀귀리의 발아를 진행하면서 부패취의 강도를 측정한 결과 20°C 발 아에서는 부패가 발생하지 않았으며, 25°C 발아에서는 72 시간 후에 부패가 시작되었고, 30°C 발아에서는 발아 48시 간부터 부패가 발생하여 72시간 후에는 부패취의 강도가 증가하였다.
|
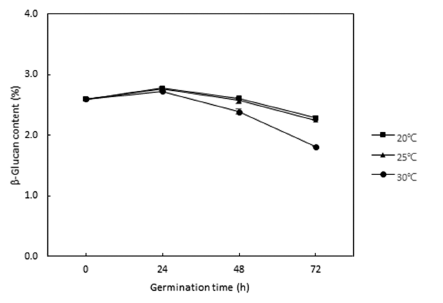
발아 온도 및 시간에 따른 발아귀리의 베타글루칸 함량 변화를 측정한 결과는 Fig. 1과 같다. 쌀귀리의 베타글루칸 함량은 발아 전 2.60% 수준을 나타내었으며, 모든 발아 온도 조건에서 발아 24시간 후에 베타글루칸 함량이 증가 한 후 발아 72시간까지 감소하는 경향을 나타내었다. 20°C 와 25°C 온도 조건에서 발아 시간에 따른 발아귀리의 베 타글루칸 함량은 각각 24시간 후 2.78%, 2.77%, 48시간 후 2.61%, 2.58%, 72시간 후 2.29%, 2.26%로 유의적인 차이를 나타내지 않았으며, 발아 시간에 따른 베타글루칸 의 감소율이 크게 나타나지 않았다. 그러나 30°C 조건에서 발아귀리의 베타글루칸 함량은 발아 24시간 후 2.73%, 48 시간 후 2.39%, 72시간 후 1.81%로 나타나 20°C와 25°C 조건에 비해 동일한 발아 시간에서 베타글루칸 함량이 유 의적으로 낮았으며, 발아 시간에 따른 베타글루칸의 감소 율이 더 높게 나타났다. Kim et al. (2019)의 연구에서 싹 길이에 따른 발아귀리의 베타글루칸 함량을 비교하였을 때 발아 전에 비해 싹 1mm의 발아귀리에서 베타글루칸 함량 이 증가한 후 싹이 길어질수록 베타글루칸은 지속적으로 감소하는 경향으로 본 연구와 유사한 결과를 보였다. Jeong et al. (2018)은 발아 시간에 따른 발아 새일미의 영 양성분 함량 변화를 분석한 결과 나이아신과 엽산은 발아 시간과 비례하여 증가한 반면 티아민은 발아 24시간까지 증가한 후 감소하였고, GABA 함량은 발아 20시간에서 최 대 함량에 도달한 후 발아에 따라 감소하여 발아 32시간에 는 발아 전 함량보다 낮은 값을 나타내었다. 콩의 발아 연 구에서도 발아 시간에 따른 isoflavone 함량 변화를 분석한 결과 발아 전에 비해 발아 12시간에서 증가한 다음 발아 시간에 따라 서서히 감소하는 경향을 보였다(Choi et al., 2013). 곡류에서 발아에 따른 성분의 변화는 품종 및 발아 조건에 따른 영향을 받는 것으로 알려져 있으며(Cha et al., 2012;Jeong et al., 2018), 발아 시간이 증가할수록 발 아 곡류에서 베타글루칸 함량이 감소하는 원인은 발아기간 중 β-glucanase의 작용에 의해서 분해되기 때문으로 보고 되고 있다(Wang et al., 2004).
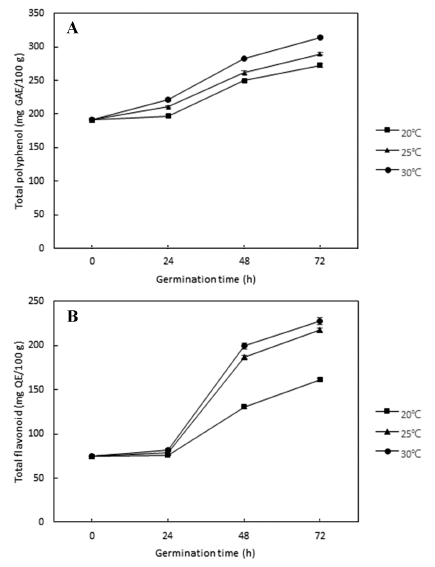
페놀성 화합물은 식물계에 널리 분포되어 있는 물질로 분자 내의 hydroxyl 기가 단백질과 같은 거대분자와의 결 합을 통해 항산화, 항암, 항균 등의 생리활성을 나타내며, 곡류에 함유되어 있는 폴리페놀 화합물들은 우수한 항산화 활성을 가지는 것으로 알려져 있다(Rice-Evans et al., 1997). 플라보노이드는 주로 anthocyanidins, flavonols, flavones, cathechins 및 flavanones 등으로 구성되어 있으며, 구조에 따라 항산화, 항균, 항염증 등 다양한 생리활성을 갖는 것 으로 보고되고 있다(Woo et al., 2010). 본 연구에서 발아 조건에 따른 발아귀리의 항산화 성분으로 총 폴리페놀과 플라보노이드 함량을 측정한 결과 발아 온도 및 시간과 비 례하여 증가하는 경향을 나타내었다(Fig. 2). 총 폴리페놀 함량은 발아 전 190.82 mg GAE/100 g에서 발아에 따라 증가하여 발아 72시간 후 발아 온도별 발아귀리의 총 폴 리페놀 함량은 20°C에서 272.21 mg GAE/100 g, 25°C에서 289.38 mg GAE/100 g, 30°C에서 314.23 mg GAE/100 g의 높은 함량을 나타내었다. 총 플라보노이드 함량은 발아 전 74.52 mg QE/100 g에서 발아 72시간 후 발아 온도별로 20°C에서 161.15 mg QE/100 g, 25°C에서 217.20 mg QE/ 100 g, 30°C에서 227.39 mg QE/100 g로 증가한 결과를 보 였다. 발아 시간에 따른 발아귀리의 총 플라보노이드 함량 은 발아 24시간까지 근소하게 증가하였으나(75.80-82.17 mg QE/100 g), 발아 48시간에 온도별로 130.58-199.37 mg QE/100 g의 함량으로 크게 증가하는 경향을 나타내었으며, 25°C와 30°C 조건의 총 플라보노이드 함량은 큰 차이를 보이지 않은 반면 20°C 조건의 발아에서는 다른 발아 온 도에 비해 상당히 낮은 함량을 나타내었다. Kim et al. (2019)의 연구에서 싹 길이에 따른 발아귀리의 총 폴리페 놀과 플라보노이드 함량은 발아가 진행될수록 증가하다가 싹 5 mm 이상부터 감소하는 결과를 보여 본 연구와는 다 소 차이가 있었다. 그러나 Hwang et al. (2020)의 연구에 서는 발아 전에 비해 발아 5일 후 발아귀리의 총 폴리페 놀과 플라보노이드 함량은 각각 약 60%와 86%가 증가하 였으며, 발아 과정 중 결합 형태의 폴리페놀이 프리 폴리 페놀로 바뀌면서 쉽게 유리되기 때문으로 보고하였다. Seong et al. (2022)의 연구에 따르면 품종별 발아현미의 발아일수에 따른 총 폴리페놀 및 플라보노이드 함량을 분 석한 결과 남평과 다산 품종은 발아에 따라 증가한 반면 적미인 밀양356호는 발아 전에 비해 감소하는 결과를 보 이며 품종에 따라 경향이 다르게 나타남을 보고한 바 있으 며, 귀리의 발아에 따른 항산화 성분의 변화도 품종에 따 른 차이가 있을 것으로 추정된다.
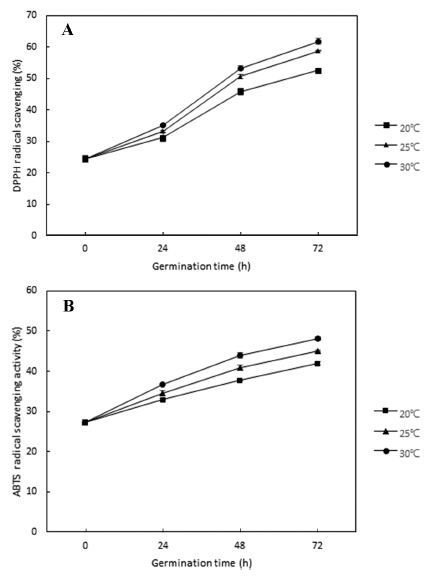
자유라디칼은 인체 내에서 각종 질병과 세포의 노화를 유발하므로 자유라디칼에 전자를 공여하여 산화를 억제하 는 능력은 항산화 활성의 중요한 척도이다(Han et al., 2009). 발아 온도 및 시간에 따른 발아귀리 추출물의 DPPH 및 ABTS 라디칼 소거능을 측정한 결과는 Fig. 3과 같다. 발아 조건에 따른 총 폴리페놀 및 플라보노이드 함 량 변화와 유사하게 발아 온도 및 시간이 증가할수록 발아 귀리 추출물의 라디칼 소거능이 증가하는 경향을 나타내었 다. DPPH 라디칼 소거능은 발아 전 24.44%에서 발아 72 시간 후 발아 온도에 따라 52.61-61.74% 수준으로 증가하 였으며, ABTS 라디칼 소거능은 발아 전 27.30%에서 발아 72시간 후 발아 온도에 따라 41.97-48.13% 수준으로 증가 하였다. Hwang et al. (2020)의 연구에서도 귀리 추출물의 DPPH 라디칼 소거능은 발아 전 20.58%에서 5일 발아 후 43.71%로 2배 이상 증가하였다. Ham et al. (2015)의 연구 에서 발아 온도(15°C, 20°C, 25°C) 및 시간(0-72시간)에 따 른 국산밀 추출물의 라디칼 소거능을 분석한 결과 발아 온 도 및 시간의 증가에 따라 DPPH 및 ABTS 라디칼 소거 능이 유의적으로 증가하여 본 연구와 유사한 결과를 보였 다. Kim et al. (2012)의 연구에서는 발아 기간(0-8일)에 따 른 발아 벼 추출물의 라디칼 소거능을 분석한 결과 DPPH 라디칼 소거능은 발아 2일에 최대값을 나타낸 후 감소하였 으나, ABTS 라디칼 소거능은 발아 4일까지 증가한 후 감 소하는 결과를 보였으며, 이러한 차이는 각 라디칼 소거능 과 연관된 성분의 차이에 의한 것으로 보고하였다. DPPH 및 ABTS 라디칼 소거능은 페놀류나 플라보노이드 물질에 기인하여 활성을 나타내는 것으로 알려져 있으며(Kang et al., 1996), 본 연구에서도 발아 온도 및 시간에 따른 총 폴리페놀 및 플라보노이드 함량의 증가에 따라 라디칼 소 거능이 증가하는 것으로 생각된다.
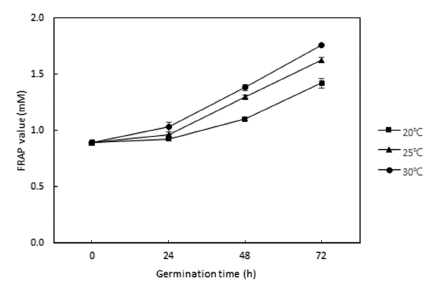
환원력은 활성 산소종과 유리기에 전자를 공여하는 능력 을 의미하며, FRAP 방법은 Fe3+를 Fe2+로 환원시키는 능력 을 측정하여 환원력에 따른 시료의 항산화 활성을 측정할 수 있는 방법이다(Benzie & Strain, 1996). 발아 온도 및 시간에 따른 발아귀리 추출물의 환원력을 측정한 결과 라 디칼 소거능 측정 결과와 유사하게 발아 온도와 시간이 증 가할수록 환원력이 높아지는 결과를 나타내었다(Fig. 4). 발아 시간에 따른 발아귀리의 FRAP value는 발아 전 0.90 mM에서 발아 24시간 후 0.93-1.03 mM 수준으로 낮은 증 가율을 나타내었으나, 발아 72시간 후에는 1.42-1.76 mM 수준으로 크게 증가하였다. FRAP 측정법은 라디칼 소거능 측정법과 높은 상관관계를 나타내는 것으로 알려져 있으며 (Moon et al., 2003;Chae et al., 2019), Kim et al. (2012) 의 연구에서도 발아 기간에 따른 발아 벼 추출물의 환원력 은 총 폴리페놀 함량 및 라디칼 소거능 측정 결과와 유사 한 경향을 나타내었다.
요 약
본 연구에서는 국내 재배 쌀귀리를 이용한 가공 연구 및 기능성 식품 소재화를 위한 기초 연구로 쌀귀리의 발아 온 도 및 시간에 따른 발아특성, 베타글루칸 및 항산화 성분 함량, 항산화 활성 변화를 조사하였다 발아귀리의 싹은 25°C 조건에서 가장 길게 측정되었고, 부패취는 발아 온도 및 시간에 따라 증가하였다. 발아귀리의 베타글루칸 함량 은 모든 온도 조건에서 발아 24시간 후 최대 함량을 나타 내었고, 총 폴리페놀 및 플라보노이드 함량은 발아 온도 및 시간에 비례하여 증가하였다. 발아 조건에 따른 발아귀 리 추출물의 DPPH 및 ABTS 라디칼 소거능과 환원능을 측정한 결과 발아 온도 및 시간에 따라 증가하는 경향을 보였다.







