서 론
가물치(Channa argus)는 중국과 말레이시아와 같은 아시 아 태평양 국가에서 자생하는 전통적인 고부가가치 민물고 기 종이다(Wahab et al., 2015;Wu et al., 2018). 2018년 중국에서 연간 양식업 생산량은 0.48 백만 톤을 초과하였 다(China Fishery Statistical Yearbook, 2019). 가물치는 뼈 가 거의 없기 때문에 식용 부분이 63%를 차지하고 많은 물고기와 마찬가지로 고품질 단백질과 미량 영양소가 풍부 하다(Wu et al., 2018). 높은 수준의 필수 아미노산과 지방 산으로 인해 일반적으로 아시아 태평양 국가에서 인기있는 반찬인 수프의 재료로 사용된다(Sahid et al., 2018;Zhang et al., 2018). 가물치는 글리신, 글루탐산, 프롤린, 알라닌 및 아르기닌 등의 아미노산을 다량 함유하고 있으며(Kim, 1982), 상처와 화상의 치유를 크게 촉진하는 것으로 보고 되었다(Sahid et al., 2018). 상처 회복 과정은 다양한 유 형의 자유 라디칼을 생성하여 세포의 산화 스트레스를 유 발할 수 있다. 이러한 산화 스트레스는 상처 치유를 심각 하게 방해한다(Schäfer and Werner, 2008). 이전의 많은 연구에서 생선 및 생선 제품의 상처 치유 촉진 효능은 주 로 방출된 항산화 펩티드에서 파생 될 수 있다고 보고되었 다(Venkatesan, et al., 2017;Wang et al., 2019). 항산화 펩 티드는 활성산소종을 소거하고 전이 금속을 킬레이트화 하고 지질 과산화를 억제함으로써 세포의 산화 스트레스 로부터 인체를 보호할 수 있다(Delgado et al., 2016;Sila & Bougatef, 2016).
최근의 분자생물학, 신경영상술, 세포병리학의 발달로 인해 우울증의 병태생리와 항우울제의 작용기전을 분자 혹은 세포 수준에서 이해할 수 있게 되었다. Duman 등 (1999)은 스트레스와 우울증 및 항우울제의 작용기전을 세포내 신호전달경로와 신경 가소성의 개념으로 설명하는 분자와 세포 가설(molecular and cellular theory)을 제시 하였다. 즉, 심한 스트레스는 해마 신경원의 위축(atrophy) 과 세포 사멸 뿐만 아니라 신경조직발생(neurogenesis)을 억제하여 해마(hippocampus)의 구조적 변화와 기능 장애를 초래하는데, 이런 신호전달경로의 장애와 신경원 적응 (neuronal adaptation)의 실패가 우울증을 유발하게 되며, 항 우울제는 이를 회복시키는 역할 을 한다는 것이다. 우울증 의 병인에 중요한 역할을 하는 또다른 인자에는 활성산소 종(reactive oxygen species, ROS)이 있다. ROS는 조직 손 상, 염증(Maes et al., 2009), 신경 퇴화(Stockmeier et al., 2004), 조직 손상에 의해 생성된 자가면역 메커니즘, 세포 자멸사(Maes et al., 2011)와 같은 다양한 메커니즘에 의해 우울증의 병태 생리학에 적극적인 역할을 할 수 있다.
차(Camellia sinensis L.)는 세계 3대 음료 중 하나이며, 항산화물질이 풍부하기 때문에 건강 음료로 알려져 있다. 차의 기능성 성분으로 카테킨과 카테킨 산화물 등의 폴리 페놀과 카페인, 아미노산, 사포닌, 미네랄 등이 존재하는데 (Chacko et al., 2010), 이들 성분들은 체내에서 항산화작용 (Majchrzak et al., 2004), 항균작용(Yam et al., 1997), 활성 산소 소거작용(Chacko et al., 2010), 혈당상승 억제(Crespy et al., 2004), 혈압상승억제작용(Negishi et al., 2004) 등의 여러 생리활성을 가지는 것으로 보고되었다. 이런 생리활 성을 가지는 차의 대표적인 물질인 카테킨류의 polyphenol 류로는 (-)-epicatechin (EC), (-)-epigallocatechin gallate (EGCG), (-)-epicatechin gallate (ECG), (-)-epigallocatechin (EGC)의 4종 주성분 외에 (+)-gallocatechin (GC), (+)- catechin(C) 등 수 종류가 존재하는데, 이런 차의 이런 성 분으로 인하여 아미노산 함량 증가와 정신적으로 우울증에 도움이 되고자 실험에 활용하였다.
본 연구는 가물치 추출물이 신경조직발생에 미치는 영향 을 확인하려는 시도로, PC12 세포(rat adrenal pheochromocytoma cell)에 향신경성인자(neurotropic factor)인 신경 성장 인자(nerve growth factor, NGF)만 처리했을 때와 NGF와 추출물을 함께 처리했을 때 세포의 신경돌기 (neurite) 변화에 어떤 영향을 미치는지를 관찰하였다. 또한, 산화 스트레스에 의한 세포 사멸 억제 효과를 확인하였다. 물론 약물에 의해 일어나는 인체의 변화를 단일세포에서 알아본다는 것이 한계가 있지만, 이는 여러가지 환경 변수 에 관한 통제가 제대로 이루어지지 않는 생체실험보다 우 선되어야 하는 기초연구라고 생각한다. 아울러 가물치 추 출물이 신경돌기 변화와 항산화 기전에 영향을 준다면 어 떤 기전에 의해 영향을 미치는지 분자유전학적 수준에서 연구하는 기초 자료를 제공하는 기회를 만드는데 본 연구 의 목적이 있다.
재료 및 방법
본 실험에서 사용된 가물치는 ㈜정옥(Hadong, Jinkyo, Korea)에서 제공받아 사용하였다. 가물치를 끓는 물에 10 분간 데치기를 거친 후 초저온냉동고(MDF-U53V Stand, Sanyo Electric Co., Ltd, Osaka, Japan)에서 24시간 보관 후 동결건조(FD 8518, IlShinBio Co., Ltd, Dongducheon, Korea)를 실시하고 10메쉬 이하로 분쇄(Cyclotec Mill 1093, Foss Co., Ltd, Hönganäs, Sweden)하여 실험재료로 사용하였다. 그리고, 본 실험의 추출물에 사용한 효소는 단 백질 분해에 효과적인 endo-peptidase이며, 해산물 분해에 탁월한 Alcalase 2.4 L, 중성 pH에서 효과적으로 분해하는 효소인 Neutrase 0.8 L, 다양한 조건에서 안정적인 활성을 나타내고, 내부와 외부의 peptide 결합을 동시에 끊어주는 효소인 Flavourzyme 500MG효소를 사용하여 가물치의 아미 노산 함량을 높이는 목적으로 실험에 사용하였다. 추출 조 건은 다음과 같다. 증류수 상온 추출물(Room temperature- Extract, RE)은 시료 50 g에 10배수의 용매(증류수)를 첨가 하였다. 녹차 상온 추출물은(Green tea-Room temperature- Extract, GRE) 시료 50 g에 가루 녹차 0.5 g (원료 대비 1%)을 넣고 10배수의 용매(증류수)를 첨가하였다. 효소 상 온 추출물은(Enzyme- Room temperature-Extract, ERE) 시 료 50 g에 효소 3종(Alcalese 2.4 L. Favourzyme 500MG, Neutrase 0.8 L)를 각 0.5 g (원료 대비 1%)을 넣고 10배수 의 용매(증류수)를 첨가하였다. 녹차 효소 상온 추출물 (Green tea-Enzyme-Room temperature-Extract, GERE)은 시 료 50 g에 녹차 0.5 g, 효소 3종 각 0.5 g을 넣고 10배수의 용매(증류수)를 첨가하였다. 이들 추출물은 shaking incubator (IS-971R, JS Research Inc, Gongju, Korea)에서 110 rpm, 50°C에서 6시간 추출하고, 효소 상온 추출물과 녹차 효소 추출물은 95°C 항온 수조(JSEB-60T, JS Research Inc., Gongju-si, Korea)에 담근 후 30분 동안 효소 불활성화를 시켰다. 이후 모든 추출물은 여과지(whatman No.2)로 여과 한 후 동결건조하여 4°C에 보관하면서 실험에 사용하였다.
시료 0.3 g에 증류수 10 mL을 가한 다음 3시간동안 진탕 시켜 10% 5-Sulfosalicylic acid dihydrate 1 mL을 첨가한 후 4°C 냉장고에서 12시간 동안 방치하여 단백질을 침전 시켜 제거하였다. 이들 시료는 4,000 rpm으로 15분간 원심 분리 한 후 상등액을 취하여 감압농축기(Eyela N-1100VW; Rikakikai Co. Ltd, Tokyo, Japan)를 이용하여 농축하였 다. 다음으로 0.2M의 lithium citrate loading buffer (pH 2.2) 를 5 mL 첨가하여 용해하고, 0.45 μm membrane filter로 여과한 여액을 아미노산분석기(S7130 Amino acid reagent organizer; Sykam Co., Ltd., Gilching, Germany)로 분석하 였고, UV/VIS detector 400 nm (1.00 AU)와 570 nm (1.00 AU)로 검출하였다.
준비된 추출물의 DPPH를 이용한 라디칼 소거활성을 측 정하기 위하여 80% 메탄올에 용해한 0.1 mM DPPH를 517 nm에서 흡광도 값이 1.00 ± 0.02가 나오도록 80% 메탄 올에 희석해 사용하였다. 시료용액 0.05 mL에 흡광도 값을 맞춘 DPPH 용액 1.45 mL를 첨가하여 실온에서 30분 방치 한 후 517 nm에서 흡광도를 측정하였다(Blois, 1958;Kim et al., 2018).
준비된 추출물의 ABTS를 이용한 라디칼 소거능 측정은 Kim 등(2003)의 연구에 의하여 실시된 방법을 응용하여 시행하였다. 2.5 mM ABTS [2,2'-azino-bis (3-ethylbenzothiazoline- 6-sulfonic acid)]와 150 mM 염화나트륨(NaCl)이 포 함된 100 mM 인산 완충액(pH 7.4)에 혼합한 후 70°C 항온 수조에서 30분 동안 반응하고 실온에서 10분간 냉각하였 다. 이를 PFFL 0.45 μm 필터를 이용하여 여과시켜 4°C에 서 24시간 동안 냉장보관 후 사용하였다. ABTS 라디칼 용액은 증류수로 희석하여 흡광도(734 nm) 값이 0.70±0.02 가 나오도록 조절하였다. 시료용액 20 μL에 흡광도 값이 조정된 ABTS 라디칼 용액 980 μL 혼합하여 37°C에서 10 분간 반응시키고, 734 nm에서 반응 용액의 흡광도를 측정 하였다.
PC12 세포는 American Type Culture Collection (Manassa, VA, USA)에서 구입하여 사용하였으며, 10% (v/v) 마혈청 (horse serum, HS; Gibco, Carlsbad, CA, USA), 5% 우태 혈청(fetal bovine serum, FBS; Gibco)을 첨가한 RPMI 1640 배지(Gibco)로 37°C, 5% CO2가 유지되는 조건하에 서 배양하였다. 배양된 세포는 3-4일 간격으로 계대 배양 하여 실험에 사용하였다. 다양한 조건으로 추출된 가물치 추출물 처리에 따른 PC12 세포의 세포생존율을 측정하기 위하여 Cell Counting Kit-8 (CCK-8; Dojindo, Kumamoto, Japan)을 사용하여 다음과 같이 측정하였다. PC12 세포는 부착성을 거의 띄지 않고 부유하는 세포이므로, 10 μg/cm2 농도의 collagen IV (C5544, Sigma, St. Louis, MO, USA) 를 코팅한 24-well plate에 1×105 cell/well로 분주한 다음 세포 부착을 위하여 37°C, CO2 배양기에서 24시간 배양 하였다. 그 후 추출물을 0.1, 0.25, 0.5, 0.75% 네 가지 농 도로 24시간 처리한 후에 각 well에 CCK-8 반응액을 첨 가하여 2시간 반응시킨 후 microplate reader (VERSAmax, Molecular Devices, Sunnyvale, CA, USA)를 이용하여 450 nm에서 흡광도를 측정하고 무처리군을 100%로 하여 세포생존율을 계산하였다.
PC12 세포는 10 μg/cm2 농도의 collagen IV (C5544, Sigma)를 코팅한 6-well plate에 10% HS와 5% FBS가 포 함된 RPMI-1640 배지를 첨가한 후 저밀도(1×104 cell/ well)로 분주하여 24시간 배양하였다. 24시간 배양한 PC12 세포에서 혈청 함유 배지를 제거한 후, NGF (13290010, ThermoFisher Scientific, Waltham, MA, USA)를 20 ng/ mL 함유하는 Opti-MEM 배지로 교체하여 6일간 배양하 였으며, 격일로 배지를 교환해주었다. 분화된 PC12 세포 는 4% paraformaldehyde로 고정하고 anti-tubulin-bIII 항체 (1:800, Santa Cruz Biotechnology, Santa Cruz, CA, USA) 로 면역형광염색을 수행하고, 형광현미경(IX70, Nikon, Tokyo, Japan)을 이용하여 형광이미지를 촬영하고 이미지 를 NIS Elements software (version 4.1, Nikon)를 사용하 여 분석하였다.
신경돌기 길이 다음과 같이 측정하였다(Harrill and Mundy, 2011). NGF와 함께 가물치 추출물을 처리하여 6 일간 분화시킨 PC12 세포는 임의로 다섯 부분을 선택하여 100배 배율의 위상차현미경에 보이는 시야(field)를 확인하 고 사진으로 이미지를 획득하였다. 임의로 선택된 다섯 부 분에서 신경돌기가 가장 길게 자란 순서대로 총 250개의 신경세포를 선택하여 각각의 신경돌기 길이를 측정한 후 이를 평균화하여 추출물별로 비교하였다. 만일 하나의 세 포에서 여러 개의 신경돌기가 자라나거나 분지(branch)가 형성된 경우는 이를 모두 합산하여 신경돌기의 길이로 간 주하였다.
신경세포 분화 관련 유전자들의 발현을 단백질 수준에 서 비교하기 위하여 준비된 세포를 차가운 PBS 완충액으 로 2회 세척 후, protease & phosphatase inhibitor cocktail (1861281, ThermoFisher Scientific, Cambridge, MA, USA) 를 섞어 제조한 radioimmunoprecipation assay buffer (Santa Cruz Biotechnology, Santa Cruz, CA, USA)을 넣고 얼음 속에서 10분간 세포들을 용해시켰다. 다시 초음파분쇄기 를 이용하여 균질화 하였다. 균질액은 4°C에서 13,000×g 으로 15분간 원심분리 한 후 상층액을 BCA Protein Assay Kit (Pierce, Rockford, IL, USA)를 이용하여 총 단백질을 정량하였다. 정량된 단백질은 동일한 농도 (30 μg)로 10% SDS polyacrylamide gel에서 전기영동 후 nitrocellulose membrane으로 옮기고 나서 5% skim milk (Difco, Detroit, MI, USA)가 첨가된 Tris-buffered saline with 0.05% Tween 20 (TBST) 완충액으로 1시간 실온에 서 blocking 하였다. synapsin-1 (5297S, Cell Signaling Technology, Beverly, MA, USA)과 GAP43 (ab75810, Abcam, Cambridge, MA, USA)에 대한 1차 항체를 5% skim milk에 희석하여 4°C 냉장고에서 overnight시켰다. 다 음날 horseradish peroxidase (HRP)가 결합되어 있는 2차 항체와 1시간 동안 상온에서 반응시켰다. 다시 TBST 완 충액으로 10분간 3회 세척한 후 Clarity Western ECL Substrate (Bio-Rad Laboratories Inc., Berkeley, CA, USA) 로 1분간 반응시킨 뒤 ChemiDocTM Touch Imaging System (Bio-Rad Laboratories Inc.)을 사용하여 band를 검출했으며, β-actin (Sigma)을 loading control로 사용하였다.
결과 및 고찰
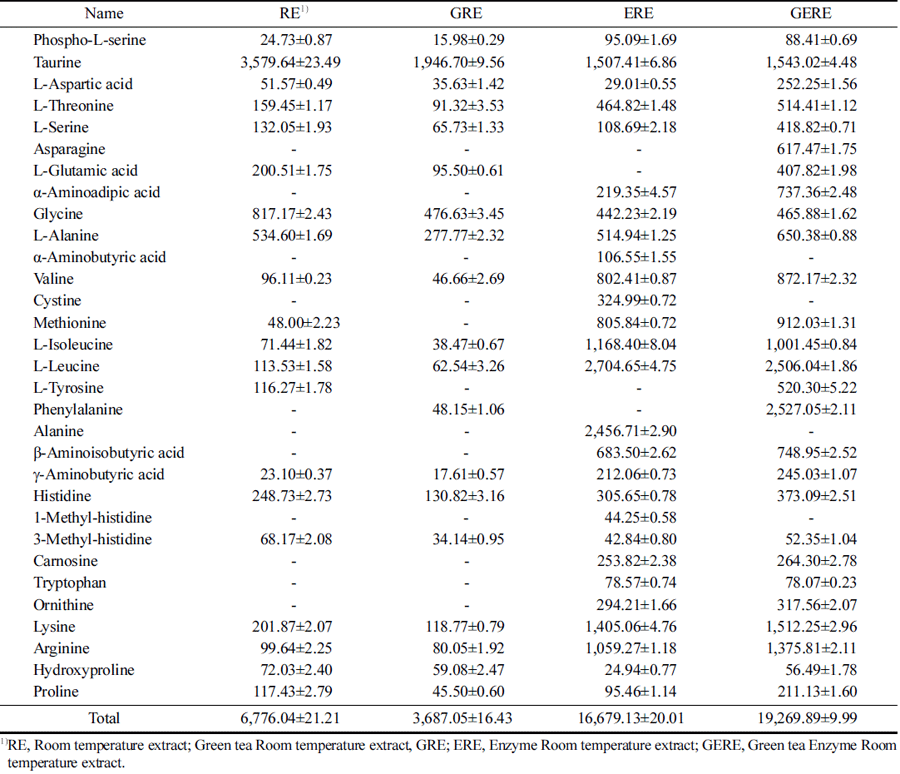
RE, GRE, ERE, 및 GERE의 유리아미노산 함량을 분 석한 결과는 Table 1과 같다. 총 유리아미노산 농도는 GRE<RE<ERE<GERE 순으로 증가하는 경향을 보였다. 특히 효소를 사용하여 추출한 ERE와 GERE의 경우 총 유리아미노산의 함량은 건중량 100 g당 각각 16,679.29, 19,269.89 mg으로 RE 7,210.88 mg과 GRE 3,687.05 mg에 비교하여 2.3-5.2배 이상 총 유리아미노산 농도가 증가하였 다. 필수아미노산 중 황 함유 아미노산인 메티오닌의 함 량은 RE와 비교하여 ERE와 GERE에서 각각 16.8배, 19 배 이상의 함량 증가를 보였다. 혈액-뇌 장벽(blood-brain barrier)을 투과할 수 있는 아미노산인 티로신과 5-히드록 시트립토판은 각각 도파민과 세로토닌의 전구체이다 (Gelenberg et al., 1984;Hou et al., 2006). 티로신은 RE, ERE, GERE에서 각각 116.27, 428.41, 520.30 mg으로 증 가하는 경향을 보였다. 이 외에 우울증 치료에 효과가 있 는 아미노산은 트립토판, 페닐알라닌, 글루타메이트, 글 리신 등이 있다(Kravitz et al., 1984;Altamura et al., 1995;Parker and Brotchie, 2011;Sanacora et al., 2012). 트립토판은 ERE, GERE에서, 페닐알라닌은 GERE에서, 글 루타메이트는 GERE에서, 글리신은 RE에서 많이 추출되었 다. 우울증과 관련된 주요 요인 중 하나는 신경 전달 물질 인 노르에피네프린, 세로토닌 및 도파민(the amine theory) 의 감소이다(Hou C et al., 2006;Hasler, 2010). 이러한 신 경 전달 물질의 낮은 수준은 수많은 질병을 유발할 수 있 다는 것이 알려져 왔다. 신경 전달 물질 불균형은 우울증, 불안, 공황 발작, 불면증, 과민성 대장, 호르몬 기능 장애, 섭식 장애, 섬유근통, 집착, 강박, 부신 기능 장애, 만성 통 증, 편두통, 심지어 조기 사망을 유발할 수 있다. 신경 전 달 물질은 식이 단백질에서 얻은 아미노산으로부터 합성된 다는 것은 잘 알려져 있다. 단백질은 특정 화학 물질과 효 소의 작용을 통해 아미노산 성분으로 분해되고, 이들 아미 노산은 신경 전달 물질로 바꿀 수 있는 효소의 기질로 사 용된다. 따라서, 아미노산 요법(amino acid therapy)은 많은 환자에게 처방된 항우울제에 대한 보조제로 사용될 수 있 을 것이다.
|
본 실험에서는 대표적인 활성 산소종인 라디칼에 대한 소거능으로 항산화력을 측정하였다. 인체 내에서 생성되는 라디칼을 실험하는 부분은 어렵기 때문에 다른 라디칼을 대상으로 실험하여 인체내에서 라디칼 소거능을 간접적으 로 확인하는 방법인데, 각각의 실험에서 대체로 비슷한 경 향의 결과가 나오긴 하지만 완전 일치하게 결과가 나오진 않는다. 즉, 라디칼의 종류에 따라 표시되는 항산화능이 다 를 수 있기 때문에 본 실험에서는 DPPH 라디칼 소거능과 ABTS 라디칼 소거능을 실험하여 추출물들의 결과를 보았 다. 보라색을 나타내는 DPPH는 분자 내에 안정한 라디칼 을 함유하지만, 항산화활성이 있는 물질과 만나면 라디칼 이 소거되며 노란빛을 띄게 된다. 이때의 DPPH의 거동은 ·OH와 유사하며, 반응의 정도는 항산화제의 수소 공여능에 의존한다. 이런 DPPH 라디칼을 이용하여 일정량의 시료 용액과의 반응에 의하여 DPPH 라디칼이 감소하는 정도를 흡광도로 측정하여 시료의 항산화 활성을 측정하는 방법을 사용하여 RE, GRE, ERE, GERE의 항산화능을 비교하였 다. 시료의 농도를 1-10 mg/mL으로 조절하여 DPPH 라 디칼 소거능을 측정하였다(Fig. 1A). 추출 조건에 따른 항 산화능의 증가는 특별히 나타나지 않았다. 또한, ABTS 라디칼 소거능은 DPPH 방법과 함께 항산화 활성을 스크 리닝 하는데 많이 이용되며 ABTS를 peroxidase, H2O2와 의 반응에 의해 생성된 활성 양이온인 ABTS+가 시료 중 의 항산화성 물질에 의해 제거되어 고유의 청록색의 변화 를 흡광도 값으로 나타내어 추출물의 ABTS+ 라디칼 소거 활성을 측정할 수 있다. 추출 조건에 따른 가물치 추출물 의 ABTS 소거능을 측정하였다(Fig. 1B). 효소를 이용하여 추출 한 ERE, GERE에서 RE, GRE 보다 비교적 높은 ABTS 라디칼 소거활성을 보였다. 우울증에 기여할 수 있는 다른 요인으로는 뇌 세포의 세포막과 DNA 파괴를 유발할 수 있는 산화 스트레스가 있다(Khanzode et al 2003), 항산화제인 아스코르브산은 주요 우울증과 음의 상 관 관계를 가지고 있다는 사실이 잘 알려져 있다(Gautam et al., 2012). 또한, 마우스 우울증 모델에서 아스코르브산 투여가 우울증 완화에 효과가 있는 것으로 보고되었다 (Moretti et al., 2012).

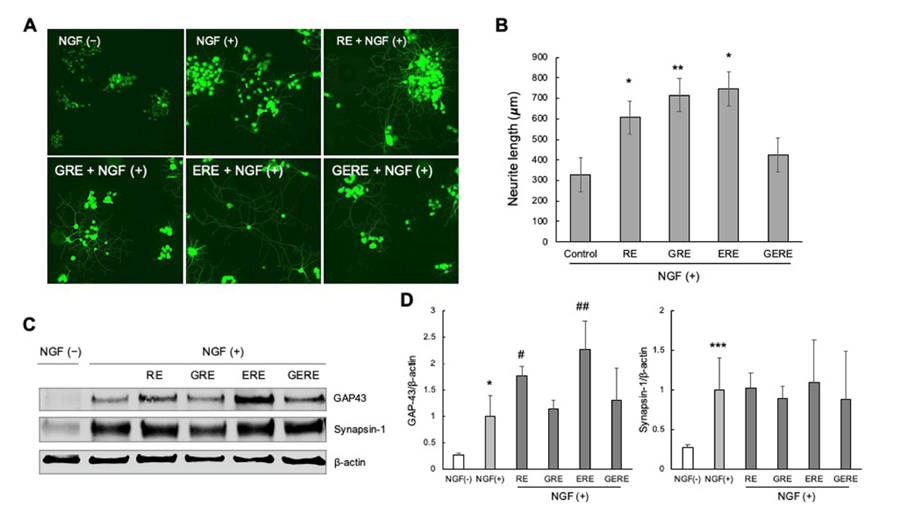
PC12 신경세포를 NGF 비처치군(NGF-), NGF 처치군 (NGF+), 가물치 추출물과 NGF를 동시에 처치한 군 (RE+NGF+, GRE+NGF+, ERE+NGF+, GERE+NGF+)으 로 나누어 6일간 분화 시킨 세포의 신경돌기 길이를 비교 하여 다음과 같은 결과를 얻었다. 현미경으로 관찰하였을 때 NGF가 없는 상태에서 배양했을 때 거의 모든 PC12 세포가 하나의 세포 직경보다 큰 신경 돌기 성장을 나타 내지 않았다(Fig. 2A, NGF-). 이에 비해 100 ng/mL 농도 의 NGF를 처리한 PC12 세포에서 몇 가지 신경돌기 성장 을 자극하였다(Fig. 2A, NGF+). 또한, NGF와 함께 다른 추출 조건에서 추출된 가물치 추출물에 노출 된 PC12 세 포는 모두 긴 신경돌기를 형성했으며, 이는 세포 직경이 3 개 이상인 이웃 세포까지 확장되었다(Fig. 2A, RE+NGF+, GRE+NGF+, ERE+NGF+) 이러한 결과는 NGF와 함께 RE, GRE, ERE를 처리한 세포군에서 PC12 세포의 NGF 유도 신경 돌기 성장을 상당히 촉진 할 수 있다는 정량적 분석에 의해 뒷받침된다(Fig. 2B). 우선 대조군인 NGF만 을 처리한 대조군(Control)에서 신경돌기 길이를 측정한 결과, 가장 잘 자란 250개 신경세포의 신경돌기 평균 길이 는 328.53±104.83 mm이었다. 또한 RE, GRE, ERE를 함 께 처리한 세포군에서 신경돌기의 평균 길이는 각각 607.03±156.22 (p=0.032473), 715.13±148.85 (p=0.006796), 745.92±54.09 mm (p=0.016274)로 대조군에 비해 통계적으 로 유의미한 소견을 보여주었다. 하지만, GERE를 함께 처 리한 세포군은 신경돌기의 평균 길이가 423.74±148.79 mm (p=0.266915)로 대조군에 비해 길어진 소견을 보였으 나 통계적으로 유의미한 소견은 아니었다(Fig. 2B). 다음으 로 척추 동물의 뉴런 특이적 단백질이며 성장 원추의 바이 오마커인 GAP-43 (Shubayev and Myers, 2004)에 대한 웨 스턴 블롯 분석을 통해 NGF에 의해 유도된 GAP-43의 증 가가 RE, GRE, ERE 처리로 더욱 강화되었음을 입증하여 이들 가물치 추출물이 새로운 신경 돌기 형성에 대한 효과 를 촉진했음을 확인하였다. 또한, 가물치 추출물은 신경 전 달 물질 방출 조절에 필수적인 인단백질인 synapsin-1 (Romano et al., 1987a and b)의 발현을 증가시킬 수 있음 을 발견했다. 본 연구의 결과들을 종합해 보면, NGF만 처리한 대조군에 비해 가물치 추출물을 함께 처리한 후 배양 한 세포의 신경돌기 길이가 더 길게 자라남을 관찰 하였다.
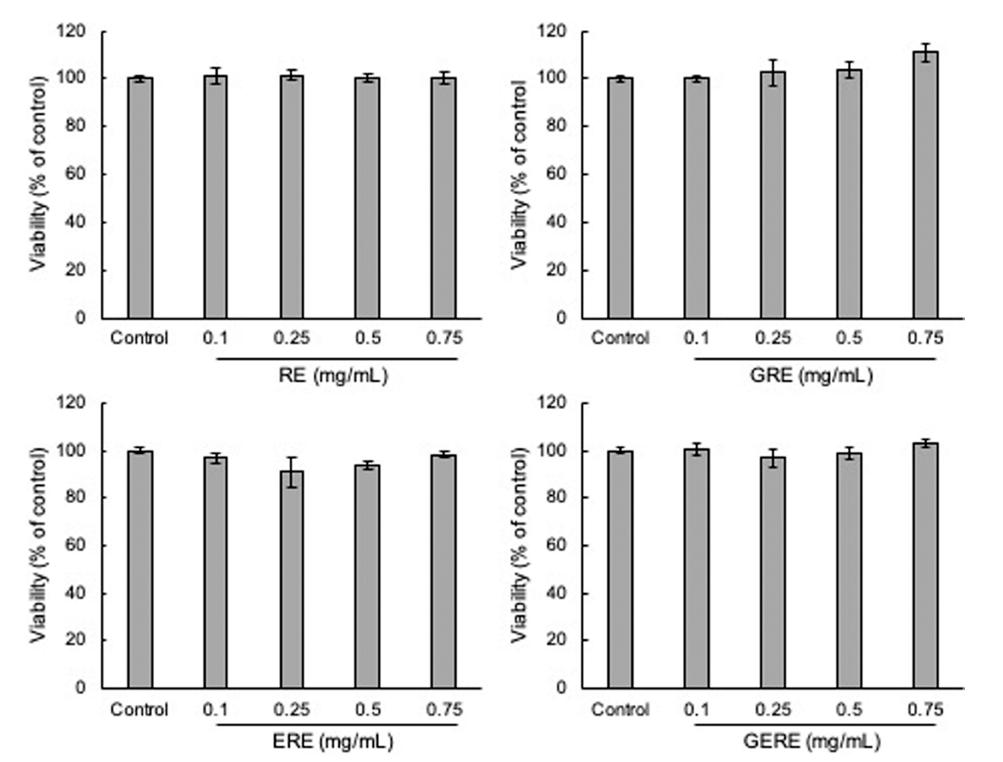
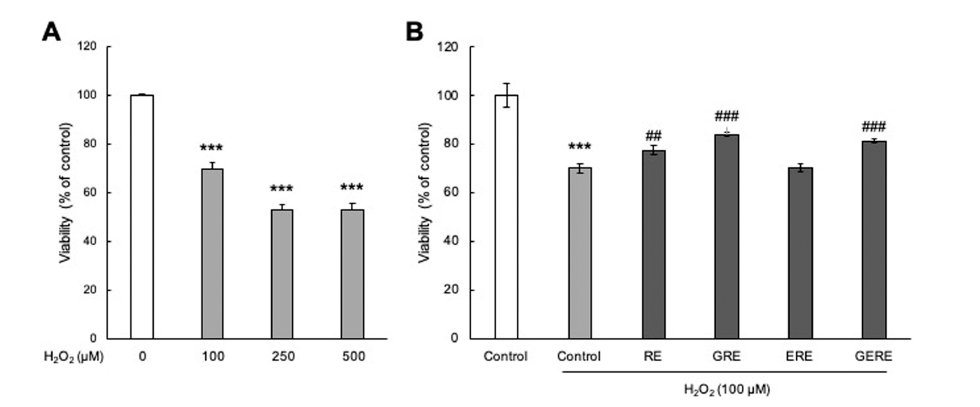
PC12 신경세포를 이용하여 추출 조건에 따른 가물치 추 출물을 농도별로 처리하여 세포 독성을 확인한 결과(Fig. 3), RE, GRE, ERE, 및 GERE 모두 0.75 mg/mL까지 세포 생존율의 뚜렷한 변화는 관찰되지 않아 PC12 세포에 대한 세포 독성이 거의 없는 것으로 판단되어 이후의 실험은 0.75 mg/mL의 농도범위에서 실시하였다. 과산화수소를 이 용하여 인위적으로 산화스트레스를 유도하였을 때, 세포 생존율은 대조군(control)에 비해 약 52% 정도로 감소하였 다(Fig. 4A). 추출 조건에 따른 가물치 추출물의 산화 스트 레스에 의한 신경세포 보호 효과를 확인하기 위해 배양한 PC12 신경세포에 각각의 가물치 추출물을 전 처치 후 산 화 스트레스를 유발하였을 때, 세포 생존율이 증가하였다 (Fig. 4B). RE는 최대 약 78%의 세포 생존율을 보였고, GRE의 경우 최대 약 84%의 세포 생존율을 보였다. 또한, GERE의 경우 약 81%의 세포 생존율을 보여 H2O2만 처리 한 대조군에 비해 세포 생존율이 증가하는 경향을 보였다. Zhang 등(Zhang et al., 2018)은 위장(gastrointestinal, GI) 소화 중에 가물치 수프의 항산화 활성이 증가하는 것을 발 견하였다. 또한 같은 연구 그룹에서 GI 소화를 시뮬레이션 한 가물치 수프에서 얻은 항산화 펩티드를 분리, 동정하고 특성을 규명하였으며, 이들 새로운 항산화 펩티드의 항산 화 메커니즘은 세포 항산화 Keap1-Nrf2 신호 전달 경로의 활성화를 통해 일어난다는 것을 보고하였다(Zhang et al., 2021). 따라서, 가물치 추출물은 과산화수소로 유도된 산화 스트레스에 대하여 녹차와 효소를 이용한 다양한 추출 조 건에서 추출한 추출물 내에 존재하는 페놀화합물 같은 산 화방지제와 펩타이드 성분에 의해서 신경세포를 보호하는 것으로 여겨진다.
요 약
본 연구에서는 가물치(Channa argus) 추출물의 신경세포 분화와 산화 스트레스에서의 효능을 분석하기 위하여 녹차 와 효소를 이용한 다양한 추출 방법(상온 추출물, RE; 녹 차 상온 추출물, GRE; 효소 상온 추출물, ERE; 녹차 효소 상온 추출물, GERE)을 사용하여 제조 된 추출물의 아미노 산 조성과 항산화 활성을 비교 분석하였고, 신경성장인자 (NGF) 유도 신경세포 분화 및 과산화수소 처리에 의해 유도된 PC12 세포 독성에 대한 보호효과를 규명하고자 하였다. 총 아미노산 함량은 RE 및 GRE보다 효소 추출물 인 ERE 및 GERE에서 훨씬 더 높았다. 효소 가수 분해물 (ERE 및 GERE)에서 ABTS 라디칼 소거 활성은 RE 및 GRE보다 높았다. 또한, RE와 ERE는 PC12 세포에서 neuronal growth factor (NGF) 매개 신경 돌기 성장뿐만 아 니라 growth associated protein (GAP)-43 및 synapsin-1의 발현을 현저하게 향상 시켰다. 과산화수소(H2O2)에 의해 손 상된 PC12 세포에 4가지 유형의 Channa argus 추출물을 첨가 한 후 PC12 세포의 생존율을 측정하였다. PC12 세포 의 생존율은 RE, GRE, GERE에서 각각 77.5±1.9%, 84.0±0.8%, 81.1±0.9%이였다. 이러한 세포 생존율은 H2O2 만을 처리 한 음성 대조군(70.0±2.0%)에 비해 더 높았다. H2O2 처리에 의해 유도 된 세포 독성도 RE, GRE 및 GERE 처리에 대한 반응으로 상당히 완화되었다. 종합하 면, Channa argus 추출물은 산화 스트레스와 신경 손상을 감소시키는 기능성 물질로 유용하다는 것을 시사하며, 향 후 이들 소재를 활용한 다양한 기능성 제품의 개발이 필요 할 것으로 판단된다.







