서 론
Nitric oxide (NO)는 NO synthase (NOS)에 의해 L-아르 기닌으로부터 생산되는 자유라디칼으로써, 혈관 이완, 신경 전달, 혈소판 응집 억제, 면역 방어 등 다양한 생리학적 과 정에서 중요한 역할을 한다(Mayer & Hemmens, 1997;Lala & Chakraborty, 2001). NOS에는 neuronal NOS (nNOS), inducible NOS (iNOS), endothelial NOS (eNOS) 등 세 종 류의 단백질 동형이 존재한다. nNOS와 eNOS는 상시 발 현되는 효소인 반면에 iNOS의 발현은 염증성 사이토카인 및 내독소에 의해 유도되며 다른 NOS에 비해 훨씬 많은 양의 NO를 생성한다(Forstermann et al., 1991). 하지만 iNOS에 의해 과량 생성된 NO는 염증, DNA 손상, 세포 사멸, 발암, 패혈성 쇼크 등의 병리 생리학적 문제들을 발 생시킬 수 있기 때문에 이를 조절하는 것은 매우 중요하다 (Dimmeler & Zeiher, 1997;Lala & Chakraborty, 2001).
Nuclear factor-κB (NF-κB)는 염증, 면역, 세포 증식, 세 포 사멸 등에서 중요한 역할을 하는 전사인자이다 (Viatour et al., 2005). 특히 NF-κB는 전염증성 유전자 발현의 가장 중요한 조절자중 하나로 알려져 있으며, tumor necrosis factor α (TNF-α), interleukin 1β (IL-1β), interleukin 6 (IL- 6) 등의 사이토카인의 합성은 iNOS 및 cyclooxygenase-2 (COX-2)의 발현과 마찬가지로 NF-κB에 의해 매개된다 (Surh et al., 2001;Tak & Firestein, 2001). 비활성 상태의 NF-κB는 억제 단백질인 IκB와 결합한 채로 세포질 내에 존재하지만, 기능적으로 활성화된 NF-κB는 주로 Rel family (Rel A 또는 p65, p50, p52, c-Rel, v-Rel, Rel B)의 소단위체로 구성되는 이종이량체의 형태로 존재한다(Surh et al., 2001;Tak & Firestein, 2001). 세포가 유사분열물질, 염증성 사이토카인, 자외선 조사, 이온화 방사선, 바이러스 단백질, 활성산소, 세균의 lipopolysaccharide (LPS) 등의 외부 자극에 노출되면 IκB의 인산화 및 프로테아좀에 의 한 분해가 유발되고, 자유로워진 NF-κB 이량체는 세포질 에서 핵으로 이동하여 사이토카인, 성장인자, 세포부착분자 등을 암호화하는 다양한 초기 반응 유전자를 전사시킬 수 있게 된다(Surh et al., 2001). 이러한 NF-κB 활성화는 다 양한 염증성 질환에 광범위하게 관련되어 있으며 새로운 항염증 약물에 대한 매력적인 치료 목표로서 많은 관심을 끌고 있다(Lawrence, 2009).
유산균은 그람 양성, 비 포자 형성, 혐기성 등의 특징을 가지는 세균으로, 전통적으로 다양한 발효 식품의 보존에 이용되어왔다(de Vries et al., 2006). 유산균은 식품에 존 재하는 당류로부터 유산을 생산하여 식품의 빠른 산성화 를 일으키고, 아세트산, 에탄올, 방향 화합물, 박테리오신, 세포 외 다당류(exopolysaccharide) 등의 다양한 대사산물 을 생성한다. 이러한 방법을 통해서 유산균은 식품의 유 통기한(Arendash et al., 2006) 및 미생물에 대한 안전성 을 증가시키고, 식품의 질감, 향미 등의 관능적 특성을 개 선시킬 수 있다(Leroy & De Vuyst, 2004). 그 중 에서도 Lactobacillus plantarum은 식물 유래 식품의 발효에 가장 흔하게 이용되는 유산균으로, L. plantarum이 식물에 풍부 하게 함유되어 있는 페놀 화합물을 분해하여 고부가 가치 의 항산화제(hydroxytyrosol, pyrogallol) 및 방향 성분(4- vinyl phenol, 4-vinyl guaiacol)을 생산하는 것이 알려지면 서 큰 관심을 끌고 있다(Rodriguez et al., 2009).
커피는 전 세계적으로 가장 널리 음용되는 음료 중에 하 나로, 최근에는 커피의 다양한 생리활성에 대한 연구들이 지속적으로 보고되고 있다. 다수의 연구들은 커피의 섭취가 간경화(Tverdal & Skurtveit, 2003), 파킨슨병(Ascherio et al., 2004), 당뇨병(Salazar Martinez et al., 2004), 알츠하이 머병(Arendash et al., 2006), 심혈관계 질환(Bonita et al., 2007), 각종 암(Tavani & La Vecchia, 2004;Gelatti et al., 2005;Tworoger et al., 2008;Zvrko et al., 2008) 등 다양한 질병의 위험을 감소시킨다고 보고하였다. 특히, 커피에서 발 견되는 카페인, 클로로겐산, 카페스톨, 트리고넬린, 카와웰 등의 항산화 물질은 만성 염증을 감소시키고, DNA 분해를 막아 궁극적으로 질병 위험을 완화할 수 있으며, TNF-α, IL-1β, IL-6, C-반응성 단백질 등의 염증 표지물질을 감소시 킬 수 있다(Frost Meyer & Logomarsino, 2012;Liang & Kitts, 2014). 하지만 현재까지 전염증성 사이토카인 및 관 련 신호 단백질에 대한 유산균 발효커피의 면역조절 기능 은 밝혀진 바가 없다. 따라서 본 연구에서는 L. plantarum 을 이용한 유산균 발효커피를 제조하여, LPS로 자극된 RAW264.7 대식세포에 대한 면역 조절 효과를 조사하였다.
재료 및 방법
본 실험에 사용된 에티오피아 예가체프(Ethiopia Yirgacheffe) 원두와 과테말라 안티구아(Guatemala Antigua) 원두는 2016년 지에스씨인터내셔날(GSC International, Inc., Seoul, Korea)에서 구입한 것으로 4°C에서 냉장 보관하여 실험에 사용하였다. MRS 배지는 Difco (Detroit, MI, USA) 에서, RPMI-1640 배지, fetal bovine serum (FBS), penicillin/ streptomycin는 Welgene (Gyeongsan, Korea)에서, EZCytox Cell Viability Assay Kit는 Daeil Labservice (Seoul, Korea)에서, Griess 시약, LPS는 Sigma-Aldrich (Saint Louis, MO, USA)에서, TRI reagent®는 Molecular research center, Inc. (Cincinnati, OH, USA)에서, High capacity cDNA transcription kit는 Applied Biosystems (Foster city, CA, USA)에서, SYBR ® Premix Ex TaqTM II는 Takara Bio, Inc. (Kusatsu, Japan)에서 각각 구입하였다.
본 실험에는 Korean Collection for Type Cultures (KCTC, Jeongeup, Korea)에서 분양 받은 L. plantarum KCTC3108 (이하 L. plantarum) 균주를 사용하였으며, L. plantarum의 배양을 위해 MRS 배지를 변형한 배지를 제조하여 사용하 였다(de Man et al., 1960;Sawatari et al., 2006).
L. plantarum의 초기배양을 위해 먼저 MRS 배지를 사용 하였다. L. plantarum을 MRS 배지 5 mL에 접종하여 배양 기(SIF500, Jeiotech Inc., Daejeon, Korea)에서 24시간 동 안 배양한 후 멸균 생리식염수(8.5 g/L of NaCl)로 수세하 여 동일한 용액 5 mL에 희석하였다. 그리고 희석액 2 mL를 위의 식용 배지 200 mL에 접종한 후 37°C, 100 rpm에서 다시 24시간 동안 증균배양하였다. 배양액은 4°C, 2,600×g 에서 10분간 원심분리(Combi 514R, Hanil Scientific Inc., Gimpo, Korea)하여 배지를 제거한 후 동결건조(FDV-7006, Operon-80, Operon Co., Gimpo, Korea)하여 -70°C에서 보 관하였다.
먼저 발효에 필요한 수분을 흡수시키기 위하여, 커피 생 두 300 g에 멸균증류수 30 mL을 첨가하여 40°C에서 4시간 동안 정치하였다. 이어서 생두 무게를 기준으로 각각 2, 5, 10% (w/w)의 포도당을 첨가하고, L. plantarum 분말을 1×105 CFU/g의 동일한 농도로 접종하여 40°C에서 24시간 동안 발효하였다. 발효가 끝난 원두는 멸균증류수로 2회 세척한 후 오븐(OF-02G, Jeiotech Inc., Daejeon, Korea)을 사용하여 50°C에서 24시간 동안 건조하였다.
건조가 끝난 원두는 220°C로 미리 예열된 커피 배전기 (IR-12, Diedrich Korea Inc., Hanam, Korea)에 투입하여 내부 온도가 100°C로 떨어질 때까지 약 3분간 방치한 후 온도를 다시 187°C까지 상승시키면서 약 3분간 배전하였 다. 더치커피 추출은 분쇄기(K30, Mahlkoenig, Hamburg, Germany)로 원두를 2 mm 크기로 분쇄한 후 칼리타 워터 드립 머신(45011, Kalita Inc., Yokohama, Japan)을 사용하 여, 분쇄한 원두 250 g을 2 L의 정제수를 이용하여 10시간 동안 추출하였다. 추출이 끝난 시료는 4°C에서 냉장 보관 후 실험에 사용하였다.
RAW264.7 대식세포를 10% FBS와 1% penicillin/streptomycin이 함유된 RPMI-1640 배지에 현탁 시킨 후, 96 well plate에 접종(1×105 cells/well)하여 24시간 동안 배양한 후 LPS와 5% 커피 추출물을 처리하였다. 다시 24시간 동안 배양한 후 상등액을 버리고 EZ-Cytox Cell Viability Assay Kit를 사용하여 Kim et al. (2011)의 방법에 따라 대식세포 의 증식률을 측정하였다. 대식세포의 증식률 (%)은 다음의 식에 따라 계산되었다.
커피 추출물에 대한 면역 활성을 조사하기 위하여 대식 세포의 NO 생성량을 조사하였다. RAW264.7 대식세포를 96 well plate에 접종(1×105 cells/well)하여 24시간 동안 배 양한 후 LPS와 5% 커피 추출물을 처리하였다. 다시 24시 간 동안 배양한 후 상등액을 채취하여, Griess 시약을 처리 한 다음 540 nm 파장에서의 흡광도를 측정하여 NO 생성 량을 조사하였다(Green et al., 1982;Cao et al., 2014).
RAW264.7 대식세포로부터 총 RNA를 분리하기 위해 TRI reagent®를 사용하였다. 그리고 100% 이소프로판올을 사용하여 RNA를 침전시킨 후 75% 에탄올로 세척하였다. 추출한 RNA는 핵산분해효소를 제거한 증류수에 용해한 후 나노분광광도계(P330, Implen Inc., Munchen, Germany)를 사용하여 농도를 측정하였다. cDNA는 High capacity cDNA transcription kit를 사용하여 제조사가 제공한 방법에 따라 합성하였다.
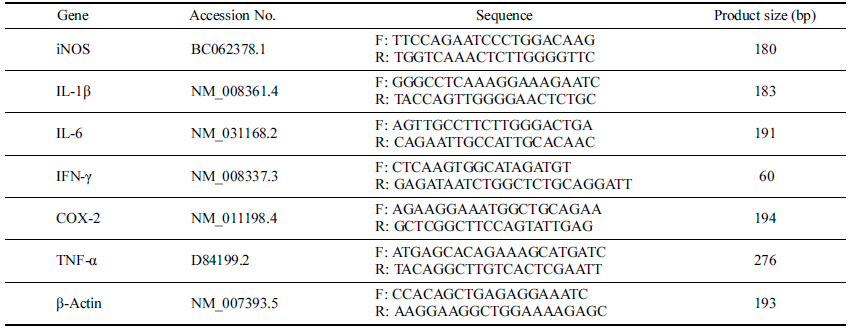
RAW264.7 대식세포의 면역관련 유전자의 발현을 분석 하기 위하여 SYBR ® Premix Ex TaqTM II와 96 well 방식 의 QuantStudioTM 7 Flex Real-Time PCR system (Thermo- Fisher scientific, Waltham, MA, USA)을 사용하였다. 반응 액에는 각 유전자의 프라이머쌍 0.4 μM (Table 1) 및 cDNA 주형 0.1 ng이 포함되었다. PCR 증폭 조건은 95°C 에서 30초 동안의 초기 변성(initial denaturation) 이후에 95°C에서 5초 동안의 변성(denaturation), 55°C에서 5초 동 안의 결합(annealing) 및 신장(extension)을 40회 반복하여 수행하였다. 정량 결과는 2-ΔΔC T법(Livak & Schmittgen, 2001)을 이용하여 참조 mRNA (β-actin)와 비교하여 나타 내었다.
|
결과 및 고찰
커피 추출물이 RAW264.7 세포의 독성에 미치는 영향을 확인하기 위하여, RAW264.7 세포에 각각의 커피 추출물 을 처리하여 배양한 후 EZ-Cytox Cell Viability Assay Kit 를 사용하여 세포의 증식률을 조사하였다(Fig. 1). 예가체 프 원두를 사용하여 추출한 Y2, Y5, Y10 처리군의 경우 에는 대조군과 비교하여 100% 이상의 생존율을 보여 어떠 한 독성 효과도 없는 것으로 확인되었다. 그러나 안티구아 원두를 사용한 A2, A5, A10 처리군의 경우에는 대조군보 다 낮은 세포 생존율을 나타내어, 사용된 커피 원두의 품 종에 따라 대식세포의 증식률의 차이가 발생하는 것으로 판단하였다.

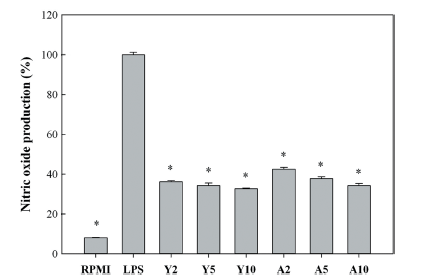
대식세포는 숙주 방어와 염증 반응의 중요한 매개체인 NO 및 전염증성 사이토카인의 생산을 비롯한 다양한 기능 을 수행하는 다능성 세포이다. 이러한 점에서 그람음성 세 균의 세포벽의 구성성분인 LPS는 대식세포 기능의 가장 중요한 조절자 중 하나이다(St Denis et al., 1998). LPS에 의한 대식세포의 자극은 iNOS의 발현을 초래하며, 이는 L-아르기닌과 분자 산소로부터 많은 양의 NO를 생산하는 촉매 작용을 한다(Cho et al., 2003). 하지만 면역세포 내에 서 iNOS에 의해 과도하게 생산된 NO는 세포 손상의 발 생 원인이 되기 때문에, iNOS의 생산 및 활성을 차단함으 로써 과량의 NO 생성을 방지하는 것은 면역 질환 치료의 유용한 전략이 될 수 있다(Kim et al., 2004). 따라서 본 연구에서는 유산균 발효 커피 추출물의 항염증 활성을 확 인하기 위하여 LPS에 의해 자극된 RAW264.7 대식세포의 NO 생성량을 측정하였다(Fig. 2). RAW264.7 세포에 LPS 를 처리하고 24시간 후, 배지 내에 축적된 NO의 농도는 약 12배 이상 증가하였다. 그러나 각각의 커피 추출물을 RAW264.7 세포에 처리했을 때, 모든 처리군에서 LPS 자 극에 의해 증가된 NO 생성이 유의하게 억제되는 것을 확 인하였다. 특히 생두 무게의 10% (w/w)의 포도당을 사용 하여 발효한 Y10과 A10 커피 추출물은 2% (A2와 Y2)와 5% (A5와 Y5)의 포도당을 사용하여 발효한 커피 추출물 보다 높은 NO 생성 억제 능력을 나타내었다.
NF-κB는 염증 및 면역 반응에 관여하는 다양한 초기 반 응 유전자의 발현을 조절하는 전사인자로서의 역할에 근거 하여 새로운 항염증 및 면역조절 약물에 대한 치료 목표로 서 많은 관심을 끌고 있다(Lawrence, 2009). NF-κB에 의 해 조절되는 것으로 알려진 유전자에는 COX-2와 iNOS가 포함되어있다(Tak & Firestein, 2001). COX-2와 iNOS는 염증 반응을 조절하는 중요한 효소들로, COX-2 및 iNOS 유전자의 5'-프로모터 영역은 모두 NF-κB 결합 서열을 포함하기 때문에 동일한 병리 생리학적 자극이 두 유전 자의 발현을 동시에 유발할 수 있다(Surh et al., 2001). RAW264.7 세포에 LPS를 처리하고 24시간 후, COX-2와 iNOS 유전자의 발현은 모두 현저히 증가하였다(Fig. 3). 하 지만 각각의 커피 추출물을 RAW264.7 세포에 처리했을 때, 모든 커피 추출물 처리군에서 LPS 자극으로 증가한 COX-2 및 iNOS 유전자의 발현이 유의적으로 감소하는 것 을 확인할 수 있었으며, Y10과 A10 커피 추출물이 2% 및 5%의 포도당을 사용한 커피 추출물 보다 상대적으로 높은 활성을 나타내었다. 또한, iNOS 유전자의 경우 NO 생성 (Fig. 2) 결과와 유사한 경향을 나타내어, 커피 추출물에 의한 NO 생성량의 감소는 iNOS 유전자의 발현 억제 효 과에 기인하는 것으로 판단하였다.
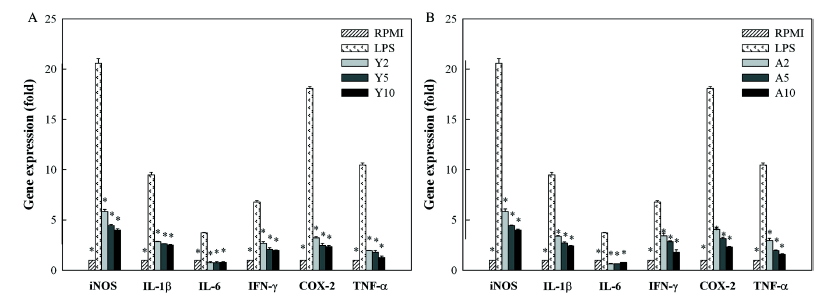
COX-2와 iNOS 유전자 이외에도 TNF-α, IL-1β, IL-6, IFN-γ 등 사이토카인 유전자의 발현도 측정되었다. IFN-γ 는 Th1 세포, NK 세포 등을 포함한 다양한 종류의 세포 에서 생성되는 다면 발현성 사이토카인으로, TNF 활성을 증가시키고 NO 생성을 유도하는 역할을 하기 때문에 전염 증성 사이토카인으로 여겨진다(Dinarello, 2000;Schroder et al., 2004). 또한, TNF-α, IL-1β, IL-6 등의 전염증성 사 이토카인은 활성화된 대식세포에서 분비되며 염증 반응을 유발하는 것으로 알려져 있다(Zhao & Liu, 2016). 본 연구에 서는 커피 추출물의 처리가 LPS 자극에 의해 증가한 TNF- α, IL-1β, IL-6, IFN-γ 등 네 가지 사이토카인 유전자의 발 현을 유의하게 억제하는 것을 확인할 수 있었으며, TNF-α, IL-1β, IL-6의 경우에는 NO 생성 및 COX-2, iNOS 유전 자의 정량 결과와 마찬가지로 Y10과 A10 추출물이 다른 커피 추출물에 비해 상대적으로 높은 활성을 나타내었다. 반면에 IL-6의 경우에는 2%의 포도당을 사용하여 발효한 Y2와 A2 커피 추출물이 가장 높은 억제효과를 나타내었다.
커피에서 발견되는 카페인, 클로로겐산, 카페스톨, 트리고 넬린, 카와웰 등의 성분은 항산화 작용을 나타내기 때문에, 커피는 산화적 스트레스 줄임으로써 염증을 감소시키는 역 할을 할 수 있다(Liu & Kitts, 2011;Liang & Kitts, 2014). 그중에서도 클로로겐산은 커피에 가장 풍부하게 함유되어 있는 항산화제로써, 카페익산, 페룰산, p-쿠마린산 등의 trans-cinnamic acid와 퀸산의 에스테르 결합으로 구성되어 있다 (Ferruzzi, 2010). 커피 원두에 함유된 클로로겐산의 일부는 배전과정 중에 퀴노락톤이나 멜라노이딘으로 변형 되며, 이는 클로로겐산이 보다 높은 항산화 활성을 나타내 는 카페익산과 퀸산으로 대사되는데 영향을 미친다 (Natella et al., 2002). L. plantarum의 cinnamoyl esterase는 클로로겐산 내의 에스테르 결합을 가수분해하여 카페익산 과 퀸산을 생산하는 것으로 보고된 바 있으며, 본 실험에 서는 L. plantarum에 의한 클로로겐산의 분해가 유산균 발 효커피의 항산화 활성에 영향을 미친것으로 판단된다 (Fritsch et al., 2016).
종합적으로, 본 연구를 통해서 유산균 발효커피 추출물 이 LPS에 의해 활성화된 RAW264.7 대식세포 내에서 염 증전달물질인 NO의 생성과 COX-2, iNOS, TNF-α, IL-1β, IL-6, IFN-γ 등의 면역관련유전자의 발현을 감소시키는 것 을 확인하였다. 이러한 항염증 활성은 아마도 NF-κB 신호 전달 경로를 통해서 조절된다고 생각된다. 본 연구 결과는 면역세포에 대한 유산균 발효 커피 추출물의 항염증 기전 을 이해하는데 도움이 될 수 있으리라 생각되며, 또한 유 산균 발효 커피 추출물은 유용한 항염증성 식품 소재로 이 용될 수 있다고 판단된다.
요 약
커피는 전 세계적으로 가장 널리 음용되는 음료 중에 하 나로, 항산화 및 항염증 활성을 나타내는 카페인, 클로로겐 산, 카페스톨, 트리고넬린, 카와웰 등의 물질을 함유하고 있다. Lactobacillus plantarum은 식물성 식품의 발효에 가장 흔하게 사용되는 유산균으로, 식물에 풍부하게 함유 되어 있는 페놀 화합물을 분해하여 고부가 가치의 항산화 제 및 방향 성분을 생산한다. 본 연구에서는 L. plantarum 을 이용한 발효커피를 제조하여 RAW264.7 대식세포에 대 한 면역 조절 효과를 조사하였다. 커피 발효에는 에티오피 아 예가체프(Ethiopia Yirgacheffe)와 과테말라 안티구아 (Guatemala Antigua) 2종의 원두가 사용되었으며, Y2와 A2는 2%의 포도당, Y5와 A5는 5%의 포도당, 그리고 Y10과 A10은 10%의 포도당이 발효를 위해 첨가되었다. lipopolysaccharide에 의해 자극된 RAW264.7 세포에서 유 산균 발효 커피 추출물은 nitric oxide 생성 및 inducible nitric oxide synthase, cyclooxygenase-2, tumor necrosis factor α, interleukin 1β, interleukin 6, interferon γ 등의 면 역 관련 유전자의 발현을 유의하게 억제하였으며, Y10과 A10 추출물이 다른 커피 추출물에 비해 상대적으로 높은 항산화 활성을 나타내었다. 반면에 IL-6의 경우에는 Y2와 A2 커피 추출물이 가장 높은 억제효과를 나타내었다. 본 연구 결과는 면역세포에 대한 유산균 발효 커피 추출물의 항염증 기전을 이해하는데 도움이 될 수 있으리라 생각되 며, 또한 유산균 발효 커피 추출물은 유용한 항염증성 식 품 소재로 이용될 수 있다고 판단된다.







