서 론
동충하초는 곤충을 숙주로 하여 생장하는 버섯으로 자낭 균강(Ascomycota), 맥각균목(Clavicipitales), 맥각균과(Clavicipitaceae) 에 속한다. 이들 중 대표적인 균은 Cordyceps 속으로서 전 세계적으로는 현재까지 약 300여종이 알려져 있고, 이 중 국내에서 채집 및 분류된 것은 약 80여종이다 (Jeong and Choi, 2015). Cordyceps 속 중에서 대표적인 동충하초 종으로는 번데기에 기생하는 버섯인 Cordycepsmilitaris이며, 북동충하초, 잠용충초, 용초, 번데기 동충하초 등으로 불린다(Huang et al., 2009).
동충하초는 다양한 생리활성을 지니고 있는데, 피로회복 (Paik et al., 2006), 항산화능 및 항암활성(Kim et al., 2001; Wang et al., 2013) 등이 보고되고 있다. 이러한 생리활성을 지니는 성분으로는 cordycepin, cordycepic acid, ergosterol, 충초다당, nucleosides, 펩타이드, superoxide dismutase 등 이 있는데, 이중에서 adenosine의 유도체인 cordycepin이 동충하초의 대표적인 지표물질이다(Yue et al., 2012; Jeong and Choi, 2015). Lu et al.(2015)은 C. militaris로부터 분리 된 화합물 중 cordycepin, ergosterol, 3,4-O-isopropylidene- D-mannitol과 ergosterol peroxide가 염증 매개체 생산과 인 간 암세포 증식을 억제하였고, TLR4 매개 NF-κB 신호 전 달 경로를 억제하여 항염증 활성을 갖는다고 보고하였으며, Park et al.(2012)은 발아대두 동충하초 추출물의 아토피 개 선 효과를 입증하였다. 동충하초는 식품공전 상에서 버섯 류로 분류되어 있으며, 현재 식품으로서의 안정성을 인정 받은 눈꽃 동충하초와 밀리터리스 동충하초 2종만 식품으 로의 제조 및 판매가 가능하고, 동충하초 주정추출물이 면 역기능성 증진을 토대로 개별인정형 원료로 인정되어 있다.
대두(Glycine max Merrill)는 콩목(Fabales), 콩과(Fabaceae), 콩속(Glycine)에 속하는 한해살이풀로, 청국장, 된장, 두유 등 다양한 식품에 사용되어 왔고, isoflavone, 올리고당, saponin, peptide 등 기능성 성분이 다량 함유되어 있어 체 내 콜레스테롤을 낮추고, 만성질환 예방 효과가 있다고 밝 혀졌다(Lee, 2005). 발아대두는 대두를 발아를 통해 기능성 성분이 강화되는데, Kim et al. (2004)은 대두를 발아시키 면 isoflavone이 향상된다고 하였고, Lee et al. (2005)은 발아 시작 후 1-2일 후인 발아 초기에 isoflavone이 현저하 게 증가한다고 보고하였다.
유산균은 다양한 생리활성을 지니고 있어 대표적인 프로 바이오틱스 균주로 식품이나 의약품 등에 사용되고 있다 (Barreto, 2014; Shi et al., 2014). 식품을 유산균으로 발효 시키면 식품을 보다 오래 보관할 수 있고, 인체 내 유해한 미생물을 억제시킬 수 있을 뿐만 아니라 대사산물로 아세 트산, 에탄올, 아로마 화합물 및 다양한 효소를 생산하여 생리활성능이 증가하고 맛과 향이 향상된다(Leroy, 2004).
따라서 본 연구는 우수한 생리활성을 지니는 식품 소재를 개발하기 위하여 발효능이 우수한 유산균주를 분리한 후 다 양한 생리활성이 있는 동충하초와 발아대두를 발효시킴으로 써 cordycepin 함량이 증진된 유산균 발효 소재를 개발하고 자 하였으며, 이를 위한 공정 최적화연구를 수행하였다.
재료 및 방법
본 연구의 표준균주로 사용된 Lactobacillus plantarum KCCM12116은 (사)한국종균협회 부설 한국미생물보존센터 (Seoul, Korea)로부터 분양받았고, 동충하초 분말과 발아대 두 분말은 ㈜세포활성연구소(Seongnam, Korea)로부터 제공 받았다. BCP plate count agar는 MB cell (Seoul, Korea)에 서 구입하였고, MRS broth와 agar는 BD (Franklin Lakes, NJ, USA)에서 구입하였으며, API kit는 bioMérieux Ltd. (Marcyl'Étoile, France) 제품을 사용하였다.
유산균주 분리를 위한 동충하초 한천배지는 1%(w/v) 동 충하초 분말과 1.5%(w/v) agar를 증류수에 넣어 121°C에 서 15분 동안 멸균하여 조제하였으며, 동충하초 액체배지 는 1%(w/v) 동충하초 분말을 증류수에 넣어 121°C에서 15 분 동안 멸균하여 조제하였다. 발아대두 동충하초 고상발 효의 종균 배양을 위한 발아대두 동충하초 액상 발효액은 발아대두에 증류수를 25배수 첨가하여 105°C에서 2시간동 안 추출하여 추출액을 제조한 후, 발아대두 추출액과 동충 하초 분말이 각각 50%(v/v)와 0.5%(w/v)이 되도록 액상배 지를 제조한 다음 pH를 7.0으로 조정하였다. 이를 121°C 에서 15분 동안 멸균한 후 유산균주를 접종하여 종배양과 본 배양을 각각 37°C에서 24시간 동안 수행하여 제조하였 다. 발아대두 동충하초 고상 배지는 동충하초 분말과 발아 대두 분말을 일정비율로 증류수에 혼합한 후 121°C에서 15분 동안 멸균하여 사용하였다.
유산균주 분리를 위하여 전통발효식품(김치, 젓갈, 장류 등), 낙과, 채소 등으로부터 유산균주를 분리하였다. 각 시 료 1 g을 멸균생리식염수(0.88%(w/v) NaCl)에 현탁한 후 십진희석하여 BCP plate count agar에 도말한 후 37°C에서 24시간동안 anaerobic Gas Pack (BD)에 넣어 혐기 배양하 여 생성된 집락을 순수 분리하였다. 분리균주를 1%(w/v) 동충하초 한천배지에 37°C에서 24시간 배양한 후 집락을 생성하는 유산균을 동충하초 발효능이 있는 균주로 1차 선 별하였다.
1차 선별한 유산균주를 1%(w/v) 동충하초 액체배지에 접종하여 37°C에서 24시간 배양한 후 Epoch microplate spectrophotometer (BioTek, Winooski, VT, USA)를 사용하 여 640 nm에서 접종 직후와 24시간 배양 후의 흡광도 차 를 측정하여 발효능이 우수한 유산균주를 2차 선별하였다. 2차 선별된 균주를 1%(w/v) 동충하초 액체배지에서 37°C 에서 24시간 배양한 후 배양액을 15,900 × g에서 3분간 원 심분리하여 0.2 μm PVDF filter로 여과한 다음 그 여과액 의 cordycepin 함량을 HPLC로 분석하여 cordycepin의 함 량이 증가한 시료의 유산균주를 3차 선별하였다.
3차 선별한 유산균주를 1%(w/v) 동충하초 액체배지에 37°C에서 24시간 배양한 후 동충하초 원물에 접종하여 37°C에서 24시간동안 배양하여 고상발효하였다. 동충하초 고상발효물 1 g을 취해 증류수 9 mL을 넣고, 90°C에서 2시 간동안 추출한 후 15,900 × g에서 3분간 원심분리하여 0.2 μm PVDF filter로 여과한 다음, 여과액 내의 cordycepin 함량을 분석하여 cordycepin의 함량이 증가한 시료의 유산 균주를 4차 선별하였다.
시료의 cordycepin 함량은 HPLC(Dionex ultimate 3000, Thermo Fisher Scientific, Waltham, MA, USA)를 이용하 여 아래의 조건으로 분석하였다. 이동상은 d-H2O:methanol = 80:20 용액을 사용하였고. column은 ZORBAX eclipse plus C18 4.6×250 mm, 5 μm (Agilent Technologies, Santa Clara, CA, USA)를 사용하였다. 시료는 10 μL를 주입하였 으며 column의 온도는 30°C, 유속은 1 mL/min으로 20분간 수행하였고 UV 검출기로 254 nm에서 시료를 검출하였다. 데이터 분석은 ChromeleonTM 7.2 Chromatography Data System (CDS) Software를 사용하였다.
분리 군주의 16S ribosomal DNA sequencing을 이용한 계통학적 분류 동정 방법과 Gram 염색, KOH 시험, 운동 성 시험, catalase 시험, API 50 CHL kit를 이용한 당 이 용성, 전자현미경 관찰 등의 형태학적, 생리학적 특성 분석 은 Shim et al. (2014)의 방법에 따라 수행하였다.
총 플라보노이드 함량은 aluminum chloride법에 따라 비 색 정량하였다(Lin & Tang, 2007). 시험관에 에탄올로 10 배 희석한 동충하초 고상발효 추출물 0.5 mL과 95% 에탄 올 1.5 mL, 10%(w/v) aluminum chloride hexahydrate 0.1 mL을 차례로 넣고 혼합하였다. 이 때 공실험의 경우, aluminum chloride hexahydrate 대신 증류수를 첨가하였다. 1M potassium acetate 0.1 mL과 증류수 2.8 mL을 차례로 넣고 실온에서 30분간 반응 후 spectrophotometer를 이용하 여 415 nm에서 흡광도를 측정하였다. 표준곡선은 0-200 μg/mL 범위의 quercetin을 이용하여 작성하였다.
총 폴리페놀 함량은 Folin-Denis 방법으로 측정하였다 (Lee et al., 2013). 시험관에 증류수로 10배 희석한 동충하 초 고상발효 추출물 0.1 mL와 2 N Folin-ciocalteu’s reagent 0.2 mL, 증류수 2 mL을 차례로 넣은 후 3분간 실온에서 반응시켰다. 20%(w/v) Na2CO3 2 mL을 첨가한 후, 실온에 서 1시간동안 발색하였고, spectrophotometer를 이용하여 765 nm에서 흡광도를 측정하였다. 표준곡선은 0-500 μg/mL 의 gallic acid를 이용하여 작성하였다.
96 well plate에 희석한 동충하초 고상발효 추출물 0.01 mL와 methanol에 용해한 0.1 mM DPPH (1,1-diphenyl-2- picrylhydrazyl) 0.19 mL을 가하여 섞은 후 암소에서 30분 간 반응시켰다. 이후 spectrophotometer를 이용하여 517 nm에서 흡광도를 측정하였으며 표준곡선은 0-5 mM의 ascorbic acid를 사용하여 작성하였다. 이때 공실험의 경우, 시료 대신 증류수를 넣었고, 양성 대조군은 2 mM의 ascorbic acid를 사용하였다. 시료의 DPPH 라디칼 소거 활 성은 다음 식을 이용하여 계산하였다.
통계분석은 IBM SPSS(2014) Statistics ver. 23 program 을 이용하여 일원배치 분산분석(ANOVA)를 시행한 후, p<0.05 수준에서 Duncan의 다중범위검정에 의해 실험군간 평균치의 유의성을 검정하였다.
결과 및 고찰
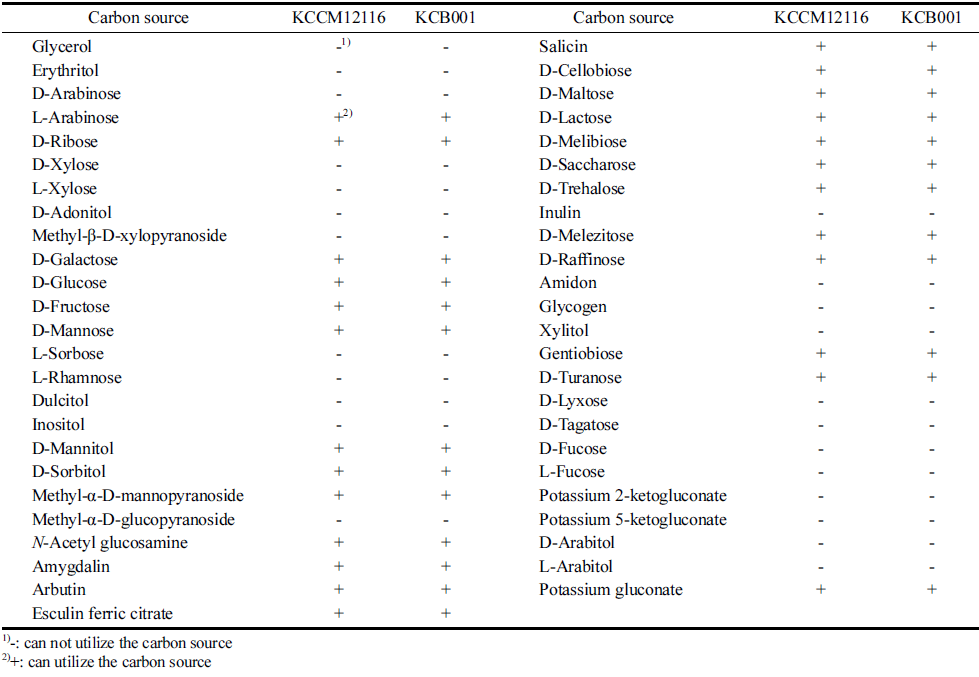
발아대두 동충하초의 발효를 위한 균주를 탐색하기 위하 여 다양한 발효식품, 낙과, 채소로부터 총 654개의 유산균 을 분리하여 1%(w/v) 동충하초 분말을 함유한 고체배지에 배양한 결과 500균주가 집락을 형성하여 이를 동충하초에 서 생육이 가능한 균주로 1차 선별하였다. 1차 선별한 균 주를 1%(w/v) 동충하초 액체배지에 배양하여 배양 전과 후의 배양액 흡광도 차가 0.3 이상인 58균주를 동충하초 액체배지에서 생육활성이 우수한 균주로 2차 선별하였다. 이들 균주의 배양액 내 cordycepin 함량의 배양 전과 후의 변화가 높은 4균주를 3차 선별하였다. Cordycepin 함량을 증진시키는 4균주 중 동충하초 고상발효 후 cordycepin 함 량 변화가 가장 높은 균주인 KCB001을 본 연구의 스타터 균주로 최종 선정하였다. KCB001 균주는 배양액 내의 cordycepin 함량이 배양에 의해 10.2% 증가하였다(결과 미 제시). 최종 선정된 KCB001 균주를 동정하기 위해 16S rRNA 유전자의 염기서열을 분석한 후 phylogenetic tree를 작성한 결과 Lactobacillus plantarum XLP1733, L. plantarum IDCC 3502, L. plantarum NOS 7318 등 다수의 L. plantarum 과 100% 동일한 염기서열을 지니고 있어, 최종 선정된 균 주를 Lactobacillus plantarum KCB001로 명명하였다(Fig. 1(A)). L. plantarum은 다양한 발효식품과 채소에서 분리 가능한 프로바이오틱스로 잘 알려져 있는데, 높은 내산성 과 내담즙성을 가지며, 위장관에서의 높은 수준의 유전적 접근성 및 성능 때문에 다른 유산균보다 선호된다(De Vries et al., 2006). Yang et al. (2015)은 L. plantarum을 사용하여 카사바 바이오 매스로부터 신경전달물질인 γ- aminobutyric acid를 생산하여 식품 및 제약 산업에 사용될 수 있다고 발표하였고, Ahrén et al. (2014)은 블루베리에 서 분리한 L. plantarum은 고혈압을 감소시키고, 심혈관 질환의 위험을 줄여준다고 보고하였다. L. plantarum은 그 외에도 항산화, 면역증강, 항암, 항콜레스테롤, 항비만 효과 등을 지닌다고 보고되고 있다(Arasu et al., 2016). 선정된 L. plantarum KCB001은 Gram 양성 세균으로 확인되었으 며, KOH test과 catalase test, 운동성 시험은 음성반응으로 나타나 운동성이 없는 유산균으로 판단되었다. L. plantarum 에는 superoxide dismutase, catalase 및 peroxidase가 존재 하지 않아 산소가 있는 환경에서 생장이 가능하지만, 혐기 적인 물질대사를 유지한다(Gregory & Fridovich, 1974). API 50CHL kit를 이용하여 L. plantarum KCB001과 표준 균주로 사용한 L. plantarum KCCM12116의 당 이용성을 분석한 결과 동일한 당 이용성을 나타내었다(Table 1). 두 균주는 단당류인 arabinose, ribose, galactose, glucose, fructose, mannose와 이당류인 cellobiose, maltose, lactose, melibiose, saccharose, trehalose, gentiobiose, turanose, 삼 당류인 melezitose, raffinose를 이용하였고, 당알코올인 mannitol, sorbitol과 페놀 배당체인 salicin, raffinose 배당체 인 N-acetyl glucosamine, esculin ferric citrate, 그리고 cyan 배당체인 amygdalin, arbutin을 사용하는 것을 확인하 였다. 한편 주사전자현미경(scanning electron microscope, SEM)을 이용하여 L. plantarum KCB001의 형태를 관찰한 결과, 간균으로 균체의 길이는 1-2 μm, 폭은 0.7-0.8 μm로 측정되었다(Fig. 1(B)).

|
발아대두 동충하초의 유산균 고상발효 조건을 최적화하 기 위하여 L. plantarum KCB001 배양액을 이용하여 고상 발효 배양 조건을 최적화하였다. 고상발효를 위한 발아대 두 동충하초의 유산균 발효 종배양액은 선행연구를 통해 최적화한 조건에서 제조하였다(Cho et al., 2017).
고상발효 시 발아대두와 동충하초의 혼합비에 대한 영향 을 알아보기 위해 동충하초에 발아대두를 각각 0, 11, 20, 33%(w/w)를 혼합한 후 증류수 40%(v/w)를 첨가한 배지에 L. plantarum KCB001 배양액을 접종하여 발효시키면서 균주의 생육도와 cordycepin 함량의 변화를 관찰하였다. Fig. 2(A,B)에 나타낸 바와 같이, 발아대두의 농도가 높을 수록 생균수는 증가하여 33%(w/w) 발아대두 함량에서 가 장 생육도가 높았으나 cordycepin 함량변화는 20%와 33% 사이에 유의적인 차이가 없었다. 따라서 발아대두 함량은 cordycepin 함량이 일정 수준에 이르는 20%(w/w), 즉 발아 대두와 동충하초의 함량비를 1:4로 결정하였다.
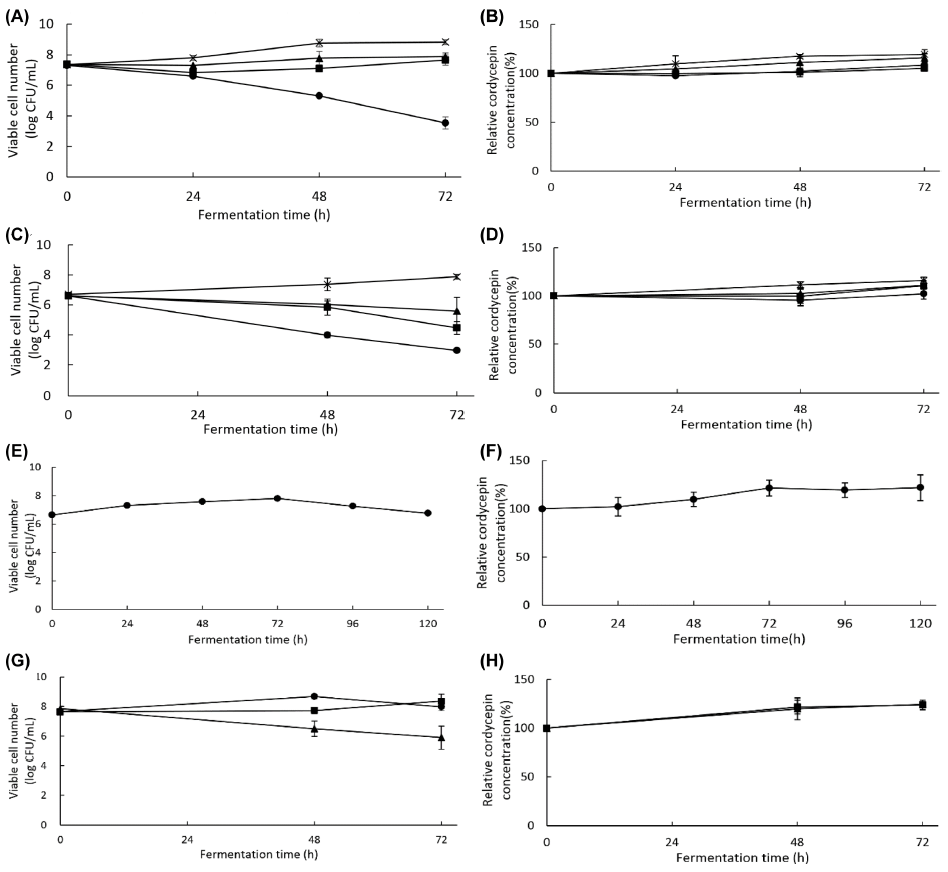
동충하초와 발아대두 혼합물에 첨가하는 수분량에 따른 발효능을 조사한 결과 Fig. 2(C,D)에 나타낸 바와 같이 가 수량이 0, 20, 30%(v/w)일 때에는 발효시간에 따라 생균수 가 감소하였으나, 40%(v/w)의 가수량 시료에서만 72시간 발효 후 7.9 log CFU/mL까지 증가하였다. 가수량이 0, 20, 30%(v/w)인 시료에서는 유산균의 발효가 제대로 일어나지 않았기 때문에 cordycepin의 함량에는 변화가 없었고, 40%(v/w)인 시료에서만 16% 증가하였다. 따라서 최적 가 수량은 40%(v/w)로 결정하였다.
발효시간에 따른 발효능을 조사하기 위하여 동충하초와 발아대두의 비를 4:1로 혼합한 후 40%(w/v) 가수한 다음, L. plantarum KCB001를 액상 발효액을 접종하여 120시간 동안 발효한 결과 Fig. 2(E,F)에 나타낸 바와 같이, 발효 후 72시간까지 증가하다가 96시간과 120시간 배양 시, 7.3, 6.8 log CFU/mL로 감소하였다. Cordycepin의 함량은 24, 48, 72, 96, 120시간동안 배양 후 각각 2.2, 9.8, 21.4, 19.5, 22.0%씩 증가하였고, 72, 96, 120시간동안 배양한 시 료들 사이에는 유의적인 차이가 없는 것으로 나타나 72시 간을 최적 발효시간으로 결정하였다.
발효온도에 따른 발효능은 Fig. 2(G,H)와 같이 37°C에서 가장 좋은 발효능을 나타내었다. Wardani et al. (2017)은 L. plantarum Dad 13은 37°C에서는 생장이 가장 우수하 다고 보고한 반면, Park & Lim (2015)은 건강한 성인의 분변에서 분리한 L. plantarum FH185은 40°C를 최적 발 효온도로 결정하였고, Noori et al. (2016)은 L. plantarum T5jq301796.1의 발효능은 37-40°C에서 가장 우수하였다고 보고하였다. Cordycepin 함량은 온도에 따른 차이는 나타 내지 않았다. 한편 종배양액의 최적 접종 농도는 20%(v/w) 로 확인되었다(결과 미제시).
이상의 결과로 동충하초 발아대두의 L. plantarum KCB001를 이용한 고상발효 조건은 동충하초와 발아대두 를 4:1로 혼합한 후 40%(v/w)의 물을 첨가하고, 121°C에 서 15분간 멸균한 후 종배양액 20%(v/w)를 접종하여 37°C 에서 72시간동안 발효하는 것으로 결정하였으며, 이를 Fig. 3에 도식화하였다.
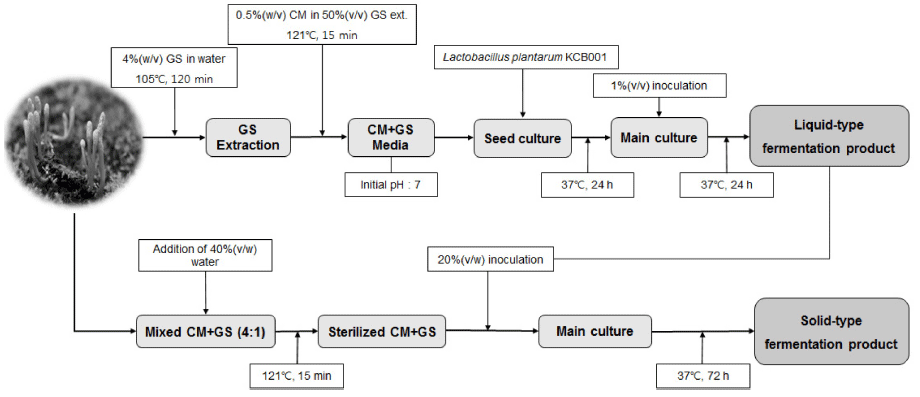
고상발효는 액상발효에 비하여 배지 제조비용이 저렴하 고 생산수율이 상대적으로 높으며, 발효산물의 농축과정이 필요없고 다양한 배양조건을 부여할 수 있는 등 많은 장점 을 지니고 있기 때문에 발효물의 산업적 생산에 있어서 선 호하는 발효방식이나 발효 최적화가 액상발효에 비하여 어 려운 점이 있기에 본 연구에서 수행한 발효공정 최적화는 동충하초 발아대두의 유산균발효를 산업적으로 생산할 때 적용할 수 있다는 점에서 의미가 있다.
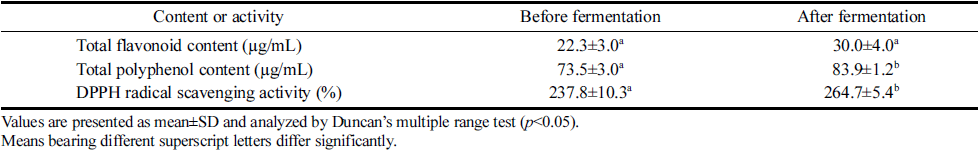
최적 조건에서 고상 발효한 발아대두 동충하초의 발효에 따른 총 폴리페놀 함량과 총 플라보노이드 함량, DPPH 라디칼 소거활성 변화를 Table 2에 나타내었다. 총 플라보 노이드 함량은 발효 전 동충하초에서 22.3 μg/mL, 발효 후 동충하초에서 30.0 μg/mL로 측정되었지만 통계적으로 유의 적인 차이는 없었다. 총 폴리페놀 함량은 발효에 의해 73.5 μg/mL에서 83.9 μg/mL로 유의적으로 증가하였다. Xiao et al. (2014)의 연구에 의하면, 병아리콩을 C. militaris로 발 효하였을 경우 총 폴리페놀 함량이 증가되었고, 증가한 폴 리페놀에는 shikmic acid, chlorogenic acid, p-coumaric acid가 포함되어 있으며, rutin, daidzein, genistein, biochanin A 등의 플라보노이드가 검출되었다. Landete et al. (2014) 과 Chiou et al. (2013)은 미생물 발효 중 탄수화물 분해 효소 활성의 증가와 함께 배당체의 부분적인 절단 또는 변화를 통해 강력한 항산화 물질을 방출한다고 하였다. L. plantarum은 aryl glycoside를 생체 활성 aglycone으로 효 율적으로 생물전환시킬 수 있기 때문에 발효에 의해 식물 성 식품의 항산화 활성을 높이기 위한 기능성 스타터로 사용할 수 있다고 보고된 바 있다(Landete et al., 2014). 한편, DPPH 라디칼 소거활성은 발효에 의해 16.9% 증가 하였는데, 이는 동충하초의 유산균 발효 후 폴리페놀 함 량이 증가함에 따라 항산화활성도 증가한 것으로 판단되 었다.
|
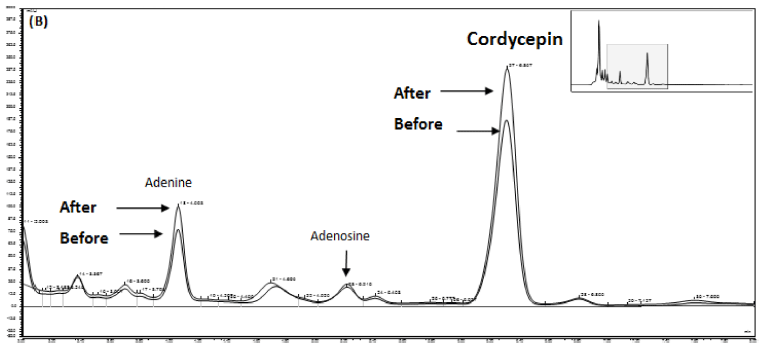
발효에 의해 동충하초 내 cordycepin의 함량 변화를 HPLC로 분석한 결과를 Fig. 4에 나타내었다. 발효 전 cordycepin의 함량은 107.2 μg/mL에서 발효 후 132,9 μg/ mL으로 24% 증가하였다. 한편 동충하초 내 adenine의 농 도는 32% 증가하였지만, adenosine의 함량은 18% 감소하 였다. Cordycepin은 3'-deoxyadenosine으로서 그 생합성 경 로는 아직 정확하게 밝혀져 있지 않으나 cordycepin의 구 조 일부분이 purine과 같은 것으로 보아 de novo purine nucleotide 생성경로를 통해 합성되는 것으로 여겨지고 있 다. 즉, adenosine이 adenosine kinase (ADK)와 adenylate kinase (ADEK)에 의해 AMP와 ADP로 각각 전환된 후, ribonucleotide reductase에 의해 3번 탄소의 수산기가 제거 되어 3’-dADP가 생성되며, 3’-dADP가 ADEK에 의해 3’- dAMP로 전환된 후 5’-nucleotidase (NT5E)에 의해 최종적 으로 cordycepin으로 생합성될 것으로 예상하고 있다 (Vongsangnak et al., 2017). 따라서 본 연구결과에서 발효 에 의해 cordycepin의 함량이 증가한 이유는 L. plantarum KCB001의 purine 생합성 경로에서 작용하는 adenylate kinase와 5’-nucleotidase가 adenosine을 이용하여 adenine과 cordycepin의 생합성을 유도하기 때문인 것으로 판단되나, 이에 대한 연구는 추후 이루어져야 할 것이다.
다양한 생리활성을 지니고 있는 발아대두와 동충하초를 유산균 발효한 연구는 아직 보고된 바 없으며, 특히, 유산 균 발효를 통해 동충하초의 지표물질인 cordycepin의 함량 을 증가시킨 예는 본 연구가 최초이기 때문에 본 연구에 서 확립한 유산균 고상발효 최적화는 발아대두와 동충하 초를 이용한 기능성소재의 산업적 개발에 유용할 것으로 판단된다.
요 약
발아대두 동충하초의 유산균 발효를 위하여 발아대두와 동충하초가 함유된 배지에서 생육이 우수한 유산균주를 김 치로부터 분리하여 동정한 결과 Lactobacillus plantarum KCB001로 명명하였다. 선정된 유산균을 이용하여 발아대 두 동충하초의 고상발효조건을 최적화한 결과, 동충하초와 발아대두의 혼합비는 4:1, 가수량은 40%(v/v), 종배양액의 첨가량은 20%(v/w), 최적 발효온도와 시간은 각각 37°C와 72시간으로 확인되었다. 유산균발효에 의해 총 폴리페놀함 량과 DPPH 소거능이 증가하였으며, 특히 동충하초의 지표 물질인 cordycepin 함량은 발효에 의해 24% 증가함으로써 발효에 의해 발아대두 동충하초의 기능성이 증가함을 확인 하였다.







