서 론
현재 우리 사회는 소득의 증가와 삶의 질적 향상에 기인 하여 기본적인 의식주 해결의 기본적인 문제에서 기능을 고려하는 상황으로 변화하고 있으며 이러한 경향은 여성 중심의 제품으로 여겨지던 화장품에게도 적용되어 남성용 제품의 수요가 증가하고 있는 추세이다(Ban et al., 2013). 또한 웰빙에 관한 지속적인 관심과 자연주의의 확산으로 천연 소재의 안전성에 주목하게 됨으로써 기능성이 확보된 천연 소재를 이용한 다양한 제품의 개발이 활성화 되고 있 으며 이는 기능성 식품 개발에도 적용되어 천연물 유래의 기능성 소재 개발을 위하여 생리 활성 평가가 지속적으로 이루어지고 있다(Chung et al., 2014).
우리나라에서는 예로부터 질병치료를 위한 소재로 천연 소재를 활용해 왔으며, 최근에는 적용분야가 의약품, 건강 기능식품 및 화장품으로 다양해질 뿐 아니라 활용제품이 급격히 증가하는 실정이다(Jeon & Kwon, 2014). 뿐만 아니 라 천연 소재에 관한 다양한 연구는 항염, 항암, 항균, 항산 화 등의 다양한 생리활성을 밝힘으로써(Bae et al., 2012) 향후 그 적용범위는 지속적으로 확장될 것이다. 선행 연구 들에 의하면 블루베리 잎과 백량금 열매 추출물에서 항산 화 및 항염 효과를 확인하였고(You & Yoon, 2013; Kim & Lee, 2014), 질경이 종자 추출물의 항산화 활성에 관한 연 구(Yoon et al., 2013)가 진행되었다. 또한 녹차 초임계 추 출물에서는 피부 염증 유발균에 대한 항균활성 및 항산화 효과에 대한 연구(Kim & Han, 2014)가 진행되었다.
산딸기는 장미과에 속하는 관목의 열매로 야산이나 산악 지역에 자생하며, 6-7월에 성숙하여 수확하는 품종과 9-10 월에 수확하는 것으로 분류된다(de Ancos et al., 2000; Zhang et al., 2010). 생산량이 많지 않아 산딸기는 대중적 인 가공식품으로 판매되지는 않았으나 식초, 잼, 퓨레 등 기본적인 가공품은 물론 케이크, 마카롱 및 파이 등 다양 한 제품에 적용되고 있어 그 활용분야가 점차 확장되고 있 다. 산딸기에는 다양한 종류의 phytochmical 물질을 함유하 고 있어 항산화, 항염, 항균 등의 생리활성을 갖는 것으로 알려져 있다(Zhang et al., 2010; Bobinaite et al., 2012). 특히 flavonoid, tannnin, phenolic acid와 같은 페놀성 화합 물과 수용성 색소인 anthocyanin 성분이 다량 함유되어 있 으며, 각종 약리 작용을 하는 triterpen류가 존재하는 것으 로 알려져 있다(Bobinaite et al., 2012). 산딸기에 대한 연 구는 생리활성 물질의 탐색을 중심으로 진행되어 산딸기 추출물의 항산화효과, 암세포의 증식 억제 및 항염증 효과 등에 관한 연구(Juranic et al., 2005; Huanga et al., 2011) 등이 진행되었으며 국내에서는 예로부터 약용식물에 이용 되고 있는 복분자(Rubus coreanus, 복분자 딸기의 익지 않 은 열매)의 기능성에 대한 다양한 연구가 진행되고 있다 (Yang et al., 2007).
염증 반응은 외부 자극에 대한 신체조직의 방어기작으로 외부로부터 발생한 물리적, 화학적 자극에 의한 신체 손상 을 회복하려는 기전이다(Jung et al., 2014). 이런 염증 반 응에서 대식세포는 interleukin-4 (IL-4), tumor necrosis factor-α (TNF-α), interferon-γ (IFN-γ)와 같은 염증성 매개 물질을 생산하여 초기 방어기작에 관여하지만(Higuchi et al., 1990) 이런 매개 인자가 과발현 되면 지속적인 염증 반응으로 인해 만성 염증성 질환이 유도된다(Ljung et al., 2006). 이와 같이 염증성 사이토카인은 염증 반응과 관련 되어 있어서 이들의 발현을 조절할 수 있는 물질이 염증 질환의 예방 또는 치료제로서 관심을 받고 있다. 특히 현 재 사용되고 있는 항염 소재가 부작용을 발생하고 있기 때 문에(Kim et al., 2009) 항염 기능을 가진 제품의 개발에 있어서 기능성과 안전성이 확보된 천연물 유래 소재 탐색 에 대한 연구가 활발히 진행되고 있다.
현재까지 산딸기에 대한 연구는 열매나 씨앗에 존재하는 생리활성 물질에 국한되어 왔으나(Lee et al., 2014) 본 연 구에서는 산딸기 열매를 수확한 후 부산물로 폐기되는 산 딸기 잎에 존재하는 소재의 항염증 효과를 확인함으로써 향 후 산딸기 산업의 부가가치를 상승시키고 산딸기 잎에 서 추출한 항염증 소재의 기능성 소재에 대한 적용 가능성 을 밝히고자 한다.
재료 및 방법
실험에 사용된 산딸기 잎은 경상북도 포항에서 구입하여 건조한 후 4℃에서 저온 저장하며 이용하였다. 에탄올추출 물은 70% (w/v, 이하 동일)의 에탄올(Daejung, Ansan, Korea)을 사용하여 시료 중량의 10배(w/v)를 첨가한 후 진 탕배양기(WiseBath, Daihan Scientific, Wonju, Korea)를 사 용하여 실온에서 24시간 동안 30 rpm으로 교반하면서 추 출한 후 상층액과 침전물을 분리하였으며 동일한 방법을 3 회 반복하여 추출하였다. 추출액은 여과지(Whatman No.2, GE, Pittsburgh, PA, USA)를 이용하여 여과한 후 감압농축 기(Rotary Vacuum Evaporator, N-100, EYELA, Tokyo, Japan)로 농축하여 동결 건조한 후 -4℃로 보관하면서 실 험에 사용하였다.
마우스 대식세포 RAW264.7는 ATCC (Manassas, VA, USA)에서 구입하여 10% heat-inactivated fetal bovine serum (FBS) (HyClone, Pittsburgh, PA, USA), 100 U/mL penicillin/streptomycin (HyClone, Pittsburgh, PA, USA)을 함유한 Dulbecco's Modified Eagle Medium (DMEM, HyClone, Pittsburgh, PA, USA) 배양액에서 37°C, 5% CO2 조건의 incubator (Steriliser SFB400, Memmert, Schwabach, Germany)에서 배양하였다(Guan et al., 2014).
산딸기 잎 추출물의 세포 독성은 Berridge & Tan (1993)의 방법을 참고하였다. RAW264.7 세포를 10% FBS (HyClone, Pittsburgh, PA, USA)를 포함한 DMEM에 현탁 시킨 후 96 well plate (CORNING, Corning, NY, USA)에 5×104 cells/mL의 세포를 100 μL씩 분주하여 37°C 5% CO2 incubator (Steriliser SFB400, Memmert, Schwabach, Germany)에서 24시간 배양하였다 산딸기 잎 추출물을 배 양액에 농도별(0, 10, 20, 100, 200, 1000, 2000 μg/mL)로 100 μL를 제조하여 처리하여 최종 농동가 0, 5, 10, 50, 100, 500, 1,000 μg/mL로 되도록 하여 처리한 후 24시간 동안 배양하였다. 그 후 CellTiter 96® AQueous One Solution Cell Proliferation assay kit (Promega, Madison, WI, USA) 를 사용하여 세포독성을 측정하였다. 각 배양액 100 μL에 CellTiter 96® AQueous One Solution Reagent를 20 μL씩 분 주하고 37°C, 5% CO2 incubator에서 4시간 동안 방치한 후, 490 nm에서 흡광도를 측정하였다.
염증성 사이토카인 측정은 enzyme linked immunosorbent assay (ELISA) 방법을 이용하였다(Ghayor et al., 2015). 96-well plate에 RAW264.7 세포를 4×105 cells/well로 현탁 하였다. 24시간 후 다양한 농도의 산딸기 잎 추출물을 농도 별로(25, 50, 100 μg/mL) 전처리하고 2시간 뒤에 lipopolysaccharide (LPS) (1 μg/mL)을 처리하여 24시간 배양하였다. 배양 후 세포 상층액만을 수집하여 원심분리(1,800×g, 4°C, 5분)하여 상등액만을 모아서 IL-4, TNF-α, IFN-γ의 발현양 을 ELISA kit (R&D Systems, Minneapolis, MN, USA)를 이용하여 측정하였다.
RAW264.7 세포를 10% FBS를 포함한 DMEM에 현탁 시킨 후 6 well plate (CORNING, Corning, NY, USA)에 4×105 cells/mL의 세포수가 되도록 3 mL씩 분주하여 37°C 5% CO2 incubator에서 24시간 배양하였다. 배양액을 제거 하고 phosphate buffered saline (PBS)로 세척한 후 새로운 DMEM배지로 교환한 후 산딸기 잎 추출물의 농도를 25, 50, 100 μg/mL가 되도록 세포에 처리하여 2시간 동안 배 양한 후 자극제인 LPS를 처리하고 배양하였다. 24시간 후 단백질 발현을 측정하기 위하여 배지를 제거하고 차가운 PBS로 세척한 후 cell lysates는 lysis buffer (10 mM pH 7.4 Tris-HCl, 5 mM NaF, 1 mM Na3VO4, 1 mM EDTA, 1 mM EGTA)를 첨가하여 단백질을 추출하였다. 단백질을 정량하여, 10% SDS-PAGE에 전기영동 한 후, membrane 으로 transfer하여 5% skim milk에 1시간 동안 blocking하 였다. Cyclooxygenase-2 (COX-2), inducible nitric oxide synthase (iNOS) 및 mitogen-activated protein kinases (MAPKs)의 단백질 발현은 enhanced chemiluminescence (ECL) 용액 (Amersham, PA, USA)을 이용하여 확인하였 다(Wallert et al., 2015).
Nuclear factor-kappaB (NF-κB)의 활성화 정도를 분석하 기 위해 electrophoretic mobility shift assay (EMSA) 방법 을 활용하였다(Ghayor et al., 2015). 우선 산딸기 잎 추출 물(25, 50, 100 μg/mL)을 처리한 RAW264.7 세포로부터 핵 단백질을 분리하였다. 산딸기 잎 추출물로 처리된 세포 (2×106 cells/dish)를 배양액을 제거하고 PBS로 세척하여 세포를 회수하고, 180 μL의 hypotonic buffer (10 mM Tris-HCl, 10 mM NaCl, 3 mM MgCl2, 0.02% NaN3, 0.5 mM DTT, 1 mM PMSF, pH 7.4)를 넣고, 20 μL의 5% nonidet NP-40을 첨가하여 5분 동안 반응시켰다. 이후 원 심분리(1,800×g, 4°C, 5분)한 후 상층액을 세포질 추출물로 이용하였다. 침전물은 hypotonic buffer로 한번 세척 하고, hypertonic buffer (20 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid, 25% glycerol, 420 mM NaCl, 1.5 mM MgCl2, 0.2 mM ethylenediaminetetraacetic acid, 0.02% NaN3, 0.5 mM DTT, 1 mM PMSF, pH 7.4)를 넣고 1시간 동안 얼음 위에 방치시킨 다음 원심분리(13,000×g, 4°C, 10분)하여 상층액을 회수하여 핵 단백질을 분리하였다. NF- κB의 활성은 electrophoretic mobility shift assay (EMSA) kit (Signosis, Santa Clara, CA, USA)를 이용하여 측정하 였다.
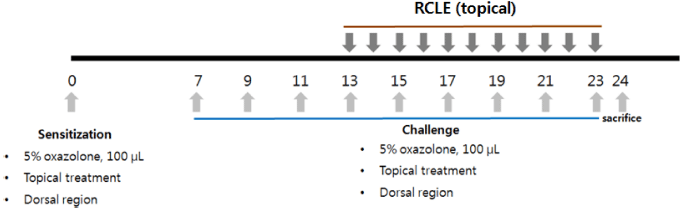
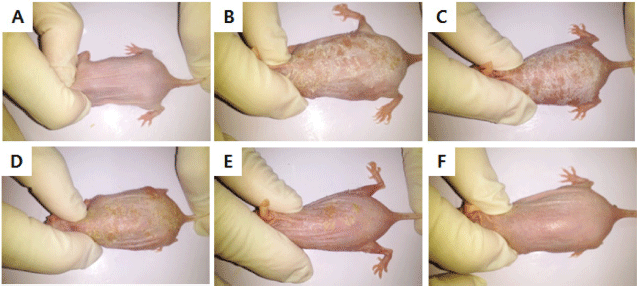
만성 접촉성 피부염 모델을 위해 oxazolone으로 감작시 킨 뒤 반복적으로 피부에 도포하여 접촉성 피부염을 유도 한 뒤 병변 부위를 관찰함으로써 산딸기 잎 추출물의 만성 접촉성 피부염 억제 효과를 확인하였다(Kim et al., 2010). Hairless 마우스는 대한바이오링크(Umsung, Korea)에서 구 입한 SKH-1outbred mice를 사용하였다. 실험은 에탄올을 이용하여 5% oxazolone을 제조하여 hairless 마우스의 등 부위에 골고루 도포하여 감작(민감화)시키고 7일 후 추출 물을 도포한 다음 30분 후에 다시 5% oxazolone을 도포하 여 접촉성 피부염을 유발시켰다. 2일 간격으로 9회 반복하 여 피부염을 유발시킨 후 병변 부위를 관찰하였다(Fig. 1).
결과 및 고찰
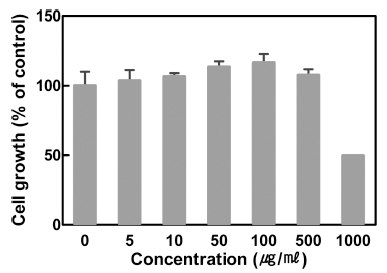
대식세포는 염증 반응에서 여러 자극에 의해 활성화되어 부종, 열 등의 염증 반응을 유도하고 염증성 사이토카인을 분비하여 다른 염증 세포들이 염증 부위로 이동할 수 있게 한다(Li et al., 2015). 산딸기 잎 추출물을 대식세포에 농 도별로(5, 10, 50, 100, 500, 1000 μg/mL) 처리하여 proliferation kit를 사용하여 세포 성장률을 측정한 결과, 1,000 μg/mL에서 성장저해와 세포 독성이 나타나는 것으로 확인 되었다(Fig. 2). 따라서 추후 진행된 실험은 세포 독성이 없는 농도인 25, 50, 100 μg/mL으로 진행하였다.
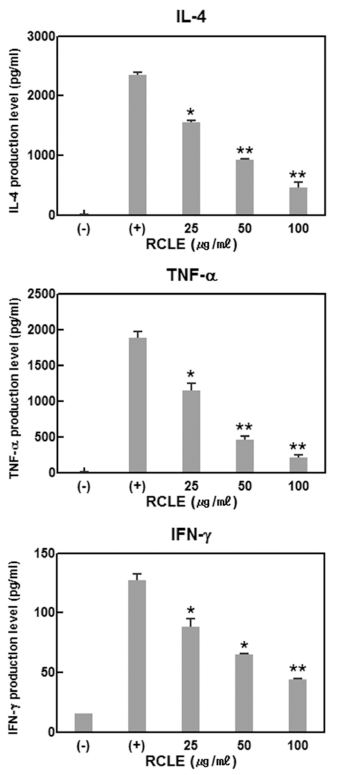
염증 반응이 개시되면 IL-4, TNF-α, IFN-γ 등의 다양한 염증성 사이토카인이 반응에 참여하게 된다(Kim et al., 2013). 특히 대식세포에서는 LPS 등의 여러 자극 인자에 의해서 활성화가 되면 여러 염증성 싸이토카인을 유리함으 로써 염증반응에 관계된다. 산딸기 잎 추출물이 염증성 사 이토카인의 발현에 미치는 영향을 확인한 결과 염증성 사 이토카인의 발현이 산딸기 잎 추출물에 의하여 농도의존적 으로 억제됨을 확인하였다(Fig. 3). IL-4의 경우 산딸기 잎 추출물의 농도를 25, 50, 100 μg/mL로 증가시킴으로써 발 현억제율이 33.7%, 59.9%, 76.4%로 증가함으로써 농도 증 가에 비례하여 억제율이 상승하는 효과를 나타내었다. TNF-α 및 IFN-γ의 경우도 동일한 산딸기 잎 추출물의 농 도에서 발현율이 각각 39.3%, 79.5%, 89.2%와 35.1%, 55.9%, 74.2%의 억제율을 나타내어 정도의 차이는 있으나 산딸기 잎 추출물이 세포독성을 나타내지 않는 100 μg/mL 이하의 농도에서는 농도 의존적으로 LPS 자극에 의한 염 증성 사이토카인의 발현을 억제함을 확인하였다.
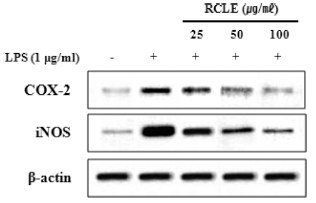
염증 반응의 초기에는 주로 COX-2와 iNOS, 그리고 이 들에 의해 발현되는 염증성 매개물들에 의해 반응이 유도 된다(Deveraux et al., 1998). COX-2는 정상적인 신체 조 건에서는 발현이 되지 않으나 여러 사이토카인이나 LPS 자극에 의하여 발현되어 prostaglandin을 생성시켜 염증 반 응을 유도한다(Chen et al., 2001). 그러므로 COX-2 발현 억제는 염증을 억제하는 효과를 나타낼 수 있다. iNOS는 염증 반응을 일으키는 중요한 효소로 많은 양의 nitric oxide (NO)를 생성한다. iNOS가 과도하게 발현되면 많은 양의 NO가 생성되어 염증을 일으킨다(Hanisch, 2002). LPS 자극과 산딸기 잎 추출물 처리 후 세포질의 COX-2와 iNOS 단백질 발현량을 측정한 결과, LPS 자극에 의하여 COX-2와 iNOS의 발현이 현저히 증가하는 것을 확인하였 으며(Fig. 4) 증가된 단백질 발현이 산딸기 잎 추출물의 처 리에 의하여 농도의존적으로 감소되는 것을 확인하였다. 그러므로 산딸기 잎 추출물은 COX-2와 iNOS 발현 억제 를 통하여 염증억제효과를 확인할 수 있었다.
MAPK는 염증성 사이토카인 발현에 중요한 조절인자로 서 ERK, JNK, p38의 신호전달경로를 가지고 있으며 대식 세포에서 LPS는 표면의 toll like receptor4 (TLK4)를 자극 하여 MAPK의 활성화를 유도하여 염증성 매개인자들의 발현을 유도한다(Kim et al., 2010). 또한 COX-2와 iNOS 발현이 조절되는 과정에는 MAPKs가 관여한다고 알려져 있다(Marina et al., 2000). RAW264.7 세포에 산딸기 잎 추출물을 농도별로 처리한 후, LPS로 자극한 후 세포질에 서 단백질을 분리하여 MAPKs의 인산화를 측정한 결과 ERK, JNK, p38의 인산화가 증가하였으며 증가된 인산화 는 산딸기 잎 추출물에 의하여 농도의존적으로 감소되는 것을 확인함으로써(Fig. 5) 산딸기 잎 추출물의 항염증 효 과가 MAPK 분자 조절에 의한 것임을 확인하였다
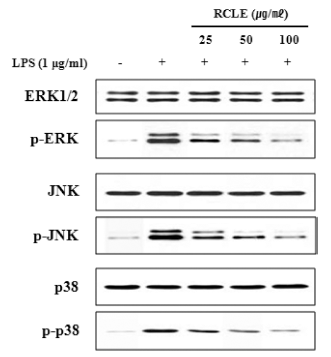
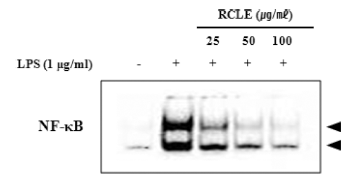
염증성 사이토카인의 발현 조절과 MAPKs 신호전달체계 에 관여하는 전사인자로는 NF-κB가 있다. NF-κB는 외부 자극에 의해 사이토카인과 케모카인 등 다양한 매개체의 세포 내 합성을 조절하는 전사인자이다(Kim et al., 2014). 따라서 LPS로 자극한 RAW264.7 세포에서 핵 단백질을 추출하여 EMSA assay kit를 활용하여 NF-κB의 활성화에 대한 산딸기 잎 추출물의 억제 효과를 확인한 결과 LPS에 의해 핵 내 NF-κB의 발현이 증가하였고 산딸기 잎 추출물 에 의하여 농도의존적으로 감소됨을 확인하였다(Fig. 6).
Oxazolone 도포로 유도한 접촉성 피부염 마우스 모델은 사람의 아토피 피부염과 매우 유사한 임상학적, 면역학적 특징을 가지고 있으며 다른 피부염 모델보다 간단하게 만 들 수 있는 장점이 있다(Chung et al., 2014). Oxazolone만 을 도포한 hairless 마우스에서는 인설, 홍반 등이 발생하였 으나 산딸기 잎 추출물을 동시에 도포하였을 때 병변 부위 가 유의적으로 완화된 것을 육안으로 관찰할 수 있었다 (Fig. 7).
요 약
웰빙에 대한 지속적인 관심과 자연주의의 확산으로 안전 성과 기능성이 확보된 천연 소재에 관심이 높아지고 이를 이용한 기능성 식품 개발이 지속적으로 증가하고 있다. 특 히 항염 효과를 지닌 천연 소재를 찾고자 많은 연구들이 활발하게 진행되고 있다. 따라서 본 연구에서는 산딸기 잎 추출물을 이용하여 기능성 천연 소재로서의 가능성을 연구 하였다. 항염 활성을 조사하기 위해서 마우스 대식세포주 인 RAW264.7 세포에 LPS로 유도된 염증 반응에서 산딸 기 잎 추출물의 매개체 억제 효과를 측정하였고 oxazolone 을 이용하여 접촉성 피부염이 유도된 hairless 마우스를 이 용하여 산딸기 잎 추출물의 항염 효과를 확인하였다. LPS 로 자극한 RAW264.7 세포에서 COX-2, iNOS와 같은 염 증성 매개체뿐만 아니라 염증성 사이토카인의 생성 및 발 현이 산딸기 잎 추출물에 의하여 현저히 억제됨을 확인하 였으며 이러한 산딸기 잎 추출물의 항염증효과는 NF-κB의 활성을 억제하여 나타나는 것으로 밝혀졌으며 NF-κB의 상 위 신호전달경로인 MAPKs에도 영향을 미치는 것으로 증 명되었다. 또한 hairless 마우스에 유도된 접촉성 피부염에 산딸기 잎 추출물을 처리하여 3주간 피부 병변을 관찰한 결과 염증 반응이 현저히 완화되는 것을 확인하였다. 이상 의 결과들을 종합해보면, 산딸기 잎 추출물이 항염 효능을 가진 천연물 소재로서 활용될 수 있는 가능성을 제시하고 있다. 다양한 염증성 질환에서 여러 매개체들의 과도한 발 현이 그 질환의 원인임을 생각해 볼 때 산딸기 잎 추출물 은 항염을 목적으로 하는 여러 제품들에서 다양하게 활용 할 수 있는 천연물 소재가 될 것으로 판단되며, 기능성 식 품 개발에 있어 산딸기 잎 추출물의 활용성이 높아질 것으 로 사료된다.







