서 론
산양삼(cultivated wild Panax ginseng)이란 산지관리법 제2조 제1호에서 정의한 바에 따라, 산지에서 차광막등 인 공시설을 설치하지 아니하고 생산되는 삼(건조된 것을 포 함)을 칭하며, 장뇌삼으로도 알려져 있다. 한국임업진흥원 에 따르면, 국내 산양삼의 지역별 생산량은 강원도가 가장 큰 비중을 차지하고 있으며 특히 평창군은 2014년 국내 최초로 산양삼 특구로 지정되었다. 산양삼은 재배 인삼과 비교하여 잔류농약의 위험요인이 없으며, 그 생리활성적 효과가 높은 것으로 알려져 있다. 특히, 삼의 사포닌 (saponin)인 진세노사이드(ginsenoside)의 함량이 높다고 보 고되었으며(Jeong et al., 2010), 또한 항암, 혈압강하, 항산 화, 간개선, 혈중지질개선, 면역조절 등에 효능이 있는 것 으로 알려져 있다(Lui & Staba, 1980; Yun et al., 2004; Jung et al., 2005).
염증반응은 미생물 감염, 조직의 물리적 손상, 또는 트라 우마와 같은 심리적 외상 및 체내에서 발생한 산화스트레 스에 의해 촉진된다(Larsen & Henson, 1983; Chawla et al., 2011). 대식세포(Macrophage)는 동물 체내 모든 조직에 분포하며 체내에서 선천면역반응을 담당하는 면역세로포, 외래성 항원인 미생물을 탐식하는 것은 물론, 손상되거나 죽은 인체의 세포, 세포의 잔해, 활성화된 혈액응고 인자 등 내생성 물질 역시 탐식할 수 있다. 탐식작용은 대식세 포의 세포막에 항원이 부착된 후, 대식세포의 세포막이 돌 출되어 위족(pseudopodia)을 형성하여 부착된 항원 물질을 둘러싸게 된다. 이 후 위족의 양쪽 끝부분이 서로 융합하 여 항원 물질을 내부에 완전히 가두는 형태(phagosome)가 형성되고, 이는 곧 대식세포의 내부로 이동한 후 리소좀과 융합하여 탐식리소좀(phagolysosome)을 형성한다. 리소좀에 는 수 많은 가수분해효소가 들어 있으므로 탐식포에 존재 하던 항원은 탐식리소좀에서 이들 효소에 의해 소화되며, 소화되고 남은 내용물은 세포외배출(exocytosis) 과정을 거 쳐 제거된다.
상기 요인에 의하여 활성화된 대식세포는 nuclear factor kappa B (NF-κB) 의존적 신호전달체계를 통하여 다양한 염증매개물질의 전사 및 발현을 촉진하는 것으로 알려져 있다(Barnes & Adcock, 1997). 특히, in vitro 연구를 위 하여 그람음성균 세포벽 성분인 lipopolysaccharide (LPS) 를 활용하여 대식세포를 자극할 경우, toll-like receptor (TLR) 4가 LPS와 결합 후, 세포 내 MyD88 의존적 신호 전달체계를 통하여 상기 NF-κB의 세포핵으로의 이동을 촉 진하는 기작은 잘 알려져 있다(Barnes & Adcock, 1997; Dobrovolskaia & Vogel, 2002). 염증상태에서는 대식 세포 내에 cyclooxygenase-2 (COX-2)와 inducible nitric oxide synthase (iNOS)의 발현이 유도되어 과량의 prostaglandins (PGs), nitric oxide (NO)등이 생성되며(Won et al., 2006), 이런 염증성 매개물의 분지를 통해 염증성 반응의 전파 (propagation)가 일어나 만성염증(chronic inflammation)으로 이어질 경우, 아토피 피부염, 류마티스 관절염, 천식, 기관 지염, 다발성경화증, 동맥경화증, 뇌졸중, 알츠하이머 등의 염증질환을 야기함이 알려져 있다(Corraliza et al., 1995).
따라서, 염증반응의 초기단계에 관여하는 대식세포의 신 호전달체계를 조절하여 iNOS 및 COX-2의 발현량을 조절 할 수 있는 물질이 염증질환의 예방 및 치료제로서 주목을 받고 있다. 그러나, 초기 연구단계에서 개발된 항염증 약물 들은 대체로 스테로이드계열의 화합물로서, 그 항염증 효 과가 탁월하나 여러 부작용들로 인하여 사용이 제한적이다. 이어 아스피린과 같은 비스테로이드계열 항염증 의약품 (non-steroidal anti-inflammatory drugs, NSAIDs)의 개발요 구가 대두되었으며, 특히 화학적인 약품이 아닌 천연물 추 출물에 의한 염증질환 치료제 및 치료보조제가 각광받고 있으며 연구가 활발히 진행되고 있다.
산양삼을 활용한 염증제어의 선행연구의 결과를 고찰하 면, 산양삼 추출물에 의하여 염증성 사이토카인 interleukin- 1 beta (IL-1β), IL-6 및 tumor necrosis factor-alpha (TNF- α)의 분비억제가 보고되었다(Kim & Son, 2012). 그러나, 산양삼은 일반적으로 7-20년의 장기간 동안 무농약, 무비 료의 청정환경에서 생산함으로써, 그 생산수율이 낮으며 생산비용이 높아서 가공식품의 소재로서 사용이 전무한 실 정이다.
본 연구에서는 비교적 가격이 저렴한 3년근, 5년근 및 7 년근으로부터 추출한 산양삼 추출물의 항염증 활성을 다양 한 염증지표를 통하여 비교 및 평가하고자 하였다.
재료 및 방법
평창지역에서 재배된 산양삼 3년, 5년 및 7년근(Woorido Co., Pyeongchang, Korea)을 구입하여, 흐르는 물을 이용하 여 3회 수세하고 증류수에 5분간 수침 후, 증류수를 이용 하여 최종 수세한 후 표면을 상온통기의 조건에서 건조하 였다. 고형분 추출을 위하여, 근령별 산양삼 시료에 25배 (w/v)의 70% 주정에탄올(Ethanol Supplies World, Co. Ltd., Jeonju, Korea)을 가한 뒤, 70°C에서 24시간 동안 환류냉각 추출기(Glass Extractor, Jung Sung Hascom, Seoul, Korea) 를 이용하여 추출하였다. Kimble-filtering flaks에 funnel을 장착하고 여과지(Whatman No.2)를 사용하여 추출물을 여 과한 뒤, 여과액을 50°C의 수온에서 회전진공농축기(N-11, Eyela, Tokyo, Japan)를 사용하여 감압농축하여 소분후 -70°C에 보관하였다.
본 연구에 이용된 RAW264.7 대식세포주(Korea Cell Line Bank, Seoul, Korea)는 1% antibiotic/antimycotic solution (Hyclone, Logan, UT, USA)과 10% fetal bovine serum (FBS, Hyclone)가 첨가된 Dulbecco’s modified Eagle;s medium (DMEM, Hyclone)에서 배양하였다. 세포를 회수 하고 계수한 후, 24-well plate에 1 × 105 cells/mL의 세포 농도로 분주하고, 산양삼 추출액을 표기종도별로 24시간 처리하였다. 이후, 산양삼 추출액이 처리된 세포배양액에 500 ng/mL 농도의 LPS (Sigma-Aldrich Co., St. Louise, MO, USA)를 처리하여 24시간 동안 염증반응을 유도하 였다.
RAW264.7 대식세포주를 5 × 104 cells/mL 농도로 분주 후, 연근별 및 농도별 산양삼 추출물을 처리하여 24시간 배 양하였다. 이후, 5 mg/mL 농도의 3-(4,5-dimethylthiazol-2- yl)-2,5-diphenyltetrazolium bromide (MTT, Amresco, Solon, OH, USA) 용액을 첨가한 후, 37°C, 5% CO2의 조건 하에 세포배양기(Heraeus BB15, Thermo Electron Co., Waltham, MA, USA)에서 4시간 배양하였다. 배양 후, 배양액을 제거 하고 MTT formazan crystal을 dimethyl sulfoxide (DMSO) 에 용출한 후, 마이크로플레이트 리더(iMark, Bio-Rad, Hercules, CA, USA)를 이용하여 590 nm에서의 흡광도를 측정하였다. 무처리군의 흡광도외 비교하여 산양삼 추출물 처리에 따른 세포 독성을 상대값(%)으로 나타내었다(Liu et al., 2012).
세포 배양액을 원심분리(300 × g, 5분)하여 상층액을 회 수한 후, 염증성 사이토카인 IL-6 및 TNF-α에 특이적인 상용 ELISA kit (eBioscience, San Diego, CA, USA)를 이 용하여 분석하였다. 간략하게 기술하면, 96-well plate를 capture antibody로 4°C에서 12시간 코팅한 후, assay diluent를 이용하여 비특이적 항원-항체반응을 막았다. Kit에 포함된 sample diluent 용액을 100배 희석한 세포배양액 100 μL를 분주하여 상온에서 1시간 방치하였다. Washing buffer를 이용하여 수차례 세척한 후, capture antibody 100 μL를 분주하여 상온에서 1시간 방치한 후, biotinconjugated detection antibody와 streptoavidin-conjugated horse radish peroxidase를 첨가하여 상온에서 1시간 반응하 였다. 제공된 기질용액을 첨가하여 30분간 발색반응을 유 도한 후, stop solution (1M H5PO4)를 첨가하여 반응을 종 료하고 마이크로플레이트 리더(iMark, Bio-Rad, Hercules, CA, USA)를 이용하여 450 nm에서의 흡광도를 측정한 후, kit에 제공된 사이토카인 표준품의 표준곡선을 이용하여 정 량하였다.
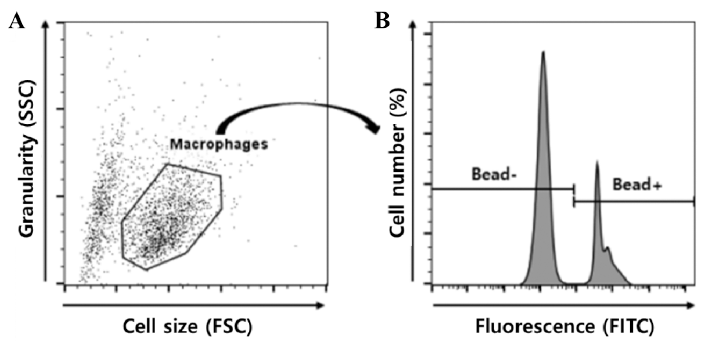
대식세포를 1 × 109 particles/mL 농도의 형광 bead (Fluorebrite® plain yellow green 1.0 micron microspheres, Polysciences, Warrington, PA, USA)와 함께 30분간 배양한 후, 4°C의 phosphate-buffered saline (PBS)을 이용하여 세 척해 회수된 세포를 flow cytometry (Accuri C6, BD Biosciences, San Jose, CA, USA)를 이용하여 분석하였다 (Dunn & Tyrer, 1981). FlowJo v10 software (Treestar, San Carlos, CA, USA)를 이용하여 scatter plot에서 대식세 포를 gating 한 후(FSC vs SSC), 대식세포 중 bead의 탐 식에 의하여 형광을 내는 세포의 비율(%)를 측정하여 탐 식능으로 표기하였다.
연근별 및 농도별 산양삼 추출물과 배양 후, LPS를 이 용하여 활성화된 대식세포를 PBS를 이용하여 세포를 세척 한 후, anti-mouse CD16/CD32 (eBioscience)와 4°C에서 10분간 반응하여 비특이적 항원-항체 반응을 막은 후, 활성 화마커 특이적 형광 항체(anti-CT80-FITC, anti-CD86-PE 및 anti-MHC-II-APC)를 이용하여 4°C에서 10분간 반응하 였다. PBS로 수차례 세척 후, flow cytometry (Accuri C6, BD Biosciences)를 이용하여 대식세포를 확인 후(FSC vs SSC), FITC, PE 및 APC의 형광도를 측정하여 CD80, CD86 및 MHC-II의 발현량을 mean fluorescence intensity (MFI)를 통하여 측정하였다(Saxena et al., 2003).
RAW264.7 세포주를 연근별 및 농도별 산양삼 추출물과 배양하여 LPS로 활성화한 후, 원심분리를 통하여 세포를 회 수하였다. RNA를 RNeasy® mini kit (Qiagen, Germantown, MD, USA)를 이용하여 제조사의 방법에 따라 추출한 후, Nanodrop 200 spectrophotometer (Thermo Scientific, Waltham, MA, USA)을 이용하여 RNA를 정량하고 순도 를 검증하였다. QuantiFast® SYBR Green RT-PCR kit (Quiagen) 및 Real-Time system (CFX Connect, Bio-Rad) 를 이용하여 50°C 10분 + 95°C 5분, 95°C 10초 + 60°C 30 초 39 사이클 조건에서 quantitative reverse transcriptase PCR (qRT-PCR)을 실시하였다. 본 연구에 사용된 프라이머 는 다음과 같다. GAPDH F 5’-ATCATCCCTGCATCCACT- 3’, R 5’-ATCCACGACGGACACATT-3’; COX-2 F 5’-TGCACTATGGTTACAAAAGCTGG-3’, R 5’-TCAGGAAGCTCCTTATTTCCCTT- 3’ (Vitali et al., 2015); iNOS F 5’-CGAAACGCTTCACTTCCAA-3’, R 5’-TGAGCCTATATTGCTGTGGCT- 3’ (Lampiasi & Montana, 2016). COX- 2 및 iNOS의 Ct 값으로부터 GAPDH의 Ct 값을 빼어 2-dCt 값을 구하여 상대적 전사량으로 표현하였다.
결과 및 고찰
산양삼 추출물의 항염증 기작을 세포수준에서 확인하기 위하여, 먼저 세포에 대한 독성을 MTT법을 이용하여 측정 하였다. 그 결과, 산양삼의 근령에 상관없이 모든 산양삼 추출물에서 100 ppm 농도까지 무처리군 대비 80% 이상의 세포생존률을 보임으로써 독성이 없음을 확인하였다(Fig. 1). 그러나, 1,000 ppm 농도에서는 모든 근령의 산양삼 추 출물에서 100%에 가까운 세포사멸률을 보였다. 따라서, 이 후의 실험에서는 안전영역에 해당하는 10 ppm 농도의 산 양삼 추출물을 사용하였다. 인삼의 사포닌을 구강투여한 랫드의 혈중 진세노사이드의 농도가 최고 1 ppm에 이르렀 다는 결과를 참고할 때(Odani et al., 1983), 본 연구에서 사용된 산양삼 추출물의 투여량은 식품을 통하여 생리학적 으로 유의미한 농도로 판단된다.

본 연구에서 사용한 RAW264.7 대식세포주를 flow cytometry와 Flowjo software를 통하여 분석한 결과, Fig. 2A와 같이 세포의 크기(FSC) 및 과립도(SCC)를 활용하여 대식세포를 gating 할 수 있었다. 또한, 형광 bead와 공배 양한 대식세포를 gating하여 분석한 결과(Fig. 2B), 탐식작 용을 한 세포(Bead+)와 탐식작용을 하지 않은 세포(Bead-) 로 구분할 수 있었으며, 나아가 탐식작용을 세포의 비율 (%)을 측정함으로써 탐식능을 측정할 수 있음을 보였다.
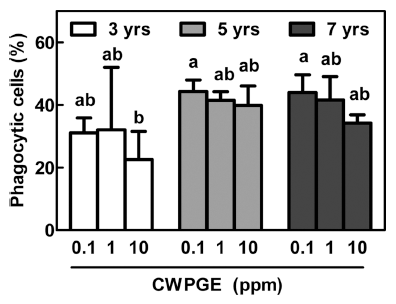
이에 따라, 연근별 및 농도별 산양삼 추출물의 처리에 따른 탐식능(phatocytic cells, %)을 측정한 결과, 동일 처 리 농도에서 산양삼의 근령에 따른 유의차는 보이지 않았 으며, 동일 근령 내에서도 처리농도에 따른 차이는 보이지 않았다(Fig. 3). 산양삼의 근령에 따라 농도별 탐식능 조절 에 차이가 있는지 밝히기 위하여 two-way ANOVA 분산 분석을 한 결과, 산양삼의 근령과 처리농도 사이에 상관관 계가 없음을 확인하였다. 이는 산양삼 추출물이 대식세포 의 선천성 면역기능인 탐식능에 영향을 미치지 않으며, 따 라서 바이러스 및 병원성 미생물에의 감염에 영향을 주지 않음을 보여준다.
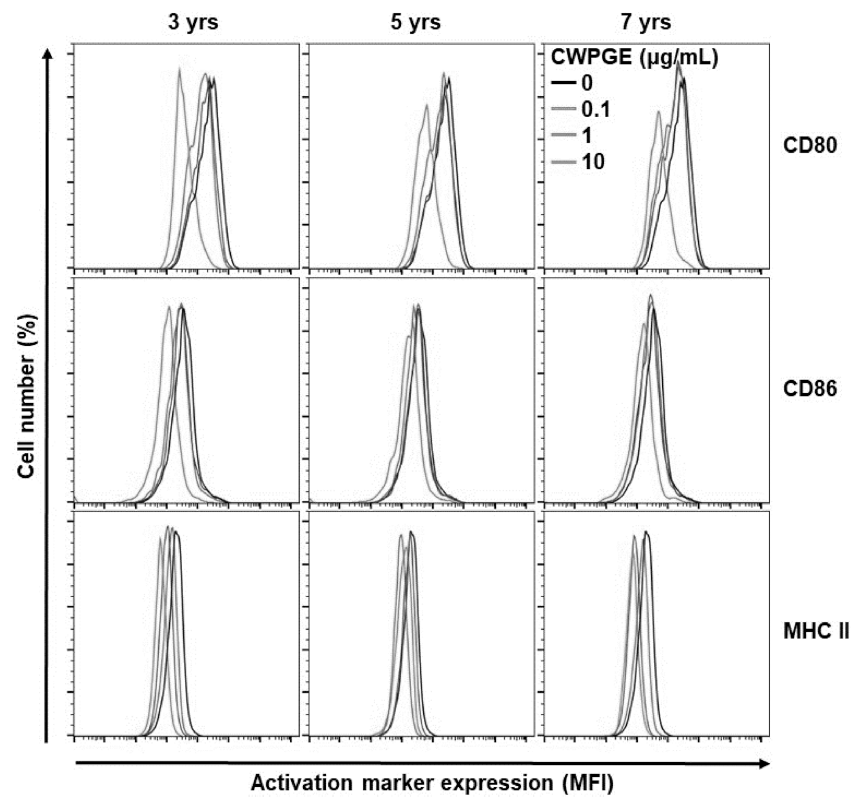
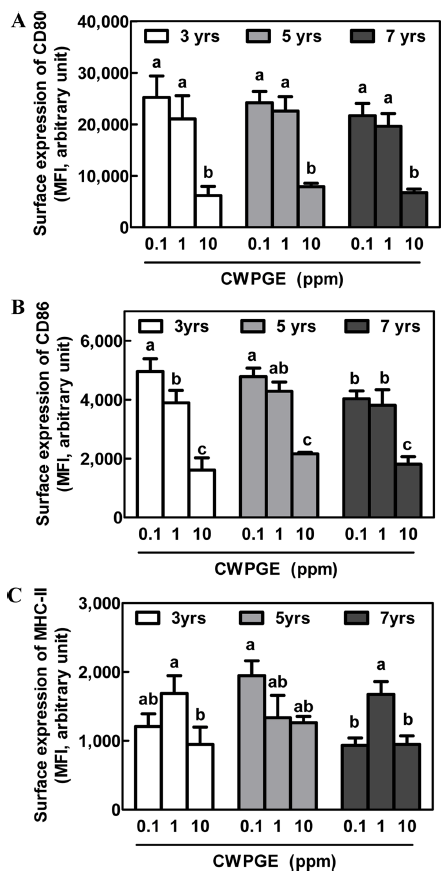
근령별 및 처리농도별 산양삼 추출물 처리에 따른 대식 세포의 활성화마커 발현량을 flow cytometry를 이용하여 분석하여, 각 처리군별 대표 histogram을 Fig. 4에 나타내 었다. MHC-II 단백질은 대식세포의 대식과정 이후 면역성 항원물질을 후천성면역세포에 제공하는 역할을 하는 단백 질로써(Gordon, 1998; Murray & Wynn, 2011), 그 발현량 은 산양삼의 근령에 따라 유의적인 차이가 없었으며, 추출 물의 처리농도에 따라 일정한 경향을 보이지 않았다(Fig. 5A). CD80과 CD86은 T-cell costimulatory molecules라고 불리우는 단백질로서, 후천성면역의 기능조절에 중요한 역 할을 한다(Saxena et al., 2003). 산양삼의 처리 농도에 따 른 CD80 의 발현량은 농도가 증가할수록 감소함을 보였 으나, 근령별 유의차는 없었다(Fig. 5B). CD86의 발현량 또한 CD80과 동일한 결과를 나타내었다(Fig. 5C). Twoway ANOVA 분석결과 근령 및 추물물 처리농도는 각각 상호영향을 미치지 않는 것으로 나타났다.
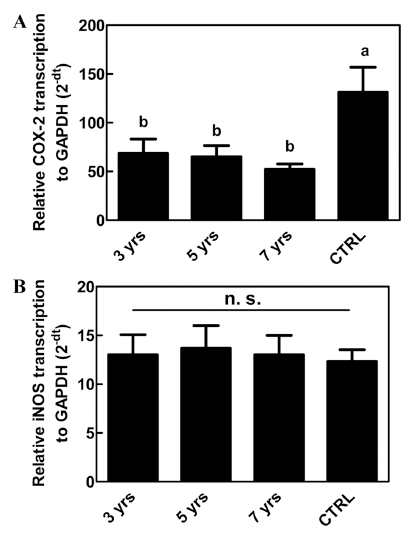
RAW264.7 대식세포주를 산양삼 추출물을 1 μg/mL 단일 농도로 처리하여 LPS로 활성화하고, 세포를 회수하여 총 RNA 중 COX-2와 iNOS mRNA를 각각 qRT-PCR을 이용 하여 정량하였다. 그 결과, 오메가-6 지방산인 아라키톤산 (arachidonic acid)을 기질로 하여 PGs를 생성하는 COX-2 의 전사량은 무처리군(CTRL)에 대비하여 산양삼 추출물의 처리시 유의(p<0.05)하게 감소함을 보였으나, 근령에 따라 서는 유의적인 차이가 없음을 보였다(Fig. 6A). 또한, 아미 노산 아르기닌(arginine)을 전구체로 하여 NO를 생성하는 iNOS의 전사량 역시 산양삼의 근령에 따른 유의적 차이는 없었으며, 무처리군과 동일한 전사량을 보였다(Fig. 6B). COX-2와 iNOS가 세포 성장성 전사인자인 NF-κB의 전사 조절 아래에 발현된다는 보고(Hong et al., 2002)를 고려할 때, 산양삼의 근령에 따른 염증성 반응의 차이는 미미한 것으로 판단된다.
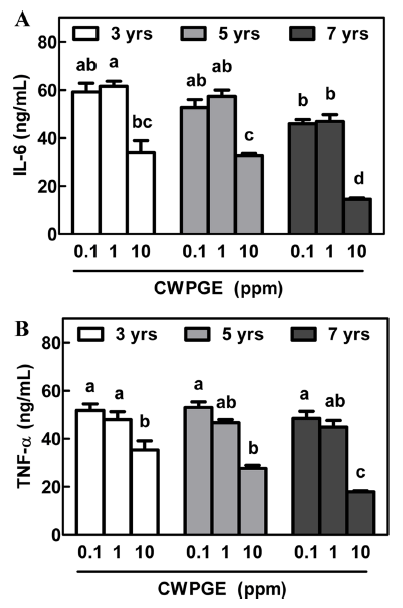
근령별 차이에 따른 산양삼 추출물이 염증성 사이토카인 의 분비에 영향을 미치는지 확인하기 위하여, LPS로 자극 된 RAW264.7 세포주의 배양액을 ELISA kit를 이용하여 IL-6와 TNF-α를 정량하였다. 산양삼의 근령과 처리농도를 독립인자로 설정하여 two-way ANOVA 분석한 결과, IL-6 의 분비량은 근령에 상관없이 처리농도에 따라 유의적 (p<0.05)으로 감소하는 경향을 보였다(Fig. 7A). 그러나 Tukey’s post-hoc test를 통하여 각각의 처리군을 비교한 결 과, 7년근 추출물 1 ppm 농도에서 IL-6의 분비량을 3년근 추출물과 비교하여 유의적으로 감소시켰다(p<0.05). 또한, 7년근 10 ppm 처리군의 경우, 3년근 및 5년근 추출물 처 리군과 비교하여 IL-6의 분비량이 유의적으로 감소함을 보였다(p<0.05). 유사하게 TNF-α의 분비량을 two-way ANOVA 분석한 결과, 근령에 따른 차이는 없었으나 처리 농도에 따라 감소함을 보였다(p<0.05)(Fig. 7B). 특히, 10 ppm 농도의 7년근 추출물 처리군에서 TNF-α의 분비량이 3년근 및 5년근 추출물과 비교하여 유의적으로 감소함을 보였다(p<0.05). 이는 산양삼 추출물의 처리가 대식세포의 염증성 사이토카인의 분비량을 농도 의존적으로 감소시키 며, 특히 근령이 증가할수록 매우 작지만 유의적으로 억제 능이 증가하는 것으로 판단된다.
요 약
본 연구에서는 평창군 지역에서 구입한 산양삼 3년근, 5 년근 및 7년근 추출물의 항염증 활성을 대식세포주 모델에 서 비교 평가하고자 하였다. 산양삼 추출물은 100 ppm 농 도까지 세포독성을 보이지 않았으며, 이는 식품섭취를 통 하여 도달 가능한 진세노사이드의 혈중농도인 10 ppm에서 도 안전한 것으로 판단된다. 대식세포의 선천적면역기능을 평가하기 위하여 형광 bead와의 공배양을 통하여 탐식능을 측정한 결과, 산양삼 추출물의 근령 및 처리농도에 따른 영향은 없는 것으로 판단된다. 또한, 후천성 면역기능에서 중요한 항원제시 단백질인 CD80, CD86 및 MHC-II의 발 현량을 측정한 결과, 산양삼의 근령에 따른 유의적 차이는 없었다. 이를 통하여, 정상적 생리활성의 농도까지 산양삼 추출물을 섭취할 경우, 근령에 상관없이 정상적인 면역기 능을 유지하는 것으로 평가된다. 대식세포의 염증성 반응 을 LPS를 통하여 유도하였을 경우, 염증성 매개물질을 생 성하는 COX-2 및 iNOS의 전샤량은 산양삼의 근령 및 처 리농도에 영향을 받지 않았으나, 염증성 사이토카인 IL-6 및 TNF-α는 산양삼 추출물 고농도 처리시 근령의 증가에 따라 유의적으로 감소하는 경향을 보였다. 따라서, 7년근이 3년근보다 유의적으로, 그러나 매우 작은 범위에서 항염증 효능이 있는 것을 판단된다. 추후, 3년근을 이용하여 7년 근과 유사한 혹은 그 이상의 항염증 기작을 갖는 가공소재 를 개발하고자 한다. 본 연구는 세포실험을 통한 근령별 산양삼의 항염증 효과를 규명한 것으로 앞으로 동물 및 인 체적용시험을 통하여 생체 수준에서 산양삼의 세부적인 기 능성 연구를 필요로 한다.







