서 론
대식세포는 식세포작용을 통하여 외부의 미생물 및 위험 요소로부터 개체를 방어하고, 상처를 치유하는 역할을 포 함하여 다양한 면역적 기능에 있어 주요한 역할을 한다 (Morrissette et al., 1999). 또한 항원을 제시하는 분자를 표면 에 발현하여 후천적 면역 반응을 유도하기도 한다(Dunster, 2016). 뿐만 아니라, 대식세포의 염증 반응중, MAPK 및 NF-κB 등의 신호전달체계를 통하여 면역성 호르몬인 사이 토카인 및 면역세포 유도물질인 케모카인을 분비한다(Singh et al., 2016). 한편, 대식세포는 항원을 효율적 제거를 위한 면역반응 유도에 따른 조직의 손상을 가하는 반면에, 항원의 제거 후 염증을 완화하거나 손상된 조직을 치유하는 역할을 하기도 한다(Ley, 2017). 이와 같이 기능적 형태적으로 구분 된 대식세포의 활성화 아집단을 구분하기 위하여 염증성 M1형 대식세포(classically activated macrophage)와 항염증성 M2형 대식세포(alternatively activated macrophage)의 표현 형으로 구분한다(Martinez & Gordo, 2014;Ley & Ley, 2017).
진핵세포의 미토콘드리아는 세포의 호흡과 에너지 생성 을 담당하는 소기관이다(Mehta et al., 2017). 이는 신호를 전달하는 기관으로서 면역세포의 표현형을 유지할 뿐만 아 니라 그들의 기능과 표현형을 전환하는데도 필수적인 역할 을 한다(Jin et al., 2017). 최근의 연구에 의하면 미토콘드 리아의 세포 내 호흡이 대식세포의 분극화와 기능에 중요 하다고 보고되었다(Mehta et al., 2017). 구체적으로, IL-4 에 의해 분극화 된 M2 형 대식세포 내의 미토콘드리아에 서 β-산화를 촉진하는 전사인자인 PPAR-γ의 발현이 증가 하였으며, 그 결과 대식세포 내 미토콘드리아의 β-산화가 촉진되어 염증의 완화 및 손상조직의 회복이 증진됨이 보 고되었다(Galvan-pena et al., 2014).
미토콘드리아의 산화적 인사화의 조절과 관련하여, 세포 내에서의 지방 대사 작용은 섭취하는 유지의 종류에 따라 조절이 가능하다. 예를 들어, 짧은사슬지방산(short-chain fatty acid)과 중간사슬지방산(medium-chain fatty acid)은 식품유지중 대부분을 차지하는 긴사슬지방산(long-chain fatty acid)보다 세포막을 통과시 carnitine을 필요로 하지 않으며 세포질 내에서 상대적으로 높은 용해도를 보이며 때문에, β-산화가 더 효율적으로 이루어진다고 알려져 있 다(Hara et al. 2014).
쌀겨에서 추출해 낸 기름인 현미유는 균형잡힌 지방산 비율과 γ-oryzanol, tocopherol류, phytosterol류 와 같은 건 강에 유익하다고 알려진 기능성 성분들을 함유하고 있다 (Nagendra et al., 2011). 현미유의 건강증진 기능과 관련하 여, 여러 선행연구들이 항염증, 항비만, 항당뇨 효과를 보 고하고 있으나(Nelson & Cohen, 1976;Yadav et al., 2016;Park et al., 2017), 그 세부적인 분자생물학적 메커 니즘은 현재까지 밝혀지지 않았다. 따라서, 염증을 유도한 동물 모델에서 염증을 완화할 수 있다는 연구 결과를 바탕 으로, 본 연구에서는 손상 조직을 회복하는 역할을 하는 M2 대식세포 모델을 이용하여 현미유의 식이급여에 따른 영향을 미토콘드리아의 호흡 조절 및 사이토카인의 분비량 측정을 통하여 평가하였다.
재료 및 방법
본 연구는 경희대학교 동물실험윤리위원회(승인번호 KHUASP(GC)-18-017)의 승인에 따라 수행되었다. 수컷의 4주령 C57BL/6 쥐를 Raon Bio (Yongin, Korea)에서 구입 하여 사용하였다. 24마리의 쥐들을 1주간 AIN-76A (Raon Bio)를 자율급여하며 적응 기간을 가진 후, 무작위로 3 그 룹(n=8)으로 나누어서 4주간 Table 1에 제시된 바와 같이 대조군인 옥배유(corn oil, CO)를 각각 팜유(palm oil, PO) (JCY, Seongnam, Korea) 또는 현미유(rice bran oil, RBO) (Serim Hyunmi, Jungeup, Korea)가 배합된 AIN-76A 변형 사료(라온 바이오)를 제조하여 자율급여하였다. 사육 환경 은 실내 온도를 25°C로 유지하였으며 12시간의 명암 주기 를 설정하였다. 4주간의 식이 후 골수 유래 세포를 얻기 위하여 CO2를 이용하여 안락사 후, 무균 상태에서 정강뼈 와 넙다리뼈로부터 골수세포를 분리하였다. 골수유래대식 세포(bone marrow derived macrophages, BMDM)의 분화 를 유도하기 위하여 세포들은 10% fetal bovine serum (FBS, Thermo Fisher Scientific, Waltham, MA, USA)와 10 ng/mL의 macrophage colony-stimulating factor (M-CSF, Thermo Fisher Scientific)를 첨가한 Iscove’s modified Dulbecco’s medium (IMDM, Thermo Fisher Scientific)에 37°C, 5% CO2 조건에서 7일간 배양하였다. 대식세포의 분 화를 유도한 후 7일 차에, 세포들은 10% FBS와 10 ng/mL IL-4 (Thermo Fisher Scientific)가 첨가된 IMDM으로 24시 간을 더 배양하여 M2 대식세포(M2-BMDM) 형태로 분극 화를 유도하였다.
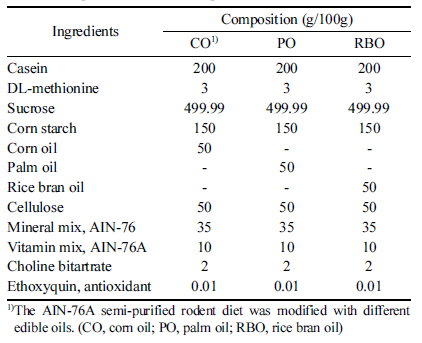
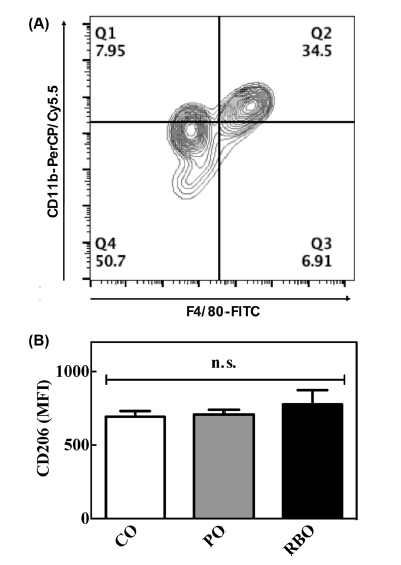
M-CSF로 7일간 분화를 유도하고, M2 대식세포로 분극화 된 세포들을 유세포분석기를 이용하여 표면의 활성화 마커 를 분석하였다. 간락히 설명하면, 세포를 배양하던 상층액을 제거하고, 차가운 PBS를 이용하여 세포를 회수하였다. 회수 한 세포를 5분간 원심분리(300×g)한 후, Fc region의 비특 이적 항체 결합을 막기 위하여 1 mg/mL농도의 anti-mouse CD16/CD32 mAbs (BD Biosciences, San Jose, CA, USA) 를 4°C에서 10분간 처리하였다. 이후 PE 형광이 부착된 anti-mouse CD206 (BD Biosciences), FITC 형광이 부착된 anti-mouse F4/80 (BD Biosciences), PerCP-Cyanine5.5 형광 이 부착된 anti-mouse CD11b (BD Biosciences)를 세포에 4°C에서 10분간 처리하였다. 원심분리(300×g)로 비부착 항 체를 제거한 후, 100 μL의 PBS에 세포를 부유시켜 BD AccuriTM C6 유세포분석기(BD Biosciences)를 이용하여 대 식세포의 활성화 마커의 발현을 평균 형광 강도(Mean fluorescence Intensities, MFI)에 따라 분석하였다.
세포를 배양한 상층액을 회수한 후 사용 전 까지 -80°C 에 보관하였다. M2 형으로 분극화를 유도한 대식세포가 분비한 사이토카인 IL-10은 sandwich ELISA kit (BD Bioscience)를 사용하여 제조사의 프로토콜에 따라 측정하 였다. 샘플 내 사이토카인의 농도는 Bio-Rad micro plate reader를 이용해 450 nm에서의 흡광도를 측정하여 표준물 질의 농도별 표준곡선을 이용해 계산되었다.
IMDM에서 7일간 배양되어 분화된 대식세포들은 mini cell scraper를 이용하여 회수한 후 XFp assay plate (Agilent Technologies, Santa Clara, CA, USA)로 옮겨졌다. 그 후 10 ng/mL의 IL-4를 처리하여 37°C, 5% CO2 배양기에서 24시간 배양하여 M2 대식세포로 분극화를 유도하였으며, 세포의 농도는 1×104 cells/well로 유지되었다. 측정 전 분 극화 유도된 대식세포는 4.5 g/L D-glucose, L-glutamine, sodium pyruvate이 첨가된 DMEM 배지로 non-CO2 배양 기에서 1시간동안 배양하였다. 이 때, 온도는 37°C로 설정 되었고, 배지는 pH 7.4로 유지되었다. 제조사의 프로토콜에 따라 mitochondrial inhibitor인 oligomycin (1.0 μM), FCCP (1.0 μM), rotenone/antimycin A (0.5 μM)이 순차적으로 세 포에 처리되었다. 산화적 인산화의 지표인 산소소비량 (Oxygen Consumption Rate, OCR)이 SeahorseTM XFp analyzer와 software (Agilent Technologies)로 계산되었다.
결과 및 고찰
골수 세포를 회수하여 7일간 M-CSF를 이용하여 BMDM 분화를 유도한 후, IL-4를 이용하여 M2-BMDM의 분극화 를 유도하였다. 세포들을 형광이 부착된 항체를 이용하여 유세포 분석기로 분석하였다. 먼저 대식세포를 구분하기 위하여 F4/80+CD11b+ 세포군을 지정한 후(Fig. 1A), M2 대식세포의 표면 활성화 마커인 CD206의 평균 형광 강도 를 비교하였다(Fig. 1B). 선행연구의 보고에 의하면 CD206 단백질은 IL-4의 수용체 없이도 대식세포의 표면에 발현될 수 있는 단백질로서, M2 대식세포를 구분할 때 사용되는 마커이다(Nawaz et al., 2017). 유세포분석 결과, 옥배유 섭 취군의 M2-BMDM의 CD206발현량은 693.9±37.73(MFI, 단위 없음)을 나타내었으며 팜유와 현미유는 각각 708.1± 32.65, 776.6±96.62를 보임으로써 식용유지에 따른 유의차 를 보이지 않았다. 현미유의 항염증 기작과 관련하여 제1 형 당뇨와 비만에 의한 고지혈증 및 지방조직 내 염증성 대식세포의 활성화를 제어하는 효과는 보고된 바가 있으나 (Cicero & Gaddi, 2001;Siddiqui et al., 2010), M2 대식세 포에 미치는 영향을 연구한 보고는 전무하다. 따라서, 본 결과에 따르면 기보고된 현미유의 항염증기작은 M2- BMDM의 분화에 비의존적인 것으로 판단된다.
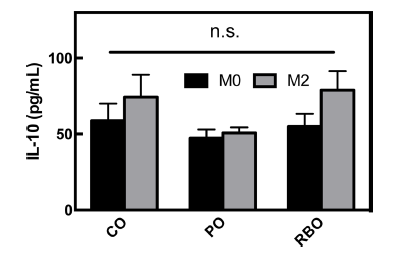
M2 분화 전의 BMDM (M0-BMDM) 배양 배지의 상층 액을 회수하여, 분비된 항염증성 사이토카인 IL-10을 측정 한 결과(Fig 2), 옥배유 vs 팜유 vs 현미유 섭취군은 각각 58.82±11.21 vs 47.30±5.756 vs 54.98±8.319 pg/mL을 보임 으로써 처리군간 유의적 차이가 없었다(p>0.05). 대식세포 가 IL-4에 의해 M2 대식세포로 유도되면 항염증성 사이토 카인인 IL-10의 분비량이 증가한다(Makita et al., 2015). 따라서, 식이중 유지의 차이가 M2 subsets의 IL-10 분비에 미치는 영향을 알아보기 위하여, M2-BMDM으로 유도후 상층액 분비량을 정량한 결과, 실험군간 유의차는 역시 나 타나지 않았다(옥배유 vs 팜유 vs 현미유, 74.35±14.61 vs 50.72±3.739 vs 78.94±12.48) (Fig 2B). 그러나, 각 식이군 별 M0-BMDM 분비 IL-10과 M2-BMDM 분비 IL-10의 발현량을 비교할 때, 옥배유 및 현미유 섭취군에서 M2- BMDM으로 분화시 증가하는 경향을 보였다. 이는 현미유 가 실험군 내에서 유의적 차이를 보이지 않았지만, 장기섭 취시 생리의학적 유의미한 변화를 유도할 수 있다는 것을 의미한다. 이와 관련하여, 관절염 염증을 유발한 쥐에서 현 미유가 함유된 식이를 한 쥐에서 관절염의 완화가 되었다 는 선행연구 결과가 보고되었다(Yadav et al. 2016). 관절염 모델에서 IL-10의 소량변화가 병변의 유의적 차이를 보였다 는 선행결과(Brennan & McInnes, 2008) 및 IL-10을 이용한 염증성 질환의 완화 및 치료효과(Asadullah, 2003)를 고려할 때, 현미유의 투여량 증량에 따른 M2-BMDM의 IL-10 분 비량 변화에 관한 후속 연구가 필요하다고 판단된다.
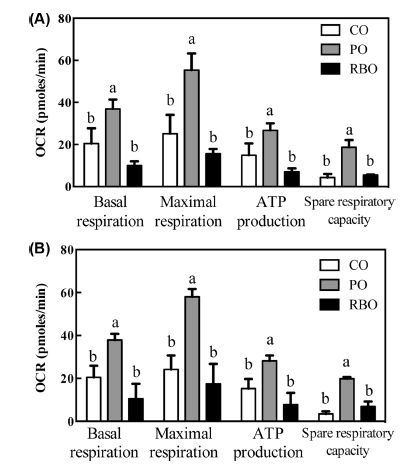
대식세포의 산소소비량(OCR)을 통해 측정할 수 있는 미 토콘드리아의 호흡은 SeahorseTM XFp cellular flux analyzer 로 측정하였다. 그 결과, M0-BMDM의 전체적인 산소 소비 량은 대조군인 팜유 처리군이 가장 높게 나타났으며 현미유 처리군의 산소소비량은 옥배유 처리군과 유의차가 없이 나 타났다(Fig. 3A). 이는 팜유가 중간사슬지방산(medium chain fatty acids)이 많이 함유되어 있고, 중간사슬지방산이 긴사슬 지방산보다 세포 내에서 β-oxidation이 증가하고 미토콘드리 아 내 호흡이 증가한다는 선행연구의 결과(Hara et al., 2014)와 일치한다. 같은 현상이 M2-BMDM에서도 나타났으 며(Fig. 3B), 이는 현미유가 염증 반응 시 M2 대식세포의 산소소비량을 증가와 무관한 기작을 통하여 항염증 효과를 나타냄을 의미한다. 실제로 현미유의 지방산 조성은 옥배유 와 유사하므로, 지방산의 산화속도 차이에 따른 차이가 없을 뿐만 아니라 현미유내의 γ-oryzanol 등 미량 유용성분들도 산소소비량에 미치는 영향은 없음을 보여준다.
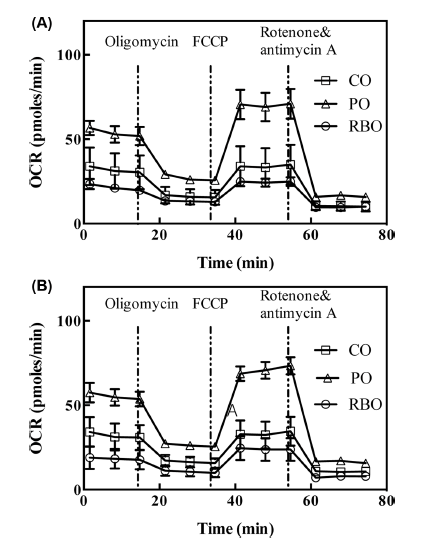
산소소비량의 변화를 좀 더 구체적으로 분석하기 위하여 일반적으로 3가지의 약물이 사용되는데, oligomycin은 미 토콘드리아의 ATP 합성효소를 제어함으로써 ATP 생성에 필요한 산소소비량을 측정하기 위해 투여하며, FCCP는 미 토콘드리아 호흡의 uncoupler로서 미토콘드리아 내외막의 수 소수송을 가속함으로써 미토콘드리아 호흡의 최대능력을 측 정하기 위하여 사용된다. 마지막으로 rotenone과 antimycin A는 미토콘드리아의 complex I과 III을 저해함으로써 모든 전자 수송 체계를 닫음으로써 세포호흡 외의 산소소비량을 측정하여 기초호흡을 측정하는데 사용된다(Van den Bossche et al., 2015). 이를 통하여 식이중 유지성분 변화에 따른 산소소비량의 변화를 측정한 결과, 팜유 처리군의 M0 및 M2-BMDM 모두에서 basal respiration, maximal respiration, ATP production, spare respiratory capacity 모두 증가함을 보였다(Fig. 4). 그러나, 옥배유와 현미유는 서로간의 유의 적 차이가 없이 낮은 값을 보임으로써, 팜유에 의한 산소 소비량 증가가 미토콘드리아내 호흡기작 중 특정 효소의 증강효과가 아닌 기질로서의 증강효과임을 보여준다.
결 론
쌀의 도정 후에 생긴 쌀겨에서 추출해낸 기름인 현미유 는 선행 연구에서 M1 대식세포라고 알려진 염증성 대식세 포에서 항염증 효과를 가진다고 알려졌다. 그러나 현미유 가 세포 내에서 작용하는 분자생물학적인 메커니즘은 명확 히 규명되지 않았다. 최근 식품 성분의 분자생물학적인 항 염증 기작에 대한 연구들은 미토콘드리아 내 호흡이 대식 세포의 기능에 영향을 미친다고 밝힌 바 있다. 따라서, 본 연구에서는 현미유의 처리에 따라 대식세포 내에서 미토콘 드리아의 에너지 대사 조절을 통한 항염증성 사이토카인 분비량의 변화를 알아보았다. 중간사슬지방산이 풍부한 팜 유를 대조군으로 사용하여 C57BL/6 마우스에 옥수수유, 팜유, 현미유를 포함한 식이를 4주간 자율급식하였다. 4주 후 안락사를 한 후, 골수 유래 대식세포를 회수하여 M2로 분극화하여 CD206의 발현량을 측정한 결과 유의적 차이 를 보이지 않았다. 세포배양액 중 IL-10의 생성량 또한 식 이군간에 통계적 차이를 보이지 않았다. 나아가, 미토콘드 리아 내 호흡의 지표인 산소소비량이 대조군인 팜유에 비 해 낮게 나타났음으로 통해서 현미유가 M2 대식세포 내에 서는 항염증 반응 조절에 관여하지 않고, 미토콘드리아의 호흡 또한 증가시키지 않는 것으로 보인다.