서 론
미세먼지는 대기의 총 부유 분진(total suspended, TSP) 중 지름이 10 μm 보다 작은 미세먼지(PM10)와 지름이 2.5 μm보다 작은 초미세먼지(PM2.5)로 구분되며, 이는 호 흡 시 체내 침착이 가능한 흡입성 먼지(respirable dust)로 알려져 있다. 미세먼지는 디젤배기가스 및 다양한 원인으 로 발생되는 질소산화물, 황산화물 등이 공기 중에서 화학 반응하여 생성되는 황산염, 질산염과 흙먼지, 꽃가루 등으 로 구성되어 있다(Mangia et al., 2015). 미세먼지는 입자가 매우 작아 폐포까지 깊숙하게 침투하여 기도의 상피세포에 염증 반응을 유발하고, 기도의 염증은 흉부교획감, 기침, 천명 등의 증상을 나타내며 각종 호흡기 질환이 기도 염증 과 관련이 있다(Doeing & Solway, 2013). 일반적으로 기 도 염증이 유발되면 기관지 폐포세척액 내의 과립구와 림 프구의 총 세포수가 늘어나면서 기도 및 폐포에 침윤한다. 또한 호산구, T helper 2 cell, mast cell 등 염증 세포에서 분비되는 tumor necrosis factor-alpha (TNF-α), interleukin- 4 (IL-4), IL-5, IL-6, IL-13, IL-33 등의 염증성 cytokine은 점액 세포의 크기와 점액 물질의 양을 가중시켜 염증을 발 생시킨다(Barnes, 1994;Nials & Uddin, 2008;Ghio et al., 2012). OECD 보고서에 따르면 대기오염으로 인한 전 세 계의 조기 사망자는 2010년 300만 명에서 2060년 약 900 만 명에 이를 것으로 추정하며, 국내의 경우 인구 100만 명당 2010년 360명에서 2060년 1,109명으로 약 3배 증가 할 것으로 전망된다(Lanzi, 2016). 그러나 현재까지 미세먼 지에 의한 기관지 염증에 관하여 보호 및 완화에 대한 뚜 렷한 대책이 없는 상황이며, 미세먼지에 노출되었을 때 발 생하는 호흡기 염증을 개선할 수 있는 천연물 소재에 대 한 관심이 높아지고 있다. 국내에서 재배되는 대표적인 선 인장인 손바닥선인장(Opuntia ficus-indica)은 기온이 따뜻 한 제주도, 남해안 일대에서 재배되며, 부채선인장과에 속 한다. 형태가 사람의 손바닥을 닮아서 손바닥선인장이라 불리는데, 백년초라고도 불린다. 예로부터 식용으로 섭취 되어 왔으며 <중약대사전>, <본초강목>에서 기침, 해열진 통제, 천식 등에 효능이 있는 것으로 기록되어 민간요법 에 활용되어 왔다. 또한 보고된 연구 자료에 의하면 진통, 소염 작용(Choi et al., 2002), 항당뇨 활성(Shin et al., 2002), 항산화 작용(Hwang et al., 2015) 등의 효과가 있는 것으로 보고되어 있다. 손바닥선인장의 항염증 효능 등이 ovalbumin (OVA) 및 미세먼지에 의한 호흡기 염증을 개선 할 수 있을 것으로 판단됨에 따라 본 연구에서는 손바닥선 인장의 줄기 추출물(OFI extract)이 OVA와 미세먼지에 의 한 호흡기 염증 개선 효능에 대하여 MH-S 세포주에서 작 용 기전을 규명하고자 하였으며 동물 모델을 통하여 염증 개선 효과를 살펴보고자 하였다. 또한, 손바닥선인장 줄기 추출물의 지표 물질을 분석하고 해당 물질의 분석법을 확 립하며, 세포 실험을 통하여 항염증 효능을 확인하고자 하 였다.
재료 및 방법
본 실험에 사용한 손바닥선인장(Opuntia ficus-indica)은 제주산으로 농업법인삼원네이처(제주시, 제주특별자치도)에 서 손바닥선인장 줄기 건조물로 구입하여 사용하였다. 열 수추출물(OFI-W)은 손바닥선인장 건조물에 10-15배수(w/v) 열수를 가하여 95±5 °C에서 5시간 동안 2회 환류추출한 후, 100 마이크론 필터로 여과하였다. 감압농축기로 농축한 후 동결 건조하여 시료로 사용하였다. 50% 주정추출물(OFI- 50E)은 손바닥선인장 건조물에 10-15배수(w/v) 50% 농도 의 주정을 가하여 65±5 °C에서 5시간 동안 2회 환류추출 한 후, 100 마이크론 필터로 여과하였다. 감압농축기로 농 축한 후 동결 건조하여 시료로 사용하였다. 실험에 사용된 미세먼지복합물(fine dust + diesel particulate matter, FDM) 은 1%의 명반(aluminium hydroxide) gell adjuvant가 혼합 된 saline 용액에 PM10 (ERM CZ-120; Sigma-Aldrich, St. Louis, MO, USA) 3mg/mL 농도와 diesel particulate matter (DPM) (SRM 2975, Sigma-Aldrich, St. Louis, MO, USA) 0.6 mg/mL 농도가 되도록 제조하여 사용하였다. FDM은 100 μL씩 intranasal tracheal (INT) injection 방법으로 3일 에 한 번씩 총 3회(약물투여 3일 후, 6일 후, 9일 후) 기도 를 통해 폐로 직접 주입하였다. Dexamethasone은 3 mg/kg 씩 매일 1회, 11일간 복강주사로 투여하였다. FDM 마지막 투여 3일 후 실험동물을 희생시켜 효능평가를 실시하였다 (Lee et al., 2022).
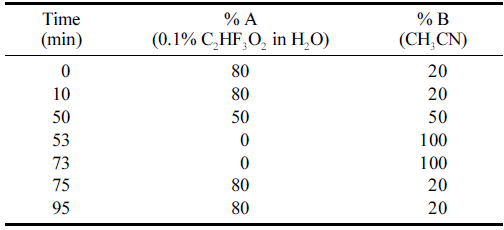
손바닥선인장 줄기 50% (w/v) ethanol extract (OFI-50E) 의 지표 물질 시험법 설정을 위해 HPLC (high performance liquid chromatography) 분석을 실시하였다. 손바닥선인장 줄기 추출물(OFI-50E)을 80% (w/v) methanol에 용해하여 PVDF syringe filter로 여과한 후 분석에 사용하였다. 분석 기기는 Waters 1500 Series System, Waters 2998 PDA Detector (Waters Corp., Worcester, MA, USA), Capcell Pak C18 column MGII (250 × 4.6mm I.D., 5 μm, Shiseido, Japan) 를 사용하였고 분석에 사용된 모든 용매는 J.T Baker (Phillipsburg, NJ, USA)로부터 구매한 HPLC grade를 사용 하였다. 이동상으로 0.1% trifluoroacetic acid (A)와 acetonitrile (B)를 사용하였고 분석 조건은 Table 1과 같다. 363 nm에서 크로마토그램을 추출한 후 주요 peak의 화합 물을 회수하여 1H NMR 분석을 실시하였다.
|
본 동물 실험은 대전대학교 동물윤리 심의위원회의 심의 를 받아 진행되었으며(동물 실험 승인번호 DJUARB2019- 021), 동물 실험 윤리위원회 가이드라인을 준수하여 시행되 었다. 7주령의 수컷 Balb/c 마우스(Orient Bio Co., Ltd. Gyenggi)를 7 군으로 나누어 실험하였으며, 각 군당 8마리씩 구성하였다. 정상군(Balb/c Normal), 대조군(OVA+PM10- CTL), 양성대조군(OVA+PM10-Dexamethsone 3 mg/kg), OVA+PM10+OFI-W 100 mg/kg, OVA+PM10+OFI-W 200 mg/kg, OVA+PM10+OFI-50E 100 mg/kg, OVA+PM10+OFI- 50E 200 mg/kg으로 실험을 진행하였다. OVA에 의한 호흡 기 손상 모델의 제작을 위해 PBS에 500 μg/mL 난황 알부 민(OVA, chicken egg ovalbumin; Grade IV)과 10% (w/v) alum (aluminum potassium sulfate; Sigma)을 용해하였다. 10 N NaOH를 이용하여 혼합물의 pH를 6.5로 조정하고 상 온에서 1시간 방치한 후 750 x g에서 5분 동안 원심 분리 하여 얻은 OVA/Alum 침전물(pellet)을 증류수에 용해하였 다. 100 μg OVA/Alum를 0.2mL로 조정하고 0일과 7일째 에 복강 내 주사하여 전신 감작 시켰다. 3일과 10일째에 2% OVA 100 μL를 기도 투여(i.t) 하고, 2주째에 1% OVA 용액을 하루 1회 30분, 일주일에 3회 분무하여 비강과 기 도를 통해 흡입시켰다. 안와채혈법으로 채혈하여 anti-OVA antibody 수준을 측정하여 천식 유발 마우스를 선별하였다. 제조된 미세먼지 PM10의 intranasal tracheal injection은 OVA 감작 22일째에 1% OVA 용액 분무와 동시 시작하여 기도를 통해 폐로 직접 주입하였다. 손바닥선인장 줄기 추출 물의 투여는 OVA 감작 21일째부터 손바닥선인장 줄기 추 출물은 매일 1회, 24일간 경구 투여하였고, dexamethasone 은 3 mg/kg씩 매일 1회, 24일간 복강 주사 투여하였다.
마우스의 기관지 폐포(bronchoalveolar lavage, BAL)로부 터 세포를 분리하기 위해 기관지에 fetal bovine serum (FBS)-free Dulbecco’s modified eagle’s medium (DMEM) 배양액 1mL를 반복 순환시켜 회수한 후, ammonium chloride potassium (ACK) 용액을 37 °C에서 5분 동안 처리 하여 FBS-free DMEM 배지로 세척하였다. 이를 기관지 폐 포세척액(bronchoalveolar lavage Fluid, BALF)으로 사용하 였다. 또한 마우스로부터 적출한 폐조직을 파쇄한 후 3mL DMEM 배지에 넣고 1 mg/mL의 collagenase IV (C5138, Sigma)를 가하여 shaking incubator에서 37 °C, 30분 동안 4 회 이상 조직 분해를 통해 폐 세포를 분리하였고, DMEM 배지로 세척 후 현탄하여 cell strainer (352350, FALCON) 으로 불순물을 제거하였고 이를 실험에 사용하였다.
BALF 및 비장 세포에서 염증성 cytokine인 IL-17, TNF-α, CXCL-1, MIP-2 등의 발현 정도를 측정하기 위해 ELISA (enzyme linked immune sorbent assay)를 이용하였다. 각 항체(antibody)를 microwell에 coating한 후 4 °C에서 24시간 반응시켰다. 각 w ell을 3회 washing buffer로 세척한 후에 10배 희석한 혈청을 100 μL씩 분주하였다. 실온에서 1시간 방치한 후 washing buffer로 2회 세척한 다음, antibody Avidin-HRP conjugeted (R&D system) 100 μL를 처리하고 실온에서 1시간 방치한 후 다시 세척하였다. TMB 기질을 100 μL씩 분주하고 암소에서 30분간 방치한 후 50 μL의 stop solution을 처리하여 ELISA leader (Emax, Molecular Devices) 450 nm에서 흡광도를 측정하였다.
폐 조직 및 BAL의 총 세포수 측정을 위해 0.04% trypan blue로 염색하고 현미경을 이용하였고, Diff-Quik Stain으로 호중구 수의 증가를 확인하였다. 면역세포수 측정을 위해 분리한 BALF, 폐 세포를 5×105 cell로 맞춘 후 4 °C에서 면 역형광염색(Immunofluorescence staining)하였고 fluorescence activated cell sorter (FACS) 분석하였다. Staining한 후 3회 이상 phosphate buffered saline (PBS)로 세척한 후 flow cytometry의 Cell Quest 프로그램(BD Biosciences, San Diego, CA)을 통해 세포 빈도수를 백분율(%)로 측정하였 고, 각 조직의 절대 총 세포수를 계산하였다.
MH-S alveolar macrophage를 1×106 cell/well로 분주하 고 6시간 된 6 w ell plate에 OFI-50E를 농도별 처리하고 30분 후 미세먼지 50 μg/mL를 처리하였다. 24시간 배양한 후 PBS로 3회 세척하고 원심분리 한 pellet에 lysis buffer 를 가하였다. 이를 4 °C에서 30분 방치한 후, 12,000 rpm에서 30분 원심분리하여 상등액을 사용하였다. 다양한 단백질의 정량을 위해 BCA protein assay kit (Thermo Scientific, Rockford, IL, USA)를 사용하였다. 희석한 sample buffer에 단백질 10 μg을 넣어 100 °C에서 10분간 불활성화 시킨 후 10% SDS polyacrylamidegel에 전기영동 하였다. SDS polyacrylamide gel을 nitrocellulose membrane으로 transfer 하여 5% non fat dry milk에서 1시간 blocking 하였다. 1 차, 2차 항체를 상온에서 1시간씩 부착시켰고 사이에 washing을 TBST buffer로 3번씩 진행하였다. ECL (Amer sham Pharmacia Biotech, NJ, USA)을 처리한 membrane을 암실에서 X-ray flim에 감광시켜 현상하였고, 각 밴드는 Image J 소프트웨어를 이용하여 정량화 하였다.
폐 조직에 대한 신호전달 단백질의 발현 양상을 확인하 기 위해 면역형광염색을 하였다. 냉동 폐조직을 cryostat microtome (CM 3050S; Leica Microsystems, Wetzlar, Germany)을 이용하여 20μm 두께로 자른 후 4% paraformaldehyde와 4% sucrose가 포함된 PBS로 40분 동 안 고정하였다. 이를 0.5% Nonidet P-40이 포함된 PBS로 투과시켰으며 2.5% 말 혈청과 2.5% BSA (bovine serum albumin)로 16시간 blocking 하였다. 2중 면역형광염색은 interleukin-1 receptor associated kinase (IRAK-1), TNF-α, CXCL-2, STAT3 등의 항체로 4 °C에서 overnight 반응시켰 고, 형광으로 표지 된 2차 항체로 2시간 추가 반응시켰다. 핵 염색은 4′, 6-diamidino-2-phenylindole (DAPI)를 사용하 였고 조직 절편은 Eclipse Ti-E inverted fluorescence microscope (Nikon Instruments Inc., Mississauga, Canada) 로 관찰하였다.
Formalin으로 고정한 폐조직을 paraffin으로 포매한 후 5 μm 두께로 절편하였다. 폐 조직 절편은 hematoxylin and eosin (H&E)과 Masson’s trichrome 염색을 하였고 Alcian blue/Periodic acid-Schiff stain (AB/PAS) 염색을 하여 광학 현미경으로 관찰하였다.
실험은 Peebles Rs Jr의 방법을 변형하여 시행하였다. 마 지막 분무 24시간 후, methacholine (Sigma, USA)을 PBS에 희석하여 3.125 mg/mL, 6.25 mg/mL, 12.5 mg/mL 및 25mg/ mL의 농도로 각각 5분간 분무를 통해 노출시킨 후 동물용 체적변동측정기를 사용하여 Penh 값을 5초 간격으로 3분 간 측정하였으며, 측정값의 평균을 대푯값으로 취하였다.
MH-S alveolar macrophage cell (ATCC, Rockville, MD, USA)을 1640 media (Gibco BRL, Gaithersburg, MD, USA) 에 10% FBS (Gibco BRL, Gaithersburg, MD, USA)와 1% antibiotics (Gibco BRL, Gaithersburg, MD, USA)를 첨가 한 배지를 사용하여 96 well plate에 w ell당 2 × 104 cell이 되도록 분주하고, narcissin을 0.75, 3, 25, 50, 100 μg/mL 농도로 처리한 후 37 °C, 5% CO2 incubator 항온 및 항습 조건에서 24시간 배양하였다. MTS tetrazolium salt와 electron coupling reagent (Phenazine methosulfate, PMS)를 20:1 비율로 혼합한 후, 혼합액과 RPMI 1640 media를 각 50 μL씩 well 당 총 100 μL를 분주하였다. 4시간 배양 후 plate reader로 490 nm에서 흡광도를 측정하였다.
MH-S alveolar macrophage cell을 1640 media에 10% FBS와 1% antibiotics를 첨가한 배지를 사용하여 6 w ell plate에 w ell당 1× 106 cell이 되도록 분주하고, PM10 50 μg/ mL와 narcissin을 25, 50, 100 μg/mL 농도로 처리한 후 37 °C, 5% CO2 incubator 항온 및 항습 조건에서 24시간 배양하였고, 배양액을 실험에 사용하였다. NO 생성량을 측 정하기 위해 배양액과 griess 시약을 각각 100 μL씩 혼합 하여 37 °C에서 10분 방치 후, ELISA reader로 550 nm에서 흡광도를 측정하였다. Sodium nitrate로 작성한 표준곡선에 대입하여 NO 함량을 산출하였다. 또한, 배양액에서 IL-6 및 TNF-α (R&D system, USA) 수준을 ELISA leader로 450 nm에서 흡광도를 측정하였다.
결 과
손바닥선인장 줄기 50% ethanol extract (OFI-50E)의 지 표성분 분석 결과, OFI-50E의 주요 화합물은 narcissin (1.59±0.1 mg/g)으로 확인되었다(Fig. 1).
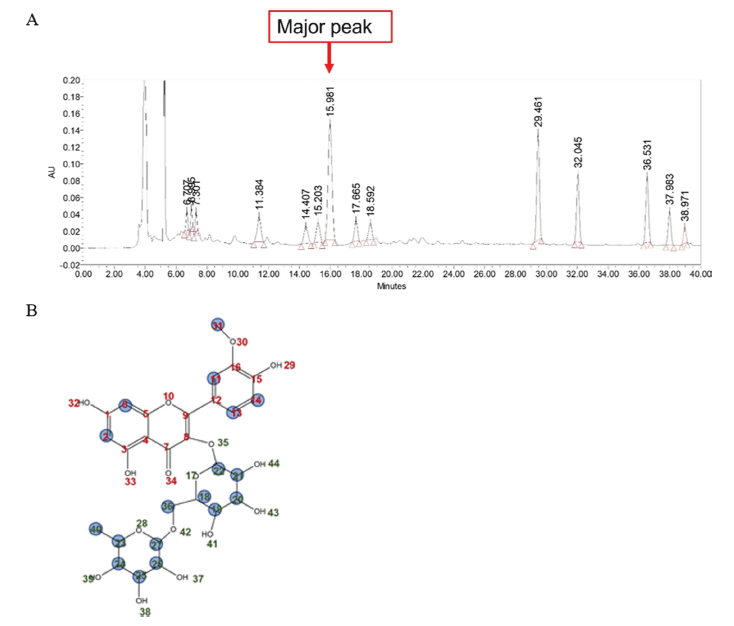
폐 조직 및 BAL의 총세포수는 OVA와 미세먼지에 노출 시킨 대조군(OVA+PM10_CTL)에서 BAL 및 폐의 전체 세 포 수가 증가하였으며, dexamethasone을 투여한 양성대조 군(Dexa, 3 mg/kg)에서 유의적으로 감소하였다. OFI-50E 100 mg/kg 투여군과(p<0.01) OFI-W 100 mg/kg 투여군 (p<0.01)의 폐 총세포수가 유의적으로 감소하였고, BAL 에 서는 OFI-50E 100 mg/kg 투여군(p<0.01), 200 mg/kg 투여 군(p<0.01), OFI-W 100 mg/kg 투여군(p<0.01)의 총세포수 가 유의적으로 감소하였다. 또한, OVA와 미세먼지로 유발 된 대조군의 호중구(neutrophils) 세포 수가 크게 증가하였 으며, 양성대조군 및 OFI-50E 100 mg/kg, 200 mg/kg 투여 군에서의 감소(p<0.01)가 눈에 띄었다. 폐의 염증 반응으로 인해 증가된 호중구 세포의 감소로 보아 손바닥선인장 줄 기 추출물이 폐의 염증 반응을 감소시킬 수 있음을 알 수 있었다(Fig. 2).
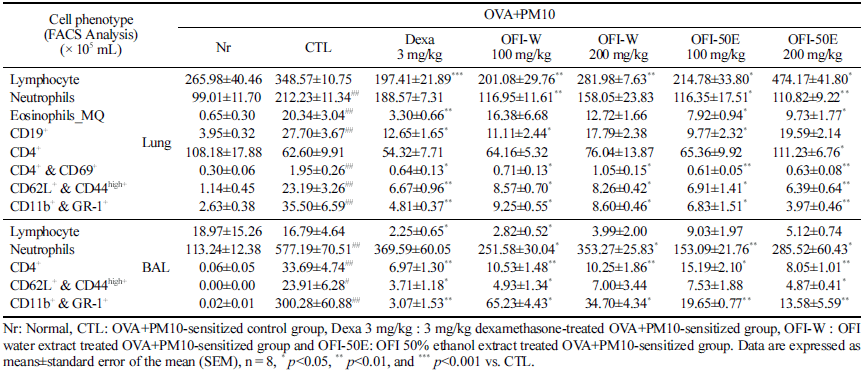
폐 조직에서의 면역세포수를 산출한 결과, 활성화된 T helper cell CD4+&CD69+ 절대세포수에서 OFI-50E 100 mg/kg, 200mg/kg 투여군이 양성대조군(Dexa, 3mg/kg) 보다 더 높은 유의성을 가지게 감소하였으며(p<0.01), CD62L/ CD44High+ cell, CD11b+/Gr-1+ cell의 결과에서는 양성대조 군과 함께 OFI-50E 200 mg/kg 투여군이 유의적으로 감소 한 것을 확인하였다(p<0.01). 또한 호중구 세포수는 OFI- 50E 200 mg/kg 투여군과 OFI-W 100 mg/kg 투여군이 특 히 유의적으로 감소되었다(p<0.01). 이는 손바닥선인장 줄 기 추출물이 OVA 및 미세먼지로 유발한 염증과 관련된 면역세포가 폐 조직으로 침윤되는 것을 억제하거나 염증 관련 면역세포의 활성화를 억제하는 것으로 판단된다. 기 관지 폐포세척액(BALF)에서 면역세포수를 분석한 결과, 대조군 대비 OFI-50E 100 mg/kg 투여군의 호중구 세포수 감소가 뚜렷하였으며(p<0.01), CD11b+/Gr-1+ cell에서 OFI- 50E 100 mg/kg, 200 mg/kg 투여군이 양성대조군과 같이 유의적인 감소를 보였다. 또한 CD4+ cell에서 OFI-W 100 mg/kg, 200mg/kg, OFI-50E 200mg/kg 투여군의 면역세포수 가 유의성 있게 감소하였음을 확인하였다(p<0.01) (Table 2).
|
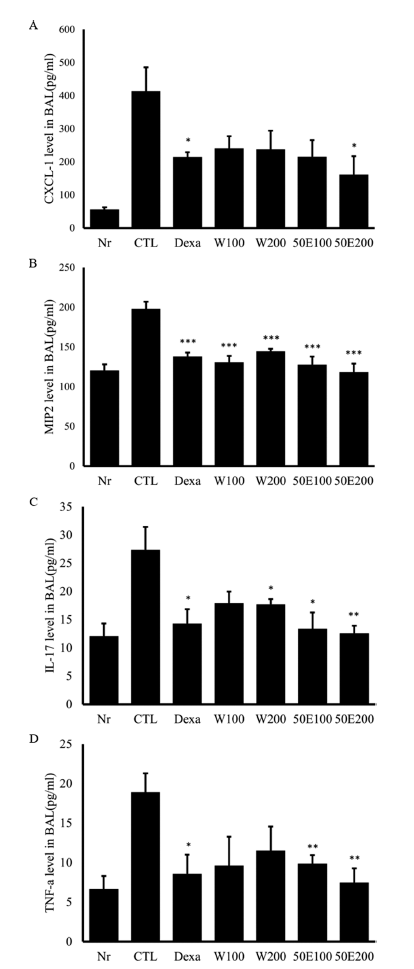
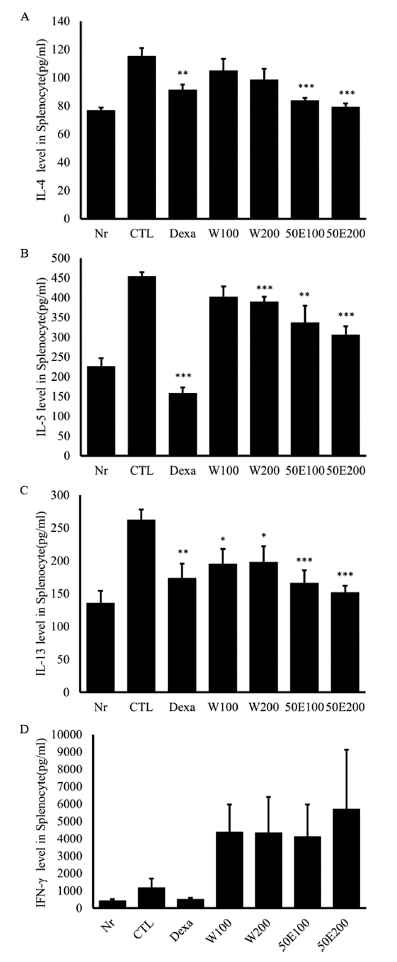
기관지 폐포세척액에서 CXCL-1 및 염증성 cytokine (MIP-2, IL17, TNF-α)을 분석한 결과, CXCL-1의 경우 OFI-50E 200 mg/kg 투여군이 양성대조군과 같이 유의적 감소를 보였다(p<0.05). MIP-2의 경우 양성대조군 및 투여 군이 모두 통계적으로 뚜렷한 감소를 보였으며(p<0.001), IL-17은 OFI-50E 200 mg/kg 투여군에서 가장 유의미한 감 소를 보였다(p<0.01). 또한 TNF-α의 경우, OFI-50E 200 mg/kg 투여군(p<0.01)과 OFI-50E 100 mg/kg 투여군(p< 0.01)에서 눈에 띄는 감소를 확인하였다(Fig. 3). 비장 세포 배양액에서 Th2 cytokine IL-4, IL-5, IL-13 생산량을 분석 한 결과, IL-4, IL-13의 경우 특히 OFI-50E 200 mg/kg 투 여군과 OFI-50E 100 mg/kg 투여군이 양성대조군보다도 유 의성 높은 감소를 보였으며(p<0.001), IL-5는 OFI-W 200 mg/kg 투여군과(p<0.001) OFI-50E 200 mg/kg 투여군(p< 0.001), OFI-50E 100 mg/kg 투여군(p<0.01)이 각각 유의성 있게 감소되었다(Fig. 4).
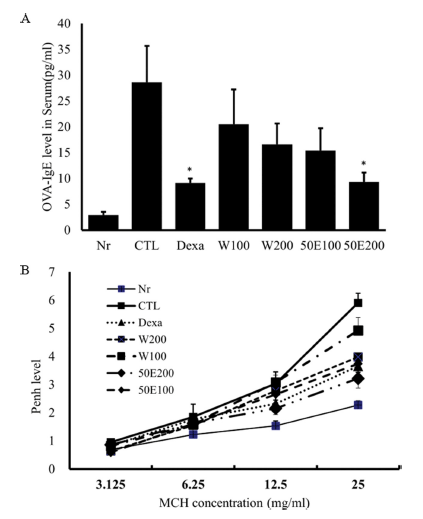
천식이 유발되면 기도내로 들어온 allergen 자극으로 Th2 세포에서 분비하는 IL-4와 IL-13 등에 의해 B 세포로 부터 immunoglobulin E (IgE) 항체가 생성되고, 천식 유발 물질인 난황알부민(ovalbumin)에 특이적인 IgE (OVAspecific IgE)가 증가하게 된다. 이에 OVA 및 미세먼지로 유발한 호흡기 염증 모델에서 OVA-specific IgE 수준을 분 석한 결과, 정상군(Balb/c Nr)에 비하여 대조군이 확연한 증가를 보였으며, 양성대조군과 OFI-50E 200 mg/kg 투여 군의 유의적인 감소가 확인되었다(Fig. 5A). 또한 천식이 유발되면 methacholine (MCH)에 의한 기도 저항 Pehn 값 이 증가하며 이에 기도저항성을 분석한 결과, MCH 25 mg/mL 처리 시 OFI-50E 100 mg/kg, 200 mg/kg 투여군이 dexamethasone을 투여한 양성대조군 보다 현저히 낮은 저 항 값을 보여 MCH에 의한 기도 과민 반응 개선 효능을 확인하였다(Fig. 5B).
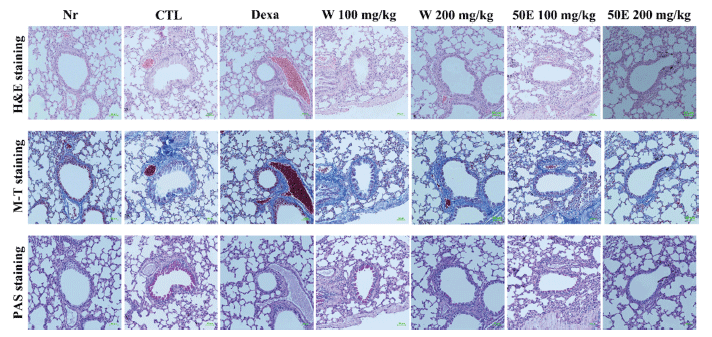
OVA 및 미세먼지로 유발된 호흡기 질환 마우스 모델의 폐조직의 단면을 H&E 염색법을 통하여 관찰하였고, M-T 염색법을 통하여 폐포 세포 파괴 정도를 관찰하였다. 미세 먼지에 의해 유도된 호흡기 질환 마우스 모델의 폐조직 단 면에서 기관지 주변에 미세먼지의 침착이 뚜렷하게 보였고, 기도의 두께가 크게 증가하였으며 염증에 의한 폐포 세포 파괴가 관찰되었다. 양성대조군(dexa, 3 mg/kg)과 OFI-W 200 mg/kg, OFI-50E 200 mg/kg 투여군은 대조군에 비하여 기관지의 미세먼지 침착이 뚜렷하게 감소하였고, 기도의 두께가 정상군에 가깝게 감소됨을 관찰할 수 있었다. 또한 폐포 세포 파괴에 의한 콜라겐 침착, goblet 세포의 침착 정도도 대조군에 비하여 눈에 띄게 개선됨을 확인하였다 (Fig. 6).
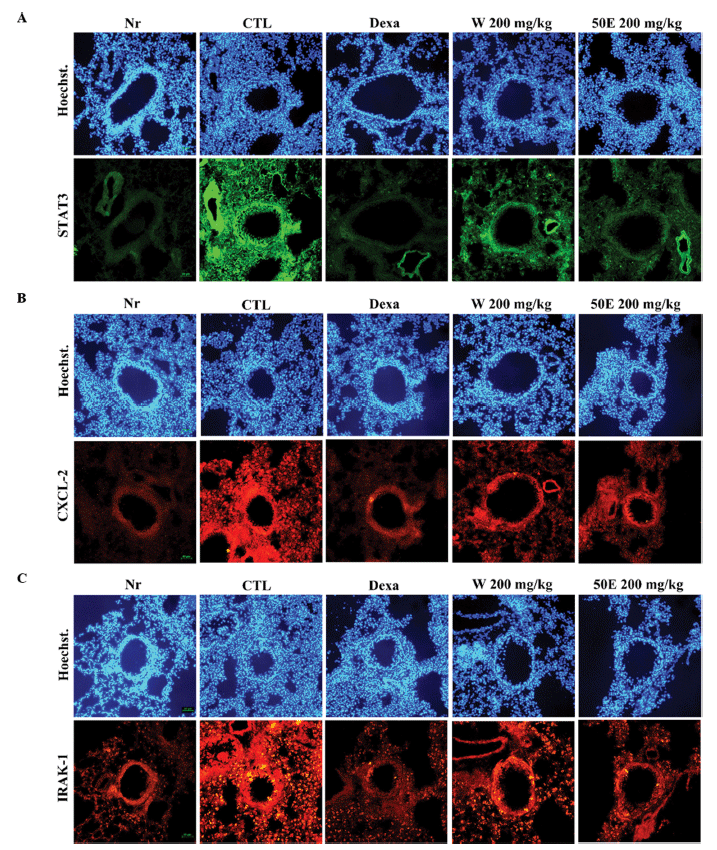
OVA 및 미세먼지로 유발된 호흡기 복합동물모델의 폐 조직에서 신호전달 STAT3 (Signal transducer and activator of transcription 3)와 CXCL2, IRAK1 단백질 발현을 면역 형광조직염색(immune histology fluorescent, IHF)을 통해 분석하였다. 그 결과, 대조군에서 STAT3, IRAK1, CXCL-2 단백질 발현이 뚜렷하게 증가하였고, 양성대조군과 OFI-50E 200 mg/kg 투여군에서 크게 감소됨이 확인되었다(Fig. 7).
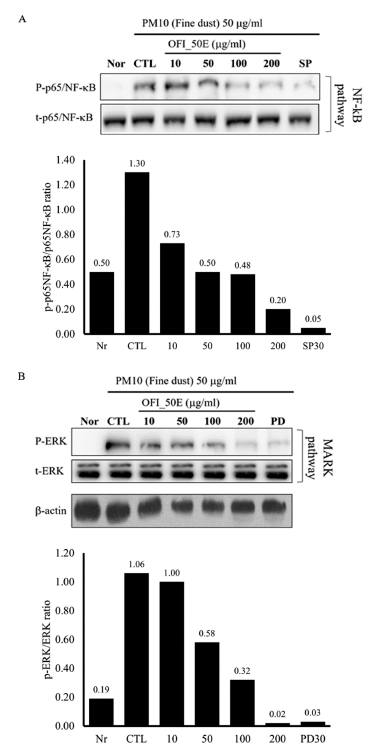
손바닥선인장 줄기 추출물(OFI-50E)이 염증 매개 인자의 발현에 관여하는 NF-κB pathway와 MAPK pathway에 미 치는 영향을 w estern b lot 분석을 통해 관찰한 결과, MH-S 세포에 미세먼지를 처리한 대조군에서는 NF-κB p65 subunit의 인산화가 정상군에 비해 증가한 반면에 OFI-50E 를 처리한 시험군에서는 농도 의존적으로 p65의 인산화가 감소됨을 확인하였다. 또한, MAPK pathway에서 관여하는 ERK의 인산화를 분석한 결과에서도 OFI-50E 처리군에서 농도 의존적으로 ERK 인산화가 감소됨을 확인하였다. 이 결과는 OFI-50E가 미세먼지(PM10)에 의해 활성화되는 NF-κB pathway와 MAPK pathway를 억제하여 미세먼지 유도에 의한 염증 매개인자의 발현을 억제할 수 있음을 시 사한다(Fig. 8).
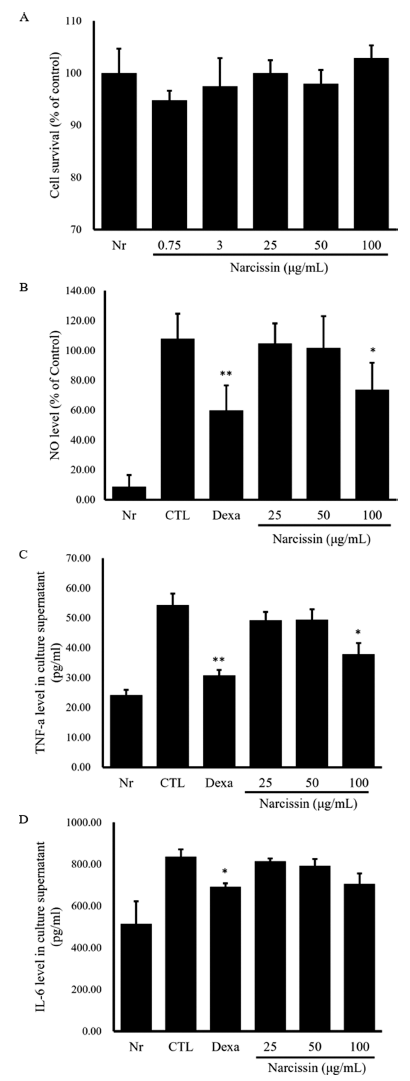
MH-S murine alveolar macrophage 세포주에 대한 narcissin 의 세포독성 측정 결과, narcissin 처리 농도(0.75, 3, 25, 50, 100 μg/mL)에 따른 세포 독성이 발견되지 않았다(Fig. 9A).
요 약
본 연구에서는 기관지 천식 등 호흡기 치료에 민간 약재로 활용되어 온 손바닥선인장 줄기를 활용하여 OVA와 미세 먼지로 유발된 동물 모델을 대상으로 호흡기 염증 보호 효 과를 연구하였고, in vitro 시험을 통해 그 작용기전을 구 명하였다. 동물 모델에서 OFI-50E 투여군의 혈중 OVAspecific IgE 수준이 감소되는 결과로서 OVA에 의해 유도 되는 과민 반응 및 알레르기 반응을 감소시키는 것을 확인 하였고, MCH에 의한 기도저항성 분석 결과, OFI 50% ethanol extract 투여군에서 유의적으로 낮은 저항값이 분석 되었다. 특히 OFI-50E 200 mg/kg 투여군은 dexamethasone 을 투여한 양성대조군보다도 낮은 저항값을 보여 천식 유 발 모델의 기도 과민 반응 개선 효능을 확인하였다. 기관 지 폐포세척액, 폐 조직에서의 림프구 및 호중구를 포함한 면역 세포 분석 결과, Th cell 결과에서 실험군 간 유의적 인 차이는 없었으나, 활성화된 T helper cell (CD4+/CD69+) 이 특히 OFI-50E 200 mg/kg 투여군에서 눈에 띄는 감소를 보였고, BAL에서의 염증성 cytokine CXCL-1, MIP2, IL- 17, TNF-α가 OFI 50% ethanol extract 투여군에서 유독 유의적인 감소를 보였다. 또한 비장 세포에서의 염증성 cytokine IL-4, IL-5, IL-13 분석 결과, 마찬가지로 OFI-50E 투여군에서 크게 감소하였다. 이러한 결과로 보아 OFI-50E 가 미세먼지에 의해 증가되는 염증 작용을 완화시키는 것 으로 판단된다. 손바닥선인장 줄기 추출물의 폐 염증 완화 효능 작용기전으로 폐 조직에서 IRAK-1 활성 세포가 억제 되었으며, CXCL-2 및 STAT3 등의 발현이 강력하게 억제 됨을 확인하였다. 또한, MH-S 세포주에서 미세먼지에 의 해 유도되는 MAPK 인산화와 NF-κB 인산화가 억제됨을 확인하였다. 따라서, 미세먼지에 의한 염증 반응에 대한 손 바닥선인장 줄기 추출물의 폐 염증 완화 효능 작용 기전은 IRAK-1 활성화 억제를 통해 NF-κB 및 MAPK 경로 등을 억제함으로써 염증성 cytokine의 생성을 저해하는 것으로 판단된다. 상기의 결과들에 따르면 손바닥선인장 줄기 추 출물의 개선 효능은 일반적으로 염증 완화를 위하여 처방 되는 dexamethasone을 양성대조군으로 투여한 그룹과 비슷 한 수준으로 개선되는 것을 알 수 있고, 이는 손바닥선인 장 줄기 추출물이 천식과 같은 폐 기능 저하 질환 등에 관여하는 다양한 cytokine과 염증 세포에서의 조절을 통해 호흡기 염증을 개선하는 효능이 있음을 시사한다. 손바닥 선인장 줄기 50% ethanol extract (OFI-50E)의 주요 화합 물로 narcissin이 확인되었으며, 이를 지표 물질로 설정하였 다. MH-S cell line에 대한 narcissin의 세포 독성이 발견되 지 않았고, NO 생성량 및 TNF-α 생성량이 narcissin 100 μg/mL 처리군에서 유의적으로 감소한 것을 확인하였다. Isorhamnetin 배당체인 isorhamnetin-3-O-glucosyl-rhamnosylrhamnoside, isorhamnetin-3-O-glucosyl-rhamnoside 등은 IL- 6, TNF-α 생성을 저감하는 효능이 보고되어 있다(Antunes- Ricardo et al., 2015). Narcissin은 isorhamnetin 배당체의 한 종류로서 본 연구의 결과에서 narcissin이 NO, TNF-α 생성 억제를 통해 항염증 효능을 가짐을 확인하였으며 이 는 지표물질로 설정한 narcissin이 잠재적으로 유효성분일 수 있음을 암시한다.







