서 론
결명자(Cassia tora L.)는 콩과에 속하는 1년생 초본으로 원산지는 북아메리카이고 우리나라 남쪽 지방에서도 재배 되고 있으며 성숙한 종자는 외관상 갈색을 띠고 윤택이 난 다. 결명자는 한방에서 눈을 밝게하고 간장과 신장의 보호 효과가 있으며, 고혈압, 혈중콜레스테롤 저하 등에 효과가 있는 것으로 알려져 있어(Ha et al., 2003), 우리나라에서 는 예로부터 약재나 차의 형태 정도로 이용되어 왔다(Kim et al., 1990). 결명자에는 anthraquinone류인 chrysophanol, physcion, emodin, aloe-emodin, obtusin, chryso-obtusin 및 aurantio-obtusin 등과 naphthalene류인 torachrysone, toralactone, rubrofusarin, cassiaside 등 다양한 종류의 생리활 성물질들이 함유되어있다(Jang et al., 2007;Cherng et al., 2008;Hyun et al., 2009). 결명자는 항균작용, 간보호, 돌 연변이 억제, 항산화, 항균작용, 혈압강하, 혈중 지질저하 효과, 혈당강하 등의 다양한 생리활성 효능이 있는 것으로 보고되었다(Wong et al., 1989;Choi et al., 1994;Kim et al., 2004;Patil et al., 2004;Ko et al., 2020).
결명자를 차로 제조하기 위해서는 보통 볶음처리를 하는 데 볶음처리한 결명자는 독특한 향미와 색을 가지고 있어 건강음료로 음용되고 있다. 볶음처리에 따라 결명자 성분 들간의 상호작용에 의해 물리화학적 변화가 일어나 색, 향 미 생성 등 기호성이 향상되며 여기에는 Maillard 반응이 크게 관여하는 것으로 생각된다(Kim et al., 1995). 볶음공 정은 종실의 세포벽 분해와 세포내부의 공간 증대, 세포의 구성성분인 다당류, 단백질, 지질간의 결합 네트워크를 붕 괴시키고 상호작용을 촉진시켜 화학적 성분을 조정하며, 생리활성 성분 및 수용성 고형분의 추출을 용이하게 해준 다(Lee et al., 2013). 차 성분의 추출은 차의 종류, 추출온 도/시간, 가수량, 분쇄 입도, 추출횟수, 저장조건 등 여러 가지 요인들과 관련이 있다(Pastoriza et al. 2017). 그 중에 서도 차 추출액의 생리활성물질과 항산화활성 등 기능성은 추출온도와 추출시간에 크게 달라지는 것으로 알려져 있다 (Hajiaghaalipour et al., 2016).
곡류나 두류의 영양적 가치와 생리기능성 성분을 증가시 키는 방법으로 종자를 발아시켜 가공하는 방법이 이용되고 있다. 발아(germination)란 종자를 적정 조건에서 1 - 5 mm 정도 싹을 틔운 것으로(Augustin & Klein, 1989) 발아공정 에 의해 종자의 조직을 연화하여 질감을 개선할 뿐만 아니 라 종자에 함유되어있는 영양성분 및 각종 기능성 성분의 함량을 변화시킬 수 있다(Nkhata et al., 2018). 최근에는 결명자를 발아시켜 발아결명자의 이화학적 특성과 생리활 성성분을 비교하여 조사한 바 있다(Kang, 2021).
본 연구에서는 일반적으로 음용하는 결명자차와 달리 결 명자를 우선 발아시킨 다음 볶음처리하여 제조하는 발아결 명자차로 가공하였다. 차의 추출방법은 차 추출액의 유용 성분의 함량에 영향을 미치며, 일반적으로 차를 우려내는 방법인 열수 추출 뿐 만 아니라 찬 물에 우려내어 마시는 것도 선택 사항이 될 수 있다(Rodrigues et al., 2015). 따 라서, 본 연구에서는 발아결명자차의 추출온도에 따른 항 산화성분과 in vitro 항산화활성을 상업적으로 판매되고 있 는 일반 결명자차와 비교하여 발아결명자차의 유용성을 조 사하고자 하였다.
재료 및 방법
본 실험에 사용한 결명자는 2019년산으로 소화농장(경북 예천)으로부터 구입하여 4°C에서 보관하면서 실험에 사용 하였다. 결명자차 추출액의 특성을 조사하고 비교하기 위 해 시중에 판매중인 결명자차 4개 제품(A-D)을 선택하여 실험에 사용하였다.
정선한 결명자를 2시간 동안 실온에서 수침한 다음 종자 발아기(Dasol Scientific Co, Ltd. Hwaseong, Korea)를 사 용하여 25°C, 습도 90% 조건에서 30시간 발아시켰다. 발 아시킨 결명자를 55°C로 조절한 건조기(Lassele Co, Ansan, Korea)에서 18시간 건조하였다. 건조한 발아결명자 를 30 mesh체를 사용한 분쇄기(Poongin Co, Pyeongtaek, Korea)를 사용하여 분쇄하였으며 곡물볶음기(Poongin Co.) 를 사용하여 180°C에서 3분간 로스팅 하였다.
본 실험에서 제조한 발아결명자차와 시판 결명자차 제품 시료를 각각 1.2 g씩 채취하여 빈 티백주머니(4×6 cm, Dr- No, Incheon, Korea)에 넣은 후 5°C, 24°C, 80°C의 100 mL 증류수에 3분간 침출식으로 추출하여 분석에 사용하 였다.
총 페놀 함량 분석은 Folin et al. (1912)의 방법에 따라 분석하였다. 시료 추출액 0.2mL에 증류수 0.8mL를 가한 후 Folin-Ciocalteu phenol reagent 0.2 mL를 넣고 교반한 후 실온의 암소에서 5분간 반응시켰다. 반응이 끝난 후 종 결시약 7% Na2CO3 용액 2mL를 넣어 교반하고 암소에 1 시간 방치한 후 분광광도계(Karaltay Scientific Instruments, Beijing, China)를 사용하여 734 nm에서 흡광도를 측정하였 다. 표준물질 gallic acid를 사용하여 0-200 μg/mL의 농도 로 제조한 후 시료와 동일한 방법으로 분석하여 작성된 표 준용액곡선으로 함량을 계산하였다.
총 플라보노이드 함량은 Zhishen et al. (1999)의 방법을 변형하여 분석하였다. 시료 추출액 0.5mL에 에탄올 1.5mL, 10% 질산알루미늄 0.1mL, 1M 초산칼륨 0.1mL, 증류수 2.8mL를 순서대로 가한 후 교반하여 실온의 암소에서 40분 간 반응시킨 후 분광광도계(Karaltay Scientific Instruments) 를 사용하여 415 nm에서 흡광도를 측정하였다. 표준물질 quercetin을 이용하여 0 - 200 μg/mL의 농도로 제조한 후 시 료와 동일한 방법으로 분석하여 작성된 표준용액곡선으로 총 플라보노이드 함량을 계산하였다.
베타-카로틴 함량은 Biswas et al. (2011)의 방법을 변형 하여 측정하였다. 시료 추출액 1mL에 5mL의 아세톤을 첨가하고 4°C에서 13,000 rpm으로 15분간 원심분리 하였다. 상등액을 분리하여 버리고, 5 mL의 아세톤을 첨가하여 같 은 조건에서 다시 원심분리 하였다. 상등액을 수거하여 분 광광도계를 이용하여 450 nm에서 측정하였다.
DPPH (2,2-diphenyl-1-picrylhydrazyl) 라디칼 소거능은 Blois (1958)의 방법을 변형하여 측정하였다. 시료 추출액 0.2 mL에 적정량의 에탄올과 DPPH 용액 0.8mL을 가한 후 교반하여 실온의 암소에서 10분간 반응시킨 후 분광광 도계를 사용하여 525 mm에서 흡광도를 측정하였다. 바탕 시험인 시료 무첨가구는 시료 대신 증류수를 사용하여 측 정하였다. DPPH 라디칼 소거능(전자공여능)은 [1 - (시료첨 가구의 흡광도/무첨가구의 흡광도)] × 100 (%)로 나타내었다.
ABTS (2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)) 라디칼 소거능은 Re et al. (1999)의 방법을 변형하여 측정하 였다. 7.4 mM ABTS 용액과 2.45 mM potassium persulfate 를 1:1로 혼합한 후 24시간동안 암소에 방치시켜 radical을 생성하였다. 734 nm에서의 ABTS 라디칼 용액의 흡광도가 0.70±0.02가 되도록 phosphate-buffered saline (pH 7.4)으 로 희석하였다. 시료 추출액 50 μL에 희석된 ABTS 라디 칼 용액 1.9mL를 혼합한 다음 실온의 암소에서 10분간 반응시킨 후 분광광도계를 사용하여 734 nm에서 흡광도를 측정하였다. 시료 무첨가구는 시료 대신 증류수를 사용하 여 측정하였고 ABTS 라디칼 소거능은 [1 - (시료첨가구의 흡광도/무첨가구의 흡광도)] × 100 (%)로 나타내었다.
결과 및 고찰
페놀 화합물은 식물에 존재하는 2차 대사산물의 하나로 식품에 존재하는 페놀 화합물은 반응과정에서 수소를 공여 하여 자유라디칼을 제거함으로써 항산화 활성에 관여하는 중요한 인자로 작용한다(Singh et al., 2017). 본 연구에서 제조한 발아결명자차(GRC)를 시판되고 있는 결명자차 제 품(A-D)과 함께 각각 5, 24, 80°C에서 추출한 후 추출액의 총 페놀 함량을 분석한 결과는 Fig. 1과 같다. 결명자차와 발아결명자차 추출액의 총 페놀 함량은 추출온도가 증가함 에 따라 증가하는 추세였으며, 이는 차의 추출온도가 높아 질수록 차 추출물의 총 폴리페놀 함량이 증가한다고 보고한 결과들(Hajiaghaalipour et al., 2016;Chang et al., 2020)과 유사하였다. 발아결명자차 추출액의 총 페놀 함량은 추출 온도 5, 80°C에서 각각 35.46 μg/mL와 109.81 μg/mL로 시판 결명자차보다 높았고, 추출온도 24°C에서도 53.34 μg/mL로 B 추출액 다음으로 높았다. 발아결명자차 추출액의 총 페 놀 함량이 높은 이유는 세포벽 성분과 공유결합을 하는 결 합형 폴리페놀이 발아하는 과정에서 일부 추출이 가능한 유리형 폴리페놀로 변화하여 추출되기 때문으로 판단되었 다(Pajak et al., 2014). 또한, 발아결명자의 볶음공정에 따 른 가열처리로 결명자 내부조직이 파괴되어 페놀성 화합물 이 보다 쉽게 추출되었기 때문으로 판단되었다.

플라보노이드는 자연계에 널리 존재하는 항산화능을 나 타내는 생리활성물질로 anthocyanidines, flavonols, flavones, cathechins, flavanones 등을 포함한다(Kwak et al., 2013). 발아결명자차를 각각 5, 24, 80°C에서 추출하여 추출액의 총 플라보노이드 함량을 분석하였으며 시판 결명자차 제품 들과 비교한 결과는 Fig. 2와 같다. 결명자차의 추출온도가 증가할수록 추출액의 플라보노이드 함량은 대체로 증가하 는 추세를 보였다. 추출온도 5°C에서는 A 추출액의 플라 보노이드 함량이 4.68μg/mL로 가장 높았고, 추출온도 24°C에서는 B 추출액이 4.82 μg/mL로 가장 높았으며 추출 온도 80°C에서는 D 추출액이 7.59 μg/mL로 가장 높게 나 타났다. 보통 차의 경우에서 총 플라보노이드 함량은 추출 온도가 증가함에 따라 증가한다고 보고되었다(Rodrigues et al., 2015;Hajiaghaalipour et al., 2016). 발아결명자차는 총 페놀 함량과는 달리 총 플라보노이드 함량이 시판 결명자 차 추출액에 비해 상대적으로 높지 않았다. 이는 발아과정 중 플라보노이드가 아닌 다른 페놀 화합물의 생성량이 보 다 많았기 때문으로 사료되었다.
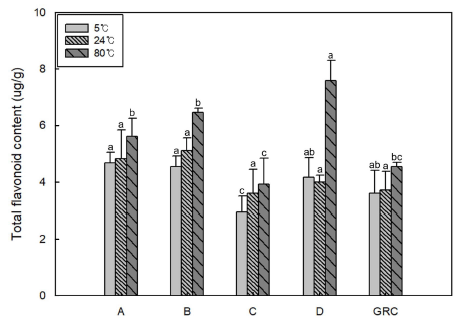
베타-카로틴은 자연계에 존재하는 대표적인 카로티노이 드 중의 하나로 비타민 A 전구체로서 면역기능 증강효과 가 있고, 강력한 항산화제로서 인체내 해로운 활성산소를 제거함으로써 노화예방은 물론 항암효과도 있는 것으로 알 려져 있다(Burri, 1997). 발아결명자차와 시판 결명자차 제 품들을 각각 5, 24, 80°C에서 추출하여 추출액의 베타-카 로틴을 측정한 결과는 Fig. 3에 나타나 있다. 결명자차 추 출액의 베타-카로틴 함량은 추출온도가 증가함에 따라 증 가하는 양상을 보였다. 발아결명자차 추출액의 베타-카로틴 함량은 5, 24, 80°C에서 각각 0.66, 0.75, 1.17 μg/mL로 시 판 결명자차의 평균 수치인 0.52, 0.60, 0.84 μg/mL에 비해 유의적으로 높게 나타났다. 결명자로부터 얻은 oil에는 0.12 mg/g의 카로티노이드를 함유하고 있으며(Górnaś et al., 2018), 발아처리가 두류에서 베타-카로틴의 함량을 증 가시킨다고 보고한 바 있다(Huang et al., 2017). 발아결명 자차 추출액이 시판 결명자차 추출액에 비해 베타-카로틴 함량이 높은 이유는 결명자의 발아에 따른 카로티노이드 함량 증가와 볶음공정에 의한 열처리 정도의 차이 등과 연 관이 있을 것으로 판단되었다.
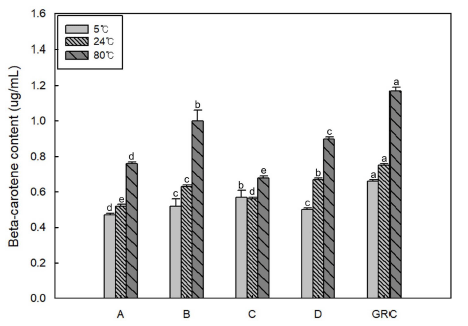
결명자차 추출액의 항산화활성은 DPPH 라디칼 소거능 과 ABTS 라디칼 소거능으로 측정하였다. DPPH 라디칼 소거능은 일반적으로 항산화능을 측정하는데 이용되는 방 법의 하나로 다른 항산화능 측정방법들보다 단시간에 측정 가능한 방법이다. 발아결명자차와 시판 결명자차 제품들을 각각 5, 24, 80°C에서 추출하여 추출액의 DPPH 라디칼 소거능을 측정한 결과는 Fig. 4(A)와 같다. 결명자차의 DPPH 라디칼 소거능은 추출온도가 증가함에 따라 증가하 였으며, 5, 24°C에 비해 80°C 추출온도에서 DPPH 라디칼 소거능이 현저하게 증가하였다. Chang et al. (2020)은 높 은 추출온도에서 차의 DPPH 라디칼 소거능이 높게 나타 난다고 보고하였다. 한편 발아결명자차는 시판 결명자차에 비해 DPPH 소거능이 5°C에서 3.0배, 25°C에서 2.1배, 80°C에서 1.2배 높아 발아결명자차가 저온의 추출에서도 DPPH 소거능이 높게 나타났다. 이는 결명자가 약 30시간 의 발아과정을 거치는 과정에서 페놀성 물질들을 포함한 항산화 성분들이 증가하였고 상대적으로 낮은 온도에서 용 이하게 추출되었기 때문으로 판단되었다.
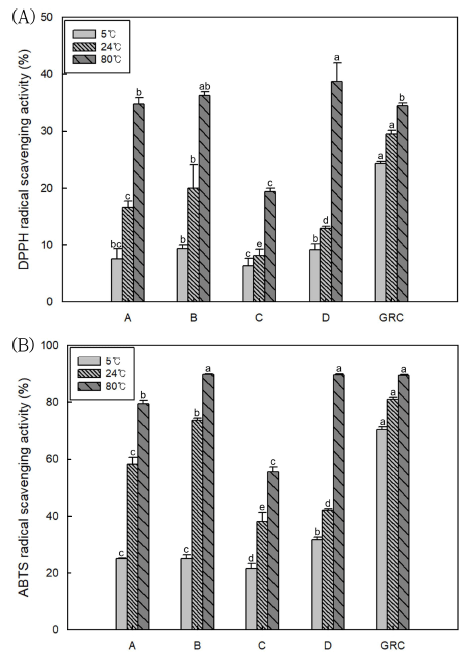
ABTS 라디칼 소거능 방법은 potassium persulfate와의 반응으로 생성되는 양이온 ABTS 라디칼이 추출물에 함유 된 항산화성 물질에 의해 제거되고, 라디칼 특유의 청록색 이 항산화 물질의 라디칼 저해작용으로 인해 연한 녹색으 로 탈색되는 것을 이용한 방법으로 극성, 비극성 시료의 구분 없이 항산화 활성을 측정할 수 있다(Awika et al., 2003). 결명자차의 ABTS 라디칼 소거능을 측정한 결과는 Fig. 4(B)에 나타나 있다. 결명자 추출액의 ABTS 라디칼 소거능은 DPPH 라디칼 소거능과 마찬가지로 추출온도가 증가할수록 증가하여 80°C에서 가장 높았다. 시판 결명자 차는 5, 24°C 보다 80°C의 추출온도에서 ABTS 라디칼 소 거능이 현저하게 증가하였다. 이는 차의 추출온도가 높아 질수록 항산화능이 뛰어난 페놀성 물질의 추출량이 증가하 여 ABTS 라디칼 소거능 또한 높아진다는 결과와 유사하 였다(Perez-Burillo et al., 2018). 발아결명자차 추출액의 ABTS 라디칼 소거능은 DPPH 소거능과 비슷하게 시판 결 명자차들에 비해 특히 5, 24°C의 낮은 추출온도에서 월등 히 높게 나타났다.
결명자차 추출액의 ABTS 라디칼 소거능이 DPPH 소거 능 보다 높았으며, 동일한 시료에서 DPPH 라디칼 소거능 과 ABTS 라디칼 소거능이 다르게 나타날 수 있다. 이는 DPPH 소거능의 경우 유리 라디칼이 소거되는 것을 이용 하는 반면, ABTS 라디칼 소거능은 양이온 라디칼이 소거 된다는 점에서 다른 소거능을 보이기 때문으로 사료된다 (Floegel et al., 2010). 또한 시료마다 다양한 항산화 물질 을 함유하고 있고 이와 관련해 서로 다른 항산화 활성을 가지고 있으므로(Shah et al., 2015) 보다 정확한 검증을 위해서는 다양한 방법의 항산화 실험을 진행하는 것이 바 람직한 것으로 여겨졌다.
요 약
결명자를 발아와 로스팅처리로 가공하여 발아결명자차로 제조하였으며, 발아결명자차의 추출온도에 따른 추출액의 항산화성분과 항산화 활성을 분석하고 이를 시판 결명자차 와 비교하였다. 발아결명자차의 추출온도가 증가함에 따라 (5-80°C) 추출액의 총 페놀, 플라보노이드, 베타-카로틴 함 량은 증가하였으며 in vitro 항산화활성(DPPH 및 ABTS 라디칼 소거능) 또한 증가함을 확인하였다. 발아결명자차는 시판 결명자차에 비해 항산화활성이 높았으며 특히 저온의 추출온도에서 그 차이가 유의적으로 크게 나타났다. 본 연 구에서 적정한 발아와 열처리 가공에 의해 제조한 발아결 명자차는 항산화 생리활성성분과 그 활성이 높은 것으로 평가되어, 발아결명자의 다류 식품소재로서의 가치를 확인 할 수 있었다.







