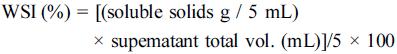서 론
생강과(Zingiberaceae)에 속하는 생강(Zingiber officinale Roscoe)은 아열대 및 열대 지역이 원산지이며 국내 주요 생산지는 경북 안동, 충남 서산, 전북 봉동 지역으로, 다년 생 초본 식물 중의 하나로서 건조하지 않은 뿌리줄기를 말 한다(Kim et al., 1991;Nam et al., 2018). 생강은 일반적 으로 수분이 80-90%를 차지하며, 전분이 전체 고형분의 40-60%의 비율을 가진다. 기호성이 좋은 향신료로 알려진 생강의 근경은 특유의 맛과 향기를 지니고 있어 기원전 3 세기경부터 세계적으로 널리 애용되고 있다. 마늘, 파, 고 추 등과 함께 향신료로 많이 쓰이고 있으며, 건 생강, 날 생강, 정유 및 추출물 등의 형태로 유통되고 있다(Leung, 1980). 생강의 알려진 주요 기능 성분으로는 gingerol과 shogaol로 독특한 매운맛을 내며 항산화, 항염증의 특성을 가지고 있다(Connell, 1970). 또한, 일부 식욕증진, 요통, 복통, 설사, 소화 보조제 등의 치료제로 다양하게 이용되는 것으로 알려져 있다(Kim et al., 1991;Bang et al., 2001).
발효란 미생물이 당질을 이용하여 유기물을 분해하는 현 상을 말한다. 유용 미생물(probiotics)이 이산화탄소, 유기산 및 알코올 등의 발효 산물을 생성하며, 이에는 진균, 유산 균, 고초균 등이 있다(Park et al., 2009;Park, 2012). 발효 된 식품은 유용한 향, 맛과 저장성을 증가시킨다. 발효 숙 성 과정 중에는 유기 영양물로 분해되어 비타민, 단백질 및 필수아미노산, 필수지방산 등을 다량 함유한 식품을 제조할 수 있다. 이러한 유용 성분의 증진과 함께 영양소 의 소화력 및 흡수율을 높이며, 건강을 유지하는데 큰 도 움을 준다(Park, 2012). 이와 관련한 생강 연구로는 발효생 강의 품질 특성(Chun & Chung, 2011), 발효 숙성생강의 생리활성 특성(Seo et al., 2017), 발효 숙성생강 추출물 활 용 제품 개발(Kim et al., 2018)에 관한 보고가 있으며, 이 러한 발효 숙성 연구에는 Leuconostoc속, Lactobacillus속, Streptococcus속과 같은 유산균이 사용되었다.
단백질, 다당류 및 다양한 화합물의 복합체로 이루어진 생강은 복잡한 결합 형태를 가진 세포벽으로 인해 미생물 학적, 물리적, 화학적 작용에도 쉽게 분해되기 어렵고, 수 용화되기 쉽지 않은 것으로 보고되었다(Nam et al., 2018). 일반적으로 식재료에 포함된 다당류 성분은 전분, 섬유소, 단백질 및 펙틴 등으로 이루어져 있으며, 주로 식품 생산 에 이용되고 있는 효소처리 수용화 기술로 이들의 분해를 용이하게 한다. 식물 세포벽 분해 효소인 pectinase 및 전 분 분해 효소인 amylase을 통해 기능 성분의 추출 증진 및 수율 확대 효과를 가져올 수 있다고 하였다(Nam et al., 2019). 효소처리에 관련한 생강 연구로는 고압효소처리 생강 추출물의 수용화 특성(Nam et al., 2018), 주정 효소 복합처리 생강 추출물의 기능성분 수용화(Nam et al., 2019)가 있으며, 생강의 복잡한 구조를 가수분해하기 위해 Pectinase와 Alpha-amylase가 복합으로 사용되었다. 반면 에, 진균만 단일로 활용하여 가수분해하거나 발효와 효소 처리를 복합으로 진행한 생강 연구는 거의 이뤄지지 않은 상태이다.
따라서 본 연구에서는 발효 미생물 중에서도 전분 및 단 백질 분해력이 우수한 균주로 선발된 황국균(Aspergillus oryzae)과 백국균(Aspergillus luchuensis)으로 생강을 발효 하여 제조된 발효물의 기능성분 변화를 확인하였고, 이를 통해 생강에 적합한 균주와 첨가량을 선정하였다. 선정된 균주를 활용하여 발효 및 효소 복합 처리한 생강 추출물의 항산화 성분 및 활성을 비교 분석함으로써 생강의 기능성 최적화 및 산업화를 위한 가능성을 제시하고 기초 자료로 활용하고자 한다.
재료 및 방법
본 실험에 사용된 생강은 2019년 완주봉동생강조합에서 구입한 국내산 생강 열풍 건조 분말을 -20°C 냉동고에 보 관하면서 실험에 사용하였다. 발효시 사용한 균주는 상업 용으로 제조 판매되는 황국균(Aspergillus oryzae, CF1003) 과 백국균(Aspergillus luchuensis, CF1005)을 ㈜충무발효 (Ulsan, Korea)에서 구입하여 사용하였다. 효소는 Pectinase (Pectinex Ultra SP-L)와 Alpha-amylase (Termamyl 2X)를 Novozymes (Novo Nordisk, Copenhagen, Denmark)사에서 구입하여 사용하였다. 분석에 사용된 시약은 dinitrosalicylic acid (DNS), Folin-Ciocalteu's reagent, gallic acid, glucose, catechin, sulfuric-acid, 2,2-diphenyl-1-picrylhydrazyl, 2,2′- azino-bis(3-ethylbenzothiazoline-6-sulfonia acid), potassium persulfate (Sigma-Aldrich Co., St. Louis, MO, USA)을 사 용하였다. 지표성분 표준물질 6-gingerol, 8-gingerol, 10- gingerol, 6-shogaol, 8-shogaol, 10-shogaol (Chromadex, Laguna Hills, CA, USA)을 사용하였다. 그 외 시약 및 용 매는 분석용 특급시약(Sigma-Aldrich Co.)을 사용하였다.
최적의 발효 균주 및 첨가량 선정을 위한 생강 분말 20 g에 가수하여 수분 함량을 4 0%로 조정한 후 멸균하였고, 균주 종류는 황국균(A. oryzae)과 백국균(A. luchuensis)을 사용하였다. 황국 및 백국균의 균수는 2.0×109/포자수/g, 4.0×109/포자수/g으로 이에 접종된 균과 첨가량에 따라 황 국균 0.5% (A), 황국균 1% (B), 백국균 0.5% (C), 백국균 1% (D)로 접종하였으며, 배양기(VS-1203PFHLN, Vision Scientific, Co., Ltd., Daejeon, Korea)에서 온도 37°C, 습도 70%의 조건으로 7일 동안 배양하였다. 배양된 시료 전량 을 유리병에 담아 70% ethanol 400 mL를 넣고 6시간 동 안 300 rpm 속도로 교반하면서 추출한 후 감압여과한 것 을 동결 건조하여 총 폴리페놀(TP) 및 총 플라보노이드 (TF) 함량, DPPH 및 ABTS 라디칼 소거 활성 실험에 사 용하였다. 대조구(CON)는 균주를 접종하지 않고 동일한 조건으로 진행하였다.
본 연구에서 사용된 처리 방법의 과정은 Table 1에 나 타내었다. 발효 및 효소 복합 처리(ALEZ)는 열풍 건조 생강 분말에 발효 균주로 선정된 백국균(기질 대비 1%)을 접종하여 배양(온도 37°C, 습도 70%, 7일)하였다. 이 배 양물에는 Nam et al. (2018)의 효소 처리 방법을 활용하 여 세포벽 분해 효소인 Pectinase (기질 대비 1%, 0.2 g, 660 Unit)를 넣어 반응(50°C, 2시간, 200 rpm)하였고, 전분 분해 효소인 Alpha-amylase (기질 대비 1 %, 0 .2 g , 4 8 Unit)를 넣고 반응(93°C, 1시간, 200 rpm)하였다. 이 후, 처 리물 내의 효소 불활성화를 위하여 교반기에서 추가로 100°C, 5분간 처리하였다. 효소 처리(EZ)는 ALEZ의 방법 에서 효소 처리 방법만 진행하였고, 발효 처리(AL)는 ALEZ의 방법에서 발효만 진행하여 얻은 배양물에 항온수 조(Water Bath Shaking, MaXturdy-18, Daihan sci., Wonjusi, Korea)에서 처리(1차: 50°C, 2시간, 200 rpm; 2차: 93°C, 1시간, 200 rpm)하였다. 열수추출물(HW)은 EZ 방법에서 효소첨가를 제외한 처리 방법으로 진행하였다. 처리된 모 든 추출물은 여과지를 사용하여 감압여과하였다. 상등액은 수분용해지수(WSI), 총 당(TS), 환원당(RS), TP, TF, DPPH 및 ABTS 실험에 사용하였다.

|
생강 추출물의 수분용해지수(Water Solubility Index, WSI)는 Anderson et al. (1970)의 방법에 따라 생강 추출 물을 aluminium 접시에 담아 열풍건조기(Ovens, Thermo- Stable OF-305, Daihan Sci.)에서 50°C, 24시간 동안 건조 한 뒤 상등액의 고형분 함량을 측정하였으며 산출식은 아 래와 같다.
생강 추출물의 총 당(Total Sugar, TS)은 Dubois et al. (1956)의 phenol sulfuric acid법을 이용하였으며, 감압여과 한 상등액을 50-200배로 희석한 후 사용하였다. 희석된 시 료 0.5 mL에 5% phenol 용액 0.5 mL를 넣고 혼합한 후 sulfuric acid 2.5 mL를 가하여 발열시켰다. 이 혼합액을 30분간 실온에 방치한 후 Microplate Reader (Infinite 200 PRO, TECAN, Grodig, Austria)를 이용하여 4 70 n m에서 흡광도를 측정하였으며, 당 정량은 glucose를 표준물질로 사용하여 표준곡선으로부터 환산하였다. 환원당(Reducing Sugar, RS)은 Miller (1959)의 DNS 방법에 의해 측정하였 다. 감압여과한 상등액을 1-5배로 희석한 시료 1 mL에 DNS 시약 3 mL를 넣고 혼합한 후 끓는 물에서 5분간 중 탕한 다음 냉각하여 25 mL volumetric flask에 넣고 증류 수로 정용하였다. 흡광도 550 nm에서 측정하여 포도당 함 량에 상당하는 값(glucose equivalent, GE, g%)으로 나타내 었다.
생강 추출물의 기능성분 분석은 추출물을 동결 건조한 후, 1 mL의 80% methanol에 용해시켜 0.2 μm syringe filter (Millipore, Billetica, MA, USA)로 여과하여 UPLC 로 분석하였다. 분석에 이용된 UPLC 조건은 Nexera X2 system (Shimadzu, Kyoto, Japan)을 사용하였고 column으 로는 Kintex XB.C18 100 Å column (1.7 μm, 150×2.1 mm, phenomenex, CA, USA)을 이용하였다. 0.1% acetic acid를 함유한 acetonitrile 및 증류수를 이동상으로 사용하 였고 유속은 0.3 mL/min, 분석 주입량은 2 μL, Diode Array Detector (DAD, UV)의 검출기를 이용하여 280 nm 로 분석을 진행하였다. 생강의 지표성분은 6-gingerol (6- G), 8-gingerol (8-G), 10-gingerol (10-G), 6-shogaol (6-S), 8-shogaol (8-S), 10-shogaol (10-S)을 측정하였는데 이 때, 각 성분들의 표준곡선은 10, 50, 100, 500, 1,000 ppm으로 제조하여 분석하였다.
생강 추출물의 총 폴리페놀(total polyphenol: TP) 함량은 Dewanto et al. (2002)의 방법에 준하여 비색 정량하였다. 각 추출시료 100 μL에 2% Na2CO3 용액 2 mL를 가하고 3분간 방치한 후, 50% Folin-Ciocalteu 시약(Sigma Aldrich, St. Louis, MO, USA) 100 μL를 가한 후 혼합하여 30분간 실온에서 정치한 다음 750 nm에서 흡광도 값을 측정하였 다. 표준물질로는 gallic acid를 이용하여 표준곡선으로부터 환산하여 정량하였다. 총 플라보노이드(total flavonoid: TF) 함량은 Jang et al. (2012)의 방법에 따라 측정하였다. 추출 물 250 μL에 증류수 1 mL와 5% NaNO2 75 μL를 가한 후 5분 동안 실온에서 방치하였다. 이후 10% AlCl3·6H2O 150 μL를 가하고 6분간 방치한 후 1 M NaOH 0.5 mL를 넣고 혼합한 후 11분간 정치시켰다. 반응액의 흡광도 값은 510 nm에서 측정하였다. 표준물질로는 (+)-catechin을 사용 하여 표준곡선으로부터 환산하였다.
생강 추출물의 DPPH 라디칼 소거 활성은 Hwang et al. (2011)의 방법에 준하여 측정하였다. Methanol에 DPPH를 넣고 60분간 충분히 용해하여 제조하였다. 추출물 50 μL 에 0.2 mM DPPH 용액 1 mL를 넣고 30분 동안 상온에 서 방치한다. 520 nm에서 흡광도의 감소치를 측정하여 AEAC (L-ascorbic acid equivalent antioxidant capacity) 로 나타내었다. ABTS 라디칼 소거 활성은 Hwang et al. (2013)의 방법을 응용하여 7mM ABTS와 2 .4 5mM potassium persulfate를 암소에서 12-16시간 동안 방치하여 ABTS radical 양이온을 형성시킨 후, 734 nm에서 흡광도 값이 1.0-1.1이 되도록 희석하였다. 희석한 ABTS·+용액 1 mL에 추출물 50 μL를 넣고 30분간 상온에서 방치하였다. 이후 흡광도의 감소치를 측정하여 AEAC로 나타내었다.
결과 및 고찰
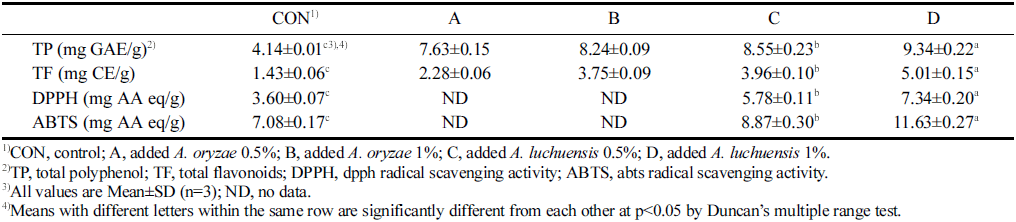
발효에 필요한 균주 및 첨가량을 선정하기 위한 총 폴리 페놀(TP), 총 플라보노이드(TF) 함량, DPPH 및 ABTS 라 디칼 소거 활성 측정 결과는 Table 2에 나타내었다. 발효 균 주 선정에서는 황국균(A. oryzae) 및 백국균(A. luchuensis)을 각 첨가량별로 접종하여 제조한 발효물을 대조구(CON) 와 비교하였다. TP는 4.14-9.34 mg GAE/g 범위였으며 백 국균 1% (D)가 9 .34 mg GAE/g으로 가장 높게 나타났고 CON (4.14 mg GAE/g)에 비해 약 2.3배 유의적으로 증가 한 것을 확인하였다. TF도 TP와 유사한 경향이었으며, 황 국균 0.5% (A) 2.28 mg CE/g, 황국균 1% (B) 3.75 mg CE/g, 백국균 0.5% (C) 3.96 mg CE/g, 백국균 1% (D) 5.01 mg CE/g으로 D가 가장 높았다. Kayath et al. (2020) 의 연구에서 생강 주스를 발효하는 동안 발효 16일까지 총 폴리페놀 함량이 높아졌다고 했는데, 발효 중에 생산되 는 미생물이 세포벽 분해 효소를 분비하여 페놀 화합물의 양을 증가시킴으로써 폴리페놀 함량이 증대되는 것으로 보 고되었다. 이상의 결과로 보아 생강 추출에 적합한 발효 균주는 백국균으로 판단되었고, 첨가량 선정은 항산화 활 성 비교를 통해 결정하고자 하였다.
|
백국균이 각각 0.5, 1%로 첨가된 C와 D의 DPPH 라디 칼 소거 활성은 각각 5 .78, 7 .34 mg AA eq/g으로 나타났 고, ABTS 라디칼 소거 활성은 각각 8.87, 11.63 mg AA eq/g로 나타났다. DPPH 라디칼 소거 활성에서는 D (7.34 mg AA eq/g)가 유의적으로 가장 높았으며, CON (3.60 mg AA eq/g)에 비해 약 2배 증가하였다. ABTS 라디칼 소거 활성은 CON이 7.08 mg AA eq/g으로 나타났고, 발 효에 의해 활성이 최대 1.6배 증가하였다. 백국균과 같은 사상균은 주로 쌀, 보리, 고구마 등을 당화하는데 쓰이는 균주이다. 백국균에 의한 전처리는 lignocellulose 기질에서 식물체의 거의 모든 부분을 동시 분해하면서 균주와 효소 가 접근 용이한 상태로 만들며, 유용 성분 및 항산화 물질 추출에 직접적인 영향을 미친다(Taniguchi et al., 2005). 이 러한 결과들로, 생강 발효에 효과적인 균주는 백국균이며, 첨가량은 1%로 선정하였다.
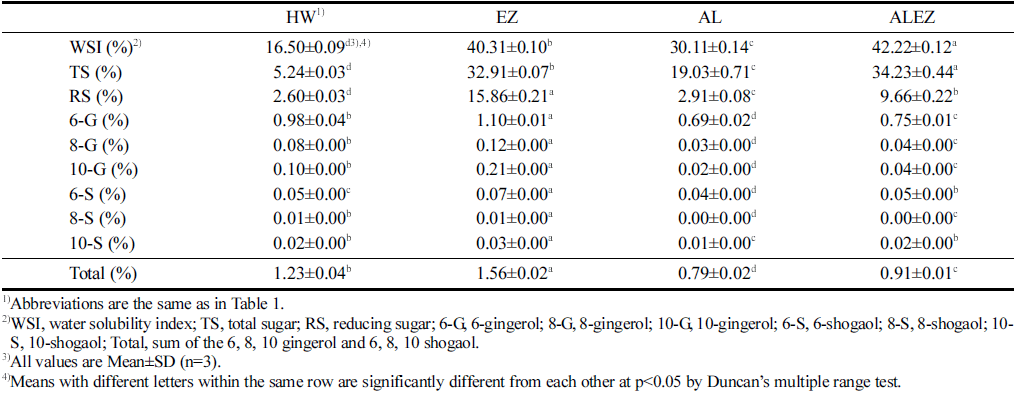
생강 추출물의 수분용해지수(WSI)를 측정한 결과는 Table 3과 같다. WSI는 열수추출물(HW)이 16.50%로 가장 낮았으며, 순차적으로 발효 처리(AL) 30.11%, 효소 처리 (EZ) 40.31%, 발효 및 효소 복합 처리(ALEZ) 42.22%로 나타났다. 각 처리구들은 HW에 비해 1.8-2.6배 높게 나타 났다. Pectinase를 이용하여 효소 처리한 생강의 WSI는 고 압 조건(100 MPa, 50°C, 2시간)에서는 무처리구에 비해 4.4배 증가하였으며, 열수 조건(50°C, 100 rpm, 2시간)에서 는 3.5배 증가하였다고 보고되었다(Nam et al., 2018). 생 강에는 약 3% 가량의 복합 섬유질과 60% 이상의 전분질 을 함유하고 있어 단순한 수용성 처리로는 추출 수율이 낮 고 다른 작물에 비해 가공 적성이 낮다. 이러한 문제점을 해결하기 위해 발효를 접목한 연구가 다양하게 진행되어 왔다. 균주를 활용한 발효 과정은 glycoside 가수분해효소, cellulose 또는 xylan 분해 효소와 같은 다양한 유형의 효 소를 생산하며, 이는 세포벽을 파괴하고 에스테르화된 불 용성 결합 물질에 영향을 준다(Yokoyama et al., 2002). 또 한, polygalacturonase와 같은 효소는 식물 세포벽의 pecticacid를 분해하며, β-glucosidase가 탄수화물 잔기를 포함하 는 glycoside, alkyl 또는 aryl β-D-glucosidase의 glycoside 결합의 가수분해를 촉매하는 것으로 알려져 있다(Yan et al., 1998). 이러한 결과로, 식물체 성상에 적합한 발효 및 효소 복합 처리는 식물체의 가수분해 효율을 증가시키는 요인으로 생각된다.
|
생강 추출물의 총 당(TS) 및 환원당(RS)을 측정한 결과 는 Table 3과 같다. TS는 HW가 5 .24 %로 나타났고, AL 19.03%, EZ 32.91%, ALEZ 34.23% 순으로 나타났다. ALEZ는 HW에 비해 유의적으로 6.5배 더 높게 나타났다. 발효 처리 과정은 식물 세포벽 내의 기공 크기를 증가시키 면서 lignin을 감소시키고 분해 효소가 cellulose나 hemi-cellulose에 침투에 용이한 상태를 만든다고 알려져 있다 (Taniguchi et al., 2005). 이러한 발효 작용에 효소 처리의 병행을 통해 생강의 당 성분 수용화를 증진시킴으로써 총 당 함량이 증가한 것으로 생각된다. RS는 HW 2.60%, AL 2.91%, ALEZ 9.66%, EZ 15.86% 순으로 유의적으로 높게 나타났다. EZ의 경우 HW에 비해 6.1배, AL에 비해 5.5배 높았다. Lee et al. (1996)은 탁주 술덧의 발효가 진행되는 동안 환원당 함량이 낮아졌다고 보고하였는데 본 연구에서 도 EZ보다 AL의 환원당 함량 값이 더 낮았으며 이는 선 행연구 결과와 유사한 경향이었다. 발효가 진행되는 동안 전분 함량이 높은 생강이 분해되면서 미생물의 영양원으로 작용함으로써 환원당 함량이 감소하였다고 생각된다.
Gingerol 및 shogaol 측정 결과는 Table 3과 같다. 6-G는 AL 0.69%, ALEZ 0.75%, HW 0.98%, EZ 1.10% 순으 로 나타났으며, EZ가 유의적으로 가장 높게 나타났다. 또 한 8-G, 10-G, 6-S, 8-S, 10-S의 함량도 EZ가 높았다. Gingerol과 shogaol 총 합인 Total 함량의 결과도 유사한 경향으로 나타났다. 발효가 진행된 AL과 ALEZ의 경우에 서는 HW함량보다 각각 64.2%, 73.9% 비율로 낮게 나타 났다. Nam et al. (2018)은 생강 분말을 고압처리 했을 때 지표성분 함량이 6-G 0.49%, 8-G 0.03%, 10-G 0.00%, 6- S 0.01%, 8-S 0.00%, 10-S 0.02%, Total 0.56%로 보고하 였으며, 그 값은 본 연구의 대조구 및 처리구보다 낮거나 같은 함량을 나타냈다. 이러한 결과값의 차이는 시료의 처 리 방법에 의한 것으로 생각되며 효소처리를 통해 함량을 증진시킬 수 있는 방법이라고 사료된다. Vergara-Salinas et al. (2015)의 포도 찌꺼기의 열수추출 연구에 의하면 처리 온도는 페놀성 화합물의 안정성에 영향을 미친다고 보고하 였다. 이러한 결과로, 생강 추출물의 기능 성분 함량 차이 는 생강 내의 세포벽을 분해하는데 작용할 수 있는 발효, 효소 처리 등의 처리 종류와 온도, 시간 등의 요인이 영향 을 미치는 것으로 판단된다.
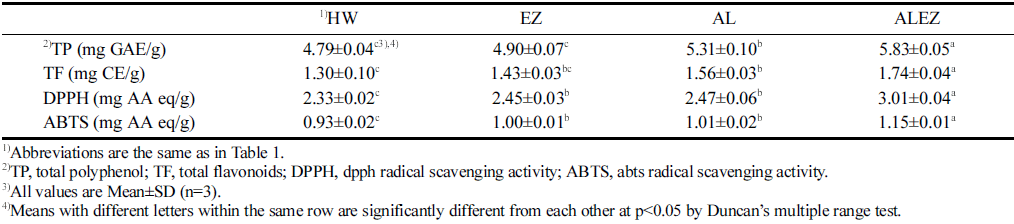
생강 추출물의 총 폴리페놀, 총 플라보노이드 측정 결과 는 Table 4에 나타내었다. TP는 4.79-5.83 mg GAE/g의 범위로 HW (4 .79 mg GAE/g)에 비해 각 처리구들은 1.0- 1.2배 가량 증가함을 확인하였고, ALEZ (5.83 mg GAE/g) 가 가장 높게 나타났다. TF는 HW 1.30 mg CE/g으로 나 타났으며, EZ 1.43, AL 1.56, ALEZ 1.74 mg CE/g 순으 로 ALEZ가 높게 나타났다. 그리고 HW에 비해 각 처리구 들은 1.1-1.3배 증가하였다. Kang et al. (2011)은 꾸지뽕 열매 발효 추출물 연구에 의하면 꾸지뽕 열매는 발효 후에 TP 함량이 약 1.3-1.5배 증가한다고 보고하여 본 연구의 발효 경향과 유사하였다. 발효과정에서 전분질 등의 분해 와 기능 성분의 함량 증진의 특성에 관한 기존의 보고를 통해 본 연구에서 생강 추출물의 총 폴리페놀 및 총 플라 보노이드 함량의 증가에도 이러한 발효균주의 특성들이 영 향을 미치는 것으로 생각된다(Kwon et al., 2004).
|
DPPH 라디칼 소거 활성은 2.33-3.01 mg AA eq/g의 범 위로 나타났으며, ALEZ (3.01 mg AA eq/g)는 HW (2.33 mg AA eq/g)에 비해 약 1.3배 가량 가장 높은 활성을 나 타냈다(Table 4). 명월초 발효물은 L. casei KCTC 2180 균주로 발효시 대조군보다 1.4배 항산화 활성이 증가하였 으며(Bae et al., 2019), 이러한 결과는 미생물의 가수분해 작용으로 인해 DPPH 라디칼 소거 활성이 높은 대사산물 을 생성하고 추출하는데 영향을 미친 것으로 생각된다. ABTS 라디칼 소거 활성은 HW 0.93, EZ 1.00, AL 1.01, ALEZ 1.15 mg AA eq/g의 순서로 나타났으며, HW보다 ALEZ가 약 1.2배 가량 높았다. Seo (2017)의 발효 숙성생 강 연구에 의하면 각 균주(L. mesenteroides, S. thermophilus, L. brevis, L. acidphilus)간의 유의차는 나타나지 않았으나 대조군에 비해 DPPH는 1.3배, ABTS는 1.5배 가량 증가하 였다고 보고하였다. 이러한 결과는 ALEZ에서 발효와 효소 의 시너지 작용이 일어나 생강 내의 페놀성 화합물의 용출 을 효과적으로 증대시킨 결과로 생각되며, ALEZ는 항산화 물질과 활성을 효과적으로 증가시킬 수 있는 유용한 방법 으로 판단된다. Lee 등(2020)은 숙성한 흑생강의 항산화 활성과 6-shogaol의 함량이 증가하는 것은 서로 연관성이 있었다고 보고하였는데, 본 연구결과와는 다소 차이가 있 었다. 그 이유로는 발효균주 및 효소의 복합작용으로 인 한 여러 요인에 의한 것으로 사료된다. 또한 Lee 등 (2014)은 생강의 높은 항산화 활성의 이유로 phenol 화합 물과의 관련성을 보고하였다.
요 약
본 연구는 황국균과 백국균으로 발효 처리한 생강 발효 물의 품질 특성을 확인하여 생강 발효에 적합한 최적 균주 를 선정하였고, 발효 및 효소 복합 처리 기술을 적용하여 제조한 생강 추출물의 기능성분 변화를 알아보고자 하였 다. 생강 발효에 사용할 균주를 선정하기 위해 황국균과 백국균을 이용하였고, 각 첨가량별로 추출하여 CON과 비 교하였다. TP와 TF 측정 결과, D가 CON에 비해 각각 2.3배, 3.5배 높게 나타났다. 생강 발효에 적합한 발효 균 주에는 백국균을 선정하였다. 백국균의 첨가량을 결정하기 위한 DPPH와 ABTS 라디칼 소거 활성 측정 결과 D는 각 각 7.34, 11.63 mg AA eq/g으로 C보다 유의적으로 가장 높게 나타나 백국균의 첨가량은 1%로 최종 결정하였다. 선정된 균주와 첨가량을 활용하여 제조한 생강 추출물 (HW, EZ, AL, ALEZ)의 기능성분 변화를 확인하였다. WSI와 TS는 ALEZ이 HW에 비해 값이 증가하는 경향 을 보였으나, RS에서는 HW 2.60%, AL 2.91%, ALEZ 9.66%, EZ 15.86% 순으로 높았으며 EZ가 ALEZ보다 유 의적으로 높게 나타났다. 6-G는 AL 0.69%, ALEZ 0.75%, HW 0.98%, EZ 1.10% 순으로 높아졌으며, 이 외 8-G, 10- G, 6-S, 8-S, 10-S의 함량 또한 EZ가 유의적으로 높게 나 타났다. TP와 TF는 EZ에 비해 ALEZ가 1.2배 정도 가장 높았으며, DPPH와 ABTS의 경우 AL에 비해 1.1-1.2배 정 도 가장 높은 활성을 나타냈다. 이상의 결과로 볼 때, 생 강의 고유 성분인 gingerol 및 shogaol을 효과적으로 용출 하는 방법은 EZ로 나타났으나 수용화 및 항산화 활성 물 질은 ALEZ가 단일 처리인 EZ나 AL보다 효과적임을 확 인할 수 있었다. 결과적으로 발효 및 효소 복합 처리를 통 해 식품소재의 기능성 향상을 위한 가공기술 개발의 기초 연구자료 및 산업적으로 광범위하게 활용될 수 있을 것으 로 생각된다.