서 론
홍삼은 인삼(Panax ginseng C.A. Meyer)을 다양한 방법 으로 찌고, 익혀 말린 것으로 이 과정에서 다양한 생리활 성물질이 생성되고, 사포닌의 일종인 ginsenosides의 함량 이 향상되며 새로운 ginsenosides가 생성되기도 한다(Nam, 2005). 홍삼 내 ginsenosides는 다양한 기능성 및 약리작용 을 지니고 있어 항암, 항노화, 항염증 효능 등 현재까지 많 은 연구가 이루어진 바 있다(Cho et al., 2006; Chae et al., 2009;Leung & Wong, 2010; Kim et al., 2018).
홍삼의 ginsenosides는 주로 배당체 형태로 존재하며 당의 종류, 개수, 위치에 따라 protopanaxadiol (PPD), protopanaxatriol (PPT), oleanane으로 나누어지고, 180개 이상의 ginsenoside가 알려져 있다(Christensen, 2009; Amdadul Huq et al., 2014). Ginsenosides는 major ginsenosides와 minor ginsenosides로 나누어지고, major ginsenosides (Rb1, Rb2, Rc, Rd, Re, Rg1)의 잔기에 존재하는 당이 β-glucosidase에 의하여 제거되면 minor ginsenosides (F2, Rg3, Rh2, C-K, Rg2, F1, Rh1)로 전환되는데(Sanada et al., 1974; Noh et al., 2009), 대부분의 생리활성은 minor ginsenosides가 지 니고 있기 때문에 많은 연구가 minor ginsenosides의 기능 성에 치중되어 있다(Bae et al., 2002; Cheng et al., 2007).
미생물을 이용한 ginsenosides의 생물전환에 대한 연구로 는 김치에서 분리된 유산균을 이용하여 Rb1을 Rg3로 생 물전환하였고(Park et al., 2017), Bifidobacterium longum을 이용하여 Rb1, Rd, Rh1, Rg1을 Rg3, Rh2로 생물전환한 바 있으며(Park et al., 2013), Aspergillus oryzae (Kim et al., 2006), Saccharomyces cerevisiae (Choi et al., 2014) 등의 진균류가 ginsenosides를 생물전환시키는 것으로 보고 되어 있다. 대부분의 효모는 β-glucosidase 활성을 지니고 있기 때문에 ginsenosides의 생물전환에 적합할 것으로 판 단되나(Saha & Bothast, 1996; Schmidt et al., 2011), 효모 를 이용한 ginsenosides의 생물전환에 대한 연구는 미미한 실정이다.
기존 연구에서는 ginseonosides를 생물전환시키는 균주를 탐색하여, 메주에서 분리된 Candida allociferrii JNO301의 특성을 파악하였고(Lee et al., 2014), 본 연구에서는 C. allociferrii JNO301을 이용하여 홍삼추출물에 존재하는 major ginsenosides를 minor ginsenosides로 생물전환하는 조건을 최적화하였고, 이에 따른 생물전환 경로를 확인하 였다.
재료 및 방법
홍삼 추출물은 ㈜웰바이(Seoul, Korea)에서 구입하였고, 균주의 배양은 YM 배지(Becton, Dickinson and Company, Franklin Lakes, NJ, USA)를 이용하였다. TLC plate (TLC Silica gel 60 F254)는 Merck (Whitehouse Station, Readington, NJ, USA)사의 제품을 사용하였고, HPLC 분석에 사용된 용매인 클로로포름, 메탄올, 아세토니트릴은 Mallinckrodt Baker사(Phillipsburg, NJ, USA)의 것을 사용하였다. 표 준물질인 ginsenosides Rd, Re, Rg1은 BTGin (Okcheon, Korea)에서, Rb1, Rg3, Rh1, compound K (C-K), compound O (C-O), compound Mc1 (C-Mc1)은 Ambo Institute (Daejeon, Korea)에서 공급받았다.
본 연구에서 홍삼의 생물전환 최적화에 사용된 효모 균주 는 메주에서 분리되었고, C. allociferrii JNO301로 동정 및 명명되었다(Lee et al., 2014). 순수 배양된 C. allociferrii JNO301은 20% (v/v)의 glycerol과 혼합하여 -80°C에 동결 보존하였고, 동결 보존된 균주는 30°C에서 48시간동안 YM 배지(yeast extract, 3 g/L; malt extract, 3 g/L; peptone, 5 g/L; dextrose, 10 g/L)에 계대하여 사용하였다. C. allociferrii JNO301의 종배양은 YM 배지 10 mL에 접종하 여 30°C에서 145 rpm으로 배양하여 사용하였다.
TLC 분석에 사용된 시료는 배양액을 8,000×g로 10분간 원심분리하여 배양 상등액을 취하고, 동량의 수포화 부탄 올을 첨가하여 10분간 vortexing으로 ginsenosides를 추출 하여 감압농축하였다. 농축물은 메탄올에 용해하여 점적하 였다. 전개용매로서 CHCl3:CH3OH:H2O (65:35:10, v/v/v)를 사용하였고, 10%의 황산을 분무한 뒤 5분간 가열건조하여 발색시켰다.
Ginsenosides의 정량 및 정성 분석은 HPLC (SP930D, Younglin Instrument, Seoul, Korea)를 이용하였다. 컬럼은 C18 컬럼(4.6×250 mm, ID 5 μm, ODS2, Waters, Milford, MA, USA)을 사용하였고, 시료는 20 μL를 주입하였다. 컬 럼 오븐의 온도와 유속은 각각 40°C, 1.6 mL/min으로 진행 하였고, 203 nm 파장의 자외선을 이용하여 검출하였다(UV 730D, Younglin Instrument). 이동상은 아세토니트릴과 증 류수를 사용하였고, 시간에 따른 용매의 비율은 0-5분 15:85(아세토니트릴:증류수), 5-55분 15:85, 55-75분 40:60, 75-90분 58:42, 90-97분 90:10, 97-99분 90:10으로 진행하 였다.
배지 내의 탄소원에 따른 ginsenosides의 생물전환을 확 인하기 위하여 탄소원으로서 glucose, fructose, galactose, mannose, rhamnose, xylose를 첨가하여 C. allociferrii JNO301의 생물전환능을 확인하였다. 또한, 배지 내의 질소 원에 따른 ginsenosides의 생물전환을 확인하기 위하여 glucose만 첨가된 배지조성에 단독 질소원으로서 beef extract, casein, casitone, casamino acid, malt extract, neopeptone, peptone, polypeptone, proteose peptone, soytone, tryptone, yeast extract를 각각 첨가하여 C. allociferrii JNO301의 생물전환능을 확인하였다. 이를 위하여 C. allociferrii JNO301은 YM broth에 접종하여 30°C에서 145 rpm으로 하룻밤 배양하였고, YM 배지에서 탄소원을 제거 하고 1% (v/v)의 홍삼 농축액을 첨가한 배지(YM-R) 200 mL에 각종 탄소원 및 질소원을 단독으로 1% (w/v) 첨가한 배지에 배양액 1% (v/v)를 접종하였다. 각기 다른 탄소원 및 질소원에 접종한 균주는 30°C, 145 rpm에서 10일간 배 양하였다.
결과 및 고찰
기존의 연구에서 메주로부터 분리된 C. allociferrii JNO301가 홍삼 추출물에 존재하는 ginsenosides의 생물전 환능을 지니고 있음을 확인하였다(Lee et al., 2014). C. allociferrii JNO301는 ginsenoside Rc를 C-Mc1으로, Rf를 Rh1으로, Rb1을 Rd로, 전환된 Rd를 F2로, Rb2를 C-O로 전환되는 것을 TLC로 확인된 바 있다(Lee et al., 2014).
탄소원이 ginsenosides 생물전환에 미치는 영향을 확인하 기 위하여 glucose, fructose, galactose, mannose, rhamnose, xylose를 YM-R 배지에 각각 1% (w/v)를 첨가하여 C. allociferrii JNO301의 생물전환능을 TLC와 HPLC로 분석 하였다(Fig. 1). 첨가한 탄소원에 따라 생물전환은 큰 차이 를 보이지 않았으나, 모든 실험구에서 Rb1에 의하여 Rd와 F2가 증가하였고, Rb2와 Rc의 반응으로 인하여 C-O, CMc1, Rf, Rh1이 생성된 것을 확인할 수 있었다. 김치에서 분리한 Leuconosotc citreum LH1와 Lactobacillus rossiae DC05은 Rb1으로부터 Rd, F2, C-K를 형성하였다고 보고 되었고(Quan et al., 2011; Amdadul Huq et al., 2014), 막 걸리에서 분리된 S. cerevisiae HJ-014은 Rd, F2, C-K를 형성하여 유산균뿐만 아니라 효모에서도 ginsenosides의 생물전환이 이루어지는 것을 확인하였다(Choi et al., 2014). 이러한 결과는 다양한 균주에서 ginsenosides의 생 물전환이 이루지는 것으로 판단되며, 균주가 다르더라도 생물전환 경로가 일치할 수도 있는 것으로 확인된다. 또한 각 탄소원 첨가에 따른 ginsenosides의 생물전환을 HPLC 로 확인하였을 때, galactose를 첨가한 실험구에서 각 ginsenosides의 정량값이 F2 (7041.96), C-O (2593,31), CMc1 (2190.93), Rh1 (2334.86), RM1 (1186.07)의 값이 가 장 큰 것을 확인할 수 있었다. Galactose는 저렴한 가격과 쉽게 이용할 수 있는 탄소원이라는 점에서 경제적인 효율 성을 지니고 있다. Galactose의 최적 농도를 확인하기 위하 여 홍삼추출물에 galactose를 0.5-3.5%(w/v)로 첨가하여 ginsenosides의 생물전환을 확인한 결과, galactose 농도의 증가에 따라 생물전환 또한 높게 나타났다(결과 미제시). Rf, Rd, Rb2, Rc, down spot의 생물전환으로 F2, C-O, CMc1, RM1, Rh1의 농도가 증가하였고, 0.5% (w/v)의 저농 도에서도 생물전환능이 높은 것으로 확인되었다. Galactose 농도에 따른 전환율은 HPLC를 이용하여 정량하였을 때, 2.5%(w/v)의 galactose를 최적 탄소원으로 결정하였다.
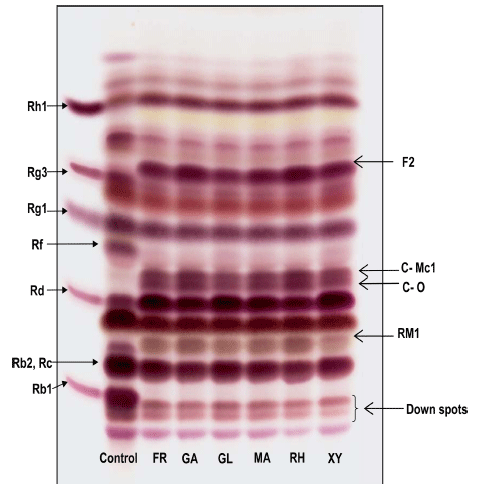
질소원에 따른 ginsenosides의 생물전환을 확인하기 위하 여 홍삼추출물에 beef extract, casein, casitone, casamino acid, malt extract, neopeptone, peptone, polypeptone, proteose peptone, soytone, tryptone, yeast extract을 각각 첨가하여 그 결과를 TLC로 확인하였다(Fig. 2). Rb1의 생 물전환으로 인하여 Rd의 농도가 증가하였고, casein, malt extract를 첨가한 실험구를 제외하고 모두 F2로의 생물전환 이 일어난 것이 확인되었다. 특히 casitone, neopeptone, proteose peptone, soytone을 첨가하였을 때, 생물전환으로 F2, C-O, C-Mc1, Rh1, RM1의 농도가 증가하였고, 특히 C-K가 생성된 것을 확인하였다. C-K는 Rb1의 생물전환에 따른 F2의 C3위치의 glucose의 가수분해 결과로 생성된 것 으로 사료되었다. 특히 C-K는 Caulobacter ledyia (Cheng et al., 2006), Fusarium sacchari (Han et al., 2007), Acremonium strictum (Chen et al., 2008), Leu. mesenteroides (Quan et al., 2011), L. paralimentarius (Quan et al., 2013) 에 의하여 전환될 수 있고, 최근 다양한 생리활성기능이 연구되고 있다(Yang et al., 2015). C-K는 항암효과(Zhou et al., 2006), 항염증작용(Li et al., 2014), 항당뇨(Li et al., 2012), 신경보호작용(Lee et al., 2013) 등이 밝혀져 있다. 본 연구에서 C. allociferrii JNO301의 발효를 통해 다양한 생리활성을 지니는 ginsenosides인 C-K의 농도가 향상되어 산업적 가치가 높을 것으로 사료된다.

HPLC로 반응산물을 정량하였을 때, proteose peptone을 첨가한 실험구에서 반응산물의 생성량이 가장 높았고, soytone을 첨가한 실험구와 유사하였다(결과미제시). 그러나 고가인 proteose peptone보다 soytone이 경제적으로 용이하 다고 판단되어 최적 질소원은 soytone으로 결정하였고, 1.0% (w/v)의 soytone을 첨가하였을 때 생물전환능이 가장 향상되었다.
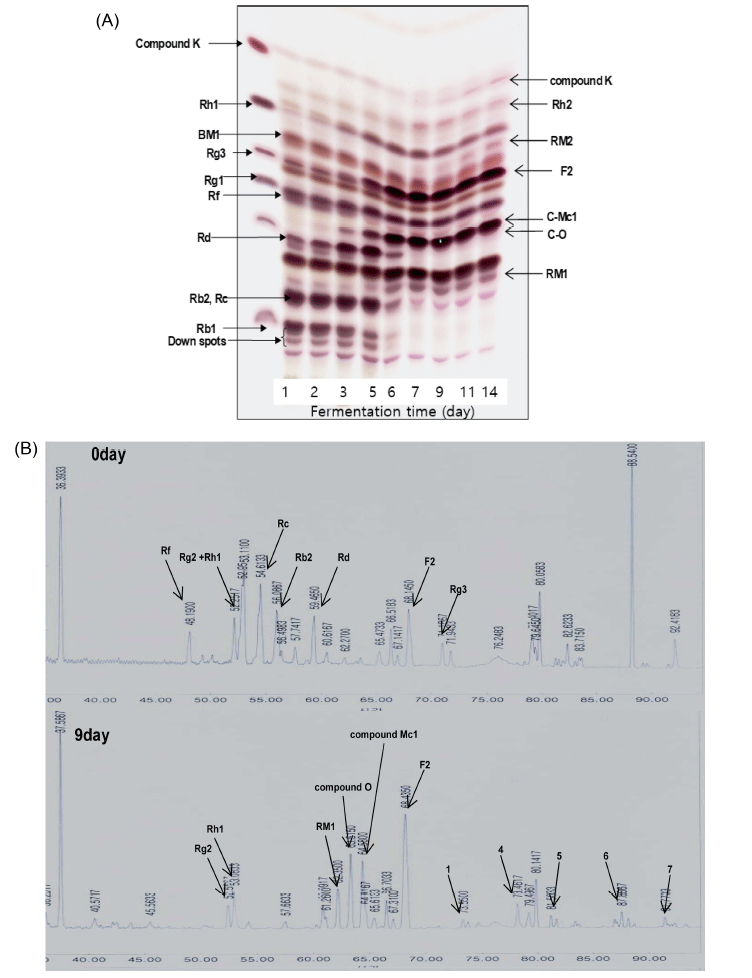
발효에 있어서 탄소원 및 질소원 뿐만 아니라 발효기간 에 따라 생물전환능이나 생물전환양상이 상이하기 때문 에 상기 결과에서 2.5% (w/v)의 galactose와 1.0% (w/v)의 soytone을 각각 ginsenosides 생물전환의 최적 탄소원과 질 소원으로 선정하였고, 시간에 따른 생물전환을 확인하기 위하여 0-14일간 샘플링하여 생물전환반응을 확인하였다 (Fig. 3A, 3B). 생물전환 3일까지 시간이 경과됨에 따라 Rb1이 생물전환되어 Rd의 농도가 증가되었고, Rb2, Rc, Rf의 생물전환에 따라 C-O, C-Mc, Rh1이 생성되었다. Rd 의 경우 7일째에 모두 F2로 전환되었고, Rg3로부터 Rh2가 생성된 것을 확인하였다. 생물전환 9일 이후부터 C-K의 생성이 이루어졌고, 이를 통하여 C. allociferrii JNO301은 PPD 계열의 ginsenosides의 비당체 C-3 위치의 glucose를 특이적으로 절단하여 생성된 것으로 판단된다. 또한 HPLC 크로마토그램에서도 확인할 수 있듯이(Fig. 3B), 생물전환 9일차에 F2, C-O, C-Mc1 등의 minor ginsenosides의 농도 가 향상되는 것으로 보아 TLC 결과와 일치하였다. 이와 같은 생합성 경로는 Leu. mesenteroides DC102에 의하여 Rb1으로부터 C-K가 합성되는 것과 같았고(Quan et al., 2011), L. paralimentarius에 의한 C-K 생합성 경로와 일치 하였다(Quan et al., 2013). 8일차에 ginsenosides의 생물전 환이 가장 잘 일어났고, 최적 ginsenosides 생물전환 기간 으로 판단하였다.
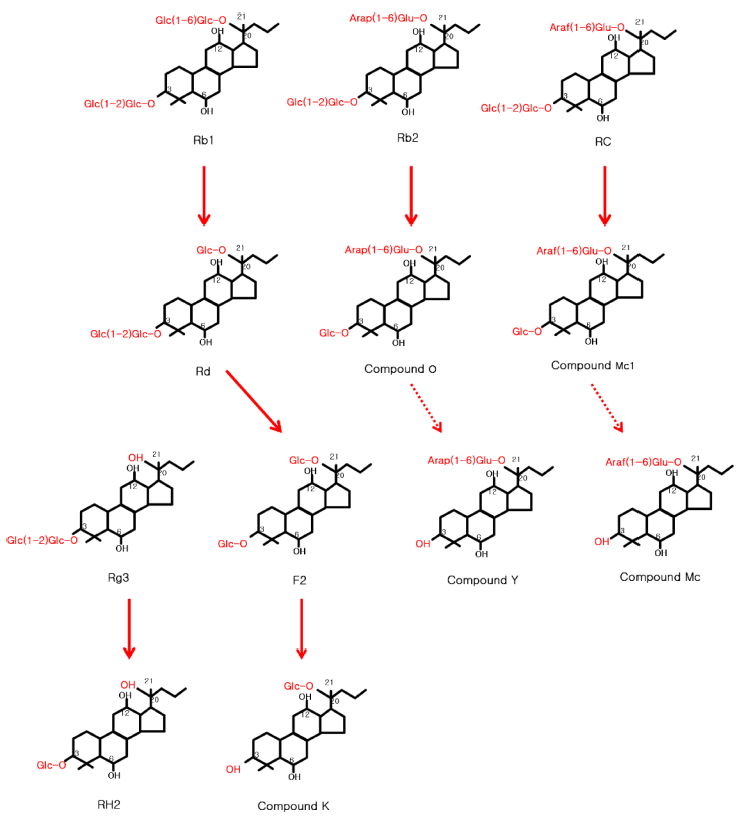
전 연구에서(Lee et al., 2014) C. allociferrii JNO301을 이용하여 홍삼 ginsenosides의 생물전환경로를 일부 밝힌 바 있지만, 본 연구에서는 최적 생물전환 조건을 확립한 후 최적 조건으로 생물전환하였을 경우, Fig. 4와 같이 생 물전환경로를 추가로 확인할 수 있었다. C. allocifferri JNO301은 홍삼의 Rb1, Rb2, Rg3, RC를 생물전환하였고, 이를 통하여 C-K, C-O, Rh2, C-Mc1으로 전환되었다. S. cerevisiae HJ-014는 4.5% (w/v)의 홍삼 추출물에서 96시 간 배양 시 ginsenosides Rd가 C-K로 전환되었고(Choi et al., 2014), 효모뿐만 아니라 L. rossiae DC05, L. paralimentarius 등의 유산균도 본 연구와 같이 Rb1으로부 터 C-K로 전환된 연구가 이루어져 있다(Quan et al., 2013; Amdadul Huq et al., 2014). 현재까지 C-K, Rh1, Rh2 등은 이미 그 기능성이 입증되어 연구된 바 있으나 (Kim et al., 2017), F2, C-O, C-Mc1 등은 아직 C-K, Rh2, C-MC, C-Y 등의 중간 대사체로서만 여겨지고 있고, 그 기능성에 대한 연구는 미비하다. 본 연구에서는 C. allociferrii JNO301를 이용하여 최적 홍삼 내 ginsenosides 를 생물전환조건으로 기능성 및 생체 이용율이 향상된 발 효홍삼추출물을 제조할 수 있었고, ginsenosides 생물전환 경로를 확인하였다. 추후 생물전환물의 다양한 기능성 및 안전성에 대한 연구가 요구되며, 기능성 소재로서의 응용 을 위한 기초자료로 활용될 수 있을 것으로 사료된다.
요 약
본 연구에서는 메주에서 분리된 C. allociferrii JNO301 을 이용한 최적 홍삼 ginsenosides의 생물전환 조건을 확인 한 결과, 1.0% (v/v)의 홍삼 추출물에 탄소원으로서 2.5%(w/ v)의 galactose, 질소원으로서 1.0% (w/v)의 soytone을 첨가 하여 30°C에서 145 rpm으로 8일간 배양을 최적 생물전환 조건으로 확립하였다. C. allociferrii JNO301에 의해 홍삼 추출물에 존재하는 Rb1, Rb2, Rc, Rf가 생물전환되어 F2, Rh1, Rh2, compound O, compound Mc1, compound K 등 의 minor ginsenosides의 함량이 증가되었다.







