서 론
비피도박테리아는 장내 혹독한 환경에서 살아남을 수 있 는 힘을 길러왔으며 핵심 효소인 fructose-6-phosphoketolase (EC)를 중심으로 하는 “bifid shunt”라는 대사 경로를 통해 hexose sugar를 대사한다(Sela et al., 2008;Pokusaeva et al., 2011). 대장 안에 주로 서식하는 장내세균은 자칫 영 양이 결핍될 수 있으므로 인간을 포함한 숙주가 소화시키 지 못해 결과적으로 대장까지 온 탄수화물을 분해시킬 수 있는 유전자를 만든다. 펙틴이나 헤미셀룰로오즈, 자일란 과 같은 식물에서 유래하는 복합 탄수화물은 비피도박테리 아의 먹이인 prebiotics가 된다(O'Callaghan & van Sinderen, 2016). Bifidobacterium 속, Lactobacillus 속과 같은 프로바 이오틱 균주는 비소화성 영양성분인 prebiotics가 생육활성 증식 뿐만 아니라 bacteriocin 생합성을 촉진한다(Audisio et al., 2001). 유산균의 bacteriocin 생산량과 생산 균주의 성 장 속도는 비례 관계이며, 배양 시간이 경과할수록 활성이 증가하고 주로 대수 증식기 후반에 최대 활성에 이른다고 알려져 있다. 최대의 bacteriocin 생산은 균종마다 차이가 있 으며 생산균의 생장 단계에 따라 상이하다(Al-Jumaily et al., 2014). Bacteriocin은 단백질성 물질이므로 체내 단백질 가수분해 효소에 의해 쉽게 분해되므로 인체 무독성이고 잔류성이 없으며, 다양한 식중독 균에 대한 증식 억제 및 사멸 효과로 인해 생물학적 보존제나 생물 제어제로서의 적용이 가능하다(Deegan et al., 2006;Rattanachaikunsopon & Phumkhachorn, 2010). Staphylococcus aureus는 즉석 조리 식품에서 가장 중요한 식중독균(Genigeorgis, 1989;Wieneke et al., 1993)으로 이 균의 단백 독소인 장관독소(enterotoxin) 는 열에 강하여 100°C에서 30분 정도 가열처리로는 거의 무독화 되지 않고 섭취한 사람에게 급성위장장해를 일으킨다(Jang et al., 2005). 따라서 Lactobacillus plantarum 에 대한 항균활성효과로 인해 병원미생물 제어 항균제로 서의 효용 가치도 기대되고 있다(Ogunbanwo et al., 2003). 하지만 장내미생물 유래의 항균물질은 정제 전에 는 유색, 유취라는 문제점이 있어 산업적으로 이용하는데 한계가 있어 정제단계를 거쳐야 한다(Mahrous et al., 2013). Chromatography로 항균물질을 정제할 경우 생산 단가가 올라가고 처리 과정 중 일부 활성이 소실될 수도 있다. 따라서 prebiotics를 이용하여 bacteriocin의 생합성을 촉진하여 bacteriocin의 생산량을 높여 산업적으로 이용하 게 될 때 생산 비용을 절감시키고 항생제를 대체시킬 수 있는 안전한 항균물질로서 병원성 미생물을 제어하는데 효 과적일 것이다(Jozala et al., 2007). Mannan 계열의 갈락토 만난(galactomannan) 성분을 풍부히 함유하고 있는 콩과 식물 Trigonella foenum-graecum는 D-galactose 단위에 대 한 D-mannose의 평균비율은 대략 1:1.2로 구성되어 있다 (Jiang et al., 2007;Bera et al., 2018). 본 연구실에서는 bifidobacterium의 생육활성에 효과를 보이는 gum 유래 galactosyl mannooligosaccharide와 konjac 유래 glucosyl mannooligosaccharide의 장내세균의 우수한 생육활성을 보 고한 바 있다(Lee & Park, 2008). 결론적으로 본 연구에서 는 Trichoderma reesei 유래 정제된 β-mannanase를 활용 하여 Trigonella foenum-graecum galactomanna으로부터 galactomanno-oligosaccharides를 생산 및 정제하여 고중합 도와 저중합도별 Lactobacillus plantarum의 생육활성 증진 을 확인하며 이에 따른 L. plantarum의 bacteriocin 생산 및 정제를 통해 항균제 감수성 실험을 진행하여 병원성 미 생물의 제어 효과를 입증하였다.
재료 및 방법
Trigonella foenum-graecum으로부터 Galactomannan 조제 를 위해 DattaRimi의 방법에 따라 수행하였다(Datta & Bandyopadhyay, 2005).
본 실험에 사용된 Trichoderma reesei KCCM35503는 한 국미생물보존센터(KCCM, Seoul, Korea)로부터 분양받았으 며 효소생산 액체배지 100 mL에 접종하여 30°C, 150 rpm, 72시간 배양하였다(Zurbriggen et al., 1990). 배양액은 4°C 9,000×g, 10분간 원심분리(JXN-30, Beckman, Indianapolis, IN, USA)하여 상층액을 조효소액으로 사용하였다.
효소 활성 측정은 Dinitrosalicylic acid (Sigma Chemical Co., St. Louis, MO, USA)를 사용하였고 β-mannanase의 생산량은 DNS환원당 정량법(Miller, 1959)에 의하여 수행 하였으며 최근 보고된 방법(Park et al., 2013)으로 측정하 였다.
DNS 환원당 정량법(Miller, 1959)에 의하여 수행하였다. 즉 mannose를 함유한 가수분해물 0.1 mL와 DNS 시약 1.0 mL를 혼합하여 10분간 물중탕을 하여 냉각시킨 후 희석하 여 570 nm에서 흡광도를 측정하였다. 표준곡선은 Dmannose를 0.1-1.0 mg/mL를 사용하였다.
DEAE Sephadex A-50 (Pharmacia Biotech, Uppsala, Sweden)는 column (2.5 cm × 30 cm, Bio-Rad Laboratories, Hercules, CA, USA)에 충진시켜 50 mM Citrate buffer (pH 5.0)로 평형화 하였다. 이후 투석한 조효소액(47.4 unit/10 mL)를 column에 loading하였으며 0-0.5M NaCl로 gradient 농도 구배하여 용출하였다. 이때 용출속도는 40mL/h로 하였 고, 용출액은 5mL씩 분획수집기(pH18-1003-64, Pharmacia Biotech, Uppsala, Sweden)에 받았다. 활성 분획을 회수하 여 ultrafilteration (AMICON Cell 8010, Millipore Co., Bedford, MA, USA)을 이용하여 농축시킨 후, Sephadex G-100 (Pharmacia Biotech, Sweden)는 column (1.5 cm × 50 cm, Bio Rad Laboratories, Hercules, CA, USA)에 충진시 켜서 50 mM Citrate buffer (pH 5.0)으로 평형을 유지 시킨 후, 농축 된 활성 분획을 용출시켰다. 이때 용출속도는 30 mL/h로 하였고, 용출액은 5 mL씩 fraction collector에 모았 고, SDS-PAGE를 통해 순도 확인 후 정제 효소액으로 사용 하였다. Tricine SDS-PAGE 상에서 나타난 band와 protein size marker의 relative mobility를 계산하고 작성한 그래프 를 이용하여 분자량을 확인하였다(Laemmli, 1970).
정제 β-mannanase (511.92 unit/10 mL)에 galactomannan 0.5%를 50°C 3시간 가수분해 한 뒤 Bio-Gel P-2 (Bio Rad Laboratories, Hercules, CA, USA)는 증류수에서 25°C 4시간 활성화한 후 탈기하여 column (3 cm × 120 cm)에 충진하였 다. 24시간 동안 증류수를 이용하여 평형화 후 가수분해 용 액을 주입하고, 60 mL/hr 유속으로 시험관 당 10 mL씩 용 출하여 galactomanno-oligosaccharides를 분리한 뒤 McCleary BV의 방법으로 TLC를 수행하였다(McCleary, 1982).
Total reducing sugar (TRS)을 direct reducing sugar (DRS) 으로 나눈 값을 가수분해된 galactomanno-oligosaccharides의 중합도로 결정하였으며(Timell et al., 1956), 최근에 보고된 방법(Park et al., 2013)과 동일하게 수행하였다.
L. plantarum ATCC8014는 American Type Culture Collection (ATCC, Manassas, VA, USA)으로부터 분양 받았으 며 혐기적 조건하에서 37°C 48시간 동안 배양 하였다. L. plantarum ATCC8014 대한 생육촉진 활성을 측정하기 위 해 MRS배지에서 탄소원을 포도당 대신에 분리 조제된 중합도별 galactomanno-oligosaccharides를 회수하고 이를 LMOS (Low-molecular weight galactomanno-oligosaccharides, DP2+3)와 HMOS(High-molecular weight galactomanno-oligosaccharides, DP4+6)인 두 그룹으로 나누어 연구를 진행 하였다. 진공 농축시킨 후 DNS법을 이용하여 dextrose와 동일한 환원당량으로 조절한 후 121°C 15분간 멸균한 modified MRS 배지를 조제하여, 초기균수 104 CFU/mL로 각각 접종하여 혐기적 조건하에서 37°C 48시간 평판배양한 후 colony수를 MRS 배지와 비교하고(Deya et al., 1982), 동일한 조건으로 액체 배양하여 590 nm에서 흡광도를 측정 하여 총 균수를 MRS 배지와 비교하였다(Toba, 1985).
Bacteriocin의 항균 활성은 S. aureus KCCM11335를 대 상으로 Paper disk method으로 측정 하였다. S. aureus KCCM11335는 한국미생물보존센터(KCCM, Seoul, Korea) 로부터 분양받았으며 37°C에서 24시간 동안 배양하였다. S. aureus KCCM11335의 생균수를 McFarland 0.5관(1.5 × 108 CFU/mL)으로 조정하였고, Tryptic Soy Agar (Difco Laboratories, Detroit, MI, USA)에 접종 한 뒤 평판배지 위에 항균물질을 가한 paper disc(8 mm, Advantec., Toyo Co., Tokyo, Japan)를 놓고 배양하였다.
L. plantarum ATCC8014은 100 mL modified MRS에 서 초기균수 104 CFU/mL로 각각 접종하여 혐기적 조건 에서 37°C 16시간 정치배양을 하였다. 배양액은 4°C 8,000×g, 6분간 원심분리하여 얻은 상층액을 취하였으며 0.45 μm filter (Milipore, Schwalbach, Germany)로 여과하 여 culture supernatants로 사용하였다. Culture supernatants 는 90% (NH4)2SO4를 처리하여 4°C 12시간 반응하였으며 4°C 8,000×g, 10분간 원심분리 후 상층액과 침전물로 분리 하였다. 침전물은 10 mM Tris-HCl (pH 7.4)에 현탁한 후 투 석막(16 mm × 30 cm, Sigma Aldrich, St. Louis, MO, USA) 을 이용해 4°C 24시간 투석하였고 이를 crude bacteriocin 용액으로 사용하였다. Sephadex G-100을 column (2.5 cm × 30 cm, Bio Rad Laboratories, Hercules, CA, USA)에 충 진시키고 10 mM Tris-HCl (pH 7.4) 용액으로 평형을 유지 시킨 후 crude bacteriocin 용액 1 mL를 주입하고, 10 mM Tris-HCl (pH 7.4) 용액으로 용출시켰다. 이때 30 mL/hr 유 속으로 용출액은 tube 당 5 mL씩 fraction collector에 모았 고, 각 용액의 흡광도는 분광광도계(T60 UV/VIS Spectrophotometer, PG Instruments, Alma Park, UK)를 이용하여 280nm에서 측정하였으며, 각 분액의 항균 효과는 Paper disc method을 이용하여 측정하였다. SDS-PAGE를 통해 순도 확인 후 Tricine SDS-PAGE 상에서 나타난 band와 protein size marker의 relative mobility를 계산하고 작성한 그래프를 이용하여 분자량을 확인하였다(Zurbriggen et al., 1990).
AU는 항균 물질을 2배씩 점차적으로 희석 하여 clear zone을 형성하는 최대 희석배수의 역수 값을 취하고, 이 값을 1 mL로 환산하는 값에 곱하여 AU/mL로 정하였다 (Yamamoto et al., 2003).
대사산물의 생성량과 소비량은 다음과 같은 실험 방법으 로 실행하였다(Lim, 2015). pH.는 pH meter (Starter 2100, Ohaus, Zurich, Switzerland)를 이용하여 배양액의 pH를 측 정하였다. lactic acid는 crude bacteriocin solution에 동량의 증류수를 가하여 1% (w/v) phenolphthalein을 첨가한 후 0.1 N NaOH 용액으로 적정한 다음, 미홍색의 종말점에 도 달한 소비량을 측정하여 계산식 (적정산도(%) = (0.1 N NaOH 소비량 × 0.1 N NaOH 역가 × 0.9)/시료양)에 대입하 였다. Acetoin은 acetoin solution 5 mL에 0.5% Creatine solution 1 mL과 5% α-naphthol solution 1 mL을 혼합하여 실온에서 1시간 동안 방치하고 분광광도계(T60 UV/VIS Spectrophotometer, PG Instruments, Alma Park, UK)를 사용 하여 540 nm에서 흡광도를 측정하였다(Westerfeld, 1945). 표준곡선은 stanadard acetoin 2-12 μg/mL을 사용하여 같은 방법으로 처리하여 검량선을 작성하였다. 배지 내 잔당량 은 배지를 15,000 × g에서 3분간 원심 분리한 후 상등액을 phenol-sulfuric method (total sugar)법으로 측정하였다 (Masuko et al., 2005).
L. plantarum ATCC8014가 생산하는 bacteriocin의 pH, 온도, 가수분해효소에 대한 안정성을 측정하였다. pH에 대 한 bacteriocin의 안정성은 bacteriocin 시료 용액의 pH를 1 N NaOH 또는 1 N HCl을 이용하여 pH 2-12로 조정한 후 37°C에서 3시간 방치한 다음 pH를 7.0으로 다시 복원한 후 잔존하는 bacteriocin의 활성을 확인하였다. 온도에 대한 안정성을 조사하기 위하여 bacteriocin 용액의 pH를 7.0으 로 조정한 후 40, 60, 80, 100°C에서 각각 60분간, 그리고 121°C에서 15분간 처리한 후 잔존하는 bacteriocin의 활성 을 확인하였다. 가수분해효소에 대한 안정성은 lysozyme (EC 3.2.1.17, Sigma Chemical Co., St. Louis, MO, USA), α-amylase (EC 3.2.1.1, Sigma Chemical Co.), lipase (EC 3.1.1.3, Type VII, Sigma Chemical Co.), trypsin (EC 3.4.21.4, Sigma Chemical Co.), Proteinase K (EC 3.4.21.64, Sigma Chemical Co.)를 10 mM sodium phosphate 완충용 액(pH 7.0)에 4 mg/mL이 되도록 준비하였다. 정제한 효소 를 최종 농도가 1 mg/mL가 되도록 bacteriocin 시료에 첨 가한 다음 37°C에서 3시간 반응시킨 후 bacteriocin의 역가 를 측정하여 확인하였다.
결과 및 고찰
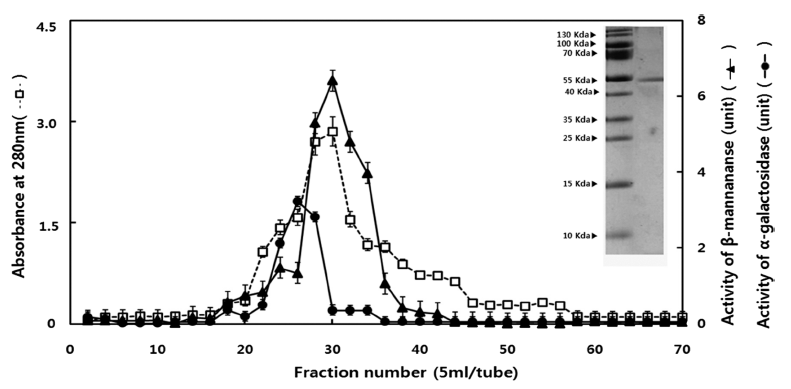
정제효소는 SDS-PAGE에 의해 단일밴드를 나타내었으며, 분자량은 54 kDa으로 추정되었다(Fig. 1). 정제 효소의 비 활성은 57.6 units/mg, 정제배율은 10.8배, 수득률은 6.4%로 나타났다. Bacillus sp. 유래 β-mannanase의 경우 38.9 kDa 이며(Choi & Park, 2004a), Trichoderma harzianum은 52.5 kDa (Park et al., 2007), Thermotoga neapolitana 5068 (Park et al., 1998)은 65 kDa으로 미생물 유래에 따라 β-mannanase 의 분자량이 다양하게 나타났다.
분리도 및 중합도를 확인하기 위하여 TLC를 이용하여 분리도를 확인할 수 있었으며, 중합도 결정을 위해 Timell 의 방법에(Timell et al., 1956) 의해 분석한 결과 각각 분리 된 Fraction No. 16 가수분해 올리고당의 TRS는 11.18, DRS는 1.90, TRS/DRS는 5.88로, Fraction No. 29 가수분해 올리고당의 TRS는 11.57, DRS는 2.85, TRS/DRS는 4.06으 로 나타났다. 또한, Fraction No. 41 GM-Oligosaccharides 가수분해 올리고당의 TRS는 8.18, DRS는 2.64, TRS/DRS 는 3.10로, Fraction No. 60 가수분해 올리고당의 TRS는 8.27, DRS는 3.98, TRS/DRS는 2.07로 나타났다. Fraction No. 16 올리고당은 중합도 6, fraction No. 29 올리고당은 중합도 4, Fraction No. 41 올리고당은 중합도는 3, Fraction No. 60 올리고당 중합도 2으로 규명하였다(Fig. 2). D.P 2 와 D.P 3, D.P 4와 D.P 6은 각각 LMOS, HMOS로 나누 어 향후 실험에 사용 하였다.
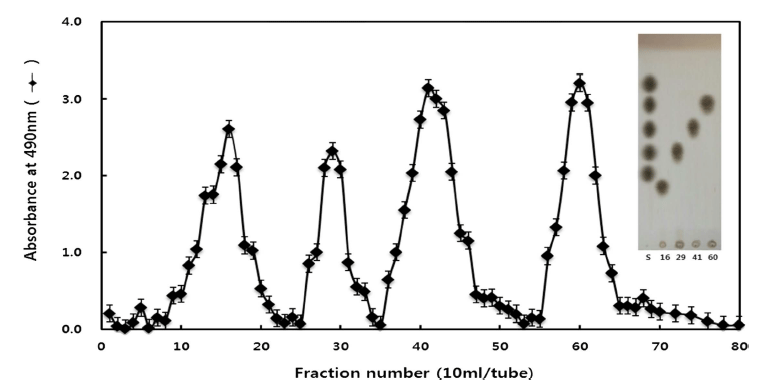
반면에 A. niger 유래 정제한 β-mannanase으로 Trigonella foenum-graecum의 가수분해 결과 중합도 2, 3, 7과 비교했 을 때 가수분해 패턴의 차이가 있음을 확인할 수 있었다 (Reid et al., 2003).
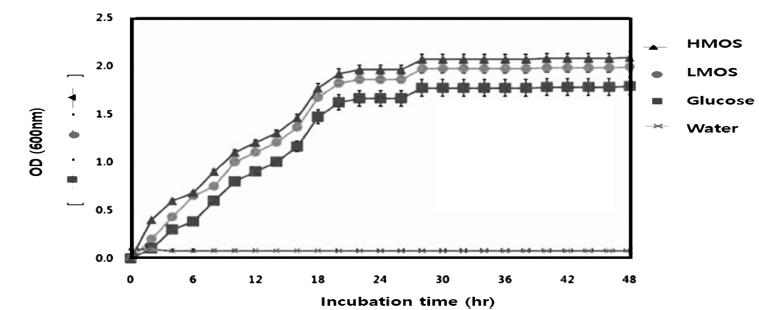
L. plantarum ATCC8014에 대한 생육촉진활성을 측정하 기 위해 MRS medium에서 탄소원을 dextrose 대신에 조제 된 galactomanno-oligosaccharides을 첨가한 후 평판배양을 하여 측정한 결과 올리고당이 첨가되지 않은 MRS broth에 비해 생육 촉진 활성을 보였다. L. plantarum ATCC8014에 서는 HMOS가 첨가된 modified MRS는 standard MRS 보다 1.8배 높은 생육활성을 보였고, LMOS가 첨가된 modified MRS에서는 1.3배 높은 생육 활성을 보였다(Fig. 3). Bacillus sp. 유래 정제효소에 의한 galactomannan 가수분해 올리고당 의 경우 B. longum에서는 D.P. 5 galactomannooligosaccharide 를 탄소원으로 대체한 경우 표준 MRS배지와 비교하여 10 배의, D.P. 7을 처리한 경우에도 7.5배의 상대 활성을 나타 내어 가장 우수한 생육활성을 나타내었다. B. bifidum의 경 우에서도 D.P. 5에서 9.8배, D.P. 7에서 7.7배의 우수한 생 육활성을 나타내었으며 이외에도 B. breve, B. animalis, B. infantis에 있어서도 D.P. 5의 경우 2.9-5.7배의 상대활성을 나타내었으나, B. infantis에 대한 D.P. 7의 경우에서는 표 준 MRS배지와 비교하여 0.62배로 감소하였다. 또한 중합 도 5의 올리고당이 중합도 7의 올리고당보다 생육활성에 크게 기여하는 것으로 나타났다(Choi & Park, 2004b).
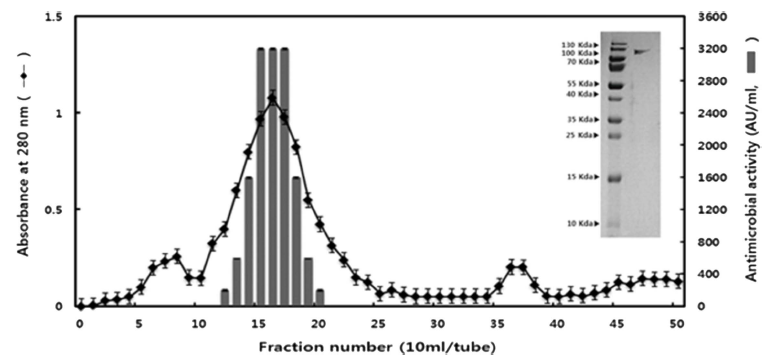
m-MRS 배지에서 배양시킨 L. plantarum ATCC8014의 배양액을 90% (NH4)2SO4에 농축 후, Sephadex G-100으로 Gel filtration chromatogram를 행하였다. Sephadex G-100 을 실시한 결과는 Fig. 3과 같으며 fraction No. 16에서 가 장 높은 peak가 나타났고 Tricine SDS-PAGE 상에서 확인 하였을 때 120 kDa 부근에 단일 band를 보였다(Fig. 3). Todorov et al. (2011)은 파파야(Carica papaya) 유래 L. plantarum ST16Pa에서 6.5 kDa의 분자량을 가진 bacteriocin 을 분리 해냈다. Bacteriocin은 단백질로 이루어져 있기 때 문에 L. plantarum은 그 유래에 따라 분자량의 크기가 다 양함을 확인 할 수 있었다. 정제전 활성역가는 800 AU/ mL 나타냈고, 정제 후 활성역가 값은 3200 AU/mL, 정제 배율은 4배, 수득률은 56.7%로 나타났다(Fig. 4).
우수한 생육활성을 보인 HMOS가 첨가된 modified MRS 배양액 내에서 lactic acid는 두 배지 모두 배양 시간에 따 라 증가하였다(Table 1). Lactic acid의 생성량은 m-MRS 배지(9.3 g/L) 내에서 MRS 배지(8.5 g/L) 보다 유의하게 더 높게 나타났다. pH는 배양 시간에 따라 감소하였으며 m- MRS 배지 (3.6)가 MRS 배지 (3.7)보다 배양액의 pH가 보 다 유의하게 낮았다. 배양액 내에서의 sugar는 두 배지 모 두 배양 시간에 따라 감소되었고 48시간 후에는 reducing sugar 성분은 검출되지 않았다. 반면 acetoin은 두 배지 모 두 배양 시간에 따라 증가 하였으며 acetoin의 생성량은 m-MRS 배지(4.8 mg/L) 내에서 MRS 배지(4.3 mg/L) 보다 유의하게 높게 나타났다. 정제한 Bacteriocin의 항균활성은 MRS 액체배지에서는 1600 AU/mL, m-MRS 액체배지에서는 3,200 AU/mL로 더 높게 나타났다(Table 1). MRS에 fructooligosaccharide, 폴리덱스트로오스 및 이뉼린 등의 prebiotics (20 g/L)를 각각 첨가한 MRS 배지에서 배양하여 L. lactis CECT 4434의 세포량을 측정한 결과, 프리바이오틱을 첨가 한 배지에서 균 성장량이 유의하게 증가되었으므로 fructooligosaccharide가 유산균의 대사와 세포량 증가에 도움을 주는 것으로 보고하였다(Farinha et al., 2015).
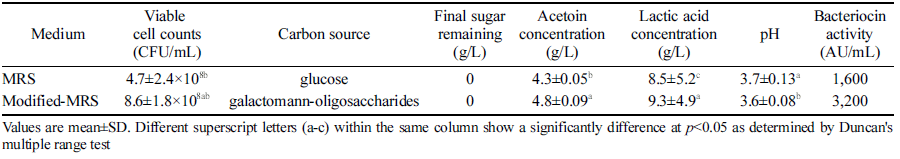
|
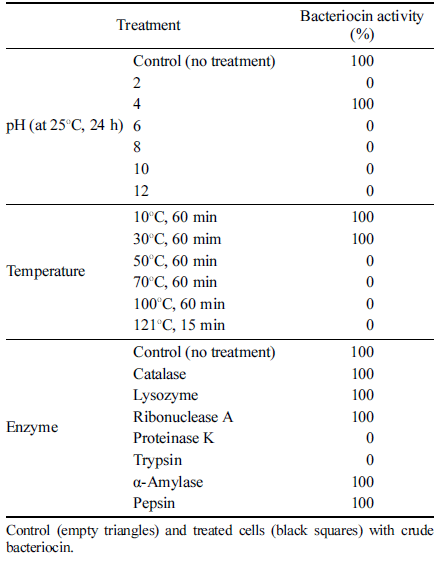
L. plantarum ATCC8014이 생산하는 bacteriocin의 pH, 온도, 가수분해효소에 대한 안정성을 측정한 결과를 Table 2에 나타내었다. pH 4.0의 좁은 범위에서 비교적 안정한 활 성을 나타내었으나, 4.0 미만 및 초과한 pH 값으로 조정하 면 활성이 저해되는 것을 볼 수 있었다. Liu & Hansen (1990)는 bacteriocin 용액의 pH가 높을 경우 hydroxides ions, deprotonated amines 및 deprotonated hydroxy group 들이 bacteriocin과 반응하여 bacteriocin의 3차 구조를 변 화시킴으로써 활성을 저하시킨다고 보고하였다. 김치에서 분리한 L. plantarum KK3 균주가 생산하는 bacteriocin의 항균활성은 pH 3.5-8.5의 넓은 pH 구간에서도 안정함을 보고하였다(Chung et al., 2010). 열처리에 따른 bacteriocin 의 안정성을 조사한 결과 10°C 30°C의 좁은 범위에서 비 교적 안정한 활성을 나타낸 반면, 60°C 이상부터 항균 활성 이 저해된 것을 확인할 수 있었다. 김치에서 분리한 L. plantarum KK3 균주가 생산하는 bacteriocin의 항균활성은 pH 3.5-8.5의 넓은 pH 구간에서도 안정함을 알 수 있었다. Ribonulease A, lipase, α-amylase, catalase는 항균활성에 영 향을 주지 않았지만 proteinase K, trypsin에 의해서 항균활 성이 소실됨을 확인할 수 있었다. 분리된 bactericoin을 효 소처리 후 SDS-PAGE를 통해 확인해 본 결과 α-amylase, lipase에 의해 bactericoin이 분해된 것을 확인하여 탄수화 물과 지질의 결합이 항균 활성에 영향을 주지 않음을 판단 할 수 있었다(Table 2).
|
요 약
본 연구에서는 hemicellulose 기질로서 사용하여 galactomannano- oligosaccharides를 제조하여 prebiotics 소재로 써 유용성을 검증 하였으며 L. plantarum ATCC8014의 bacteriocin을 정제하여 새로운 대체제인 항균물질의 유용성 을 검증하였다. Trichoderma reesei 유래 β-mannanase를 10% (NH4)2SO4에 침전 및 투석하여 DEAE Sephadex A- 50 ion exchange chromatography와 Sephadex G-100 gel chromatography로 정제한 후, tricine SDS-PAGE 상에서 단일 band를 확인하였으며 분자량은 54 kDa으로 나타났 다. Trigonella foenum-graecum로부터 galactomanno-oligosaccharides을 조제하였고 TLC 및 Timell의 방법에 의해 가수분해 galactomanno-oligosaccharides의 중합도를 2, 3, 4, 6으로 규명하였다. 4가지의 중합도로 가수분해 된 galactomanno-oligosaccharides를 LMOS와 HMOS로 나눈 뒤 각각 galactomanno-Oligosaccharides가 첨가된 modified MRS를 조제 하여 장내세균에 대한 생육활성을 측정하였 다. L. plantarum에서는 HMOS를 탄소원으로 대체한 경우 표준 MRS배지와 비교하여 2배, LMOS에서 1.8배의 상대 활성을 나타냈다.
Sephadex G-100 gel chromatography로 L. plantarum ATCC8014 유래 bacteriocin의 정제를 수행한 결과 분자량 은 122 kDa의 확인하였고 S. aureus KCCM 11335에 대 하여 항균활성을 나타냈다. HMOS를 탄소원으로 대체한 경우 표준 MRS배지와 비교하였을 때 생육 활성 증가에 따라 bacteriocin 또한 2배 높은 상대활성을 나타냈다. Bacteriocin의 이화학적 특성 조사 결과 따르면 pH와 온도 에 비교적 민감하였으며, 단백질 가수분해 효소 처리 시 활성이 소실되어 단백질 물질임을 확인하였다.







