서 론
토마토는 세계적으로 생식용이나 가공용으로 소비량이 많은 과실 중의 하나이다(Friedman, 2002; Lugasi et al., 2003; Frusciante et al., 2007). 미국이나 유럽을 중심으로 일반 토마토의 lycopene 함량에 관한 연구(Toma et al., 2008; Erge & Karadeniz, 2011; Gougoulias et al., 2012)와 β-carotene, neurosporene, lutein, zeaxnanthin의 함량에 관 한 연구(Mares-Perlman et al., 2001) 등 일반성분 및 생리 활성 성분의 함량에 관한 연구가 많이 수행되었다. 또한, 전립선암 억제효과(Edward, 1999; Edward et al., 2002; Giovannucci, 2005), 저밀도 지단백(LDL) 산화억제(Oshima et al., 1998), 항산화 효과(Talalay, 2000; Stahl et al., 2001; Mares-Perlman et al., 2001) 등 생리활성에 관한 연구가 상당수 보고되어 있다. 그러나 최근 세계적으로 소비량이 증가하고 있는 방울토마토의 생리활성 성분에 관한 연구는 충분하지 못한 실정으로 방울토마토의 lycopene, β-carotene 등의 carotenoids에 관한 소수의 연구 결과가 존재한다 (Guil-Guerrero & Rebolloso-Fuentes, 2009; Kim et al., 2015). 특히, 페놀성 화합물(phenolic compounds)의 종류 및 함량을 밝히려는 연구는 거의 없어 방울토마토의 식 품학적 가치를 이해하기 위해서는 이에 대한 연구가 필요 하다.
선행 연구(Kim & Ahn, 2014)에서는 국내산 방울토마토 단일 품종에 대해 아미노산 및 아미노산 대사산물, 그리고 폴리페놀 화합물을 알아 본 바 있다. 그러나 국내산 방울 토마토의 식품학적 가치와 활용성을 알기 위해서는 더 다 양한 품종의 생리활성 물질을 규명할 필요가 있다.
따라서 본 연구에서는 국내산 방울토마토 3종에 대해 생 리활성 성분인 lycopene, β-carotene을 정량하였고 페놀성 화합물을 HPLC와 LC-MS/MS를 사용하여 분리, 동정하고 함량을 측정하여 보았다. 본 연구의 결과는 우리나라에서 소비량이 증가하고 있는 국내산 방울토마토의 생리활성 성 분을 규명함으로써 식품 소재로서의 유용성을 밝히는데 기 여 할 수 있으리라 기대된다.
재료 및 방법
실험 재료
국내에서 재배되는 방울토마토 중 Summerking, Qutiquti, Minichal 3가지 품종을 실험에 사용하였다. 토마토는 부여 토마토시험장(Buyeo, Korea)에서 재배된 과실을 공급받아 사용하였다.
분석에 사용할 방울토마토 시료 준비를 위해서 Kim & Ahn (2014)의 방법을 사용하였다. 품종별 10 개체의 과실을 무작위로 선발하였다. 꼭지를 제거하고 과실을 약 1 cm 두 께로 썰어 액체 질소에 침지하여 급속 동결하였다. 동결된 방울토마토를 동결건조기(Model PVTFD 10R, Ilsinbiobase Co. Ltd., Yangju, Korea)를 사용하여 건조한 후 Wiley mill (Model 4, Thomas Scientific, Swedesboro, NJ, USA) 로 분쇄하였다. 분쇄된 가루를 20 mesh 체로 걸러 통과된 분말을 분석에 활용하였다. 분말시료는 습기를 차단하기 위하여 실리카겔이 포함된 데시케이터에 넣고 -25°C에서 보관하였다.
방울토마토로부터 lycopene과 β-carotene 등 카로티노이 드를 추출하기 위해서 Kim et al. (2015)의 방법을 변형하 여 사용하였다. 동결건조 처리된 방울토마토 시료 0.5 g을 50 mL 삼각플라스크에 넣고 EtOH 20 mL를 가한 후 75°C 항온수조에서 10분간 진탕 하였다. 80% (v/v) KOH 5 mL 를 넣고 다시 75°C 항온수조에서 10분간 진탕 한 후 5분 간 얼음에 방치하고 hexane 5 mL와 동량의 증류수를 가하 여 5분간 강하게 교반(stirring)하였다. 혼합액을 50 mL conical tube에 넣고 5°C, 3,000×g에서 3분간 원심분리한 후 상층액(hexane 층)을 회수하여 농축수기에 모았다. 방울 토마토의 카로티노이드를 완전히 추출하기 위하여 원심분 리 후 침전된 EtOH와 증류수 혼합액 층을 버리고 고형물 에 EtOH 10 mL를 넣고 진동혼합 한 후 75°C 항온수조에 서 10분간 진탕 하였다. 5분간 얼음에 방치하고 hexane 2.5 mL와 동량의 증류수를 가하여 강하게 진동혼합하여 원심분리 한 후 상층액을 회수하여 농축수기에 합하였다. 상기의 과정을 1회 더 반복하여 총 3회 추출한 후 상층액 을 농축수기에 모아 감압 농축기로 40°C에서 완전히 건조 하였다. 건조된 추출물에 dichloromethane:methanol (50:50, v/v) 용매 2 mL를 넣고 용해한 후 0.45 μm syringe filter (SLCR013NL, Merk Millipore Korea, Daejeon, Korea)를 사용하여 여과하여 lycopene 및 β-carotene을 분석하는데 사용하였다.
방울토마토의 lycopene 및 β-carotene 함량을 분석하기 위해서는 HPLC (Shimadzu Prominance LC-20A, Shimadzu, Kyoto, Japan)를 사용하여 분석하였다.
방울토마토 카로티노이드 추출액은 20 μL를 주입하였고 컬럼은 Inertsil ODS-3V (5 μm, 4.6-250 mm) HPLC column (GL Sciences Inc., Tokyo, Japan)을 사용하였으며, photodiode array detector (SPD-m20A, Shimadzu, Kyoto, Japan) 를 사용하여 검출하였다. 컬럼 온도는 30°C, 이동상은 acetonitrile/methnol/dichloromethane/n-hexane (50:40:5:5, v/ v/v/v)이었으며 유속은 1.0 mL/min이었다. Lycopene과 β- carotene 표준물질(Sigma-Aldrich Co., St. Louis, MO, USA) 을 사용하여 함량을 정량하였다.
방울토마토의 페놀성 화합물을 추출, 분석하기 위해서는 Kim & Ahn (2014)의 방법을 사용하였다. 동결건조 시료 100 mg을 25 mL volumetric flask에 넣고 80% (v/v) 메탄올 25 mL를 가하였다. 추출 효율을 높이기 위하여 혼합액을 초 음파 수조에 넣어 30°C에서 60분간 추출 한 후 Whatman No. 2 filter paper로 거르고 18,000×g에서 10분간 원심분 리하여 상등액을 회수하였다. 원심분리 상등액은 0.45 μm syringe filter (SLCR013NL, Merk Millipore Korea)로 여과 하여 분석 및 정량에 사용하였다.
페놀성 화합물의 분석 및 정량은 HPLC (Shimadzu Prominance LC-20A, Shimadzu)를 사용하였다. 시료 추출 여과 액 주입량은 20 μL였으며 컬럼은 Inertsil ODS-3V (5 μm, 4.6-250 mm) HPLC column (GL Sciences Inc.), 검출기는 photodiode array detector (SPD-m20A, Shimadzu)를 사용 하였다. 컬럼 온도는 30°C, 유속은 0.8 mL/min으로 유지하 였다. Mobile phase는 acetonitrile과 0.5% (v/v) formic acid 를 혼합하여 사용하였으며 시간별로 acetonitrile의 농도를 5% (0-5 min), 18% (5.1-30 min), 70% (30.1-90 min), 90% (90.1-100 min), 5% (100.1-120 min)로 조절하여 흘려주었다.
폴리페놀 성분의 함량을 정량하기 위해서는 5-caffeoylquinic acid (Sigma-Aldrich Co.) quercetin-3-rutinoside (Sigma- Aldrich Co.), naringenin chalcone (ChromaDex Inc., Irvine, CA, USA) 표준물질을 사용하여 함량을 정량하였다.
HPLC로 검출된 페놀성 화합물의 peak를 동정하기 위하 여 HPLC (Agilent Technologies 1200 series, Agilent Technologies, Santa Clara, CA, USA)가 연결된 3200Q Trap LC-MS/MS 시스템(Applied Biosystems Inc., Foster City, CA, USA)을 사용하였다.
1차 분리를 위한 HPLC분석조건, 즉 컬럼, mobile phase 및 농도구배, 유속, 검출기 등은 상기의 HPLC 분석조건과 같았다. LC-MS/MS의 분석조건은 m/z 160-1200 범위에서 negative ion mode로 분석하였으며 collision gas는 헬륨, 이온의 분리는 2 Da로 하였다. LC-MS/MS 분석 결과를 선 행연구 및 표준물질과 비교하여 미지의 페놀성 화합물의 peak를 동정하였다.
결과 및 고찰
국내산 방울토마토 3종의 lycopene 함량을 알아본 결과 는 Fig. 1과 같았다.

Qutiquti 품종과 Minichal 품종의 lycopene 함량은 각각 건조 중량 기준으로 69.40 mg/100 g, 69.07 mg/100 g으로 유 사하였다. 반면 Summerking 품종에서 38.52 mg/100 g이 함 유되어 있어 3종의 방울토마토 중 lycopene 함량이 가장 적 었다.
Erge & Karadeniz (2011)는 터키산 일반 토마토 16종의 lycopene을 분석한 결과 평균 16.4 mg/100 g이라고 보고하 였는데 이는 국내산 방울토마토에 비해 적은 함량이었다. Guil-Guerrero & Rebolloso-Fuentes (2009)는 스페인산 방 울토마토와 일반토마토의 lycopene 함량을 정량한 결과 방 울토마토에서 35 mg/100 g, 일반토마토에서 최대 39 mg/ 100 g의 lycopene이 함유되어 있음을 밝혔는데 이는 국내 산 방울토마토 Summerking에 함유된 lycopene 함량과 유 사하였다. 그리고 Kim et al. (2015)은 국내산 일반 토마토 와 방울토마토의 lycopene 함량을 정량한 결과 일반토마토 는 43.3 mg/100 g, 방울토마토는 42.2 mg/100 g의 lycopene 을 포함한다고 하였는데 본 연구에 사용된 Qutiquti 품종과 Minichal 품종의 lycopene 함량에 비해 다소 낮은 값이었다. 반면, Ilahy et al. (2011)은 튀니지산 일반토마토 중에서 lycopene을 고농도로 함유한 품종을 조사한 결과 lycopene 함량이 97-254 mg/100 g에 달하는 4가지 품종을 보고한 바 있는데 이는 국내산 방울토마토 Qutiquti 품종과 Minichal 품종의 lycopene 함량에 비해 1.4-3.6배 이상 많은 양이었 다. 이와 같은 결과는 토마토의 품종에 따른 차이뿐만 아 니라 수확 시기에 따른 차이에서 기인 한 것으로 판단되는 데 Gram et al. (1983)은 생육 단계에 따라 토마토의 색깔 변화와 lycopene의 함량 변화를 추적한 결과 개화 후 52일 이 경과하여 푸른색이 남아있는 미숙과에 비해 개화 후 60일이 경과하여 진한 붉은색을 띄는 완숙과의 lycopene의 함량이 4배 이상 많았다고 보고한 바 있다.
국내산 방울토마토의 β-carotene을 정량한 결과는 Fig. 2 와 같았다.
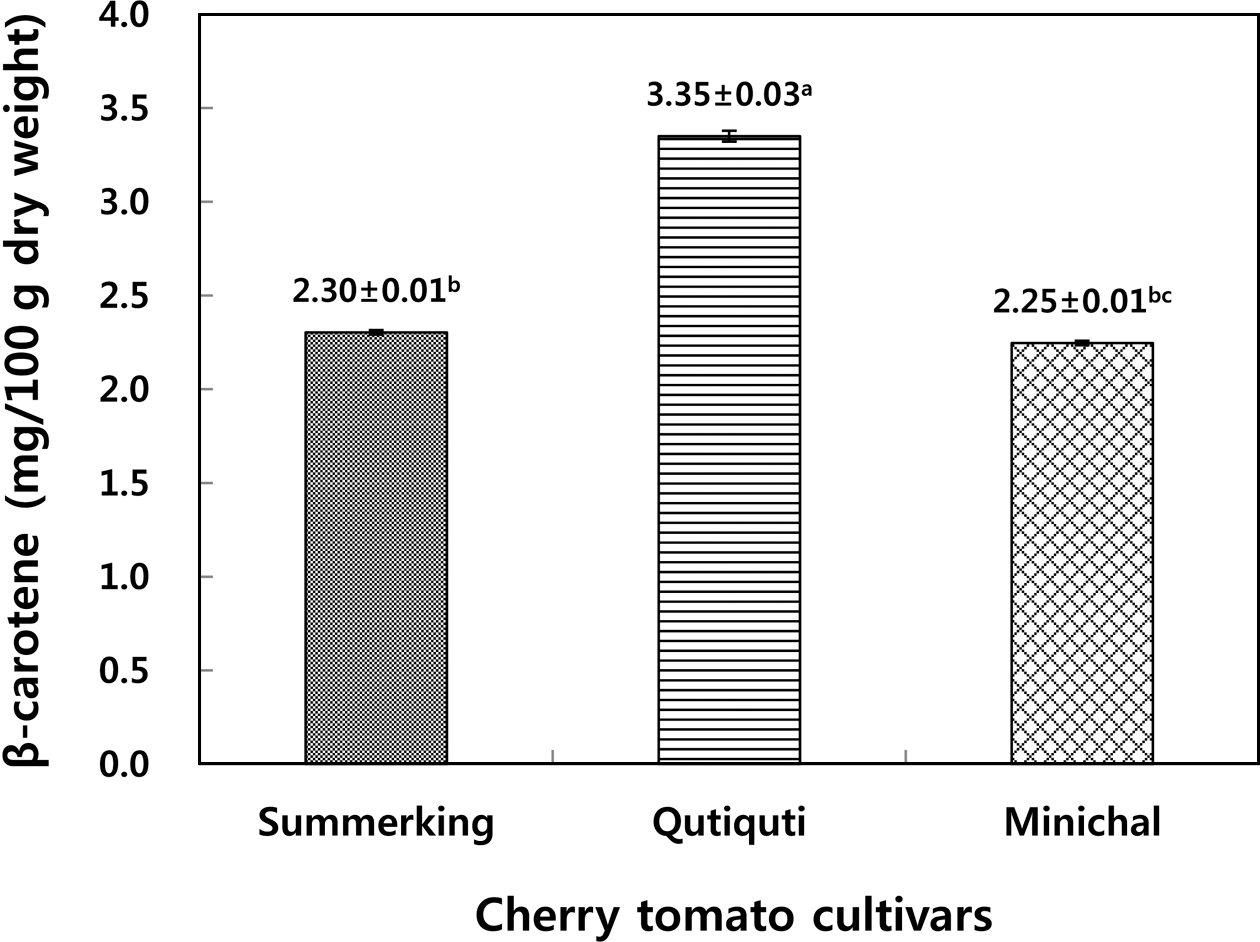
Summerking 품종과 Minichal 품종은 각각 2.30 mg/100 g, 2.25 mg/100 g의 β-carotene을 함유하고 있었고 Qutiquti 품 종은 3.35 mg/100 g을 함유하고 있어 3가지 품종 중 가장 많은 β-carotene 함량을 보였다.
Erge & Karadeniz (2011)은 터키산 일반 토마토 16종에 서 평균 3.0 mg/100 g의 β-carotene이 발견되었다고 하였는 데 본 연구에 사용한 국내산 방울토마토 3종의 평균 β- carotene 함량(2.63 mg/100 g)에 비해 다소 높은 값을 보였 다. Guil-Guerrero & Rebolloso-Fuentes (2009)는 스페인산 방울토마토에서 7.3 mg/100 g, 일반토마토에서 최대 5.6 mg/100 g의 β-carotene이 함유 되었다고 하였는데 국내산 방울토마토에 비해 높은 함량을 보였다. 또한, Kim et al. (2015)의 연구에 의하면 국내산 일반토마토에는 12.66 mg/ 100 g, 방울토마토는 7.46 mg/100 g의 β-carotene이 함유되 었음이 알려졌는데 본 연구를 통한 국내산 방울토마토 3종 의 평균 β-carotene 함량(2.63 mg/100 g)에 비해 상당히 높 은 함량을 보여 품종간 β-carotene 함량의 차이가 큼을 알 수 있었다. 이와 같이 생산지에 따라 β-carotene 함량이 차 이를 보이는 것은 토마토의 품종의 차이와 생육 단계(숙성 도)의 차이가 원인인 것으로 판단된다. Choi et al. (2010) 은 생육 단계별 토마토의 아미노산, β-carotene, chlorophyll 등의 함량을 정량한 결과 진한 붉은색을 띄는 완숙과에 비 해 푸른색이 남아 있는 미숙과가 β-carotene 함량이 더 높 음을 확인한 바 있다.
국내산 방울토마토 세가지 품종의 페놀성 화합물을 HPLC로 분리한 결과는 Fig. 3에 나타내었다. 방울토마토 추출액으로부터 단일 peak로 분리가 가능한 약 10개의 peak를 LC-MS/MS로 동정하여 보았다. 이 중 동정이 가능 한 10개의 peak를 Fig. 3에 표시하였고 Table 1에 동정 결 과를 나타내었다. 페놀성 화합물의 동정을 위해서는 190- 400 nm 범위에서 최대 흡광도 파장, MS에 의한 주이온인 [M-H]-의 m/z 값, MS/MS에 의한 ion fragment의 m/z 값 등을 활용하였고 선행 연구결과(Kim& Ahn, 2014)와 일 반 토마토 flavonoid의 LC-Mass spectrometry 결과(Moco et al., 2006)를 기본으로 기타 선행 연구를 참고하여 페놀 성 화합물을 동정하였다.
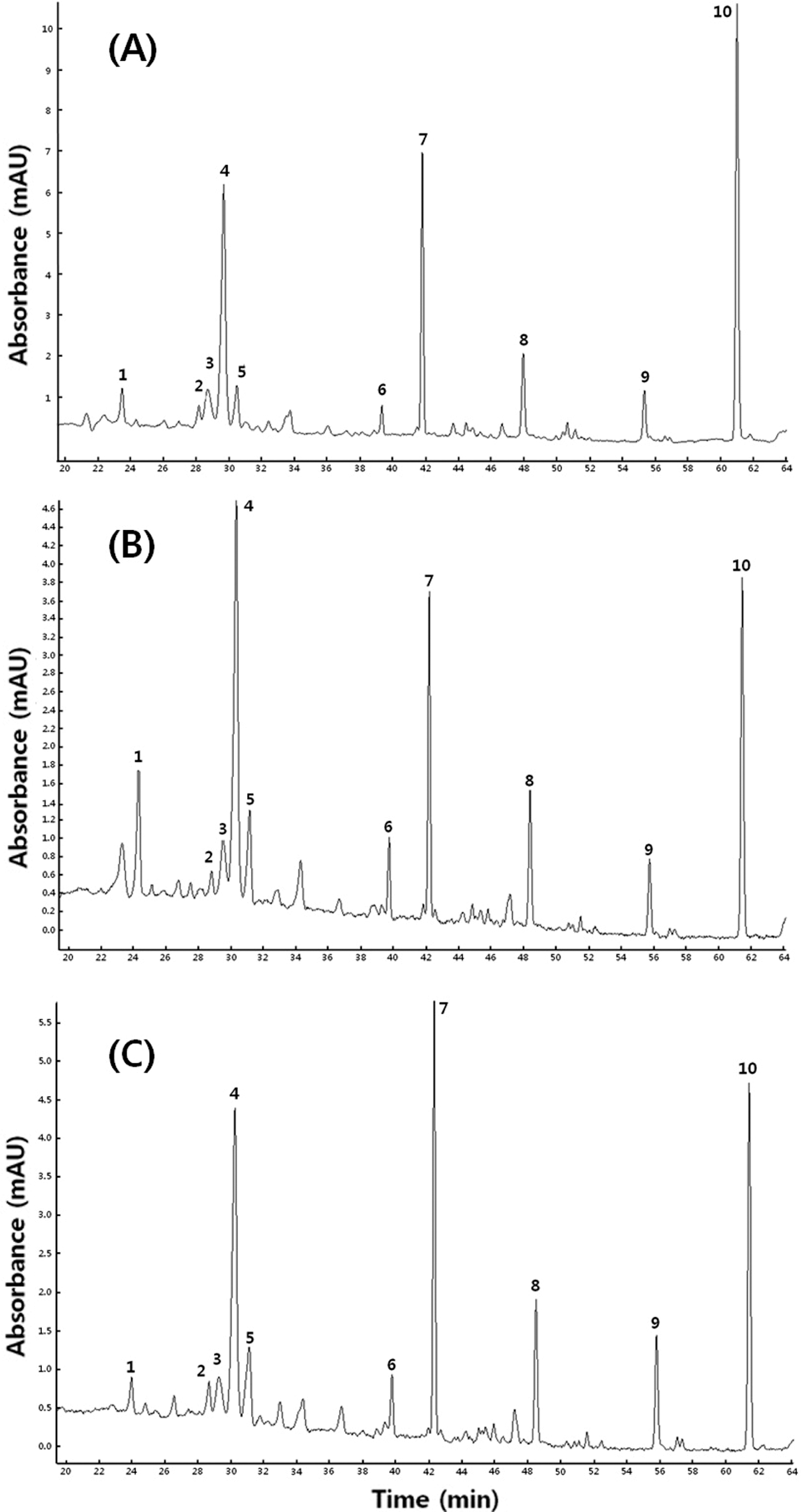
본 연구에서 peak 3, 4, 6, 7 및 10은 정확히 동정 할 수 있었으며 화합물의 구조를 Fig. 4에 제시하였다. Peak 3과 4는 최대 흡광도 파장이 248, 326 nm, 주이온([M-H]−)의 m/z 값이 353.3, MS/MS ion fragment의 m/z 값이 191로 동일 하여 이성질체로 추정하였다. 선행 연구(Ana et al., 2004)에 의하면 burr parsley로부터 peak 3, 4과 동일한 UV/Vis spectrum, 주이온 및 MS/MS의 m/z 값을 갖는 페놀성 화합 물이 분리되어 3-caffeoylquinic acid로 동정된 바 있다. 그 리고 Kim & Ahn (2014)은 방울토마토 Betatini 품종으로 부터 peak 3, 4와 동일한 최대 흡광도, 주이온 및 MS/MS 의 m/z 값을 갖는 물질을 분리하여 각각 3-caffeoylquinic acid와 5-caffeoylquinic acid로 동정하였다. Peak 3과 4를 구분하기 위하여 5-caffeoylquinic acid 표준품을 HPLC, LC-MASS로 확인한 결과 retention time, 최대 흡광도, 주 이온 및 MS/MS의 m/z 값이 peak 4와 일치하여 peak 4를 5-caffeoylquinic acid (5-CQA), peak 3을 3-caffeoylquinic acid (3-CQA)로 동정하였다.
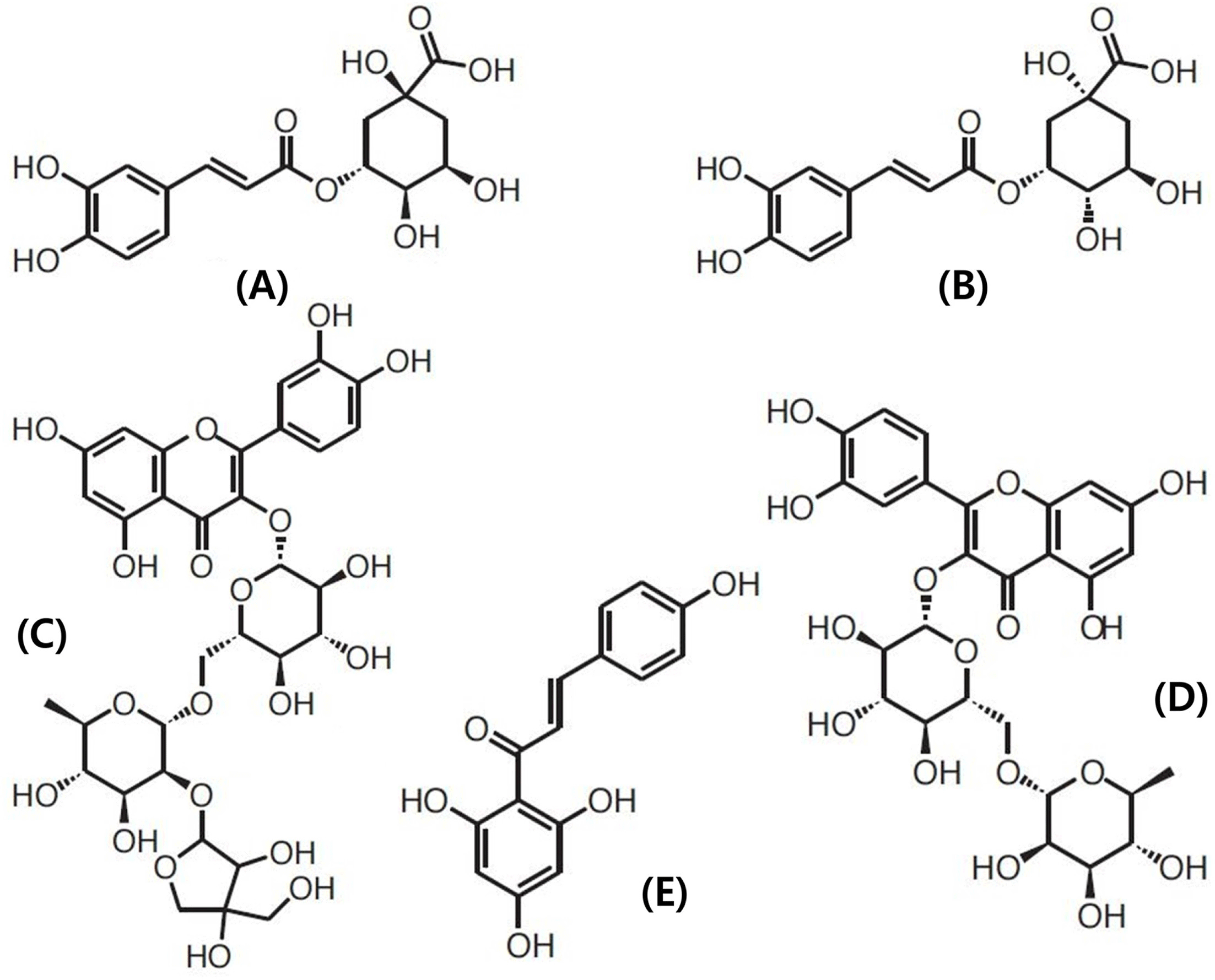
Peak 6은 최대 흡광도가 354, 254 nm, 주이온의 m/z 값 이 741, MS/MS ion fragment의 m/z 값이 301, 300이었다. Moco et al. (2006)은 일반 토마토로부터 주이온의 m/z 값 이 741, MS/MS ion fragment의 m/z 값이 301인 물질을 분리하여 quercetin-hexose-deoxyhexose-pentose (quercetin trisaccharide)로 동정하였고 Choi et al. (2010)도 동일한 물 질이 quercetin-3-apiosylrutinoside임을 확인한 바 있다. 따 라서 peak 6을 quercetin-3-apiosylrutinoside (Q-3-AR)로 동 정하였다.
Peak 7은 최대 흡광도와 MS/MS ion fragment의 m/z 값 이 peak 6과 일치하였으나 주이온의 값이 609.1로 분자량 이 서로 다른 물질임을 알 수 있었다. Choi et al. (2011) 은 대추로부터 peak 7과 최대 흡광도, 주이온의 m/z 값, MS/MS ion fragment의 m/z 값이 일치하는 물질을 분리하 여 quercetin-3-rutinoside (rutin)로 동정하였는데 peak 7은 peak 6인 quercetin-3-apiosylrutinoside에서 5탄당(pentose)이 유리된 물질이었다. 확인을 위하여 quercetin-3-rutinoside 표준물질을 사용하여 LC-MS/MS 분석을 시행한 결과 peak 7과 주이온의 m/z 값, MS/MS ion fragment의 m/z 값이 일치하여 peak 7을 quercetin-3-rutinoside (Q-3-R)로 동정하였다.
Peak 10은 최대 흡광도가 250, 366 nm, 주이온의 m/z 값 이 271, MS/MS ion fragment의 m/z 값이 151, 119이었는 데 Moco et al. (2006)은 일반 토마토로부터 주이온 및 MS/MS의 m/z 값이 일치하는 물질을 분리하여 naringenin chalcone으로 동정하였다. 확인을 위하여 naringenin chalcone 표준물질을 사용하여 LC-MS/MS 분석을 시행한 결 과 peak 10과 주이온의 m/z 값, MS/MS ion fragment의 m/z 값이 일치하여 peak 10을 naringenin chalcone (NGC) 로 동정하였다.
한편, peak 1, 2, 5, 8 및 9는 본 연구에서 정확히 동정 되지 않아 부분 동정하였다. Peak 1, 2는 주이온의 m/z 값 이 341로 일치하였으나 MS/MS ion fragment 패턴에 다소 차이가 있었으며 최대 흡광도가 서로 달랐다. 즉, 분자량은 같으나 화학구조에 차이가 있는 화합물이라 추정할 수 있었 다. MS/MS ion fragment의 m/z 값 중 179, 135는 caffeic acid의 고유한 MS/MS fragment로 알려져 있어(Moco et al., 2006) peak 1, 2 모두 caffeic acid의 유도체라고 판단 되었다. Moco et al. (2006)과 Mullen et al. (2007)은 일반 토마토와 과실 주스로부터 peak 1과 같은 주이온의 m/z 값, MS/MS ion fragment 패턴을 보이는 물질을 분리하여 caffeic acid-hexose라고 동정하였다. 따라서 본 연구에서도 hexose의 종류와 결합 위치는 알 수 없으나 peak 1을 caffeic acid-hexose isomer I (CHI)라고 부분 동정하였고 peak 2를 caffeic acid-hexose isomer II (CHI)로 부분 동정하였다.
Peak 5는 최대 흡광도가 248, 326 nm, 주이온의 m/z 값 이 353, MS/MS ion fragment의 m/z 값이 273, 204, 191 이었는데 주이온의 m/z 값과 최대 흡광도가 peak 3, 4와 같았다. 또한, MS/MS ion fragment의 m/z 값 중 191은 caffeoylquinic acid의 전형적인 특징이다. 즉, peak 5는 3- caffeoylquinic acid로 동정된 peak 3과 5-caffeoylquinic acid로 동정된 peak 4와 분자량은 같으나 결합 방식이 3- caffeoylquinic acid, 5-caffeoylquinic acid와는 다른 이성질 체임을 알 수 있었다. 따라서 peak 5를 caffeoylquinic acid isomer (CQAI)로 부분 동정하였다.
Peak 8과 9는 최대 흡광도가 250, 328 nm, 주이온의 m/ z 값이 각각 515, 677, MS/MS ion fragment의 m/z 값이 각각 354, 191, 179, 173, 135 및 353, 191, 173, 135를 보였는데 최대 흡광도가 peak 3, 4와 거의 같고 MS/MS ion fragment 중 m/z 값이 191인 ion fragment를 포함하고 있어 caffeoylquinic acid의 유도체로서 분자량이 다른 물질 이었다. Moco et al. (2006)과 Choi et al. (2010)은 일반토 마토로부터 Peak 8과 9와 최대 흡광도, LC-MS/MS 결과 가 거의 일치하는 물질을 분리하여 각각 di-caffeoylquinic acid와 tri-caffeoylquinic acid라 하였는데 본 연구에서도 결합 위치는 알 수 없으나 peak 8을 quinic acid에 2개의 caffeic acid가 결합한 di-caffeoylquinic acid (di-CQA), peak 9를 quinic acid에 3개의 caffeic acid가 결합한 tri-caffeoylquinic acid (tri-CQA)로 부분 동정하였다.
국내산 방울토마토에 포함된 페놀성 화합물의 함량은 Table 2와 같았다. 페놀성 화합물은 정확히 동정된 3- caffeoylquinic acid (3-CQA), 5-caffeoylquinic acid (5- CQA), quercetin-3-apiosylrutinoside (Q-3-AR), quercetin-3- rutinoside (Q-3-R), naringenin chalcone (NGC)에 대해 함 량을 정량하였다. 5-CQA, Q-3-R 및 NGC의 함량은 표준 물질을 사용하여 정량하였고 3-CQA의 함량은 5-CQA 표 준물질을, Q-3-AR의 함량은 Q-3-R 표준물질을 사용하여 측정하였다.
1) Abbreviations: 3-CQA, 3-caffeoylquinic acid; 5-CQA, 5-caffeoylquinic acid; Q-3-AR, quercetin-3-apiosylrutinoside; Q-3-R, quercetin-3-rutinoside; NGC, naringenin chalcone
국내산 방울토마토에서 분리, 동정된 성분 중 NGC이 가 장 많은 함량을 차지하였다. NGC는 알러지 억제효과 (Yamamoto et al., 2004; Iwamura et al., 2010), 염증억제 효과(Hirai et al., 2007), 비만억제 효과(Horiba et al., 2010) 등이 잘 알려진 생리활성 물질인데 국내산 방울토마 토에는 78.2-222.9 mg/100 g 수준으로 함유되어 있었다. 특 히, Summerking 품종에는 222.9 mg/100 g으로 매우 높은 농도의 NGC이 함유되어 있음이 밝혀져 NGC의 좋은 급 원임을 알 수 있었다. 그 다음으로 많은 함량을 차지한 페 놀성 물질은 rutin으로도 불리는 Q-3-R이었다.
Q-3-R은 항산화 효과(Metodiewa et al., 1997), 혈액응집 억제(Navarro-Núñez et al., 2008), 천식억제작용(Jung et al., 2007) 등 생리활성이 밝혀진 물질로 국내산 방울토마토 에 24.3-50.8 mg/100 g이 함유되어 있었다. 또한, 5-CQA 는 항산화 및 항스레스 효과(Iwai et al., 2004; Zhao et al., 2008), 항당뇨 및 항비만 효과(Boudielal et al., 2012; Liu et al., 2015), 항암 활성(Lee et al., 2014; Murad et al., 2015) 등이 밝혀진 생리활성 물질이다. 국내산 방울토마토 에는 5-CQA가 31.8-47.6 mg/100 g으로 Q-3-R와 비슷한 수 준으로 함유되어 있었다. 그 외에도 3-CQA와 Q-3-AR이 각각 2.2-3.4 mg/100 g과 6.1-7.3 mg/100 g으로 소량 함유되 어 있었다. 상기의 결과로 국내산 방울토마토는 lycopene, β-carotene뿐만 아니라 페놀성 화합물이 풍부하게 함유되어 있어 생리활성 물질의 좋은 급원임을 알 수 있었다.
요 약
본 연구는 국내에서 소비량이 증가하고 있는 방울토마토 의 식품소재로서의 가치를 규명하기 위하여 국내산 방울토 마토 세가지 품종(Summerking, Qutiquti, Minichal)에 대해 lycopene, β-carotene의 함량과 페놀성 화합물을 LC-MS/ MS로 분리, 동정하여 함량을 알아보았다.
Qutiquti 품종과 Minichal 품종의 lycopene은 각각 건조 중량 기준으로 69.40 mg/100 g과 69.07 mg/100 g이 함유되 어 있었고 Summerking 품종에는 38.52 mg/100 g이 함유되 어 있었다. β-Carotene을 정량한 결과 Summerking 품종과 Minichal 품종은 각각 2.30 mg/100 g과 2.25 mg/100 g을 함 유하고 있었고 Qutiquti 품종은 3.35 mg/100 g을 함유하고 있어 3가지 품종 중 가장 많은 β-carotene 함량을 보였다. 페놀성 화합물을 HPLC로 분리하고 LC-MS/MS로 동정한 결과 3-caffeoylquinic acid (5-CQA), 5-caffeoylquinic acid (3-CQA), quercetin-3-apiosylrutinoside (Q-3-AR), quercetin- 3-rutinoside (Q-3-R) 및 naringenin chalcone (NGC) 등 5가 지 화합물이 정확히 동정되었고 caffeic acid-hexose isomer 2종, caffeoylquinic acid isomer (CQAI), di-caffeoylquinic acid (di-CQA) 및 tri-caffeoylquinic acid (tri-CQA) 등 5종 의 화합물이 부분 동정되었다. 국내산 방울토마토에는 페 놀성 화합물 중에서는 공통적으로 NGC이 가장 많이 발견 되었는데 78.2-222.9 mg/100 g 수준으로 함유되어 있었다. 특히, Summerking 품종에는 222.9 mg/100 g으로 매우 높은 농도의 NGC이 함유되어 있었다. 또한, Q-3-R과 5-CQA도 각각 24.3-50.8 mg/100 g과 31.8-47.6 mg/100 g으로 상당량 함유되어 있었다. 본 연구의 결과로 볼 때 국내산 방울토 마토는 다양한 생리활성 물질을 포함하고 있어 생리활성 식품소재로서 활용 가치가 매우 높다고 할 수 있다.







