서 론
Glucansucrase (EC 2.4.1.5)는 glycoside hydrolase (GH) 70 family에 속하는 효소로, sucrose를 D-glucopyranose의 공 여체 분자로 이용해서 다양한 glucan과 glucooligosaccharide 의 합성을 촉매하고, maltose와 같은 수용체 분자의 존재 하에 고분자량 polymer 대신 저분자량 올리고당의 합성을 촉매한다(Kang et al., 2014;Shukla & Goyal, 2014). 이러 한 공여체와 수용체의 반응은 maltose나 isomaltose와 같은 수용체 분자의 존재 하에서 공여체 분자인 sucrose로부터 분해되어 나온 D-glucose가 수용체로 전달되어 중합도가 1 씩 증가되면서 올리고당이 생성된다(Patel & Goyal, 2011).
Oligosaccharide 합성에 관여하는 효소에는 glucansucrase 이외에 dextransucrase (EC 2.4.1.5), alternansucrase (EC 2.4. 1.140), mutansucrase (EC 2.4.1.5), reuternasucrase (EC 2.4. 1.5)가 있다(Heincke et al., 1999;Leemhuis et al., 2013). Dextransucrase는 glucose 사이의 α-1,6 결합이 50% 이상인 dextran을 합성하고, mutansucrase는 α-1,3 결합이 50%으로 구성된 mutan을 합성한다. Alternansucrase는 α-1,3 결합과 α-1,6 결합이 교대로 나타나는 alternan을 생합성하고, amylosucrase는 α-1,4 결합으로만 이루어진 amylose를 합성 한다(De Montalk et al., 2000;Côté et al., 2005;Joucla et al., 2006). 이러한 효소들은 glucosyltransferase (transglucosidase) 활성을 지니고 있어 난소화성 prebiotics 탄수화물인 galactooligosaccharide, oligoalternan 등의 올리고당을 효율적 으로 합성할 수 있으며, 생합성된 올리고당은 prebiotics로서 의 산업적 이용성이 높다(Naessens et al., 2005;Monsan & Ouarné, 2009;Lee et al., 2016).
Bindels et al. (2015)이 발표한 prebiotics의 정의는 ‘장관 내에 정착되어 건강에 이로움을 주는 세균의 증식을 촉진시 키는, 선택적으로 발효된 난소화성 식품소재 또는 물질’로 되어 있다. 이러한 prebiotics에는 대표적으로 fructooligosachharide, galactooligosaccharide, isomaltooligosaccharide, cyclooligosccharide 등이 알려져 있다. 올리고당은 에너지원 이나 감미료로 식품에 적용되고, 그 외에도 사료, 제약 분 야, 화장품산업에서 안정제로서 이용되기도 한다(Remaud- Simeon et al., 2000;Lee et al., 2016). 그 중 식품에 이용 될 수 있는 올리고당은 prebiotics로서 인체에 좋은 영향을 주는 연구가 많이 되어 있는데, 장 기능 향상, 유용 미생물 의 성장 촉진, 유해 미생물의 성장 저해, 단쇄 지방산 농도 증가, 총 콜레스테롤 및 LDL 콜레스테롤 감소 등의 효과 를 나타낸다(Putaala et al., 2011;Costabile et al., 2012).
Glucansucrase는 주로 유산균이 생산하는데, Leuconostoc, Lactobacillus, Streptococcus, Weissella spp. 등이 생산한다고 보고되어 있다(Wenham et al., 1981;Johansson et al., 2016;Song et al., 2016;Heng et al., 2017). 현재까지 Leu. mesenteroides가 생산하는 glucansucrase 연구는 많이 보고되 어 있으나, Leu. lactis의 glucansucrase에 대한 연구는 거의 이루어지고 있지 않은 실정이다.
본 연구에서는 전통 발효식품으로부터 glucansucrase 활 성을 지니는 유산균주를 분리한 후 균주 특성 및 효소 활 성을 확인하였고, 선정한 균주를 이용하여 올리고당 생성 을 위한 최적 조건을 조사하였다.
재료 및 방법
Glucansucrase 활성을 지니는 유산균주를 분리하기 위하 여 국내 21개 지역의 재래시장에서 판매하는 김치나 젓갈 과 같은 발효식품, 과채류 등 총 123종류의 식품을 구입하 여 유산균주를 분리하였다. 구입한 식품 10 g에 10배수의 0.88% (w/v) NaCl 용액을 첨가하여 균질화한 후, PES agar plate (2% (w/v)의 sucrose가 첨가된 phenylethyl alcohol agar plate (Becton, Dickinson and Company, Franklin Lakes, NJ, USA)에 도말하여 30°C에서 48시간 배양하여 점질성 을 띄는 colony를 선별하였다. 선별한 균주는 BCP plate count agar (Kisan Bio, Seoul, Korea)에 순수 배양한 후 배양액을 20% (v/v)의 glycerol (Duksan, Seoul, Korea)과 혼합하여 -80°C에 동결보존하여 사용하였다. 표준균주로 사용된 Leu. mesenteroides KCCM 35471은 (사)한국종균 협회 부설 한국미생물보존센터(Seoul, Korea)에서 분양 받 아 사용하였다.
유산균주가 생산하는 glucansucrase 활성을 측정하기 위 하여 LM 배지(Kim & Robyt, 1995)에 2% (w/v)의 glucose 를 첨가하여 종배양액으로 사용하였고, 같은 배지에 glucose 대신 2% (w/v)의 sucrose를 첨가하여 본 배양액으로 사용 하였다. 유산균주의 종배양액을 본 배양액에 2% (v/v)가 되도록 접종한 후 30°C에서 24시간 배양하여 27,237×g로 5분간 원심분리하여 얻어진 상등액을 효소활성 측정을 위 한 조효소액으로 사용하였다. Glucansucrase 효소 활성 측 정은 Yamaner et al. (2010)의 방법을 수정하여 측정하였다. 기질로 사용한 450 μL의 150mM sucrose (in 25mM acetate buffer, pH 5.4)에 조효소액 50 μL를 첨가한 후 30°C에서 20분간 효소 반응을 진행하였다. 효소 반응 직후, 생성된 환 원당의 함량을 Somogyi-Nelson 방법(Nelson, 1944;Somogyi, 1952)으로 정량하여 효소 활성을 측정하였다. 효소 활성 계 산을 위한 표준곡선은 0-1 μmol의 D-fructose 이용하여 작성 하였으며, 효소 1 unit은 주어진 조건에서 분당 1 μmol의 D-fructose를 생성할 수 있는 효소의 양으로 정의하였다.
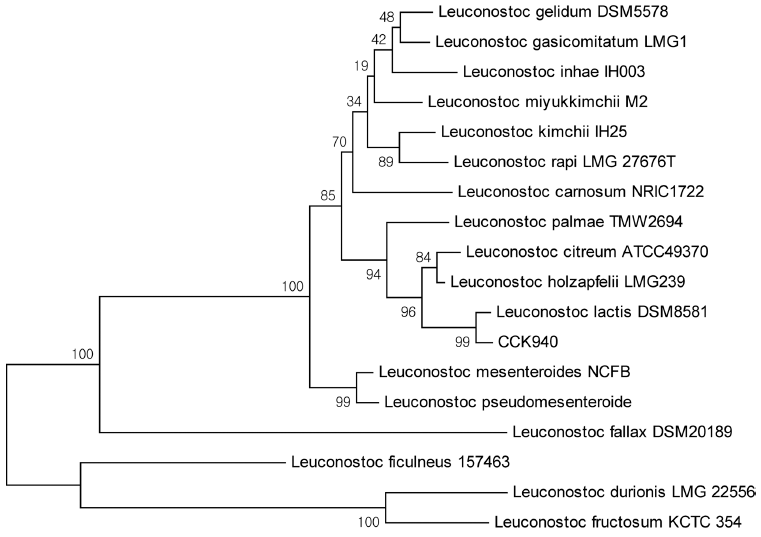
유산균주의 동정을 위하여 유산균주를 MRS 배지 (Becton, Dickinson and Company)에 배양한 후 배양액으 로부터 세포를 수확한 다음 AccuPrep Genomic DNA Extraction kit (Bioneer, Daejeon, Korea)를 이용하여 제조 사의 방법에 따라 genomic DNA를 분리하였다. 분리된 유 산균주의 genomic DNA를 16S rRNA 유전자 염기서열 결 정에 사용하는 universal primer인 27F (5'-AGA GTT TGA TCM TGG CTC AG-3')와 1492R (5'-TAC GGY TAC CTT GTT ACG ACTT-3') primer를 사용하여 polymerase chain reaction (PCR, MyCycler, BIO-RAD, Hercules, CA, USA)을 수행하였다. 증폭된 PCR 산물은 Wizard SV Gel and PCR clean-up system (Promega, Fitchburg, WI, USA)을 이용하여 정제하였다. 정제된 PCR 산물은 Bioneer (Daejeon, Korea)에 의뢰하여 ABI PRISM 3700 DNA Analyzer로 염기서열을 분석하였다. 그 결과는 BLASTN 프로그램(https://blast.ncbi.nlm.nih.gov/Blast.cgi)을 이용하여 GenBank (https://www.ncbi.nlm.nih.gov/genbank) 의 ribosomal DNA 염기서열과 비교하였으며, 염기서열의 상동성은 ClustalX 2.1 프로그램(version 2.1, Larkin et al., 2007)으로 분석하였고 Mega 6 프로그램(version 6, Tamura et al., 2013)을 이용하여 phylogenetic tree를 작성하였다.
유산균의 종배양액은 2% (w/v)의 glucose를 첨가한 LM 배지를 사용하여 37°C에서 18시간 배양하였고, 올리고당 생산 배지에 1% (v/v) 접종하였다. 공여체 분자로 사용한 sucrose와 수용체 분자로 사용한 maltose의 농도를 설정하 기 위하여 glucose가 첨가되지 않은 LM 배지에 sucrose와 maltose를 1:1 비율로 하여 각각 2.5, 5.0, 10.0, 20.0% (w/ v) 농도로 첨가하여 생성된 올리고당을 확인하였고, 1 N NaOH와 1 N HCl을 이용하여 pH를 6, 7, 8로 매 시간 조 정하면서 올리고당 생성의 최적 공여체 분자와 수용체 분 자의 농도 및 최적 pH를 설정하였다. 또한 sucrose와 maltose의 농도비를 각각 2:1, 1:1, 1:2로 조정하여 공여체 분자와 수용체 분자의 농도비를 최적화하였고, 수용체 분 자로서 maltose, melibiose, fructose를 각각 첨가하여 올리 고당 생성을 위한 최적 수용체 분자를 선정하였다.
올리고당의 중합도(degree of polymerization, DP) 분석을 위해 유산균주 배양액을 27,237×g에서 2분간 원심분리한 상등액을 사용하였고, 배양 상등액을 CarboPac PA-100 column (4×250 mm)과 CarboPac PA-100 guard column (4×50 mm)을 장착한 Bio-LC (DX 500 Chromatography System, Dionex, Sunnyvale, CA, USA)를 이용하여 high performance anion exchange chromatography (HPAEC) 법 으로 분석하였다. 검출기는 pulsed amperometric detector (PAD, ED50, Dionex, Sunnyvale, CA, USA)를 사용하였으 며, 1.0mL/min의 유속으로 진행하였다. 올리고당 분리를 위 한 이동상으로는 최초 20분까지는 150 mM NaOH를, 20- 25분까지는 150 mM NaOH:600 mM sodium acetate (in 150 mM NaOH)를 60:40에서 0:100의 농도구배를 걸어준 후, 25-40분까지는 150 mM NaOH를 사용하였다. 시료는 10 μL를 주입하였으며 표준당으로는 glucose의 중합체(DP 1-7)를 Carbosynth사(Berkshire, UK)에서 구입하여 사용하 였다.
결과 및 고찰
Glucansucrase를 생산하는 유산균주의 분리를 위해서 국 내 21개 지역의 재래시장에서 판매하는 각종 식품을 구입 하였다. 총 김치 54종, 과채류 32종, 젓갈류 26종, 장류 7 종, 막걸리 4종을 수집하여 각 식품 내에 존재하는 유산균 주를 분리하였다. 수집한 시료 내에 존재하는 유산균주 중 PES agar plate에서 점질성을 나타내는 141균주를 분리하 였고, 이 중 glucansucrase 활성을 나타내는 균주는 23균주 로 확인되었다. 또한 본 연구실에서 보유하고 있는 유산균 주 중 PES agar plate에서 점질성은 나타내는 균주는 185 균주로 확인되었고, glucansucrase 활성을 나타내는 균주는 37균주로 확인되었다. 이들의 분리원으로는 무, 양파, 부추, 당근이나 포도 등으로 다양하였으나, 특히 김치에 분리된 균주들의 효소활성이 높게 측정되었다(결과 미제시). 본 연 구에서 표준 균주로 사용한 Leu. mesenteroides KCCM 35471의 glucansucrase 활성은 123.3 mU/mL를 나타내었다. 점질성을 나타내고 glucansucrase 활성이 높은 분리 유산균 주 중에서 배추김치에서 분리된 CCK940 균주가 glucansucrase 활성이 918.2 mU/mL로 가장 높았기 때문에 본 연구 의 올리고당 생성 균주로 선발하여 균주 동정 및 올리고당 생성 최적화 연구를 진행하였다.
선정한 유산균주 CCK940의 16S rRNA 유전자 염기서 열을 결정한 후 이를 이용하여 phylogenetic tree를 작성한 결과 Leuconostoc lactis DSM8581과 99%의 상동성을 보여 가장 높은 유사성을 나타내었기 때문에 본 균주를 Leu. lactis CCK940으로 동정 명명하였다(Fig. 1). Moon et al. (2015)의 연구에서는 김치에서 분리된 Leu. lactis EFEL005 가 sucrose 대사에 관련이 있는 glucansucrase, invertase, sucrose phosphorylase 등의 유전자를 지닌 것으로 분석하 여 본 연구의 균주와 유사한 특성을 지니고 있었다.
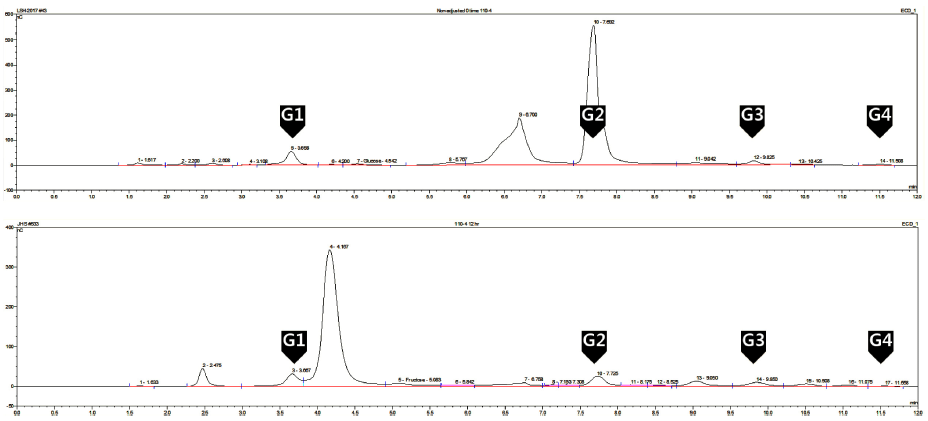
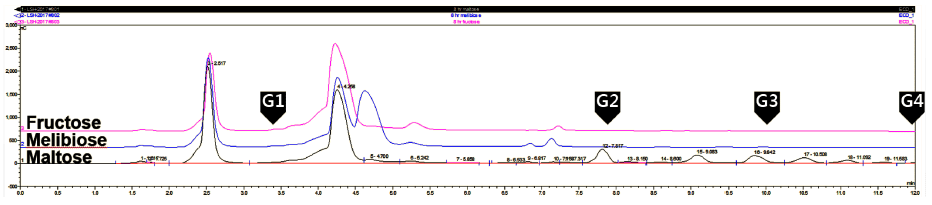
선정된 Leu. lactis CCK940 균주를 이용하여 올리고당 생성의 최적 조건을 확립하였다. Sucrose와 maltose가 각각 20% (w/v) 첨가된 LM 배지에 Leu. lactis CCK940 종배양 액을 1% (v/v) 접종하여 30°C에서 130 rpm으로 배양하였 다. 접종 후 5-12시간 동안 매 시간 pH 6.5±0.1이 되도록 1 N NaOH를 사용하여 조정하였고, 12시간 배양 후 배양 상등액 중의 당 성분을 Bio-LC로 확인하였다. 균주를 배양 하기 전 배지를 분석한 결과 sucrose는 retention time 6.7 분에, maltose는 DP 2의 위치인 7.6분에 나타났다(Fig. 2). Leu. lactis CCK940 배양 후 12시간에서의 배양 상등액에 서는 sucrose와 maltose peak가 사라졌고, glucansucrase 작 용에 의해 sucrose가 분해되어 glucose (retention time 3.6 분)와 fructose (retention time 4.1분)가 생성되었다. 또한 retention time 7.7분 이후부터 DP 2-4의 범위에서 4개의 peak들이 생성되어 균주에 의해 sucrose와 fructose로부터 여러 올리고당이 생성됨이 확인되었다.
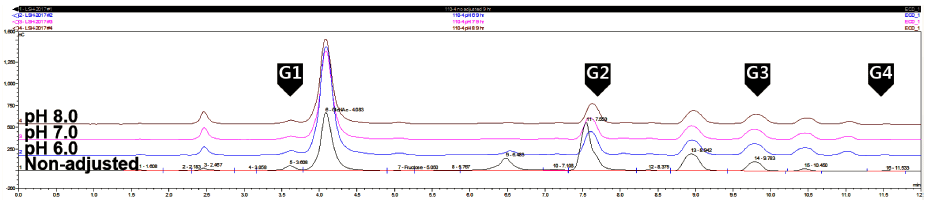
유산균 배양 시 균주가 생산하는 유산 등과 같은 유기산 에 의해 배양액의 pH는 배양시간이 지남에 따라 감소하고, 이 경우 효소활성이 저해를 받아 올리고당 생산이 저하되 기 때문에 올리고당의 효율적인 생산을 위해서는 배양액의 pH가 저하되지 않도록 하여야 한다 (Tsuchiya et al., 1952;Veljković et al., 1992). 따라서 올리고당 생성을 위한 배지 의 최적 pH를 조사하기 위하여 LM 배지에 sucrose와 maltose를 각각 20% (w/v) 첨가한 후, 배지의 pH를 각각 6, 7, 8로 조정한 다음 Leu. lactis CCK940의 종배양액 1% (v/v)을 접종하였다. 접종 후 매 시간 배양액의 pH를 각각 6, 7, 8로 조정하면서 30°C에서 130 rpm으로 9시간 동안 배양한 다음 배양 상등액의 당 분석을 수행하였다. 그 결과 Fig. 3에 나타난 바와 같이 DP 2-4의 범위 내에 서 총 4개의 peak를 확인할 수 있었다. pH 6으로 조정한 배지에서 fructose (retention time 4.1분)가 가장 높은 농도 로 관찰되었는데, 이는 glucansucrase의 활성으로 sucrose로 부터 분해되어 생성되었다. 생성된 올리고당 중에서 DP 3- 4 사이에 생성된 올리고당(retention time 10.5분)을 본 연 구의 지표물질로 정하여 해당 올리고당 peak의 상대 면적 을 확인한 결과 pH 조정을 하지 않은 것은 4.1, pH를 6, 7, 8로 조정한 것은 각각 23.8, 17.7, 17.8로 나타나 pH 6 이 올리고당 생성에 최적인 것으로 확인되었다. Kim et al. (2010)의 연구에서는 김치에서 분리 정제된 Leu. lactis EG001 glucansucrase의 효소 활성을 위한 최적 pH가 5.0 이라 보고하였고, Kim & Robyt (1995)는 dextransucrase를 생산하는 Leu. mesenteroides B-742의 돌연변이주의 최적 효소 생산 pH 범위는 5.5-5.8로 보고하여, 본 연구 결과의 최적 pH가 6인 결과와 유사하였다.
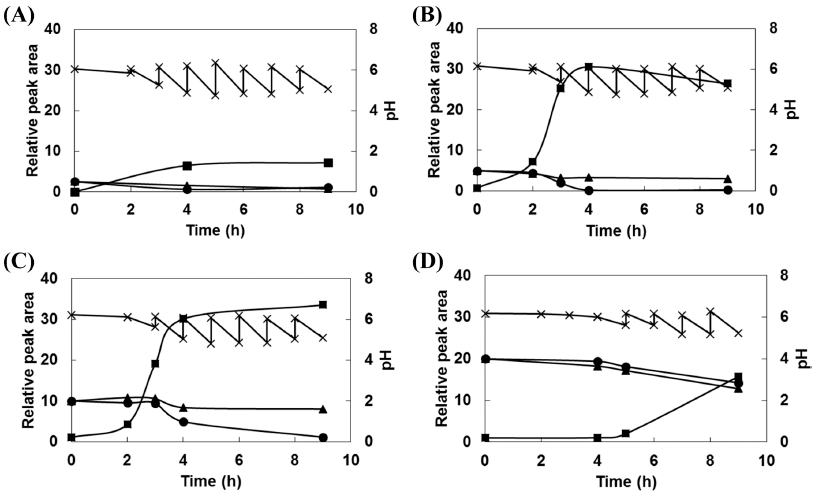
올리고당 생성을 위한 공여체 분자와 수용체 분자의 최 적 농도를 선정하기 위하여 LM 배지에 공여체 분자인 sucrose와 수용체 분자인 maltose를 각각 2.5, 5.0, 10.0, 20.0% (w/v)씩의 농도가 되도록 첨가한 후 유산균주의 종 배양액을 1% (v/v) 접종한 다음 30°C에서 130 rpm으로 9 시간 동안 배양하였다. 각 시간대 별 배양 상등액을 Bio- LC로 분석하여 sucrose, maltose, DP 3-4 사이의 올리고당 peak의 상대 면적을 분석하였다(Fig. 4). 그 결과, sucrose 와 maltose를 2.5% (w/v)씩 첨가하였을 경우, 배양 4시간 이내에 일정량 소모되어 각각 0.6, 1.6% (w/v)가 잔존하였 고, 올리고당은 배양 4시간 이후 더 이상 증가하지 않고 일정하게 유지되었다(Fig. 4A). Sucrose와 maltose를 20% (w/v)씩 첨가하였을 경우에는, 배양 4시간째에 각각 19.4, 18.2%가 잔존해있었고, 올리고당의 생성은 배양 5시간 이 후부터 개시되어 올리고당 생성속도가 느린 것으로 나타났 다(Fig. 4D). Sucrose와 maltose를 5% 첨가하였을 때, 배양 4시간만에 sucrose를 모두 소모하였고, 소모된 sucrose로 인하여 공여체의 부재로 더 이상의 올리고당 생성은 일어 나지 않았다(Fig. 4B). 10%의 sucrose와 maltose를 첨가한 결과도 5%의 결과와 유사하였는데, 배양 4시간에 sucrose 의 농도가 반으로 줄었고, 9시간에는 거의 소모되어 올리 고당이 더 이상 생성되지 않았다(Fig. 4C). 이러한 결과에 따라 소모되는 sucrose를 초기 농도와 같은 농도로 첨가해 주면 더 많은 올리고당의 생성이 이루어질 것으로 판단하 였다. Seo et al. (2007)은 85% (w/v) 이상 고농도의 sucrose에서 Leu. mesenteroides NRRL B-512FMCM을 배 양하였을 때, isomaltose를 비롯하여 sucrose의 isomer인 palatinose와 leucrose가 생성된다고 보고하였고, Robyt & Eklund (1983)의 연구에서는 dextransucrase 활성을 지니는 Leu. mesenteroides B-512F를 이용하여 공여체 분자로 sucrose를 사용하고 수용체 분자로 maltose, isomaltose, nigerose, turanose, lactose, cellobiose, melibiose, D-fructose 등을 사용할 경우 공여체 분자와 수용체 분자의 비율을 1:1로 하여 2.7%씩 첨가하였을 때 maltose를 수용체 분자 로 사용하는 것이 올리고당 생성에 가장 좋은 것으로 나타 났다.
공여체와 수용체의 효소 반응기내 비율은 만들어지는 올 리고당의 중합도와 수율에 큰 영향을 주기 때문에, 상기 결과를 기반으로 배지 내의 공여체 분자인 sucrose의 농도 는 5% (w/v)으로 고정하고, 수용체 분자인 maltose의 농도 를 달리하여 sucrose와 maltose의 최적 농도비를 조사하였 다. Maltose는 5%의 sucrose가 첨가된 LM 배지에 2.5, 5.0, 10.0% (w/v) 농도로 각각 첨가하였고, pH는 매 시간 pH 6.0±0.1로 조정하였다. 또한 배양 4, 8시간에는 sucrose 를 5% (w/v)의 농도가 되도록 추가하였다(Fig. 5). 초기 maltose 첨가량이 2.5% (w/v)일 경우, maltose는 배양 8시 간 내에 모두 소비되었고, DP 3-4 사이에 존재하는 올리 고당 peak의 상대 면적은 8시간까지 17.78까지 증가했다가 이후 12시간에는 6.08로 감소하였다(Fig. 5A). Maltose의 초기 농도가 5% (w/v)일 때, 배양 8시간째에 maltose는 거 의 소비되어 0.8% (w/v)가 잔존하였고, 이 때 공여체인 sucrose를 첨가하여도 수용체의 부재로 인하여 올리고당 추 가 생성은 관찰되지 않았다(Fig. 5B). Maltose의 초기 농도 를 10% (w/v)로 하였을 경우, 배양 12시간에 maltose가 1.5% 잔존하였고, 올리고당의 생성은 지속되어 peak의 상 대 면적이 maltose 초기 농도가 2.5% (w/v)나 5% (w/v)인 경우보다 높았다(Fig. 5C). 따라서 올리고당을 생산하기 위 한 최적 조건으로는 sucrose와 maltose의 초기 농도를 각 각 5% (w/v)와 10% (w/v)로 첨가한 후 배양 4시간과 8시 간째에 sucrose를 5% (w/v) 첨가하는 것으로 확인되었다. Leu. mesenteroides NRRL B-512F는 sucrose와 maltose의 비율이 2:1 (10%:5%)이었을 때, DP 3-9에 해당하는 isomaltooligosaccharide를 생성하는 glucose 대비 수율이 91.5 로 나타났다(Lee et al., 2008). Iliev et al. (2008)은 glucosyltransferase 활성을 지니는 Leu. mesenteroides Lm 28 의 돌연변이주를 이용하여 sucrose와 maltose의 비율을 2:1 과 7:1로 하였을 때, 생성된 올리고당의 농도는 2:1의 비율 에서 가장 높았다.
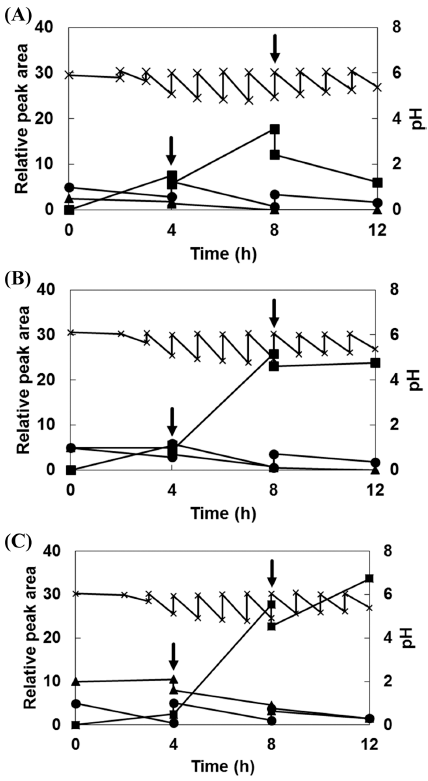
Glucansucrase에 이용되는 수용체에는 maltose가 가장 많 이 이용되지만 여러 종류의 수용체가 존재하는데, maltose, melibiose, mannose, panose, isomaltose, fructose, raffinose, leucrose, galactose 등이 수용체 분자로 이용될 수 있다 (Koepsell et al., 1952). Leu. lactis CCK940 배양 시 공여 체로서 5% (w/v) sucrose를 첨가하고 수용체로서 maltose, melibiose, fructose를 각각 3% (w/v) 첨가하였을 경우, 배 양 8시간째에 생성되는 올리고당을 Bio-LC로 확인하였다 (Fig. 6). 그 결과 수용체로서 maltose의 존재 시 DP 2-4 범위 내에서 총 4개의 peak가 검출되었으나, melibiose나 fructose를 수용체로 이용하였을 경우에는 올리고당 생성을 확인할 수 없었다. 따라서 Leu. lactis CCK940은 올리고당 생성을 위한 수용체로 조사한 수용체 당류 중에서 maltose 만을 이용하는 것으로 확인되었다. Maltose와 isomaltose는 수용체로서 가장 좋은 당 중 하나이며, 올리고당 생산물의 가장 많은 부분을 차지한다고 보고되어 있다(Côté et al., 1982). Seo et al. (2007)의 연구에서는 sucrose를 고농도 첨 가하였을 경우 sucrose가 공여체와 수용체로 동시에 사용되 어 올리고당의 중합도가 2-11로 증가한 연구결과가 보고되 었다. 수용체 반응은 단순하게 당의 형태 뿐만 아니라, hydroquinone-glucoside, hydroquinone-fructoside, epigallocatechin gallate glycoside, L-DOPA α-glycosides를 이용하 여 올리고당이 형성되는 연구결과도 보고되고 있다(Moon et al., 2006;Seo et al., 2009;Kang et al., 2009;Yoon et al., 2010). 본 연구결과 Leu. lactis CCK940는 sucrose와 maltose를 이용하여 DP 2-4 사이의 중합도를 지니는 올리 고당을 최소 4종류 생산하는 것으로 확인되었다. 향후 생 산된 올리고당의 당쇄 결합의 형태 등 구조분석에 대한 연 구가 필요할 것으로 판단된다.
요 약
국내 재래시장에서 수집한 발효식품 등에서 우수한 glucansucrase 활성을 나타내는 유산균주를 분리한 후 이 균주를 이용한 올리고당 생성의 최적 조건을 조사하였다. 배추김치로부터 분리된 유산균주 CCK940은 glucansucrase 활성이 918.2 mU/mL로 가장 높아 본 올리고당 생산을 위 한 균주로 선정하였고, Leu. lactis CCK940로 동정 및 명 명되었다. 선정된 Leu. lactis CCK940는 배지의 pH를 6.0 으로 조정하고 공여체인 sucrose와 수용체인 maltose의 초 기 농도를 각각 5% (w/v)와 10% (w/v)로 첨가한 후 배양 4시간과 8시간째에 sucrose를 5% (w/v) 첨가하는 것이 최 적인 것으로 확인되었다. 최적 조건에 12시간 배양 시 Leu. lactis CCK940는 중합도가 2-4인 올리고당을 최소 4 종류 생성하였다. 본 균주는 수용체 분자로서 fructose와 melibiose를 사용할 수 없었다.







