Article
간세포 독성과 에탄올 대사에서 추출 조건에 따른 다슬기 추출물의 효과
조경환, 추호진1, 서민균1, 김종철, 신유진, 류기형2, 조희영3, 정치영3, 하영술3,*
Effect of Semisulcospira libertina Extracts from Different Extraction Processes on Liver Cell Toxicity and Ethanol Metabolism
Kyoung Hwan Cho, Ho Jin Choo1, Min Gyun Seo1, Jong Cheol Kim, Yu Jin Shin, Gi Hyung Ryu2, Hee Young Cho3, Chi-Young Jeong3, Young-Sool Hah3,*
Author Information & Copyright ▼
3경상대학교 의과대학 외과학교실, 건강과학연구원, 경상대학교병원 의생명연구원
Institute of Hadong Green Tea
2Department of Food Science and Technology, Kongju National University
3Department of Surgery, Gyeongsang National University School of Medicine, Institute of Health Sciences, Biomedical Research Institute, Gyeongsang National University Hospital
*Corresponding author: Young-Sool Ha, Department of Surgery, Gyeongsang National University School of Medicine, Institute of Health Sciences, Biomedical Research Institute, Gyeongsang National University Hospital, Jinju 52828, Korea+82-55-750-9266, +82-55-750-9255
yshah@gnu.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Apr 24, 2017; Revised: May 18, 2017; Accepted: May 19, 2017
Abstract
Although Semisulcospira libertina is generally regarded as a supplement for the alleviation of alcohol hangover, little is known about its effects on cell metabolism. Therefore, this study was conducted to analyze the constituents of the extracts prepared using different extraction methods and to compare their biochemical properties. The amino acid contents were found to be much higher in acidic and enzymatic hydrolysates than hot water extracts from S. libertina. DPPH radical scavenging activities in acidic and enzymatic hydrolysates were higher than those of hot water extracts. Three types of S. libertina hydrolysate was added to HepG2 cells damaged by acetaminophen (AAP), after which the survival rate of HepG2 cell were measured. In addition, lactate dehydrogenase (LDH) activities in the culture media were evaluated. The survival rates of HepG2 cells were 77.0±4.3% and 81.5±1.3% at 3 h and 5h enzymatic hydrolysates, respectively. These cell survival rates were higher compared to those of the negative control group (67.8±4.3%) treated only with acetaminophen. Cellular toxicities induced by treatment with AAP were also significantly alleviated in response to treatment with the extracts of S. libertina. In addition, the activities of 2 key enzymes that metabolize ethanol, alcohol dehydrogenase and aldehyde dehydrogenase, were upregulated by 4.7- and 2.7-fold respectively in response to treatment with a 3 h enzymatic hydrolysate of S. libertina. Taken together, these results provide biochemical evidence of the method by which S. libertina exerts its biological functions, including the alleviation of alcohol hangover and the protection of liver cells against toxic insults.
Keywords: Semisulcospira libertina extract; hangover relieving effect; hepatoprotective; blood acetaldehyde concentration; aldehyde dehydrogenase
서 론
알코올 섭취는 지방산의 베타-산화(beta-oxidation) 경로 를 억제하여 간세포 내 트리글리세롤을 축적하여 지방간을 유발한다(Grunnet & Kondrup, 1986). 더욱이, 만성 알코올 섭취는 시토크롬 P-450 2E1 (CYP2E1)의 생성을 유도(Wu & Cederbaum, 1999)하여 산화스트레스를 일으켜(Di Luzio & Hartman, 1967) 신체의 주요기관인 간을 손상시킬 뿐만 아니라, 뇌, 췌장, 조혈기관, 면역계 등 체내 대사과정에 매 우 치명적인 영향을 준다(Linder et al., 1991; Hwang et al., 2010). 체내에 흡수된 알코올은 25% 정도는 위에서 흡 수되며, 나머지는 소장에서 흡수되고, 혈액을 통해 최종적으 로 간에서 분해된다(Lin & Li, 1998). 간에는 알코올 대사 에 관여하는 두 가지 중요한 효소인 alcohol dehydrogenase (ADH)와 CYP2E1이 있다(Lieber, 1997). 간에서의 알코 올 대사는 alcohol dehydrogenase (ADH) pathway와 소 포체(Endoplasmic Reticulum; ER)에 존재하는 microsomal ethanol oxidizing pathway 그리고 퍼옥시좀 내의 catalase pathway로 세 가지 경로를 통해 이루어진다(Lieber, 1997).
적당한 양의 섭취된 알코올은 간세포 내 세포질의 ADH 에 의하여 아세트알데히드와 NADH로 분해가 되고 아세 트알데히드는 다시 분해효소인 acetaldehyde dehydrogenase (ALDH)와 만나 아세트산과 물로 분해되어 소변이나 땀으 로 빠져나가거나 폐에서 호흡과정을 거쳐 탄산가스로 배출 된다(Lieber, 1994). 그러나 과음을 할 경우, ADH의 작용 에 의해 생성된 NADH가 지방산 대사를 저하시켜 지방간 을 유발하고(Glueck et al., 1980), ADH에 의해 분해되지 못하고 남은 알코올은 에탄올에 의해 유도된 CYP2E1에 의해 아세트알데히드로 분해될 뿐 아니라 oxygen radical을 생성하여 지질과산화물을 만든다(Mezey, 1980; Lieber, 1997). 그 결과 low-density lipoprotein (LDL)이 free radical 의 공격을 받아 생성된 과산화물이 세포 안에 축적되어 간 세포막을 파괴, 효소 비활성화 및 DNA 복구율 감소를 초 래한다(Morel et al., 1984; Heineckem, 1987). 또한, 체내 높은 농도의 아세트알데히드는 맥박의 증가, 식은땀, 메스 꺼움, 구토 등의 숙취현상을 나타낸다(Eriksson, 2001). 그 러므로, 음주로 인하여 야기되는 숙취나 질병을 경감시키 기 위한 연구가 활발히 진행되고 있다.
다슬기(Semisulcospira libertina)는 하천이나 호수 등지에 서 흔히 볼 수 있는 다슬기과(Pleuroceridae)에 속하는 흔한 연체동물로 동의보감 및 본초강목에서 간염, 간경화, 지방간 등의 치료 및 개선에 이용되어 왔으며, 숙취해소와 신경통 완화, 빈혈증세 완화, 골다공증의 예방과 치료에 이용되어 왔다고 알려져 있다. 다슬기에 대한 연구로는 식품학적 성 분 및 품질 특성에 관하여 보고되었고(Lim et al., 2009), 다 슬기 추출물에는 십이지장의 근수축 활성물질 및 혈관이완 활성물질이 존재한다는 보고가 있다(Cha & Bail, 1999). 다 슬기 추출물의 생리활성으로는 항산화 활성, 혈압상승 억제, 간세포손상 억제 등이 보고되어 있지만(Lee et al., 2005; Kim et al., 2009), 다슬기 추출 조건에 따른 항산화 활성, 알코올 분해효소 활성 조절, 간세포 독성 및 숙취해소 효과 등의 관련 연구는 부족한 편이다. 따라서 본 연구에서는 추 출 조건에 따른 다슬기 추출물의 항산화 능력, 아세트아미 노펜(acetaminophen, AAP) 처리에 의해 유도된 간독성에 대한 보호효과 및 ADH와 ALDH 효소 활성에 미치는 영 향을 in vitro에서 분석하였고, 이를 알코올과 함께 백서에 투여하였을 때 나타나는 혈중 독성 중간대사산물인 아세트 알데히드를 정량하여 알코올 섭취 후 나타나는 숙취해소에 대한 효능을 규명하고자 하였다.
재료 및 방법
실험재료 및 추출물 제조
본 실험에서 사용된 다슬기는 ㈜정옥(Hadong, Korea)에 서 제공받아 사용하였다. 추출물은 다슬기 과육 100 g에 대 하여 5배수의 용매(증류수)를 첨가하여 water bath (JSEB- 60T; JS Research Ich, Gongju, Korea)에서 추출하였다. 대 조군인 열수추출물은 97°C에서 1시간 추출하였고, 효소추 출물은 alcalase 2.4L 0.5%을 첨가하여 60°C에서 각각 1, 3, 5시간 추출하였다. 또한, 산추출물은 용매로 2 N HCl을 사용하여 1, 3, 5시간 추출하였으며, 효소-산추출물은 alcalase 2.4 L 0.5%을 첨가하여 60°C에서 3시간 추출 후 동량의 2 N HCl을 첨가하여 1, 3, 5시간 추출하였다. 이들 추출물은 80 mesh체로 슬러지를 제거하여 여과지(whatman No. 2)로 여과한 후 감압농축기(Loborota 20 Control; Heidolph, Schwabach, Germany)로 농축하여 동결 건조한 후 4°C로 보관하면서 실험에 사용하였다.
유리 아미노산 조성 분석
시료 0.1 g에 증류수 10 mL을 첨가하여 추출한 후 여과 하고 여과액에 5-sulfosalicylic acid dihydrate를 1 mL 가한 후 4°C 냉장고에서 24시간 동안 방치하여 단백질을 침전 시켰다. 이들 시료는 4,000 rpm으로 15분간 원심분리하여 상층액을 40°C 이하에서 감압농축기(Eyela N-1100V-W; Tokyo Rikakikai Co. Ltd, Tokyo, Japan)를 이용하여 농축 시킨 후 0.2M의 lithium citrate loading buffer (pH 2.2)를 5mL 첨가하여 용해하고, 0.2 membrane filter로 여과하여 130 μL를 아미노산분석기(S7130 Amino acid reagent organizer; Sykam Co. Ltd., Gilching, Germany)로 분석하 였고, UV/VIS detector 400 nm (1.00 AU)와 570 nm (1.00 AU)로 검출하였다.
2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거능 측정
DPPH 라디칼 소거활성은 Blois 방법(Blois, 1958)에 따 라 측정하였다. 0.01% DPPH-methanol 용액에 동량의 시 료 추출물을 혼합하여 암소에서 10분간 반응시킨 후 517 nm에서 흡광도를 측정하여 DPPH 라디칼 소거 활성은 시 료 무첨가군에 대한 시료 첨가군의 흡광도 비율(%)로 나 타내었다. 양성대조군은 ascorbic acid (Sigma-Aldrich Inc., St. Louis, MO, USA)를 사용하였다.
2,2’-azinobis-(3-ethylbenzothiazoline-6-sulphonic acid) (ABTS) 라디칼 소거능 측정
ABTS 라디칼 소거능 측정은 Re et al. (1999)의 방법에 따라, 7 mM ABTs 용액에 potassium persulfate를 2.4 mM 이 되도록 용해시켜 암실에서 12-16시간 동안 반응시킨 후 414 nm에서 흡광도 값이 약 1.5가 되도록 증류수로 조정하 여 사용하였다. 조정된 ABTS 용액에 각 시료 추출원액을 1mL씩 가하여 10초간 잘 혼합한 다음 실온에서 10분간 반응시켜 414 nm에서 흡광도를 측정하였으며, ABTS 라디 칼 소거능은 시료 무첨가군에 대한 시료 첨가군의 흡광도 비율(%)로 나타내었다. 양성대조군은 trolox (Calbiochem, Darmstadt, Germany)를 사용하였다.
세포생존율 및 세포 독성 시험
인간 간암 세포인 HepG2 세포는 10% (v/v) Fetal Bovine Serum (FBS; Gibco, Carlsbad, CA, USA), 1% (v/v) penicillinstreptomycin (Gibco)을 첨가한 RPMI-1640 배지(Gibco)로 37°C, 5% CO2가 유지되도록 배양하였다. 배양된 세포는 2-3일 간격으로 계대 배양하여 실험에 사용하였다. 세포생 존율을 측정하기 위하여 Cell Counting Kit-8 (CCK-8; Dojindo, Kumamoto, Japan)을 사용하여 아세트아미노펜 (acetaminophen, AAP) (Sigma-Aldrich Inc., St. Louis, MO, USA)을 통한 간세포 독성 유도 실험을 수행하였다. 즉 96-well plate에 세포 농도 1×104 cells/well로 분주한 다음 세포부착을 위해 24시간 배양한 후 AAP와 다양한 조건으 로 추출된 다슬기 추출물을 처리하여 세포생존율을 확인하 였다. 또한, 세포독성 측정을 위한 실험으로 세포가 괴사 (necrosis)를 일으키면 LDH의 분비가 증가되는 것을 이용하 였다. HepG2 세포를 상기와 같은 조건으로 배양한 후 LDH 활성 측정은 EZ-LDH Cytotoxicity assay kit (DoGen, Seoul, Korea)을 사용하여 측정하였다. 원심분리기를 이용 하여 배지 중에 부유해 있는 세포를 침전시키고 상층액을 새로운 96-well plate로 옮기고 LDH 반응액을 제조하여 각 well에 첨가하고 섞어준 다음 상온에서 30분간 반응시 키고 microplate reader (VersaMax; Molecular Devices, Sunnyvale, CA, USA)에서 450 nm 흡광도를 측정하여 세 포독성을 계산하였다.
ADH/ALDH 활성 측정
동물실험을 수행하기 위하여 경상대학교 동물실험윤리위 원회에서 승인(GNU-161004-M0056)을 받았으며, 규정에 따라 동물실험에 관한 윤리 과정을 준수하여 연구를 진행 하였다. 6주령 C57BL/6 마우스에 졸레틸50 (Virbac, Paris, France)과 럼푼(Bayelkorea Co., Seoul, Korea)을 8:2로 섞은 후 10배 희석하여 몸무게에 따라 복강주사로 마취(10 μL/ 10 g)시킨 후 개복하여 간문맥에 주사기 바늘을 삽입하여 고정한 다음, 전관류액을 관류시켜 혈액을 제거한 간조직은 마우스 liver dissociation kit (Miltenyi Biotec, Cambridge, MA, USA)을 사용하여 간세포를 분리하였다. 분리한 간세포 를 William E washing media (Gibco, Carlsbad, CA, USA) 로 2번 수세 후 원심분리하여 세포를 회수한 후 trypan blue 염색액(Gibco)으로 염색하여 살아있는 간세포를 계수하였 다. 분리한 간세포 4×106개를 William E culture media (Gibco)를 포함하는 세포배양접시(10 cm)에 seeding 하고 37°C CO2 배양기에서 배양하였다(Shen et al., 2012). 일차 배양한 간세포 추출액을 효소원으로 사용하여 ADH와 ALDH 효소 활성을 측정하였다. ADH는 alcohol dehydrogenase detection kit (Abcam, Cambridge, MA, USA)을 사 용하여 측정하였다. 효소반응액과 다슬기 추출물을 섞어 37°C에서 3분 반응시킨 후 450 nm에서 흡광도를 측정(A0) 한 이후 kinetic method를 사용하여 37°C에서 5분 간격으 로 30분까지 450 nm에서 흡광도를 측정(A1)하였다. ΔOD= A1-A0 값을 계산하여 NADH 표준곡선에서 반응시간(ΔT= T2-T1) 동안 ADH에 의해 생성된 NADH량 B값을 계산하 고, 다음 식에 대입하여 ADH 활성을 계산하였다.
ALDH는 ALDH activity assay kit (Abcam, Cambridge, MA, USA)을 사용하여 상기 ADH 측정 방법과 동일하게 측정하였다.
실험동물 및 처치
실험동물은 (주)오리엔트 바이오(Seongnam, Korea)로부 터 구입한 SD계 6주령 흰쥐(180-200 g)를 사용하였다. 동 물은 일정한 온도와 규칙적인 조명이 자동으로 조절되는 동물실에서 사육되었고 사료와 음수가 자유롭게 공급되었 으며 일주일간의 적응기간을 거친 후 본 실험에 사용하였 다. 실험군은 대조군과 투여군으로 크게 나누고, 알코올을 경구투여 하기 전 18시간 동안 절식시켰다. 알코올 경구투 여 1시간 전에 대조군에는 식염수 10 mL/kg을, 투여군에는 다슬기 효소-산추출물을 500 mg/kg 또는 1,000 mg/kg로 경 구투여 하였다. 1시간 뒤 실험 군 모두에 40% 에탄올을 10 mL/kg씩 1회 경구투여 하였다. 시간 경과에 따른 혈중 알코올 농도와 아세트알데히드 농도 변화를 측정하기 위해 알코올 경구투여 1, 2, 4시간 후에 미정맥에서 채혈한 혈 액을 3,000 rpm에서 20분간 원심분리 하여 혈중 아세트알 데하이드 농도 분석용으로 사용하였다.
혈중 아세트알데하이드 정량
Aldehyde의 정량은 aldehyde quantification assay kit (Abcam, Cambridge, MA, USA)를 사용하여 측정하였다. 분리된 혈청(50 μL)에 2× yellow reaction mixture (50 μL) 를 가한 후 실온에서 30분 incubation 후에 나타나는 발색 도를 550 nm에서 측정하였다. 측정된 흡광도를 aldehyde 표준곡선에 대입하여 aldehyde의 농도(μmol)를 측정하였다. 표준곡선은 10 mM aldehyde 표준용액을 1,000, 300, 100, 30, 10, 3, 1, 0.3, 0 μM로 희석하여 상기와 동일한 방법으 로 흡광도를 측정하여 작성하였다.
통계분석
모든 실험은 3회 반복 실시하여 mean±SD 또는 mean±SE 로 나타내었다. 실험군 간의 유의성은 SAS version 9.1 (SAS Institute Inc., Cary, NC, USA)를 이용하여 분산분석 (ANOVA)과 Duncan의 다중범위검증(multiple-range test), 및 반복측정자료의 분산분석(repeated measures ANOVA)으 로 유의성 검증(p<0.05)을 실시하였다.
결과 및 고찰
유리 아미노산 조성
다슬기 열수추출물, 산추추물, 효소추출물, 효소-산추출물 의 유리아미노산 함량을 분석한 결과는 Table 1과 같다. 총 유리아미노산 농도는 추출시간이 증가함에 따라 유의적 으로 증가하는 경향을 보였다. 특히 산추출물의 경우 총 유 리아미노산의 함량은 시간에 따라 각각 12.6717, 21.4334, 24.0384 mg/mL로 1.0253 mg/mL인 열수추출물과 비교하여 12-23배 이상 총 유리아미노산 농도가 증가하였다. 알코올 분해를 촉진하는 아스파라긴산 함량은 1시간 열수추출물과 비교하였을 때 5시간 효소추출물과 효소-산추출물은 각각 약 121배, 103배 증가하였다. 간장의 해독작용을 강화해주 며, 알코올을 분해하는 과정에서 많이 소모되는 비타민 B1 의 흡수를 돕고 체내 독소중화작용을 도와 간장을 보호해 과음에 의한 간 손상을 예방하는 데 탁월한 역할을 하는 글루탐산은 1시간 열수추출물과 비교하여 5시간 산추출물, 효소-산추출물, 효소추출물 순으로 각각 약 34배, 21.5배, 10배의 함량 증가를 보였다. 필수아미노산 중 황 함유 아 미노산인 메티오닌의 함량은 열수추출물과 비교하여 5시간 산추출물에서 약 88배 이상의 함량 증가를 보였다. 지금까 지 아미노산류 중에서 주로 아스파탐산, 아스파라긴, 글리 신 및 글루탐산이 간 보호 효과와 알코올 대사에 관련이 있는 것으로 보고 되었으며(Park, 1993; Iimuro et at., 1996; Yin et al., 1998; Hwang et al., 2004) 또한, 아르기 닌과 메티오닌이 알코올 대사에 관련된 ADH와 ALDH 효 소 활성을 촉진시키는 작용이 있어 숙취해소 효과는 물론 간 보호 효과도 동시에 있을 것으로 시사 되어 진다(Cha et al., 2009).
Table 1.
Compositions of free amino acids in Semisulcospira libertina extract (unit: mg/mL)
| No |
Amino acids |
Acidic extraction |
Enzymatic extraction |
Enzymatic & acidic extraction |
|
|
|
| 1 h |
3 h |
5 h |
1 h |
3 h |
5 h |
1 h |
3 h |
5 h |
| 1 |
O-Phospho-L-serine |
0.3400±0.0004 |
0.4584±0.0001 |
0.4467±0.0004 |
0.1700±0.0001 |
0.1900±0.0001 |
0.1217±0.0001 |
0.1367±0.0001 |
0.0584±0.0401 |
0.0700±0.0066 |
| 2 |
Taurine |
- |
- |
- |
- |
- |
- |
- |
- |
0.0034 |
| 3 |
O-Phosphoethanolamine |
- |
- |
- |
- |
- |
- |
- |
0.0017±0.0001 |
0.0050±0.0001 |
| 4 |
Urea |
0.0184±0.0001 |
0.0100±0.0001 |
0.0167±0.0002 |
0.0267±0.0001 |
0.0100±0.0001 |
0.0384±0.0001 |
0.0117±0.0001 |
0.0050±0.0001 |
0.0100±0.0001 |
| 5 |
L-Aspartic Acid |
0.2934±0.0011 |
0.6784±0.0089 |
0.7717±0.0025 |
0.3450±0.0001 |
1.7934±0.0251 |
3.6367±0.2933 |
0.5434±0.0491 |
1.7150±0.0970 |
3.1000±0.8062 |
| 6 |
L-Threonine |
0.3600±0.0003 |
0.6417±0.0113 |
0.7700±0.0013 |
0.0100±0.0001 |
0.1084±0.0501 |
0.1550±0.0055 |
0.1080±0.0180 |
0.1850±0.0064 |
0.3317±0.0197 |
| 7 |
L-Serine |
0.2984±0.0004 |
0.5267±0.0299 |
0.6417±0.0038 |
0.1417±0.0032 |
0.0650±0.0001 |
0.4400±0.0046 |
0.1817±0.0461 |
0.3350±0.0980 |
0.5917±0.0636 |
| 8 |
L-Asparagine |
0.4334±0.00046 |
0.8367±0.0001 |
0.8400±0.0262 |
0.0217±0.0001 |
0.1350±0.0025 |
0.0800±0.0060 |
0.0517±0.0468 |
0.0467±0.0001 |
0.0300±0.0024 |
| 9 |
L-Glutamic Acid |
1.9717±0.0520 |
3.5967±0.0049 |
3.7684±0.1336 |
0.0734±0.0001 |
0.7717±0.0011 |
1.1300±0.0899 |
0.8567±0.0594 |
1.4050±0.0849 |
2.3700±0.0959 |
| 10 |
Theanine |
0.1384±0.0029 |
0.0517±0.0001 |
0.1017±0.0023 |
0.0167±0.0001 |
0.0784±0.0001 |
0.0484±0.0050 |
0.0567±0.0014 |
0.0984±0.0001 |
0.0400±0.0005 |
| 11 |
D,L-α-Aminoadipic acid |
0.0600±0.0041 |
0.1067±0.0001 |
0.1184±0.0091 |
0.0317±0.0001 |
0.0900±0.0001 |
0.1234±0.0002 |
0.0834±0.0.38 |
0.1384±0.0095 |
0.1250±0.0262 |
| 12 |
Glycine |
0.1184±0.0027 |
0.1834±0.02010 |
0.2250±0.0021 |
0.1117±0.0022 |
0.6317±0.0265 |
1.0350±0.0099 |
0.1750±0.0068 |
0.5667±0.0001 |
1.0617±0.0496 |
| 13 |
L-Alanine |
0.5200±0.0121 |
0.8467±0.0050 |
1.0184±0.0011 |
0.0634±0.0013 |
0.0317±0.0001 |
0.0767±0.0010 |
0.1984±0.0049 |
0.4567±0.0956 |
0.8434±0.0055 |
| 14 |
L-α-Amino-n-butyric acid |
0.0234±0.0001 |
0.0450±0.0001 |
0.0600±0.0005 |
0.0084±0.0001 |
0.0317±0.0001 |
0.0767±0.0001 |
0.0384±0.0001 |
0.0634±0.0001 |
0.1034±0.0001 |
| 15 |
L-Valine |
0.4067±0.0001 |
0.7184±0.0226 |
0.8550±0.0001 |
- |
0.0484±0.0001 |
0.0417±0.0001 |
0.0550±0.0001 |
0.0450±0.0001 |
0.1034±0.0001 |
| 16 |
L-Cystine |
0.0850±0.0001 |
- |
0.1984±0.0040 |
- |
- |
- |
0.1817±0.0095 |
0.1817±0.0001 |
0.1500±0.0056 |
| 17 |
L-Methionine |
0.4350±0.0072 |
0.7767±0.0078 |
0.8817±0.0096 |
0.0250±0.0050 |
0.2050±0.0562 |
0.2134±0.0001 |
0.1634±0.0001 |
0.2117±0.0001 |
0.3450±0.0405 |
| 18 |
L-Isoleucine |
0.2984±0.0046 |
0.5300±0.0088 |
0.6100±0.0052 |
0.0134±0.0001 |
0.0167±0.0029 |
0.0867±0.0001 |
0.0167±0.0001 |
0.0317±0.0001 |
0.0267±0.0080 |
| 19 |
L-Leucine |
2.4967±0.0411 |
4.0100±0.2107 |
4.2534±0.3106 |
0.0150±0.0001 |
0.4367±0.0064 |
0.3367±0.0001 |
0.4650±0.0094 |
0.5567±0.0001 |
0.8667±0.0965 |
| 20 |
L-Tyrosine |
0.3617±0.0011 |
0.6584±0.0028 |
0.8434±0.0066 |
0.0267±0.0001 |
0.1517±0.0058 |
0.1367±0.0011 |
0.1334±0.0195 |
0.1767±0.0001 |
0.3384±0.0231 |
| 21 |
L-Phenylalanine |
0.3800±0.0020 |
0.7617±0.0019 |
0.9717±0.0065 |
0.0050±0.0001 |
0.1334±0.0037 |
0.1334±0.0098 |
0.1067±0.0641 |
0.1600±0.0001 |
0.2767±0.0131 |
| 22 |
b-Alanine |
0.2100±0.0042 |
0.3750±0.0083 |
0.4317±0.0001 |
- |
- |
0.0067±0.0076 |
0.0534±0.0010 |
0.0667±0.0025 |
0.0900±0.0401 |
| 23 |
D,L-β-Aminoisobutyric acid |
1.4550±0.0705 |
2.4184±0.0816 |
2.6217±0.0356 |
0.0584±0.0001 |
0.3467±0.0200 |
0.3584±0.0040 |
0.4567±0.0001 |
0.4634±0.0950 |
0.5934±0.0495 |
| 24 |
4-Amino-n-butyric acid |
0.0734±0.0002 |
0.1434±0.0002 |
0.1200±0.0062 |
0.0234±0.0001 |
0.0634±0.0094 |
0.0567±0.0066 |
0.0150±0.0001 |
0.0350±0.0046 |
0.0550±0.0160 |
| 25 |
L-Histidine |
0.2000±0.0590 |
0.3534±0.0181 |
0.3834±0.0861 |
0.0050±0.0001 |
0.0417±0.0011 |
0.0517±0.0010 |
0.0500±0.0026 |
0.0684±0.0001 |
0.1284±0.0462 |
| 26 |
1-Methyl-L-histidine |
0.0134±0.0078 |
0.0217±0.0.020 |
0.0300±0.0004 |
- |
0.0034±0.0001 |
0.0200±0.0032 |
0.0084±0.0001 |
0.0167±0.0001 |
0.0250±0.0501 |
| 27 |
3-Methyl-L-histidine |
- |
0.0100±0.0065 |
- |
- |
0.0034±0.0001 |
- |
0.0067±0.0001 |
0.0100±0.0051 |
0.0200±0.0028 |
| 28 |
L-Carnosine |
0.4167±0.0492 |
0.6734±0.0602 |
0.7800±0.0028 |
0.0517±0.0001 |
0.0884±0.0001 |
0.2034±0.0095 |
0.1250±0.0404 |
0.1167±0.0408 |
0.1750±0.0490 |
| 29 |
L-Ornithine- monohydrochloride |
0.2550±0.0898 |
0.2784±0.0032 |
0.3767±0.0026 |
- |
0.0250±0.0050 |
0.1100±0.0809 |
0.0434±0.0032 |
0.0617±0.0095 |
0.0884±0.0060 |
| 30 |
L-Lysine |
0.2950±0.0195 |
0.5200±0.0001 |
0.5967±0.0048 |
0.0317±0.0001 |
0.0850±0.0150 |
0.2967±0.0019 |
0.1084±0.0068 |
0.2134±0.0001 |
0.4300±0.0048 |
| 31 |
Ammonium Chloride |
0.0984±0.0048 |
0.1267±0.0084 |
0.1500±0.0062 |
0.3617±0.0658 |
0.4200±0.0615 |
0.3784±0.0094 |
0.2717±0.0025 |
0.2084±0.0001 |
0.2084±0.0064 |
| 32 |
L-Arginine |
0.6167±0.0948 |
1.0767±0.1500 |
1.1467±0.0849 |
0.0984±0.0059 |
0.2584±0.0026 |
0.2917±0.0782 |
0.1884±0.0044 |
0.2867±0.0001 |
0.5784±0.0821 |
|
|
Totals |
12.6717±0.9941 |
21.4334±0.8011 |
24.0284±0.0268 |
1.7350±0.0101 |
6.7117±0.0620 |
10.201±0.0907 |
4.8900±0.2051 |
7.9850±0.8021 |
13.1834±0.5201 |
Download Excel Table
항산화 활성
본 실험에서는 대표적인 활성 산소종인 라디칼에 대한 소거능으로 항산화력을 측정하였다. 보라색을 나타내는 DPPH는 분자 내에 안정한 라디칼을 함유하지만, 항산화 활성이 있는 물질과 만나면 라디칼이 소거되며 노란빛을 띄게 된다. 이때의 DPPH의 거동은 ·OH와 유사하며, 반응 의 정도는 항산화제의 수소 공여능에 의존한다. 이런 DPPH 라디칼을 이용하여 일정량의 시료 용액과의 반응에 의하여 DPPH 라디칼이 감소하는 정도를 흡광도로 측정하 여 시료의 항산화 활성을 측정하는 방법을 사용하여 다슬 기 열수추출물, 산추추물, 효소추출물, 효소-산추출물의 항 산화능을 비교하였다. 시료의 농도를 1-10 mg/mL으로 조 절하여 DPPH 라디칼 소거능을 측정한 결과를 Table 2에 나타내었다. 추출시간이 증가함에 따라 DPPH 라디칼 소거 활성 또한 증가하였으며, 산, 효소를 활용하였을 경우 일반 적인 열수추출물보다 높은 항산화 활성을 나타내었다. 특 히, 효소와 산을 모두 사용하여 추출한 경우 시간이 증가 함에 따라 항산화 활성 또한 급격히 증가하였다.
Table 2.
DPPH radical scavenging activity of Semisulcospira libertina extract at various extraction conditions
| Extraction methods |
Extraction times (h) |
DPPH RSA1) (%) |
| Hot water extraction |
1 |
0.33±0.06 |
| Acidic extraction |
1 |
2.76±0.45a |
| 3 |
4.03±0.47b |
| 5 |
5.00±1.64c |
| Enzymatic extraction |
1 |
0.95±0.25a |
| 3 |
1.79±0.81b |
| 5 |
5.32±0.10c |
| Enzymatic & acidic extraction |
1 |
0.79±0.17a |
| 3 |
3.17±0.45b |
| 5 |
7.48±1.34c |
Download Excel Table
ABTS 라디칼 소거능은 DPPH 방법과 함께 항산화 활성 을 스크리닝 하는데 많이 이용되며 ABTS를 peroxidase, H2O2와의 반응에 의해 생성된 활성 양이온인 ABTS+가 시 료 중의 항산화성 물질에 의해 제거되어 고유의 청록색의 변화를 흡광도 값으로 나타내어 추출물의 ABTS+ 라디칼 소거 활성을 측정할 수 있다. 추출 조건에 따른 다슬기 추 출물의 ABTS 소거능을 측정한 결과, 열수 추출물이 산이 나 효소를 활용한 추출물보다 비교적 높은 ABTS 라디칼 소거활성을 보였다. 추출 시간의 증가에 따른 항산화능의 증가는 특별히 나타나지 않았으나 추출 조건에 따라 비교 하였을 때 효소를 사용하여 추출한 경우 가장 높은 ABTS 라디칼 소거활성을 확인할 수 있었다(Table 3). 다슬기에 포함된 histidine, carnosine 등의 아미노산이 항산화 활성에 깊이 관여하고 있을 것으로 추정되며(Lee et al., 2010), 또 한, 다슬기는 이끼류, 조류 및 수중 미세부유물질을 주로 섭취하므로 먹이 중에 함유되어 있는 페놀성 항산화 물질 도 항산화 활성에 영향을 미칠 가능성이 있다.
Table 3.
ABTS radical scavenging activity of Semisulcospira libertina extract at various extraction conditions
| Extraction methods |
Extraction times (h) |
ABTS RSA1) (%) |
| Hot water extraction |
1 |
13.40±0.72 |
| Acidic extraction |
1 |
10.01±0.22 |
| 3 |
9.85±0.50 |
| 5 |
10.78±0.66 |
| Enzymatic extraction |
1 |
11.50±0.34 |
| 3 |
11.53±0.65 |
| 5 |
11.20±0.38 |
| Enzymatic & acidic extraction |
1 |
9.82±0.47 |
| 3 |
9.49±0.37 |
| 5 |
9.85±0.18 |
Download Excel Table
아세트아미노펜(AAP) 유도 간세포 독성에 미치는 효과
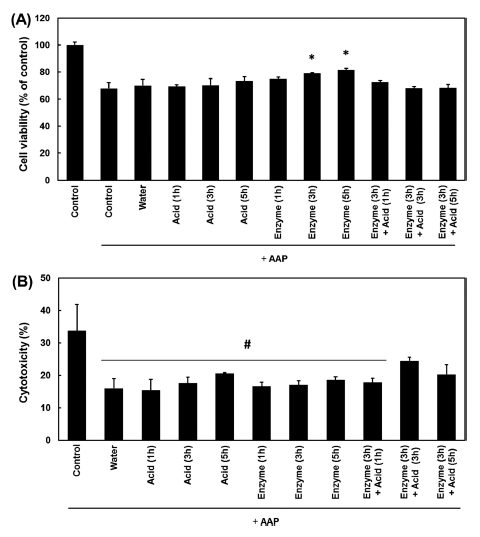
AAP 유도 간세포 생존율 측정에 앞서 HepG2 세포에 대한 다슬기 추출물의 독성을 확인하였다. 산, 효소, 효소- 산 다슬기 추출물의 독성 측정은 각각의 추출물의 최종 농 도가 200, 500 및 1,000 μg/mL가 되도록 배지에 녹여 사 용하였다. 세포의 독성은 시료를 처리하지 않고 배양한 대 조군에 대비한 세포 생존율로 측정하였으며, 모든 다슬기 가수분해물에서 독성은 나타나지 않았다(Table 4). 이와 같 은 결과는 3.5 g/kg body weight/day를 급이하여 3일간 사 육한 마우스 군에서 치사 혹은 독성을 보이지 않은 Jeon et al. (2003)의 보고와 일치한다. AAP는 예비실험을 통해 세포 생존율이 미처리 대조군에 비해 30-40% 사멸되는 농 도가 10 mM임을 확인하였으며 동일 농도에서 HepG2 세 포의 손상을 유도하였다. 시료 무첨가 대조군의 세포 생존 율을 100으로 보았을 때 AAP 만을 처리한 대조군은 67.8±4.3%의 생존율을 보인 반면 다슬기 추출물의 경우 AAP 만을 처리한 대조군에 비해 효소를 이용하여 3시간 과 5시간 추출한 다슬기추출물 1 mg/mL과 AAP를 병용처 리 한 경우 각각 9.7%와 13.7%의 간세포 생존율 증가를 보였다(Fig. 1A). 따라서, 다슬기 효소추출물은 AAP에 의 해 유발된 약물독성에 의한 간 손상에 대한 보호 효과를 가짐을 시사한다. 다음으로 AAP의 세포독성 기전 연구를 위하여 배양액 중에 들어 있는 lactate dehydrogenase (LDH)의 방출량을 측정하였다. Fig. 1B와 같이 AAP 만을 처리한 대조군은 33.7%의 세포독성을 나타낸 반면 다슬기 추출물을 처리한 경우 대조군에 비해 세포독성이 15.4%- 24.4%로 감소되었다. 이는 HepG2 세포에 대한 AAP의 세 포독성은 세포막 손상과 관련이 있으며 다슬기 추출물이 이러한 세포독성으로부터 세포를 보호한다는 것을 알 수 있게 해 주는 결과라고 할 수 있다.
Table 4.
Cytotoxicity of Semisulcospira libertina extracts on HepG2 cell
| Extraction methods |
Conc. (μg/mL) |
Cell viability (% of control) |
| Control |
|
100±3.84 |
| Hot water extraction (5 h) |
200 |
93.8±5.24 |
| 500 |
94.8±3.32 |
| 1000 |
99.1±5.13 |
| Acidic extraction (5 h) |
200 |
99.9±3.02 |
| 500 |
99.2±3.69 |
| 1000 |
98.8±3.65 |
| Enzymatic extraction (5 h) |
200 |
100.4±1.56 |
| 500 |
100.5±1.14 |
| 1000 |
103.9±1.32 |
| Enzymatic & acidic extraction (5 h) |
200 |
100.7±3.21 |
| 500 |
105.0±3.79 |
| 1000 |
100.8±2.14 |
Download Excel Table
Fig. 1.
Effects of S. libertina extracts on the cytotoxicity induced by the treatment of HepG2 cells with acetaminophen (APP).
HepG2 cells were pretreated with S. libertina extract (1 mg/mL) prior to the addition of AAP (10 mM). MTT (A) and LDH (B) assays were then performed after 24 h. *p<0.05, significant with respect to APP-alone. #p<0.05, vehicle treated control vs all groups.
Download Original Figure
ADH 및 ALDH 효소활성도에 미치는 효과
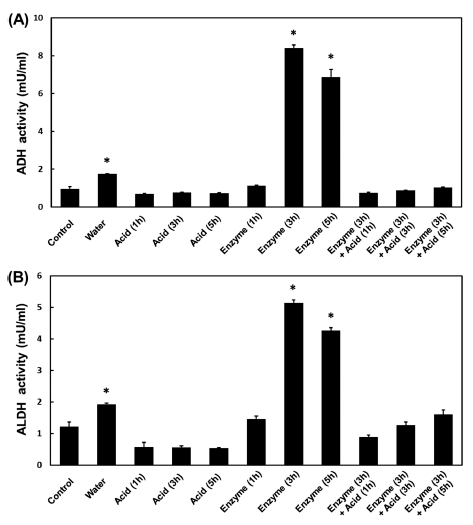
추출 조건에 따른 다슬기 추출물의 알코올 분해효능을 확인하기 위해 일차배양한 간세포를 효소원으로 하여 다슬 기 추출물이 알코올 대사 효소계에 미치는 영향을 관찰하 고자 ADH와 ALDH의 활성을 측정하였다. 실험결과는 Fig. 2와 같다. ADH 활성의 경우, 2 N HCl을 사용하여 추 출한 시료를 첨가하였을 때 ADH와 ALDH 효소활성이 추 출 시간에 상관없이 전체적으로 감소하였다. 이는 추출 후 잔존하는 HCl로 인한 알코올 대사효소계 효소의 변성 혹 은 반응액의 pH 변화에 의한 효과로 사료된다. 단백질 분 해효소인 alcalase 0.5%를 사용하여 3시간과 5시간 추출한 효소추출물(3 h)과 효소추출물(5 h)에서 각각 8.41±0.16 mU/ mL, 6.87±0.41 mU/mL로 시료를 넣지 않은 대조군(Vehicle group)과 열수 추출물에 비해 증가하였으며, ALDH의 활성 또한 5.14±0.09 mU/mL, 4.26±0.10 mU/mL로 대조군에 비 해 증가하였다. ADH 활성은 Ca2+, Zn2+, Co2+ 등과 같은 미네랄 성분에 의해 촉진되는 것이 보고되었다(Magonet et al., 1992). 또한, ADH 활성 촉진에 있어 아미노산 성분들 도 매우 중요한 인자로 작용하는데, 아스파탐산은 NAD+의 재생 촉진에 의한 NAD+/NADH 비율 증가로 ADH 활성 을 높여 알코올 분해를 촉진시킨다(Park, 1993). 이러한 보 고와 일치하게 Table 1에서 다슬기 효소추출물의 경우 아 스파탐산의 농도가 가장 높았다. 또한 글리신의 농도도 산 추출 방법보다 효소 및 효소-산추출 방법에서 높이 나타났 다. 이러한 결과는 다슬기 효소분해산물이 아세트알데히드 를 아세트산으로 신속히 분해시켜서 숙취해소에 상당한 효 과가 있을 것으로 기대된다. 일반적으로 다슬기는 간기능 개선에 효과가 있는 것으로 알려져 있지만 다슬기류에서 알코올 분해활성을 조사한 연구는 거의 없으며, 숙취해소 에 대한 연구도 주로 열수 추출물로 수행되었다. 효소추출 법에 의한 생리활성 연구가 기존의 열수 추출법보다도 다 슬기의 숙취해소능을 연구하는데 더욱 효과적인 방법인 것 으로 생각된다. ADH와 함께 ALDH의 활성 증가는 숙취 의 원인인 알데히드의 제거에 중요한 역할을 한다. 따라서 다슬기 추출물에 포함되어있는 아미노산 성분 또는 대사물 이 ADH와 ALDH의 활성을 촉진시켜 알코올과 아세트알 데히드를 신속하게 분해시킴으로서 숙취해소에 더욱 효과 가 있을 것으로 예상된다.
Fig. 2.
Effects of S. libertina extracts on ADH and ALDH activities from mouse hepatocyte homogenate.
Enzyme activities were measured using the methods described in the ‘Materials and Methods’ section. Values are mean±standard deviation. *p<0.05 compared to control.
Download Original Figure
혈중 아세트알데히드 농도
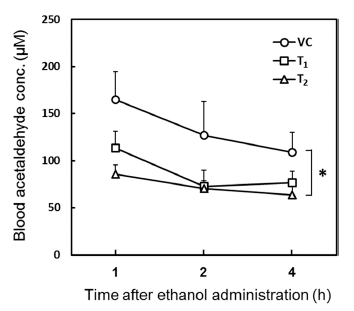
혈중 알코올이 분해될 때 생성되는 아세트알데히드는 숙 취의 주된 원인으로 알코올 대사가 빠르게 진행되지 않아 쌓이는 많은 양의 아세트알데히드는 지방간과 간 손상을 유발하는 것으로 알려져 있다. 실험동물에 40% 알코올을 투여 후 알코올 대사 중간산물인 아세트알데히드의 농도를 확인한 결과는 Fig. 3에 나타내었다. 숙취유도군(VC)의 아 세트알데히드의 농도는 알코올 투여 1시간에 165.09±29.16 μM로 가장 높은 농도를 나타내었고, 알코올 섭취 후 2시 간과 4시간에 각각 126.80±35.79 μM 108.93±20.89 μM로 시간경과에 따라 점차 감소하였다. 그에 비해 다슬기 효소 추출물 0.5 mg/kg 처리군(T1)의 경우, 알코올 섭취 후 2시 간과 4시간에 각각 72.92±5.63 μM, 76.48±12.20 μM로 알 코올 투여 후 1시간에 측정한 113.48±17.86 μM에 비해 서 서히 감소하였다. 다슬기 효소추출물 1 mg/kg 처리군(T2)은 알코올 투여 후 1시간에 85.78±9.59 μM, 2시간에 70.49 ±19.49 μM로 다른 군에 비해 알코올 대사가 빠르게 진행 되었고, 4시간이 지난 후에는 63.90±14.10 μM로 가장 낮 은 농도를 나타내었다. 결과적으로 숙취유도군의 혈중 아 세트알데히드 양이 알코올 섭취 1시간 후부터 서서히 감소 한 반면, 시료를 투여한 군은 숙취유도군에 비해 알코올 섭취 후 빠른 시간에 혈중 아세트알데히드 양이 급격히 감 소하는 양상을 보이는데, 이것은 체내 에탄올이 시료에 의 해 빠르게 분해되어 숙취가 해소된다는 것을 말해준다.
Fig. 3.
Effect of S. libertina extract obtained by enzymatic extraction method on blood acetaldehyde levels in drunken rats.
SD rats were orally administrated enzymatic extracts from S. libertina before 30 min alcohol treatment. And then collected serum at each time point. VC means only 40% ethanol treated group, T1 means 500 mg/kg of S. libertina extract treated group, T2 means 1000 mg/kg of S. libertina extract treated group. Blood samples were analyzed for acetaldehyde as described in the ‘Materials and Methods’ section. Values for blood acetaldehyde are means ± standard error (bars) for each group of 7 SD rats. Test groups were compared with the saline-pretreated vehicle control group (VC) by repeated-measures analysis of variance (ANOVA). Asterisk indicates a significant difference from VC group, *p<0.05.
Download Original Figure
요 약
본 연구에서는 다슬기 추출물의 간세포 독성과 에탄올 대사에서의 효능을 분석하기 위하여 산과 효소를 이용하여 추출한 다슬기 가수분해물의 아미노산 조성, 항산화 활성, 아세트아미노펜 처리에 의해 유도된 간독성 대한 보호효과 및 ADH와 ALDH 효소 활성에 미치는 영향을 in vitro에 서 분석하였고, 다슬기 추출물을 알코올과 함께 백서에 투 여하였을 때 나타나는 혈중 독성 중간대사산물인 아세트알 데히드를 정량하여 알코올 섭취 후 나타나는 숙취해소에 대한 효능을 규명하고자 하였다. 열수추출물과 비교하여 산추출물, 효소추출물, 효소-산추출물 모두 총 유리아미노 산 함량이 증가하였으며, 특히 숙취해소를 도와주는 아스 파라긴산, 글루탐산, 메티오닌 등이 대폭 증가하여 다슬기 추출물의 기능적 향상을 가져올 것으로 생각되었다. 또한, 항산화능의 평가지표인 DPPH 라디칼 소거활성 또한 증가 하는 경향을 확인하였다. 다슬기 추출물은 AAP로 간 손상 을 유도한 세포에 처리하여 세포생존율과 세포독성을 측정 하였다. AAP 만을 처리한 대조군은 67.8±4.3%의 생존율 을 보인 반면 다슬기추출물 1 mg/mL과 AAP를 병용처리 한 경우 각각 9.7%와 13.7%의 간세포 생존율 증가를 보 였다. 세포독성은 AAP 만을 처리한 대조군은 33.7%의 LDH 활성에 의한 세포독성을 나타낸 반면 다슬기 추출물 을 처리한 경우 대조군에 비해 세포독성이 15.4%-24.4%로 감소되었다. 또한, 에탄올 대사에서 중요한 ADH와 ALDH 활성은 열수추출물에 비해 효소를 이용한 다슬기 추출물에 서 각각 최대 4.8배와 2.7배 증가하였다. 알코올 섭취 후 혈중 아세트알데히드 농도는 다슬기 효소 추출물을 투여한 군의 경우 양성대조군에 비하여 유의하게 감소하였다. 이 상의 연구결과를 종합해 보면 다양한 추출 방법에 의한 다 슬기추출물 소재는 항산화 활성과 간손상 보호효과 및 숙 취해소능을 가지며, 효소추출물의 ADH와 ALDH 활성 증 가효과가 더 우수하였으며 향후 이들 소재를 활용한 다양 한 기능성 제품의 개발이 필요할 것으로 판단된다.
감사의 글
본 연구는 산업통상자원부 2015년도 지역주력산업육성 기술개발 사업(과제번호 R0004401)에 의해 이루어진 것으 로 이에 감사 드립니다.
References
Blois MS. Antioxidant determinations by the use of a stable free radical. Nature. 1958; 181:1199-1200.

Cha HO, Baik WA. Effect of Semisulcospira libertina, Corbicula sp and Cipangopaludina chinensis malleata extracts on liver function and other biological activities. 1999 In: 45th National SciExhibition of Ministry of Science and TechnologySejong, Korea.

Cha JY, Jung HJ, Jeong JJ, Yang HJ, Kim YT, Lee YS. Effects of amino acids on the activities of alcohol metabolizingenzyme alcohol dehydrogenase (ADH) and acetaldehyde dehydrogenase (ALDH). J. Life Sci. 2009; 19:1321-1327.

Grunnet N, Kondrup J. The effect of ethanol on the betaoxidation of fatty acids. Alcohol. Clin. Exp. Res. 1986; 10:64S-68S.

Di Luzio N, Hartman A. Role of lipid peroxidation in the pathogenesis of the ethanol-induced fatty liver. Fed. Proc. 1967; 26:1436-1442.

Eriksson CJ. The role of acetaldehyde in the actions of alcohol. Alcohol. Clin. Exp. Res. 2001; 25:15S-32S.

Forsander OA, Raiha NC. Metabolites produced in the liver during alcohol oxidation. J. Biol. Chem. 1960; 235:34-36.

Glueck CJ, HoggE AllenC, Gartside PS. Effects of alcohol ingestion on lipid and lipoprotein in normal man. Am. J. Clin. Nutr. 1980; 33:2287-2293.

Heineckem JW. Free radical modification of low-density lipoprotein mechanisms and biological consequences. Free Rad. Biol. Med. 1987; 3:65-73.

Hwang JY, Ham JW, Nam SH. Effect of maesil (Prunus mume) juice on the alcohol metabolizing enzyme activities. Korean. J. Food Sci. Technol. 2004; 36:329-332.

Hwang SJ, Choi HM, Park HJ, Lee JS, Heo D, Kim MR. Effects of medicinal herbal drink on alcohol metabolic enzyme in drunken rats. J. Physiol. Pathol. Korean Med. 2010; 24:610-615.

Iimuro Y, Bradford BU, Forman DT, Thurman RG. Glycine prevents alcohol-induced liver injury by decreasing alcohol inthe rat stomach. Gastroenterology. 1996; 110:1536-1542.

Jeon TW, Lee YS, Kim HJ. Hepatoprotection by Semisulcospira libertina against acetaminophen-induced hepatic injury in mice. J. Food Sci. Nutr. 2003; 8:239-244.

Kim YK, Moon HS, Lee MH, Park MJ, Lim CW, Paek HY, Park JI, Yoon HD, Kim DH. Biological activities of seven melania snails in Korea. Kor. J. Fish Aquat. Sci. 2009; 42:434-441.

Lee MH, Kim YK, Moon HS, Kim YA, Yoon NY, Lim CW, Park HY, Kim DH. Antioxidant activity of five melania snails of the genus Semisulcospira in Korea. Kor. J. Fish Aquat. Sci. 2010; 43:188-194.

Lee MS, Park JB, Yoon SH. Hepatoprotective effect of the water extract from Semisulcospira gottschei against liver injuries induced by carbon tetrachloride in rats. J. Korean Soc. Hyg. Sci. 2005; 11:17-26.

Lieber CS. Alcohol and the liver 1994, update. Gastroenterology. 1994; 106:1085-1090.

Lieber CS. Ethanol metabolism, cirrhosis and alcoholism. Clin. Chim. Acta. 1997; 257:59-84.

Lim CW, Kim YK, Kim DH, Park JI, Lee MH, Park HY, Jang MS. Comparison of quality characteristics of melania snails in Korea. Kor. J. Fish Aquat. Sci. 2009; 42:555-560.

Lin RC, Li TK. Effets of isoflavones on alcohol pharmacokinetics and alcohol-drinking behavior in rat. Am. J. Clin. Nutr. 1998; 68:1512S-1515S.

Linder MC. Nutrition and metabolism of fats. Nutritional Biochemistry and Metabolism: with Clinical Applications. 1991; 2nd edElsevier. Amsterdam, Oxford, NY, USA: p. 79-83.

Magonet E, Hayen P, Delforge D, Delaive E, Remacle J. Importance of the structural zinc atom for the stability of yeast alcohol dehydrogenase. Biochem. J. 1992; 287:361-365.

Mezey E. Alcoholic liver disease; roles of alcohol and malnutrition. Am. J. Clin. Nutr. 1980; 33:2709-2718.

Morel DW, DiCorleto PE, Chisolm GM. Endothelial and smooth muscle cells after low density lipoproteins in vitro by free radical oxidation. Arteriosclerosis. 1984; 4:357-364.

Park SC. Ethanol oxidation is accelerated by augmentation of malate-aspartate shuttle with aspartate. Korean. J. Biochem. 1993; 25:137-143.

Re R, Pellegrini N, Protegente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med. 1999; 26:1231-1237.

Shen L, Hillebrand A, Wang DQ, Liu M. Isolation and primary culture of rat hepatic cells. J. Vis. Exp. 2012; 29

Wu D, Cederbaum AI. Ethanol cytotoxicity to a transfected HepG2 cell line expressing human cytochrome P450E1. Alcohol. Clin. Exp. Res. 1999; 23:67-76.

Yin M, Ikejima K, Arteet GE, Seabra V, Bradford BU, Kono H, Rusyn I, Thurman RG. Glycine accelerates recovery from alcohol-induced liver injury. J. Pharacol. Exp. Ther. 1998; 286:1014-1019.