서 론
최근 발효와 효소를 이용하는 단백질가수분해물의 짠맛 증진효과에 대한 연구가 매우 활발하게 추진되고 있다. Lioe et al. (2007)은 최초로 콩단백질을 발효하여 제조된 전통 일본식 간장에서 저분자 펩타이드(500 Da 이하)가 짠맛과 우마미를 가지고 있다고 보고하였으며, Kremer et al. (2009)과 Goh et al. (2011)은 샐러드 드레싱, 수프 및 돈까스를 제조하는데 간장을 적용하여 17-50%의 소금 사 용을 줄일 수 있었다고 보고하였다. 또한 어류단백질의 효 소가수분해물이 짠맛을 증진한다는 연구결과(Shimono & Sugiyama, 2009) 및 sensomics approach와 HPLC-MS/MS 를 통해 시판중인 어간장(fish sauce)에서 짠맛증진물질을 분리·동정하여 arginyl dipeptides라고 최초로 밝혀 보고 (Schindler et al., 2011)하였다. Yun et al. (2015)은 이러한 짠맛증진물질을 국내의 전통 멸치 어간장 제조방법으로도 생산 가능하다고 하였다.
어간장을 제조하기 위한 고농도의 식염 처리는 건강에 해를 끼치는 문제뿐만 아니라 어류 내에 존재하는 proteinase와 peptidase의 활성을 저해(Noda et al., 1982;Yoshinaka et al., 1983)하여 자가소화 기간이 길어진다. 결 과적으로 어간장의 제조 기간이 6개월에서 2년에 이르게 된다. 따라서 이러한 문제를 해결하기 위하여 저염 및 속 성 어간장 제조에 관하여 많은 노력을 기울이고 있다 (Lopetcharat et al., 2001). 산 처리, 효소 처리, 코지 첨가, 어류의 내장 첨가 등으로 소금의 농도를 20% 이하로 유지 하면서 자가소화 기간을 단축할 수 있었지만 속성 및 저염 으로 제조된 가수분해물의 관능검사 결과, 어취가 너무 강 하거나(Yoshinaka et al., 1983;Dohmoto et al., 2001), 색 이 너무 밝다거나(Nakamura et al., 1979) 단맛과 쓴맛이 있다고(Lee et al., 1982;Kim et al., 1997;Morioka et al., 1999;Park et al., 2002) 보고되었다. 특히, 쓴맛의 경우에 Fujimaki et al. (1973)은 단백질 가수분해 시 같은 기질이 라도 사용되는 효소의 종류에 따라 그 쓴맛 정도가 상이하 며, 효소의 선택에 따른 쓴맛 정도가 약한 가수분해물의 제조 가능성을 제시하였고 현재는 exo-peptidase 또는 exo- 와 endo-peptidase를 혼합하여 활용하는 방안이 제시 (Raksakulthai & Haard, 2003;Nilsang et al., 2005;FitzGerald & O’uinn, 2006)되어 쓴맛 제어를 위해 상업적 으로 활용되고 있다.
식품산업에서 고압처리 기술은 주로 식품 중의 유해 미 생물의 살균목적으로 사용되어져 왔다. 그러나 최근 고압 기술은 미생물의 활성을 조절하거나 단백질, 효소 그리고 이외의 식품 성분 중 거대분자를 변화시킬 수 있는 비가열 기술로서 활용 범위가 점차적으로 확대되는 추세에 있다. 특히, 50-200 MPa에서의 중고압(medium high pressure)을 이용한 효소반응에 주목하고 있으나 어류 근육 내에서 단 백질 가수분해효소 활성에 미치는 압력의 영향에 대한 연 구는 어종, 압력의 세기, 반응온도, 시간, 반응 시스템의 pH 및 효소의 종류에 대한 것으로 제한적이다(Ashie & Simpson, 1996;Seyderhelm et al., 1996;Hurtado et al., 2002). 300 MPa 이상의 경우 근육 내에서 추출한 효소는 효소의 구조, 구조 내 형태 변화 등에 의해서 불활성화 되 고(Hernández-Andrés et al., 2008), 200 MPa 이하에서는 효소반응의 평형상수와 반응속도상수에 영향을 미쳐 효소 활성이 증가한다고 하였다(Ohmae et al., 2007). 또한 Akasaka et al. (2008)은 기질로서 ubiquitin을 효소로서 α- chymotrypsin이 반응하는 효소반응의 경우에 수 kbar 영역 에서의 압력은 단백질 가수분해반응을 촉진한다고 하였다. 그 근거로 기질인 ubiquitin이 압력에 의해서 folded conformer에서 unfolded conformer로 변하기 때문이라 하 였다. 이와 같은 기술의 활용 예로서 Okazaki et al. (2003) 은 식염을 첨가하지 않고 60 MPa의 고압 하에서 50°C, 48시간 동안 생멸치를 자가 소화시켜 어간장과 매우 유사 한 분해물을 얻을 수 있었다고 하였다. 그러나 이러한 기 술의 산업적 적용 사례는 미미한 실정이다.
이에 본 연구에서는 전통적인 어간장 제조 공정을 짠맛 증진물질을 생산하는 산업적 공정으로 개선하기 위한 기초 자료를 확보하기 위하여 중고압(100 MPa 이하) 하에서 비 교적 효소 활성이 안정하며 쓴맛이 제거된 가수분해물을 생산할 수 있는 상업용 단백질 분해효소를 선별하고자 하 였다.
재료 및 방법
본 연구에서 사용한 생멸치, Engralis japonica(체장 7.2±0.5 cm, 체중 2.7±0.4 g)는 2013년 3월에 제주도 해역 에서 어획한 것을 동해수산(Gijang, Korea)에서 구입, 빙냉 운반하여 일정량씩 polyethylene film bag에 넣은 다음 동 결고(-20°C)에 저장하여 두고 실험에 사용하였다. 실험에 사용된 상업용 효소는 Novozymes (Bagsvard, Denmark)의 Alcalase® 2.4 L와 FlavourzymeTM 500MG, Neutrase®, ProtamexTM로 대명상사(Seoul, Korea)로부터 구입하였다. 사용된 효소의 특징은 Table 1과 같다. 시약은 모두 분석 시약급을 사용하였다.
Alcalase® 2.4 L, FlavourzymeTM 500 MG, Neutrase®, ProtamexTM 및 혼합효소(Alcalase®:FlavourzymeTM 500MG =1:5)를 20 mM phosphate buffer (pH 7.0) 10 mL에 2% (w/v)의 비율로 첨가한 개별 효소용액을 각각 동결보존용 튜브에 넣고 완전 밀봉하였다. 밀봉된 효소용액을 고압액 화기(TFS-20, Innoway, Incheon, Korea)에 넣고 50°C, 100MPa의 조건에서 1, 2, 6, 12 그리고 24시간 처리하였 고, 상압(0.1 MPa)에서는 50°C로 온도를 조절한 항온수조 (Wisd WB-11, Daihan, Seoul, Korea)에 동결보존용 튜브에 밀봉된 효소용액을 넣고 동일시간 처리하였다. 각 조건으 로 처리된 시료는 즉시 단백질 분해 활성을 측정하였다. SDS-PAGE를 실시하기 위하여 각각의 효소를 Tris-HCl buffer (20 mM, pH 7.0)에 1% (w/v)로 제조하여 동일한 방법으로 100 MPa, 50°C에서 24시간 처리한 후에 0°C로 조절된 chiller (Micon control system-FC-B53 HMS, LG, Seoul, Korea)에서 냉각하고, 분석 전까지 -20°C에서 냉동 보관하였다.
고압 및 상압 처리 후의 효소활성은 Gupta et al. (2002) 의 방법을 수정하여 측정하였다. 기질로 Casein (Sigma C- 7078, St. Louis, MO, USA) 분말을 0.03M phosphate buffer (pH 7.5)에 20 mg/mL의 농도로 제조하여 사용하였 다. 기질 5 mL에 효소액을 각각 1 mL씩 첨가하여 50°C에 서 30분간 반응시키고, 0.44 M TCA 용액을 5 mL를 첨가 후 실온에 30분간 정치시켜 효소반응을 중단시켰다. 이를 원심분리(17,000 rpm, 10분)하여 상등액을 취하고 0.2 μm Whatman Puradisc syringe filter (Whatman International Ltd., Maidstone, Kent, UK)로 여과하였다. 여과액 1 mL에 0.55M Na2CO3 용액 2.5 mL, 1N Folin & Ciocalteu (Sigma, St. Louis, MO, USA) 0.5 mL을 첨가하고 37°C에서 30분 간 발색, 상온에 10분간 정치시킨 후 660 nm에서 흡광도를 측정하여 tyrosine 생산량을 검량선에서 산출하였다. 이 때 효소액 1 mL가 1분간 1 μg에 해당하는 tyrosine을 생산하는 것을 1 unit로 하였다. 표준품으로는 L-tyrosine (Sigma, St. Louis, MO, USA)을 사용하였다. 상압 및 고압 처리 후의 잔존효소활성은 아래 식에 의하여 산출하였다.
고압 처리한 효소의 안정성을 확인하기 위하여 효소의 분자량 분포를 Laemmli (1970)의 방법을 다소 수정하여 확인하였다. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)는 Ez WayTM PAG 4-15% acrylamide gradient gel (KOMA Biotech Inc., Seoul, Korea)을 사용하였고 냉동 시료를 해동하여 KTG020 버퍼 용액(10% glycerol, 2% SDS, 0.003% bromophenol blue, 5% β-merchaptoethanol, 63 mM Tris, pH 6.8, KOMA Biotech Inc., Seoul, Korea)과 동량(v/v)으로 혼합하였다. 가수분해 된 단백질 20 μL을 gel에 loading 하여 140 V에 서 약 1시간 전기영동한 후 coomassie blue로 염색하여 단 백질 밴드를 확인하였다. 각 단백질 분포는 image J (National Institutes of Health, Bethesda, MD, USA) 소프 트웨어를 이용하여 electrophoretic mobility maps (EMMs) 으로 나타내어 분석하였다. 표준단백질은 Precision plus protein standard (10-250 kDa, Bio-Rad Lab. Inc., Pinole, CA, USA)를 사용하였다.
멸치 효소가수분해물은 원료 멸치와 물을 1:2 (w/w)의 비율로 혼합하여 믹서기(HMF-3100S, Hanil, Seoul, Korea) 로 2분씩 세 번 분쇄한 후에 homogenizer (T25, IKA, Staufen, Germany)로 16,000 rpm에서 5분씩 3번 균질화하 였다. 균질화된 멸치 분쇄물에 4종의 상업적 효소와 혼합 효소를 원료 멸치 대비 2% (w/w) 첨가하고 폴리에틸렌 필름 포장지에 담아 완전밀봉한 후에 고압 및 상압조건에 서 일정시간(1, 2, 6, 12 그리고 24시간) 효소와 반응시켰 다. 고압에서의 반응은 고압액화기에서 100 MPa, 50°C의 조건으로 상압에서는 항온수조에서 50°C의 조건으로 실시 하였다. 일정시간 반응 후, 80°C에서 20분 동안 불활성하 고 4°C에서 12시간 이상 숙성하여 지방층을 제거한 후에 4°C에서 30분간 원심분리(17,000 rpm, supra 22k, Hanil, Seoul, Korea)하여 상등액을 -20°C 냉동고에서 보관하면서 분석용 시료로 사용하였다.
가수분해물의 가수분해도(degree of hydrolysis: DH)는 다음 식에 의해서 산출하였다.
여기서 h는 가수분해물에서의 아미노태 질소 함량이고 htot는 가수분해 전 시료에서의 총 단백질 함량이다. 아미 노태 질소 함량은 Alder-Nissen (1979)의 방법에 준하여 trinitrobenzensulfonic acid (TNBS-P2297, Sigma-Aldrich Co., St. Louis, MO, USA)를 이용하여 측정하였다. 시료 0.25 mL에 0.2M phosphate buffer (pH 8.2) 2 mL, 0.05% TNBS 2mL을 가하고 50°C 암소에서 60분간 반응시켰다. 0.1 N HCl 4mL을 넣고 반응을 정지시켜 30분간 방치 후 spectrophotometer (DU 530, Beckman, Brea, CA, USA)으로 340 nm에서 흡광도를 측정하고 검량선으로부터 함량을 산출하 였다. 총 단백질 함량은 auto Kjeldahl system (MBCM-12; DNP-2000MP; Crison, Titromatic, Raypa, Germany)을 사 용하여 micro-Kjeldahl법으로 측정하였다(질소계수 6.25).
전 보(Yun et al., 2015)와 동일한 방법으로 가수분해물 의 Gel Permeation Chromatography (GPC)는 ӒKTAprime plus system (GE Healthcare Life Sciences, Buckinghamshire, UK)을 사용하여 분석하였다. 표준물질로는 Vitamin B12 (MW 1355.37 Da, Sigma, St. Louis, MO, USA), Vitamin B1 (MW 337.27 Da, Yakuri Pure Chemicals Co. Ltd., Osaka, Japan), L-Glutamic acid (MW 147.13 Da, Samchun Pure Chemicals Co. Ltd., Pyeongtack, Korea)를 사용하 였다.
멸치 가수분해물의 쓴맛 강도 평가를 위하여 본교 생명 과학대학 대학원생 7명(남자 3명, 여자 4명)을 선발하였다. Hou et al. (2011)의 방법에 따라 농도를 다르게 한 tea alkaloid 표준용액(0 g/L, 0.1 g/L, 0.2 g/L, 0.4 g/L, 0.8 g/ L, 그리고 1.6 g/L)의 농도 순서에 따라 쓴맛강도를 1 (no bitterness), 2 (weakly bitter), 3 (mildly bitter), 4 (bitter), 5 (strongly bitter) 및 6 (extremely bitter)으로 수치화하였 다. 제조된 표준용액을 이용하여 쓴맛에 대하여 주 4회에 걸쳐 1개월 훈련시킨 후 가수분해물에 대한 쓴맛 강도 평 가를 실시하였다. 이때 관능검사 시료는 냉동 보관하였던 가수분해물을 상온에서 해동한 후에 단백질 함량이 5%가 되도록 조절한 후에 사용하였다. 다만 시료 간의 차이를 정확히 구분하게 하기 위하여 한 가지의 시료를 맛본 후 입안을 생수로 헹궈내도록 하였다.
Tryptophan의 함량은 high performance liquid chromatography (HPLC 1100-series, Hewlett Packard Agilent, Palo Alto, CA, USA)를 사용하여 분석하였다. 분석시료는 10,000 rpm에서 10분간 원심분리 후 상등액을 취하여 사 용하였다. 상등액 1 mL에 12% HClO4 0.5 mL을 넣고 혼 합한 후 다시 10,000 rpm에서 30분간 원심분리 하여 0.22 μm syringe filter에 통과시킨 후 HPLC에 주입하였다. HPLC 분석조건은 column (ZORBAX Eclipse AAA, 5 μm, 4.6 mm×150 mm, Agilent Technologies, Palo Alto, CA, USA)을 사용하였으며 이동상으로 Buffer A는 40 mM photassium phosphate (pH 7.8), Buffer B는 acetonitrile : methanol : 3차 D.W.을 각각 45:45:10 (v/v/v)의 비율로 혼 합하여 사용하였다. 유속은 2mL/min로 고정하여, 340-450 nm의 Scanning Fluorescence Detector (Waters 474, Milford, MA, USA)로 검출하였다.
결과 및 고찰
단백질 가수분해 공정에서 산업적으로 가장 많이 이용되 고 있는 Alcalase® 2.4 L, FlavourzymeTM 500 MG, Neutrase®, ProtamexTM 등의 4가지 효소와 쓴맛의 제어를 위하여 exo-와 endo-peptidase를 혼합하여 활용하는 방안 (Raksakulthai & Haard, 2003;Nilsang et al., 2005;FitzGerald & O’uinn, 2006)에 따라 효소 제조사로부터 제 안된 Alcalase® 2.4 L와 FlavourzymeTM 500 MG을 1대 5 의 비율로 혼합한 효소(mixed enzyme, ME)를 sodium phosphate buffer (pH 7.0)를 사용하여 2% (w/v) 용액으로 제조하였고 50°C에서 24시간까지 장시간 고압(100 MPa) 및 상압(0.1 MPa) 처리 후, 각각의 효소에 대한 단백질 분 해 활성을 측정하여 잔존 활성을 산출한 결과는 Fig. 1과 같다. Duncan의 다중범위검정(p<0.05, data not shown)과 Fig. 1에 나타낸 바와 같이 상압 및 고압 처리 모두 시간 이 경과함에 따라 유의적으로 활성이 감소하였으며, 고압 처리가 상압에서 보다 유의적으로 효소 활성이 잔존하였다 (p<0.05). 24시간 처리 후에 잔존 활성은 고압 처리의 경우 에는 FlavourzymeTM 500 MG, ME, Neutrase®, Alcalase® 2.4 L, ProtamexTM의 순서로 상압의 경우에는 Neutrase®, ME, Alcalase® 2.4 L, FlavourzymeTM 500 MG, ProtamexTMF 의 순서로 유의적인 차이를 보이며 높게 나타났다(p<0.05). 뿐만 아니라 고압 처리에 따른 잔존 효소 활성의 증가를 확인하기 위하여 각 효소별, 처리 시간별 잔존 활성 차이 에 대한 평균을 분석한 결과(data not shown), 효소별로는 유의적인 차이를 보이며 FlavourzymeTM 500 MG (39.4), ProtamexTM (28.4), Alcalase® 2.4 L (13.2), ME (9.1), Neutrase® (7.5)의 순서로 나타났지만 시간별로는 분산이 심하여 통계적으로 의미 있는 결론을 확인하기에는 미흡하 였다. 이러한 결과는 중 고압 영역(200 MPa 이하)에서 효 소에 대한 열안정성과 활성 증가에 대하여 보고한 결과 (Mozhaev et al., 1996;Ohmae et al., 2007)와 중온성 세 균으로부터 유래된 효소를 압력조건(0.1-600 MPa, 25°C, 0.1 M sodium phosphate buffer)에서 처리 후 잔존효소 활 성에 대하여 실험한 결과, 100-300 MPa까지 잔존효소 활 성이 유지되었다는 보고(Athès et al., 1997)와 일치한다. 따라서 본 연구에서 사용한 모든 상업적 효소는 고압에서 사용할 수 있음을 확인하였다.
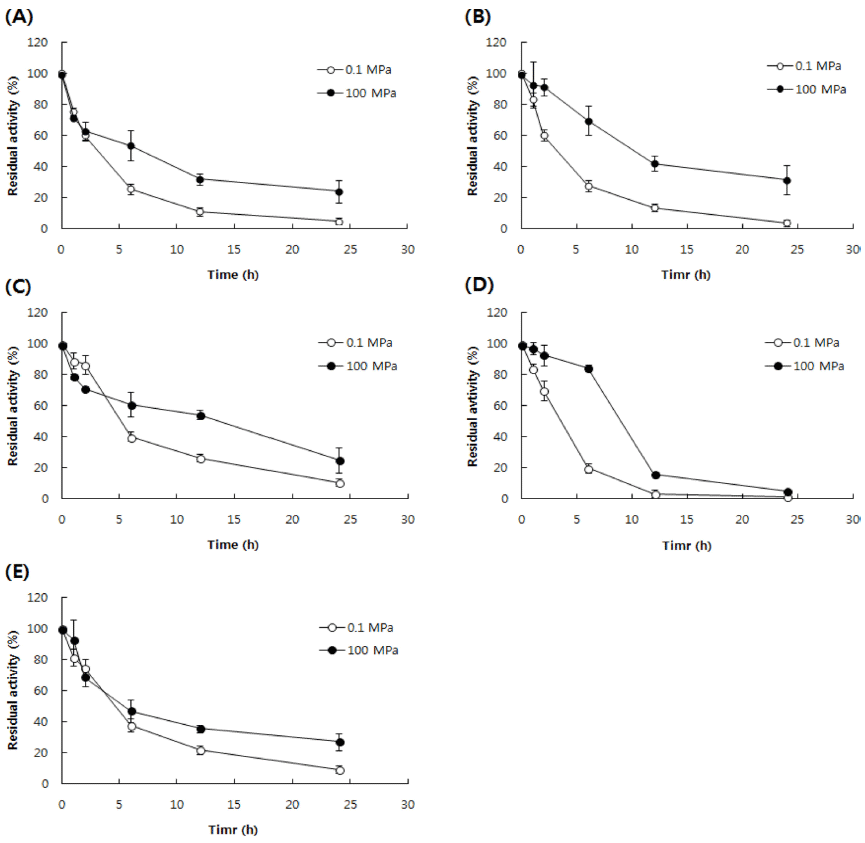
효소에 대한 열안정성과 활성 증가 또는 가수분해 반응 의 속도 증가 효과에 대한 기작에 대한 여러 보고(Mozhaev et al., 1996;Balny 2006;Vila Real et al., 2006;Ohmae et al., 2007;Akasaka et al., 2008)에 의하면 두 가지로 요 약된다. 첫째는 고압에서의 효소 반응에 대하여 전이 상태 이론(transition state theory)을 적용하여 기질과 효소가 결 합된 전이 상태에서의 부피가 고압에 의하여 줄어들면서 자유에너지(ΔG)에 영향을 미치고 결국, 반응속도상수를 증 가시켜 반응속도를 가속화시킨다는 것이고, 둘째는 효소 반응에 관여하는 기질 단백질의 형태학적 구조에 관한 것 으로 압력에 의해서 기질 단백질의 구조가 풀린 구조가 되 어 반응이 일어날 확률이 증가하여 결국 반응속도가 가속 화된다고 하였다. 효소 역시 단백질이므로 본 연구에서는 FlavourzymeTM 500 MG, Alcalase® 2.4 L 및 ME를 50°C, 100 MPa에서 24시간 처리 후에 효소의 안전성을 형태학 적 구조변화를 측정하여 확인하고자 하였다.
고압 및 상압 처리된 시료를 SDS-PAGE 실시하고 결과 를 electrophoretic mobility maps (EMMs)로 표현하여 나 타내었다(Fig. 2). Alcalase® 2.4 L의 경우인 line 1과 line 2의 분자량 분포에서 상압과 고압 처리에 따른 차이가 없 었으며, FlavourzymeTM 500 MG의 line 3, 4의 분자량 분 포와 ME의 결과인 line 5, 6에서는 동일한 분자량 분포도 를 나타내었다. 이러한 결과는 150 MPa 이하에서 ubiquitin 을 α-chymotrypsin으로 가수분해물의 분자량 분포가 변하 지 않는다는 보고(Akasaka et al., 2008)와 trypsin 및 thermolysin으로 밀 글루텐을 37°C의 상압 및 고압 조건 (300 MPa)에서 1시간 동안 반응시킨 가수분해물의 분자량 분포를 EMMs를 통하여 나타낸 패턴(Kim et al., 2013)과 유사함을 확인할 수 있었다. 따라서 시험된 3가지 효소 모 두 100 MPa에서는 형태학적 구조가 변하지 않는 것으로 확인되었다.
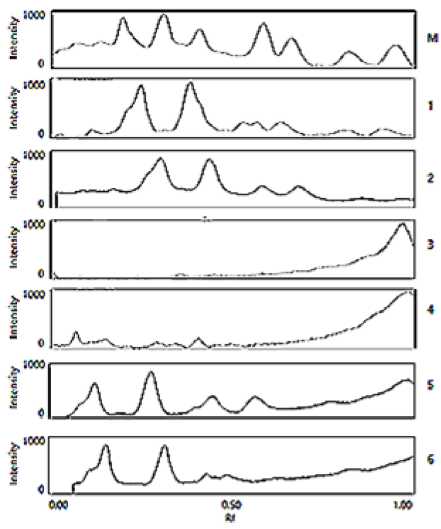
100 MPa에서의 효소에 대한 안전성을 잔존 활성과 SDS-PAGE를 통하여 확인하였지만 고압 처리에 의한 잔존 효소 활성의 증가 효과를 확인하기에는 부족하여 생멸치를 기질로 동일한 조건(50°C, 상압 및 100 MPa)에서 1, 2, 6, 12 및 24시간 다섯 가지 효소로 각각 가수분해반응을 실 시하여 가수분해물을 얻고, 가수분해도를 측정한 결과를 Table 2에 제시하였다. 여기서 어떠한 효소도 가하지 않은 자가 효소에 의한 가수분해를 대조구로 설정하였다.
대조구에서는 상압 및 고압의 조건에서 시간에 따라 계 속하여 유의적인 차이(p<0.05)를 보이며 반응이 진행되고 있는 것으로 나타나고 있으나, 효소에 의한 가수분해 반응 은 상압에서 6시간 이후에는 서서히 반응이 진행되어 평형 에 가까이 진행되는 것으로 보이고, 고압에서는 시간에 경 과함에 따라 유의적인 차이(p<0.05)를 보이면서 계속하여 반응이 진행되었다. 따라서 100 MPa의 고압 하에서는 효 소 반응이 증진되는 효과가 있음을 확인할 수 있었다.
고압 및 효소 처리에 따른 효소 반응의 증진 효과를 분 석하기 위하여 시간의 경과를 무시하고 처리 군별 가수분 해도의 산술평균을 구하여 반응 촉진 효과를 계산한 결과 (data not shown), 평균 가수분해도는 고압 효소군(45.26± 9.83), 고압 대조군(35.18±12.88), 상압 효소군(18.44±6.34) 및 상압 대조군(15.43±6.16)의 순서로 나타났으며, 상압에 서 효소 처리 군의 증진 효과는 19.6±1.8%, 고압에서 효소 처리 군의 증진 효과는 28.7±3.6%이었다. 고압 처리 시 증 진 효과는 대조군 및 효소 처리 군에서 각각 128.0±5.3% 및 145.4±7.3%로 계산되어 가수분해 반응 증진 효과는 고 압에 의한 영향이 효소에 의한 영향보다 우월한 것으로 판 단된다. 이러한 결과는 앞서 기술한 100 MPa의 고압 처리 후에도 효소 활성이 상압의 경우보다 더 많이 남아 있었던 결과와 일치하였다.
50°C, 100 MPa의 조건에서 2시간 동안 멸치에 상업적 효소를 첨가하여 반응시킨 후의 가수분해물에 대한 GPC 크로마토그램 분석결과는 Fig. 3과 같다.
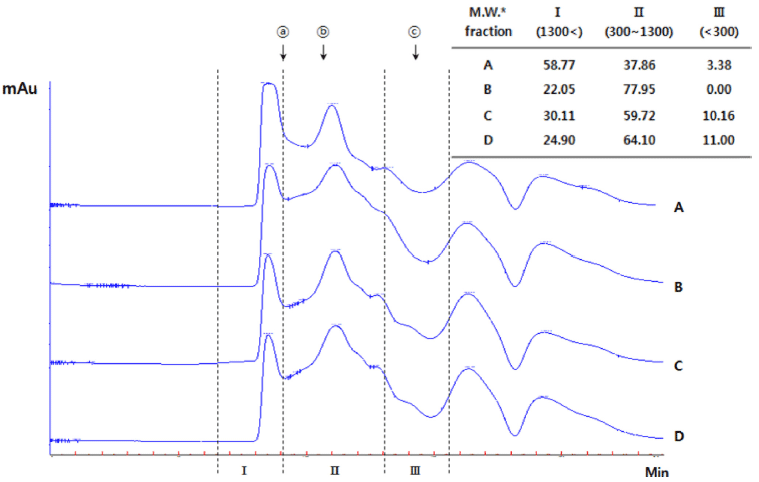
Yun et al. (2015)의 멸치 어간장의 분자량 분포를 확인 하여 중합도 2-10 사이의 oligo peptides 영역(분자량 220- 1,100)에서 짠맛증진물질의 존재 가능성에 대한 보고와 Youn et al. (2015)의 멸치 단백질 가수분해물의 관능평가 를 통한 짠맛증진효과에 대한 보고와 같이 짠맛증진물질로 밝혀진 arginyl dipeptides가 존재할 가능성이 있는 분획 II 의 분율은 효소 처리 군이 대조군에 비하여 약 2배 이상 크게 측정되었으며, 상업적 효소를 사용하여 고압 조건에 서 짠맛증진 물질의 생산 가능성을 확인할 수 있었다.
단백질의 효소가수분해 시 생성되는 쓴맛은 소비자들의 기호에 적합하지 않아 가수분해물의 활용에 제약을 받고 있으며, 이를 해결하는 방안으로 exo-peptidase 또는 exo- 와 endo-peptidase를 혼합하여 활용하는 방안이 제시되고 있 다(FitzGerald & O’uinn, 2006;Hou et al., 2011). 이에 본 연구에서는 쓴맛 제어가 가능한 상업적 효소를 선별하기 위 하여, 경제적이며 가장 가수분해 활성이 좋은 Alcalase® 2.4 L와 작용 기작이 exo-와 endo-인 FlavourzymeTM 500 MG 그리고 이들을 각각 1:5의 비율로 혼합한 효소(ME) 를 사용하여 50°C, 100 MPa의 조건에서 가수분해를 실시 하여 제조한 가수분해물에 대한 쓴맛 강도를 관능검사에 의하여 평가하였고 그 결과는 Fig. 4(A)와 같다.
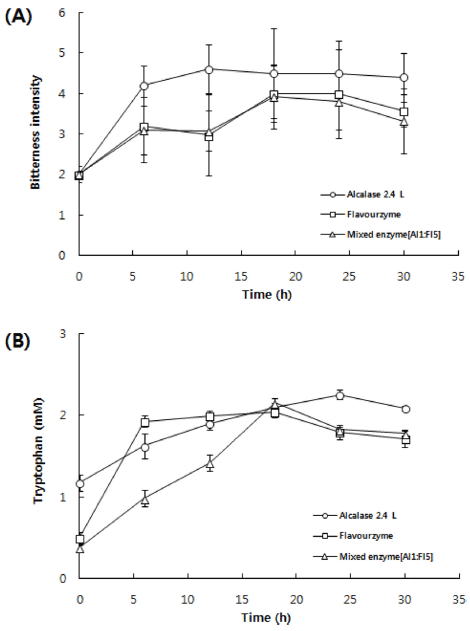
Alcalase® 2.4 L에 의해서 제조된 가수분해물의 쓴맛 강 도는 12시간까지는 증가하는 경향을 보이고 있으며, 12시 간 이후부터는 쓴맛에 대한 강도가 증가하지 않았으며 강 도는 4 (bitter taste) 보다 조금 높았다. exo-와 endo-형이 혼합된 FlavourzymeTM 500 MG과 ME의 경우에는 매우 유 사한 경향을 보이며 18시간 이후로는 강도가 감소하여 강 도 3 (mildly bitter taste)을 나타내었다. 현저한 차이를 확 인할 수는 없었지만, 이러한 결과는 Hou et al. (2011)이 미생물로부터 유래된 endo-, exo- protease를 혼합한 효소 를 이용하여 명태 프레임을 가수분해하는 경우에 쓴맛을 저하시킬 수 있었다는 보고와 유사한 결과로 FlavourzymeTM 500 MG이나 ME를 생멸치의 고압효소가수분해에 이용하 면 관능적으로 쓴맛이 개선된 가수분해물을 생산할 수 있 으리라 판단된다.
단백질의 가수분해 시 쓴맛은 소수성 잔기를 포함하는 peptide들에 의하여 나타나며, leucine, isoleucine, valine과 같은 branched-chain amino acids (BCAAs)와 phenylalanine, tryptophan, tyrosine은 쓴맛을 내는 아미노산으로 알려져 있다(FitzGerald & O’uinn, 2006;Mukai et al., 2007;Malin, 2010). 뿐만 아니라 어떤 연구(Smyth & FitzGerald, 1998;Nilsang et al., 2004)에서는 이러한 쓴맛을 나타내는 아미노산 중에 tryptophan을 쓴맛 지표로 사용하여 가수분 해물의 쓴맛을 정량화하였다. 본 연구에서도 관능검사 결 과를 검증하기 위하여 쓴맛 강도를 평가한 시료와 동일한 시료에서 tryptophan 함량을 측정하였고 그 결과는 Fig. 4(B)와 같다.
Tryptophan 함량 또한 관능검사 결과와 유사한 경향을 보 이고 있으며, 이러한 결과는 Nilsang et al. (2004)이 FSC (fish soluble contrate)에서 FlavouzymeTM 500MG와 다른 상업적 효소를 이용하여 가수분해 한 결과 FlavouzymeTM 500MG을 사용하는 경우에 tryptophan이 가수분해 반응 중에는 생성되지 않았다는 결과와 참치에서 FlavouzymeTM 500 MG을 이용하여 가수분해 시 tryptophan 함량이 감소 하였다고 한 Hernedy & FitzGerald (2012)의 결과와 유사 하였다. 특히, 반응 초기에 ME를 사용하는 경우에 가장 적게 tryptophan이 생성됨을 확인하고 최종적으로 ME를 중고압(100 MPa 이하) 하에서 비교적 효소 활성이 안정하 며 쓴맛이 제거된 가수분해물을 생산할 수 있는 상업용 단 백질 분해효소로 선별하였다. 하지만 반응 초기의 관능 평 가 결과와 쓴맛 지표 성분인 tryptophan 함량과는 직접적 인 상관관계를 보이지 않아 추후 보완실험을 통하여 쓴맛 펩타이드 성분들에 대한 분석 및 대조군을 활용한 관능평 가를 통하여 개선 효과를 검증할 필요가 있을 것으로 사료 된다.
요 약
국내산 멸치의 효소가수분해를 개선하기 위하여 압력을 활용하고자, 중고압(200 MPa 이하) 하에서 비교적 효소 활성이 안정하며 쓴맛이 제거된 가수분해물을 생산할 수 있는 상업용 단백질 분해효소를 선별하고자 하였다.
상업용 효소인 Alcalase® 2.4 L, FlavourzymeTM 500 MG, Neutrase®, ProtamexTM 및 AlcalaseTM 2.4 L와 FlavourzymeTM 500 MG을 1:5의 비율로 혼합한 ME에 대한 안정성 평가 로써 50°C에서 상압 및 100 MPa의 조건에서 처리시간에 따른 잔존효소활성과 전기영동을 실시하여 고압 처리 시 효소 활성의 잔존율이 증가하고 효소의 형태학적 변화가 없이 안정함을 확인하였고, 고압에서 잔존 활성이 높은 FlavourzymeTM 500 MG과 ME를 1차적으로 선별하였다.
동일한 조건으로 멸치 효소가수분해물을 제조하여 고압 의 효소반응 증진 효과, 짠맛증진물질 생산 가능성 및 쓴 맛 감소 가능성을 검토하였다. 가수분해도를 분석하여 가 수분해 반응 증진 효과는 고압에 의한 영향이 효소에 의한 영향보다 2배 이상 우월함을 확인하였고, GPC 크로마토그 램으로 짠맛증진물질의 생산 가능성을 확인하였으며 이 중 에서 Alcalase® 2.4 L가 가장 우수하여 2차로 선별하였다. 1차 및 2차에서 선별된 효소로 100 MPa 및 50°C 조건에 서 제조된 멸치 효소가수분해물의 쓴맛 강도와 지표성분으 로 tryptophan 함량을 측정하여 mildly bitter taste와 tryptophan을 가장 적게 생산하는 ME를 최종적으로 선별 하였다.







