Article
고압 Hormesis가 블루베리의 테로스틸벤 함량과 생물활성에 미치는 영향
김태은, 홍지영1, 종태 김, 조용진*
The Effect of High Pressure Hormesis on Pterostilbene Content and Biological Activity in Blueberries
Tae-Eun Kim, Yong-Jin Cho1, Chong-Tai Kim, Yong-Jin Cho*
Author Information & Copyright ▼
Research Group of Bioprocess Engineering, Korea Food Research Institute
1College of Pharmacy, Seoul National University
*Corresponding author: Yong-Jin Cho, Research Group of Bioprocess Engineering, Korea Food Research Institute, Songnam 463-746, Korea Tel: +82-31-780-9136; Fax: +82-31-780-9257
yjcho@kfri.re.kr
© Korean Society for Food Engineering All rights reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jul 9, 2015; Revised: Sep 1, 2015; Accepted: Sep 15, 2015
Abstract
This study was performed to investigate the enrichment of pterostilbene content and improvement of biological activity in harvested blueberries through the modulation of metabolism with high pressure treatment at hormetic doses. After harvested blueberries were pressurized under 2, 10, and 20 MPa for 5 min at 25°C along with a set of control, pterostilbene content and induction of quinone reductase activity were observed. As a result, the content of pterostilbene in high pressure treated blueberries was enriched up to 1.33 times while quinone reductase activity was improved compared to the untreated sample. These results suggest that a mild high pressure treatment can enrich pterostilbene content and improve biological activity in harvested blueberries according to hormetic response.
Keywords: high pressure; hormesis; blueberry; pterostilbene; biological activity
서 론
생물체는 잠재적인 위험성을 가지는 외부 자극에 대해 자 기 방어 시스템이 자체적으로 활성화되는데 이러한 현상을 호머시스(hormesis)라고 한다(Sharma & Alderson, 2005). DNA가 복원 가능한 수준에서 호머시스 현상을 효과적으 로 활용하면 유전자 변형이나 조작 없이 세포의 대사 작용 을 조절할 수 있기 때문에 다양한 산업기술로 활용될 가능 성이 있다(Cho et al., 2008; Donnez et al., 2009). 특히 최 근에는 식물 자원의 건강기능성 효과를 증대시키기 위해 호머시스 현상을 이용하여 식물자원의 생리활성 성분을 강 화하는 연구들이 보고되고 있다(Cantos et al., 2000; Cho et al., 2008; Wang et al., 2010; Cho et al., 2011, 2012). 이러한 연구들은 과실류 및 채소류가 수확 이후에도 세포 의 활성이 유지되는 상태라면 외부자극에 의해 기능성 성 분의 생합성이 유도될 수 있다는 사실을 보여주었다(Cho et al., 2012).
블루베리는 flavonoid, carotenoid, isoflavon, polyphenol 등의 식물 생리활성 성분인 파이토케미컬(phytochemical)이 풍부하게 존재하는데 특히 주목 받고 있는 성분이 스틸벤 류이다. 스틸벤류 중 가장 대표적인 물질인 레스베라트롤은 1997년 Science에 관련 약리 효과가 보고된 이후 관심이 급증하였다(Jang et al., 1997; Cho et al., 2003b). 레스베라 트롤은 심혈관 질환의 예방(Lekakis et al., 2005), 암세포 성장 억제 및 암 예방(Jang et al., 1997), 항염 및 항산화 작용(Stivala et al., 2001; Baur & Sinclair, 2006) 등의 효 과를 가지는 것으로 알려져 있고(Cho et al., 2003a), 이는 다양한 동물 모델을 이용한 선행 연구 결과에 의해 뒷받침 되었다(Rimando et al., 2002). 최근에는 주로 당뇨병, 지방 간 질환 및 비만 개선 효과에 대한 연구가 진행되고 있고 기능성식품 시장에서도 레스베라트롤의 관련 효과에 대해 주목하고 있다(Donnez et al., 2009; Lee & Yang, 2013).
테로스틸벤은 레스베라트롤의 유사물질로서 비슷한 기능 성 효과를 나타내는데(Rimando et al., 2002; Pan et al., 2007), 비교적 안정적인 분자구조 덕분에 경구 섭취 시 레 스베라트롤 보다 생체이용성이 훨씬 클 뿐만 아니라 (Mannal et al., 2010; Riche et al., 2013) 암세포의 성장을 억제하고 apoptosis(세포사멸)를 유도하는 효능이 더 높다 고 알려져 있다(Tolomeo et al., 2005; Chang et al., 2012). 또한, 미국 농업연구청의 Rimando 연구팀에 의하면 테로 스틸벤이 지방의 대사에 관여하는 단백질의 작용을 촉진시 켜 혈중 중성 지질의 농도를 낮추는 효과가 레스베라트롤 에 비해 우수했고 심지어 합성지질 저하제의 일종인 시프 로피브레이트(ciprofibrate)보다 더 효과적이었다고 보고하였 다(Rimando et al., 2005).
이러한 효용성에도 불구하고 테로스틸벤에 대한 연구는 레스베라트롤에 비해 미흡한 실정인데 그 이유는 천연 자원 내에 미량 존재하기 때문에 활용 자체가 쉽지 않기 때문이 다(Rodríguez-Bonilla et al., 2011). 이러한 극미량의 생리활성 물질을 생물산업적 소재로 활용하기 위해, 식물체의 세포 대 사를 조절하여 기능성 물질의 함량을 증폭시킬 수 있는 호 머시스 연구가 유용한 수단으로 활용될 가능성이 매우 크다.
따라서 본 연구에서는 낮은 수준의 고압 처리에 따른 블 루베리 내 테로스틸벤 함량분석과 생물활성 평가를 통해 수확 이후 블루베리의 테로스틸벤 함량 강화를 위한 기술 의 하나로서 압력 처리에 의한 호머시스의 가능성을 확인 하고자 하였다.
재료 및 방법
실험재료 및 시약
본 연구에서는 일산 지역에서 2014년 7월에 수확한 브 리지따(Brigitta) 품종의 블루베리(Vaccinium spp.)가 사용되 었다. 수확 직후 고압 처리를 한 블루베리는 과피와 과육 을 분리하였고, 과피만을 동결건조하여 분석에 사용하였다. 실험에 사용한 모든 시약은 HPLC grade를 사용하였고, JT Baker (Phillipsburg, NJ, USA)와 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하였다. 표준물질로 사용한 테 로스틸벤은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하여 사용하였다.
고압 처리
수확 직후의 블루베리를 0.05 mm 두께의 polyethylene bag에 담은 후 세포조직이 거의 손상되지 않을 정도로 진 공 밀봉하여 초고압 장치(TFS-10L, Toyo Koatsu Co. Ltd., Hiroshima, Japan)에 투입한 후 압력처리를 실시했다. Fig. 1은 식품고압장치의 개략적인 구조도를 나타낸 것으로 압 력관, 압력 조절장치, 온도조절장치로 구성되어 있다. 밀봉 된 시료를 압력관에 넣고 처리 조건(압력, 온도, 시간)을 설정하면, 압력조절장치와 온도조절장치에 의해 압력관 내 의 온도와 압력이 설정 조건으로 맞추어지고, 그 다음 처 리 시간 동안 압력과 온도가 유지된 후 처리 시간이 끝나 는 즉시 압력이 해제되었다. 본 실험에서는 25°C에서 5분 간 2, 10, 20MPa로 압력 조건을 다르게 하여 처리하였다.
Fig. 1.
Schematic diagram of high pressure system.
1: vessel, 2: oil return system, 3: pump, 4: solenoid value, 5: booster pump, 6: solenoid value, 7: solenoid value, 8: pilot check, 9: drain valve, 10: safety sensor, 11: relief value, 12: solenoid value, 13: level sensor, 14: solenoid value, 15: safety value, 16: drain pipe (Kim, 2009).
Download Original Figure
테로스틸벤의 추출
고압 처리에 따른 테로스틸벤의 정량적 변화를 분석하기 위해 Määttä-Riihinen et al. (2004)의 방법과 Jeandet et al. (1997)의 방법을 수정하여 스틸벤을 추출한 후 HPLC법으 로 분석하였다. 즉, 동결건조된 블루베리 과피를 믹서기로 분쇄하였다. 분쇄된 시료 3 g에 25 mL의 에틸아세테이트를 가하여 현탁시킨 후 초음파 처리기(5210R-DTH, Branson Ultrasonics Co., Danbury, CT, USA)로 30분간 처리하여 추출하였다. 추출액을 원심분리장치(Centrikon T-324, Kontron, Milano, Italy)를 사용하여 10분간 12,000×g로 원심 분리한 후 여과하였고, 잔여물을 수거하여 같은 방법으로 재추출하였다. 여과액을 혼합한 후 감압농축기(Rotavapor R-210, Buchi, Flawil, Switzerland)를 사용하여 40°C에서 농축하였고, 농축물을 1 mL의 메탄올에 녹여 0.22 μm syringe filter로 여과한 후 HPLC에 주입하였다.
HPLC 분석
블루베리 과피 추출물에 함유되어 있는 테로스틸벤을 HPLC법에 의해 정량하였다. HPLC 시스템(Agilent 1100 series, Agilent Technologies, Santa Clara, CA, USA)은 펌 프, 인젝트, 형광검출기, 적분기(Chemstation software), 컬 럼(Agilent Eclipse XDB-C18: 4.6 mm × 250 mm, 5 μm, ZORBAX) 등으로 구성되었으며, 분석 조건은 다음과 같다. Water (A)/acetonitrile (B)를 용매로 하여 gradient 조건 하 에서 1.0 mL/min의 유동속도로 40분간 작동시켰다. 이때 시료 주입량은 20 μL이었고, 용매의 gradient 조건은 초기 90:10의 A/B 비율로 시작하여 18분까지 15:85, 23분까지 15:85 비율로 유지한 후 30분까지 90:10으로 조정되었으며, 마지막으로 10분 동안 90:10으로 유지하였다. 검출파장은 형광검출기의 여기파장 330 nm, 측정파장 374 nm에서 측 정되었고, 분석 컬럼의 오븐 온도는 25°C로 일정하게 하였 다. 각 실험값은 3회 반복하여 측정한 후 평균으로 표시하 였다.
생물활성 평가
블루베리 과피 시료의 생물활성은 Hong et al. (2012)의 방법에 의해 해독화 효소 발현 조절 능력을 평가하였다. 분말화된 블루베리 시료를 100 mg/mL로 10% DMSO in PBS 용액에 녹여 -20°C 냉동고에 보관 후 실험시 희석하 여 사용하였고, 해독화 효소 발현 조절 능력은 quinone reductase (QR) 유도활성 측정을 통해 평가되었다. 마우스 간암 세포주인 Hepa 1c1c7 세포를 배양, 처리한 후 lysis 하여 효소용액을 첨가하여 반응시킨 후 단백질 양을 crystal violet 염색방법으로 정량하여 시험군 처리에 따른 QR 유도활성을 측정하였다.
통계처리
테로스틸벤 함량 변화의 경우 Windows용 SAS 8.0 version (SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석(ANOVA)을 실시하였으며, p<0.05 수준에서 Duncan의 multiple range test로 유의성을 검정하였다. 생물 활성 평가의 경우 ANOVA multi t-test (JAVA, Bonferroni Ver II)로 같은 수준에서 유의성을 판정하였다.
결과 및 고찰
고압 처리에 의한 테로스틸벤 증폭 효과
물리적 처리를 통한 호머시스 연구가 지속적으로 보고되 고 있지만 주로 자외선 처리에 의한 연구가 대부분이다. 국내에서는 자외선 조사에 의한 기능성 증폭에 대한 연구 를 Cho et al. (2008, 2011, 2012)이 수행하였으며, UV-A 와 UV-C를 이용하여 수확 직후의 과실에 자극을 주었을 때 딸기의 경우 펠라고닌(pelargonin)과 시아닌(cyanine)의 함량이 증가하는 경향을 보였고, 포도의 경우 레스베라트 롤(resveratrol) 함량을 최대 5배 이상 증폭할 수 있었다고 보고하였다.
본 연구에서는 수확된 블루베리의 대사를 조절하기 위해 3가지 수준의 압력 즉, 2, 10, 20MPa를 가한 후, 압력 처 리에 따른 테로스틸벤 함량 변화를 알아보기 위하여 HPLC 분석법을 사용하여 해당 물질의 함량을 정량분석 하였다. Table 1은 블루베리를 고압처리했을 때 압력 수준 에 따른 테로스틸벤 함량의 변화를 나타낸 것이다. 블루베 리에 압력을 처리하기 전에는 테로스틸벤의 함량이 0.25±0.03 μg/g이었으나, 고압 처리 후 0.33±0.05 μg/g까지 유의적으로 증가하였다(p<0.05). 즉, 10 MPa 이하로 처리 하였을 경우에 테로스틸벤의 함량이 약 33% 증가되어 대 조구 대비 1.33배의 함량을 얻을 수 있었다. Pombo et al. (2011)은 UV 등과 같은 물리적 처리로 과실을 자극했을 때 2차 대사산물의 생합성 경로인 phenylpropanoid pathway 에 관여하는 첫 번째 효소인 PAL의 유전자 발현이 증가됨 으로써 과실 내 페놀류의 함량이 증폭되는 호머시스 효과 를 얻을 수 있었다고 보고한 바 있다. 테로스틸벤 또한 2 차 대사산물 중 하나로, 낮은 수준의 압력 처리에 의해 생 합성 효소의 유전자 발현이 유도되어 생성율이 향상되었을 가능성이 있다. 따라서 향후 고압처리에 의한 테로스틸벤 함량 변화와 관련 유전자의 발현 양상을 분석함으로써 고 압 호머시스 기작에 대한 규명이 필요할 것으로 판단된다.
Table 1.
Pterostilbene content and enrichment ratio in blueberry peels after high pressure treatment
| Pressure |
Content (μg/g) |
| Untreated |
0.25c±0.031) |
| 2 MPa |
0.33a±0.05 |
| 10 MPa |
0.33a±0.03 |
| 20 MPa |
0.29ab±0.04 |
Download Excel Table
고압 처리에 의한 생물활성 변화 분석
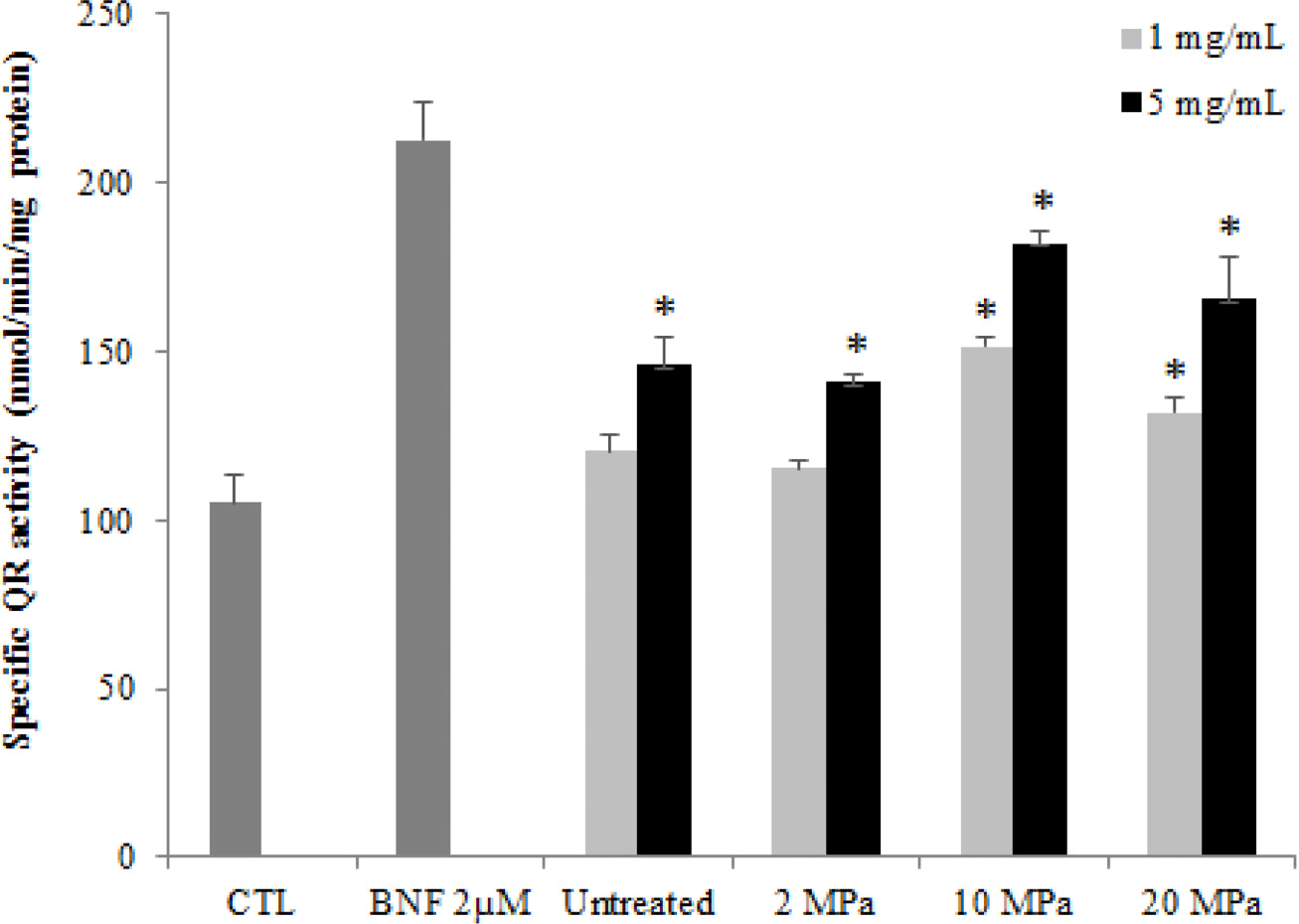
블루베리는 대표적인 생리활성물질로서 flavonoid 계열의 색소인 anthocyanin을 함유하고 있으며 이의 항암 기작으 로 QR 등의 phase II 효소 활성 변화에 대한 많은 보고가 이루어져 있다(Srivastava et al., 2007; Dulebohn et al. 2008). 특히 Hong et al. (2012)은 자외선 호머시스에 의해 기능성 성분이 증폭된 딸기에서 QR 유도활성 등의 생물활 성이 향상되는 것을 확인함으로써 과실의 숙성 조절, 저장 성 향상 등에 대한 기존의 호머시스 효과뿐만 아니라 건강 기능성이 증대되는 효과 또한 가능하다는 Cho et al. (2008)의 연구를 뒷받침하였다. 따라서 본 연구에서는 고압 호머시스에 대한 기초 연구로서 블루베리에 대한 고압 효 과를 분석하기 위하여 일차적으로 발암과정 억제에 관여하 는 해독화 효소인 QR 발현 유도 효능을 평가하였다.
Fig. 2는 낮은 수준의 압력을 처리한 블루베리의 QR activity를 분석한 결과를 나타낸 것이며, 대조구 및 압력 무 처리 블루베리와 비교하였고, 양성 대조군으로는 QR 유도 활성이 있다고 알려진 β-naphthoflavone (BNF) 2 μM을 사 용하였다. Hapa 1c1c7 cells에 시료 1 mg/mL과 5 mg/mL의 두 가지 농도로 처리한 다음 QR 유도활성을 측정한 결과, 전체적으로 압력을 처리한 블루베리에서 압력 처리하지 않 았을 때보다 높은 유도효과를 나타내었다. 따라서 본 연구 에서는 블루베리의 유용 성분 증폭 및 생리활성 증대에 있 어서 고압처리의 활용 가능성을 최초로 확인한 바, 향후 고 압 호머시스에 관한 연구의 기초 데이터로서 가치가 있다고 판단된다.
Fig. 2.
Quinone reductase activity of blueberry peels after high pressure treatment.
*Mean is significantly different at p<0.05. Mean is significantly different as compared to CTL at p<0.05.
Download Original Figure
요 약
스틸벤에 대한 다양한 건강기능성 효과가 밝혀짐에 따라 스틸벤계 대표 물질인 레스베라트롤이 기능성식품 및 관련 산업의 주요 소재로 활용되고 있다. 최근에는 레스베라트 롤 보다 생물학적 이용가능성이 훨씬 더 크다고 알려진 테 로스틸벤에 대한 관심이 높아지고 있다. 다만, 테로스틸벤 은 천연자원에서 미량으로 존재하기 때문에 산업적 소재로 활용하기 위해서는 추출 효율을 높이기 위한 시도뿐만 아 니라 함량 자체를 높일 수 있는 새로운 접근법이 필요하다. 이에 따라 본 연구에서는 과채류가 수확 이후에도 세포 활 성이 유지된다면 호머시스에 의한 2차 대사산물의 유도합 성이 가능하다는 이론에 근거하여 블루베리 수확 후 낮은 수준의 압력을 처리하였을 때 블루베리에 함유된 테로스틸 벤의 함량과 생물활성 변화를 평가하고자 하였다. 평가 결 과에 의하면, 압력 수준에 따라 다소의 차이는 있으나 전 반적으로 고압 처리 후 블루베리의 테로스틸벤 함량이 증 가하고 해독화 효소 발현 조절 능력이 향상되는 것을 확인 할 수 있었다. 따라서 본 연구팀은 호머시스를 유도할 수 있는 후보 기술로서 고압 처리의 활용 가능성을 확인하였 기에 향후 고압 호머시스에 대한 지속적인 연구의 필요성 을 제시하는 바이다.
감사의 글
본 연구는 한국식품연구원 “식품고압기술개발사업”의 지 원에 의해 이루어진 것입니다.
REFERENCES
Baur JA, Sinclair DA. Therapeutic potential of resveratrol: the in vivo evidence. Nat. Rev. Drug Discov. 2006; 5 p. 493-506.

Cantos E, Garcia-Viguera C, de Pascual-Teresa S, Tomas-Barberan FA. Effect of postharvest ultraviolet irradiation on resveratrol and other phenolics of cv. Napoleon table grapes. J. Agric. Food Chem. 2000; 48 p. 4606-4612.

Chang JW, Rimando A, Pallas M, Camins A, Porquet D, Reeves J, Shukitt-Hale B, Smith MA, Joseph JA, Casadesus G. Low-dose pterostilbene, but not resveratrol, is a potent neuromodulator in aging and Alzheimer’s disease. Neurobiol. Aging. 2012; 33 p. 2062-2071.

Cho MJ, Howard LR, Prior RL, Clark JR. Flavonol glycosides and antioxidant capacity of various blackberry and blueberry genotypes determined by high performance liquid chromatography/mass spectrometry. J. Sci. Food Agric. 2005; 85 p. 2149-2158.

Cho YJ, Kim JE, Chun HS, Kim JT, Kim SS, Kim CJ. Contetns of resveratrol in different parts of grapes. Korean J. Food Sci. Technol. 2003a; 35 p. 306-308.

Cho YJ, Kim CJ, Kim CT, Kim TE, Bae KS, Kihl JY, Pyee JH, Lee SK. Effect of UV hormesis on phenolics contents in strawberries. Food Eng. Prog. 2008; 12 p. 143-148.

Cho YJ, Kim NS, Kim CT, Maeng JS, Pyee JH. Quantitative evaluation of resveratrol enrichment induced by UV stimulus in harvested grapes. Food Sci. Biotechnol. 2012; 21 p. 597-601.

Cho YJ, Lee SK, Ahn YH, Pyee JH. Development of ultrasonication-assisted extraction process for manufacturing extracts with high content of pinosylvin from pine leaves. J. Biosystems Eng. 2003b; 28 p. 325-334.

Cho YJ, Maeng JS, Kim CT, Pyee JH. nrichment of resveratrol content in harvested grape using modulation of cell metabolism with UV treatment. J. East Asian Soc. Diet. Life. 2011; 21 p. 739-745.

Danon A, Gallois P. UV-C radiation induces apoptoticlike changes in Arabidopsis thaliana. FEBS Lett. 1998; 437 p. 131-136.

Donnez D, Jeandet P, Clement C, Courot E. Bioproduction of resveratrol and stilbene derivatives by plant cells and microorganisms. Trends Biotechnol. 2009; 27 p. 706-713.

Dulebohn RV, Yi W, Srivastava A, Akoh CC, Krewer G, Fischer JG. Effects of blueberry (Vaccinium ashei) on DNA damage, lipid peroxidation, and phase II enzyme activities in rats. J. Agric. Food Chem. 2008; 56 p. 11700-11706.

Hong JY, Lee SK, Cho YJ, Kim CJ, Kim NS, Kim CT, Maeng JS. Effect of post-harvest ultraviolet irradiation on biological activities in strawberries. Food Eng. Prog. 2012; 16 p. 69-73.

Jang M, Cai L, Udeani GO, Slowing KV, Thomas CF, Beecher CWW, Fong HHS, Farnsworth NR, Kinghorn AD, Mehta RG, Moon RC, Pezzuto JM. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science. 1997; 275 p. 218-220.

Jeandet P, Breuil AC, Adrian M, Weston LA, Debord S, Meunier P, Maume G, Bessis R. HPLC analysis of grapevine phytoalexins coupling photodiode array detection and fluorometry. Anal. Chem. 1997; 69 p. 5172-5177.

Kim JT. New technology - high pressure technology for food application and prospect as green technology. Bulletin Food Technol. 2009; 22 p. 321-330.

Lee HJ, Yang SJ. Effects of resveratrol on hepatic autophagy in high fat diet-induced obese mice. J. Nutr. Health. 2013; 46 p. 307-314.

Lekakis J, Rallidisa LS, Andreadou I, Vamvakou G, Kazantzoglou G, Magiatis P, Skaltsounis AL, Kremastinos DT. Polyphenolic compounds from red grapes acutely improve endothelial function in patients with coronary heart disease. Eur. J. Cardiovasc. Prev. Rehabil. 2005; 12 p. 596-600.

Mannal PW, Alosi JA, Schneider JG, McDonald DE, McFadden DW. Pterostilbene inhibits pancreatic cancer in vitro. J. Gastrointest. Surg. 2010; 14 p. 873-879.

Maatta-Riihinen KR, Kamal-Eldin A, Torronen AR. Identification and quantification of phenolic compounds in berries of Fragaria and Rubus species (family Rosaceae). J. Agric. Food Chem. 2004; 52 p. 6178-6187.

Pan MH, Chang YH, Badmaev V, Nagabhushanam K, Ho CT. Pterostilbene induces apoptosis and cell cycle arrest in human gastric carcinoma cells. J. Agric. Food Chem. 2007; 55 p. 7777-7785.

Pombo MA, Rosli HG, Martinez GA, Civello PM. UV-C treatment affects the expression and activity of defense genes in strawberry fruit (Fragaria × ananassa, Duch.). Postharvest Biol. Technol. 2011; 59 p. 94-102.

Riche DM, McEwen CL, Riche KD, Sherman JJ, Wofford MR, Deschamp D, Griswold M. Analysis of safety from a human clinical trial with pterostilbene. J. Toxicol. 2013; 2013 p. 1-5.

Rimando AM, Cuendet M, Desmarchelier C, Mehta RG, Pezzuto JM, Duke SO. Cancer chemopreventive and antioxidant activities of pterostilbene, a naturally occurring analogue of resveratrol. J. Agric. Food Chem. 2002; 50 p. 3453-3457.

Rimando AM, Nagmani R, Feller DR, Yokoyama W. Pterostilbene, a new agonist for the peroxisome proliferator-activated receptor α-isoform, lowers plasma lipoproteins and cholesterol in hypercholesterolemic hamsters. J. Agric. Food Chem. 2005; 53 p. 3403-3407.

Rodriguez-Bonilla P, Lopez-Nicolas JM, Mendez-Cazorla L, Garcia-Carmona F. Development of a reversed phase high performance liquid chromatography method based on the use of cyclodextrins as mobile phase additives to determine pterostilbene in blueberries. J. Chrom. B. 2011; 879 p. 1091-1097.

Shama G, Alderson P. UV hormesis in fruits: a concept ripe for commercialisation. Trends Food Sci. Tech. 2005; 16 p. 128-136.

Srivastava A, Akoh CC, Fischer J, Krewer G. Effect of anthocyanin fractions from selected cultivars of Georgia-grown blueberries on apoptosis and phase II enzymes. J. Agric. Food Chem. 2007; 55 p. 3180-3185.

Stivala LA, Savio M, Fedarico C, Perucca P, Bianchi L, Magas G, Forti L, Pagnoni UM, Albini A, Prosperi E, Vannini V. Specific structural determinants are responsible for the antioxidant activity and the cell cycle effects of resveratrol. J. Biol. Chem. 2001; 276 p. 22586-22594.

Tolomeo M, Grimaudo S, Di Cristina A, Roberti M, Pizzirani D, Meli M, Dusonchet L, Gebbia N, Abbadessa V, Crosta L, Barucchello R, Grisolia G, Invidiata F, Simoni D. Pterostilbene and 3'-hydroxypterostilbene are effective apoptosisinducing agents in MDR and BCR-ABL-expressing leukemia cells. Int. J. Biochem. Cell Biol. 2005; 37 p. 1709-1726.

Wang W, Tang K, Yang HR, Wen PF, Zhang P, Wang HL, Huang WD. Distribution of resveratrol and stilbene synthase in young grape plants (Vitis vinifera L. cv. Cabernet Sauvignon) and the effect of UV-C on its accumulation. Plant Physiol. Biochem. 2010; 48 p. 142-152.