서 론
Hemicellulose는 cellulose에 이어 자연계에 두 번째로 널 리 존재하는 다당류로서 기본적으로 D-xylan과 D-mannan 으로 구성되어 있으며 이외에도 여러 당류들의 다양한 결 합을 가지는 이형다당류(hetero-polysaccharide)이다(Lee & Papoutsakis, 1999). Hemicellulose의 주성분을 이루는 xylan 및 xylan 유도체의 함량은 침엽수에는 20-45%, 활엽수에는 80-90%, 밀, 보리, 벼, 귀리 등의 짚에는 68-78%정도로 식 물체의 종류에 따라 다양하다. 그 중 일년생 농작물 및 자 작나무에서 주로 발견되는 xylan은 5탄당인 D-xylose가 β- 1,4 결합으로 연결되어 있는 중합체로서 D-glucose, Larabinose, D-gluconic acid가 일부 결합되어 있으며 해조류 에서 발견되는 xylan의 경우 D-xylose가 β-1,3 결합으로 연결되어 있다(Horikoshi & Akiba, 1982). Xylan을 분해하 기 위해서는 산이나 알칼리 처리와 같은 화학적 방법 이외 에 미생물이 생산하는 xylan 분해효소를 이용하는 방법 혹 은 이 두 가지 방법을 병용하여 D-xylose를 생산하는 방법 이 있다(Dekker, 1983). 이 중 Xylan에 대한 가수분해 효 소는 동·식물 및 미생물에 의해 널리 생산되고 있으며 서 로 다른 기질 특이성을 가지고 있다.
Xylanase는 지금까지 매우 다양한 미생물이 생산하는 것 으로 알려져 있고 가장 많은 연구가 이루어진 미생물은 Bacillus와 Aspergillus속 미생물인데, 특히 세균인 Bacillus 에 의해 생산되는 xylanase의 경우 곰팡이인 Aspergillus속 곰팡이에 비해 배양시간이 짧고 많은 효소를 단 시간 내에 얻을 수 있으며 중성, 알칼리성 등의 환경적 조건에 적합 한 효소를 쉽게 생산할 수 있다는 장점을 가지고 있다 (Battan et al., 2007, Lu et al., 2008). 특히 물에 불용성인 xylan이 알칼리 조건에서는 쉽게 용해된다는 장점 때문에 호알칼리성 미생물이 생산하는 xylan 분해효소에 관하여 많은 관심이 집중되고 있다. 이에 본 연구자들은 국내의 토양으로부터 xylan 분해효소활성을 보유한 호알카리성 균 주를 분리하여 균주의 특성에 대하여 연구한 결과 본 균주 가 호알칼리성 세균인 Bacillus agaradhaerens임을 확인하 여 보고하였다(Choi & Bai, 2010). 본 연구에서는 호알칼 리성 세균인 Bacillus agaradhaerens DK-2386 균주로부터 xylanase의 생산조건에 대하여 검토하였다.
재료 및 방법
Xylanase 활성은 전보에서와 같이 DNS법에 의한 환원당 정량법을 사용하였다(Choi & Bai, 2010). 1% xylan 용액 (oat-spelt xylan in 50 mM sodium phosphate buffer, pH 6.0) 800 μL에 효소액 200 μL를 혼합하여 60℃에서 20분간 반응 시킨 후 반응액 300 μL에 DNS (dinitrosalicylic acid) 용액 3mL를 가하여 반응을 정지시키고 100℃에서 10분간 가열 하였다. 냉각 후 분광광도계를 이용하여 540 nm에서 흡광도 를 측정하였다. 표준시약으로는 D-xylose (Sigma Co., St. Louse, MO, USA)를 사용하였고, 효소 1 unit는 분당 1 μmol 의 D-xylose를 생성할 수 있는 효소의 양으로 정의하였다. DNS 시약은 dinitrosalicylic acid (Sigma Co.) 0.5 g과 potassium sodium tartrate tetrahydrate 150 g을 2 N NaOH 용액 50 mL와 혼합한 후 증류수 250mL에 희석하여 사용하였다.
Bacillus agaradhaerens DK-2386 균주의 액체배양에 의 한 xylanase 생산을 최적화하기 위하여 균체 증식 및 효소 생산에 영향을 주는 배양시간, 배양온도, 배양속도, pH, 탄 소원, 질소원, 무기염류 및 NaCl 농도의 영향을 조사하였 다. Horikoshi I 배지(Horikoshi & Akiba, 1982) 20 mL에 한천 평판배지에 배양하여 보관한 균체 1 loop를 접종하여 40℃에서 130 rpm의 속도로 24시간 진탕배양하여 이를 종 배양액으로 사용하였다. 이 후 각 실험에 종배양액을 본 배 양액의 1%(w/w) 농도로 접종하여 효소생산 및 배양조건 등 을 검토하였다. 균체의 생육도는 UV-VIS spectrophotometer (UV-2450, Shimazu, Kyoto, Japan)로 600 nm에서 광학밀도 (O.D.)를 측정하여 결정하였다.
결과 및 고찰
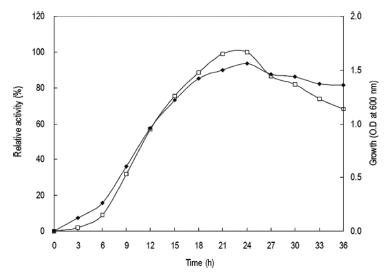
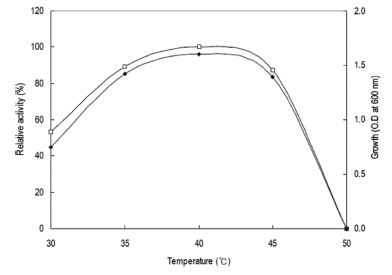
0-36시간동안 배양을 진행하면서 3시간 간격으로 배양액 을 취하여 상등액의 효소활성을 확인하였다. 그 결과 Fig. 1과 같이 배양액에서의 효소활성은 배양 24시간에 최대의 활성을 나타내었으며 이후 점차 활성이 감소하는 경향을 확인할 수 있었다. 균체생육 또한 24시간에서 최대의 생육 을 나타내었으며 30시간 이후부터 점차 생육이 감소하는 경향을 확인할 수 있어 본 균체로부터 효소의 생산은 균체 의 생육과 효소의 생산이 관련된 growth associate형임을 확인할 수 있었다. 그러므로 이후의 실험에 있어 종배양액 을 접종하여 24시간 배양 후 배양액을 회수하였다. 각 온 도별 배양액으로부터 효소활성과 균체생육을 측정한 결과 는 Fig. 2와 같았다. 효소생산은 40℃에서 최대로 생산되 었으며 균체생육 또한 40℃에서 최대로 생육하였고 50℃ 에서는 균체가 생육하지 못하였으므로 본 균주는 중온균임 을 확인할 수 있었다. 그러므로 이후의 실험에 있어 배양 온도를 40℃로 하였다.
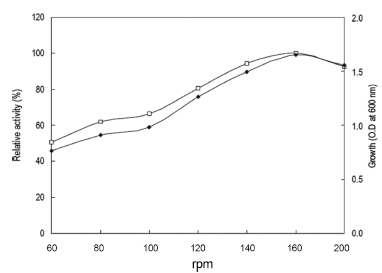
진탕배양기의 속도를 0-200 rpm까지 달리하여 40℃에서 24시간동안 배양하였으며 배양액으로부터 효소활성과 균체 생육을 측정한 결과는 Fig. 3과 같았다. 160 rpm의 속도로 진탕배양 하였을 때 최대의 효소생산을 확인할 수 있었으 며 균체 생육에 있어서도 160 rpm의 속도로 진탕 배양 시 최대로 생육하는 것을 확인할 수 있었다. 검토결과 본 균 주는 산소의 공급이 많을수록 효소의 생산성이 향상되는 것을 확인할 수 있었다. 그러므로 이후의 실험에 있어 배 양속도를 160 rpm로 하였다.
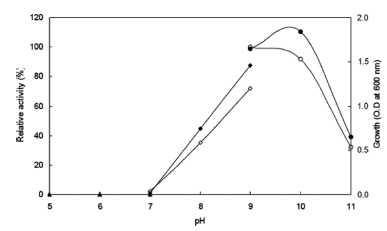
pH의 영향을 확인하기 위하여 Horikoshi I 배지에서 sodium carbonate를 제거하였다. 50 mM 농도의 각 buffer (sodium phosphate pH 5-7, Tris-HCl pH 7-9, sodium carbonate-NaOH pH 9-11)에 배지성분을 용해하여 배지를 제조하였다. 각 배양액으로부터 효소활성과 균체 생육을 측정한 결과는 Fig. 4와 같았다. 효소생산은 pH 9.0으로 배양 시 최대로 생산되었으며, 균체는 pH 8.0 이상에서부 터 생육이 증가하여 pH 10.0으로 배양 시 최대로 생육하 였다. pH 5-7 범위에서는 균체가 생육하지 못하고 pH 8.0 이상부터 생육하는 것으로 보아 호알칼리성 균주임을 확인 할 수 있었다. 그러므로 이후의 실험에 있어 배지의 초기 pH를 9.0로 조절하였다.
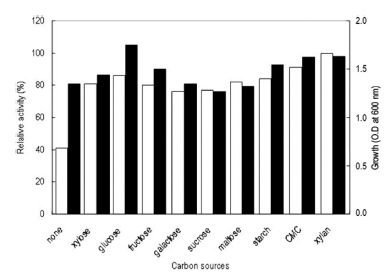
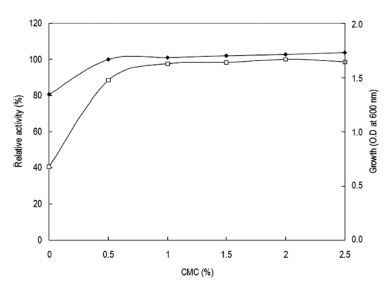
탄소원의 영향을 확인하기 위하여 Horikoshi I 배지에서 탄소원인 glucose를 제거하고 각 탄소원을 1% (w/v)씩 첨 가하여 배지를 제조하였다. 각 배양액으로부터 효소활성과 균체생육을 측정한 결과는 Fig. 5와 같았다. 탄소원으로 xylan (oat-spelt)을 이용하였을 경우 최대로 효소를 생산하 였으며, 균체의 생육은 glucose를 이용하였을 경우 최대로 생육하였다. 그러나 sodium carboxy methyl cellulose (CMC)를 탄소원으로 이용 시 xylan (oat-spelt)에 비하여 효소생산성이 10% 정도 낮았으나 CMC와 xylan (oatspelt) 의 가격을 비교한 결과 CMC가 xylan (oat-spelt)에 비 하여 13배 이상 가격이 낮으므로 CMC를 탄소원으로 이용 하는 것이 보다 효율적이었다. 또한 환원당인 glucose 등을 이용하는 경우 본 실험의 효소활성 측정방법인 DNS법에 있어 환원당의 잔당에 의한 정확한 효소활성의 측정이 어 려우므로 CMC를 탄소원으로 결정하였다. CMC 농도변화 에 따른 효소생산을 검토한 결과 배지에 1% (w/v) 농도로 첨가 시 최대 활성을 나타내었다(Fig. 6). 1% (w/v) 이상의 CMC 농도에서는 균체의 생육은 증가하나 효소활성은 큰 변화를 보이지 않는 것을 확인할 수 있었다. 그러므로 이 후의 실험에 있어 배지의 탄소원으로 CMC를 1% (w/v) 농도로 첨가하여 사용하였다.
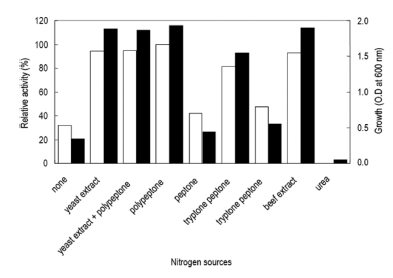
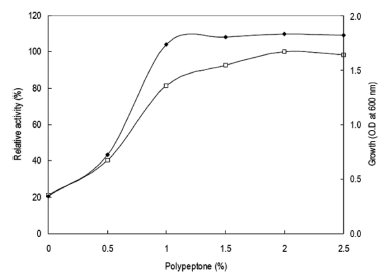
질소원의 영향을 확인하기 위하여 질소원인 yeast extract 와 polypeptone을 제거하였다. Yeast extract와 polypeptone 을 대신하여 각 질소원을 1% (w/v)씩 첨가하여 배지를 제 조하였다. 각 배양액으로부터 효소활성과 균체생육을 측정 한 결과는 Fig. 7과 같았다. 질소원으로 polypeptone을 이 용하였을 경우 최대로 효소를 생산하였으며 균체생육에 있 어서도 polypeptone를 이용 시 최대로 생육함을 확인할 수 있었다. 액체배양 시 urea를 질소원으로서는 이용하지 못하 는 것으로 확인되었다. Polypeptone 농도 변화에 따른 효 소생산을 확인한 결과 배지에 2% (w/v) 농도로 첨가 시 효소활성이 최대임을 확인할 수 있었다(Fig. 8). 그러나 2% (w/v) 이상의 농도에서는 효소생산에 큰 영향이 없음 을 확인할 수 있었다. 그러므로 이후의 실험에 있어 배지 의 질소원으로 polypeptone을 2% 농도로 첨가하여 사용하 였다. 질소원의 영향을 검토한 결과 본 균주는 질소원의 종류와 농도에 의하여 효소생산 및 균체생육에 큰 영향을 받는 것을 확인할 수 있었다.
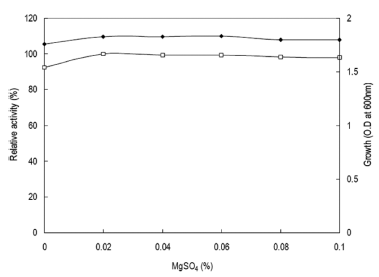
무기염류의 영향을 확인하기 위하여 탄소원과 질소원으로 glucose와 yeast extract 대신 CMC 1% (w/v), polypeptone 2% (w/v)가 첨가된 Horikoshi I 배지에 MgSO4·7H2O를 제 거하였다. MgSO4·7H2O를 대신하여 각 무기염류를 배지농 도의 0.02% (w/v) 농도로 첨가하여 배지를 제조하였다. 각 배양액으로부터 효소활성과 균체생육을 측정한 결과는 Table 1과 같았다. MgSO4·7H2O를 이용 시 효소생산이 최 대였으며, 균체의 생육에 있어서도 MgSO4·7H2O에서 최대 로 생육함을 확인할 수 있었다. 그러나 Hg2+, Li2+, Cu2+, Cd2+, Bi2+, Fe2+의 첨가 시 효소생산이 억제되거나 균체생 육이 저해되는 것을 확인할 수 있었다. 한편 MgSO4·7H2O 의 농도변화에 따른 효소생산을 검토한 결과 배지의 0.02% (w/v) 농도로 첨가 시 최대의 효소활성을 보였으며 (Fig. 9), 0.02% (w/v) 이상의 농도에서는 농도증가에 따라 효소생산 및 균체생육에 큰 영향이 없음을 확인할 수 있었 다. 그러므로 이후의 실험에 있어 배지에 무기염류로 MgSO4·7H2O를 0.02% (w/v) 농도로 첨가하여 사용하였다.
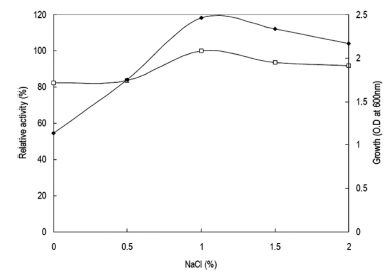
Bacillus agaradhaerens DK-2386 균주의 특성을 검토하 는 과정에 있어 본 균주의 NaCl 농도에 따른 생육정도를 확인한 결과 NaCl 농도에 따라 균체의 생육이 영향을 받 는 것을 확인할 수 있었다. 따라서 본 균주가 효소생산에 growth associate의 경향을 나타내었으므로 효소생산과 균 체생육에 미치는 NaCl의 영향을 확인하였다. Horikoshi I 배지에 NaCl을 0-2% (w/v)까지 0.5% (w/v) 단위로 각각 첨가하고 pH를 9.0으로 조절하여 배지를 제조하였다. 종배 양액을 각 NaCl 농도별 배지에 1% 농도로 접종하여 40℃ 에서 24시간 동안 160 rpm의 속도로 배양하였다. 각 배양 액으로부터 효소활성과 균체생육을 측정한 결과는 Fig. 10 과 같았다. NaCl을 배지에 1% (w/v) 농도로 첨가 시 최대 의 효소생산과 균체생육을 확인할 수 있었다. 그러나 1% 이상의 농도에서는 오히려 효소생산과 균체의 생육이 감소 함을 확인할 수 있었다. 배지에 NaCl을 1% 농도로 첨가함 에 따라 균체의 생육이 급속히 증가하는 것으로 확인되었 으며 효소의 활성 또한 약 20%정도 증가하였다. 따라서 NaCl 농도가 xylanase 생산과 균체생육에 영향을 미치는 중요한 성분임을 확인하였다.
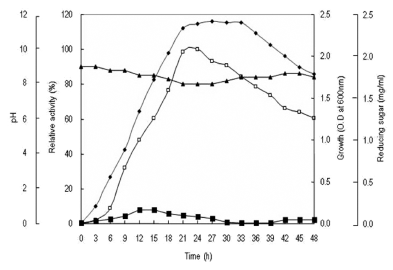
이상의 결과로서 xylanase 생산을 위한 최적 배지 조성은 1% carboxymethyl cellulose, 2% polypeptone, 0.1% K2HPO4, 0.02% MgSO4·7H2O, 1% Na2CO3, 1% NaCl, pH 9.0이었 다. 최적 조건에서 배양시간에 따른 xylanase 생산과 균체 의 생육 및 pH 변화와 잔당량의 변화를 확인하였다. 0-48 시간동안 배양을 진행하면서 3시간 간격으로 배양액을 취 하여 균체생육 및 pH를 측정하고, 배양상등액으로 부터 효 소활성과 잔당량을 확인한 결과 Fig. 11과 같았다. 효소생 산은 배양 6시간부터 증가하기 시작하여 배양 24시간에 효소생산이 최대에 도달하였으며 이후 시간의 경과에 따라 점차 감소하는 경향을 나타내었다. 균체의 생육은 배양 3 시간 후부터 증가하기 시작하여 21시간 후에 정지기에 도 달하였고 배양 33시간까지 유지되었다. pH의 변화는 균체 생육에 따라 배양 초기에 감소하는 경향을 보이다가 정지 기에 가까워질수록 다시 증가하는 경향을 확인할 수 있었 다. 잔당량의 경우 첨가한 CMC이 분해됨에 따라 배양 6 시간부터 증가하기 시작하여 대수기에 해당하는 9-15시간 사이에 최대로 증가하였으며 21시간 이후부터 점차 감소하 는 경향을 확인할 수 있었다.