Article
효소처리를 이용한 복분자 추출공정의 최적화 연구
김희선, 최우영1, 김원석1, 김명환*
Study for the Optimal Extraction Processing Condition of Anthocyanin from Bokbunja by Enzymatic Treatment
Hee-Sun Kim, Woo-Young Choi1, Won-Suk Kim1, Myung-Hwan Kim*
Author Information & Copyright ▼
Department of Food Engineering, Dankook University
*Corresponding Author : Myung-Hwan Kim, Department of Food Engineering, Dankook University, Cheonan, 330-714, Korea Tel: +82-41-550-3563; Fax: +82-41-559-7868
kmh1@dankook.ac.kr
© Korean Society for Food Engineering All rights reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 23, 2014; Revised: Dec 14, 2014; Accepted: Dec 18, 2014
Abstract
This study was performed to determine the total anthocyanin contents, DPPH radical scavenging activity, and SODlike activity of extracted anthocyanins from Bokbunja for analyzing the optimal conditions of enzyme treatment by response surface methodology (RSM) based on three factors: concentration of Pectinex Ultra SP-L, reaction temperature, and reaction time. The optimal enzyme treatment conditions of Pectinex Ultra SP-L concentration, reaction temperature, reaction time, and overall desirability by analysis of multiple response surface methodology with the same weighed value of each dependent variable were 0.5 mL/100 L, 20°C, 2 hr, and 0.63, respectively. Total anthocyanin content, DPPH radical scavenging activity, and SOD-like activity of the conditions stated above were 5.2 mg/ 100 g, 61.3% and 30.5%, respectively. Meanwhile, those of the control were 1.1 mg/100 g, 11.8% and 1.1%, respectively.
Keywords: Bokbunja; extracted anthocyanin; enzyme; optimization; response surface methodology
서 론
복분자(Rubus coreanus Miq.)는 장미목(Rosales) 장미과 (Rosaceae)의 낙엽관목으로 한반도 남부지방, 중국, 일본 등 지에 분포하고 있으며 열매는 7-8월에 성숙되어 붉은색으 로 익으며 점차 검 붉은색으로 된다(Choung & Lim, 2012). 복분자에 함유되어 있는 안토시아닌(anthocyanin)은 합성착 색제를 대체할 수 있는 천연색소로서 주목을 받고 있으며 강한 항산화작용이 혈관계 질환, 암, 당뇨, 신경계 질환 등 의 치료에 효과가 있다는 연구결과가 있다(Konczak & Zhang, 2004).
세분자의 malonyl CoA와 한분자의 p-counmaroyl CoA에 의하여 생합성 되는 안토시아닌은 식물체에서 600여 종 이 상이 발견되었으며 적색, 자색 및 청색을 나타내는 수용성 flavonoid 색소로서 모두 안토시아니딘(anthocyanidin) 배당체 이며 안토시아니딘은 flavyilium(2-phenyl-1-benzopyrilim)의 기 본구조에 수산기 또는 메톡실기가 치환되어있는 구조를 가 진다(Choi, 2010; He & Giusti, 2011). 복분자는 씨앗과 과피 가 전체 과실의 20-25%를 차지하며 착즙 후 가공 과정을 거 쳐서 술, 음료, 전병, 환 등으로 제품화되고 있다(Choung & Lim, 2012).
안토시아닌 추출방법으로 주로 용매추출법을 이용하는데 메탄올 추출은 에탄올, 아세톤, 열수 추출에 비하여 각각 20, 50, 73%의 수율 증가 효과가 있으나 식품에서는 메탄 올의 독성 때문에 일반적으로 에탄올 추출법을 이용한다 (Metivier et al., 1980). 그 이외의 추출방법으로써 초임계 추출(Vatal et al., 2009), 초음파추출(Ivanovic et al., 2014), 마이크로웨이브추출(Teng et al., 2013) 등이 연구 보고되었 다. 효소처리를 이용한 추출공정은 주로 주스제조공정에서 이용되고 있으며 일반적으로 사용되는 효소는 펙틴효소로 세포벽 바탕질(cell wall matrix)을 분해함으로서 점도저하, 향, 추출 수율, 폴리페놀 함량 등을 증가시킨다(Krammer et al., 2005). 해리효소(Macerating enzyme)로서 pectiolytic, cellulolytic, hemicelluloytic 효소들을 혼합하여 사용하는 경 우도 있는데 이는 과실의 과피, 과육의 성분은 주로 pectin, cellulose, hemicellulose로 구성되어 있으며 과일의 종류에 따라서 그 함량이 다르고 사용되어지는 효소의 종류 와 양, 반응온도, pH 등에 영향을 받기 때문이다(Ducasse et al., 2010). 안토시아닌 추출 시에는 효소 선정에 신중하여야 하며 glycosidase는 안토시아닌을 가수분해하여 색소 안정 성에 문제를 야기 시킨다고 하였다(Wrolstad et al., 1994).
본 연구에서는 복분자 안토시아닌의 추출수율 및 생리활 성을 증진시키기 위하여 Pectinex Ultra SP-L 효소처리를 사용하였을 시 요인변수인 효소농도, 반응온도 및 반응시간 에 따른 총 안토시아닌함량, DPPH radical 소거능, SODlike 활성 등의 변화를 비교분석하였다. 실험설계는 중심합 성설계법(central composite design)에 의하여 행하였으며 다 중반응표면분석법에 의하여 최적의 안토시아닌 효소처리조 건을 조사하였다.
재료 및 방법
재료
본 실험에 사용한 복분자는 (주)우리농(Wanju-gun, Jeollabuk-do, Korea)에서 구입하였으며 분석에 사용한 시 약은 모두 Sigma사(St. Louis, MO, USA)의 특급 시약을 사용하였다.
추출 및 효소처리 공정
복분자의 추출 공정은 예비실험을 통하여 에탄올과 acidic sodium metaphosphate 농도, 추출 온도 및 추출 시 간을 설정하였다. 건물 1 g을 60% 에탄올 200 mL와 함께 sonicator (VC 601, Sonics & Materials Inc., Newtown, CT., USA)를 이용하여 40℃에서 1시간 추출하였으며 pH 조절제로써 0.7%(w/v) acidic sodium metaphosphate를 사 용하였다. 추출 후 수율 및 생리활성 향상을 위하여 pectinase(Pectinex Ultra SP-L, Novozyme, Bagsvaerd, Denmark)로 효소 처리를 하였고 그 다음 4000 rpm으로 15 분간 원심 분리하여 상등액을 얻었다. 상등액의 지방 성분 을 제거하기 위해 ethyl ether : n-hexane (1:6, v/v)용액으 로 세척한 다음 진공회전농축기(BÜCHI rotavapor R-124 and BÜCHI water bath B-480, Flawil, Switzerland)로 40℃에서 20 Brix까지 농축한 후 동결건조하여 시료로 사 용하였다.
실험설계
복분자를 이용한 효소처리 공정의 처리조건에 대한 실험 설계는 중심합성계획(central composite design)을 사용하였 으며 흥미구역은 Pectinex Ultra SP-L(5,000 FDU/mL)의 manual에서 최적 activity 범위구간으로 정하였다. 요인은 세 가지로서 시료에 대한 효소농도(X1) 0.5-1.5(mL/100 L), 반응온도(X2) 20-60℃, 반응시간(X3) 2-8시간을 흥미구역으 로 정하였으며 각 요인에 대한 수준은 Table 1과 같다. 각 독립변수는 수준을 3가지로하여 -1 − 1범위의 각 code value를 갖도록 부호화하여 중심합성계획에 따라 15구간으 로 설정하였다. 또한 이들 요인변수에 의해 영향을 받는 종속변수(Yn)로는 총 안토시아닌 함량(Y1), DPPH radical 소거능(Y2), SOD-like 활성(Y3)을 선정하였다. 효소처리 공정의 최적화를 위해 반응표면분석법(response surface methodology, RSM)을 사용하였으며 각 인자의 수준 변화 에 따른 효소처리 공정의 최적화를 위하여 분산분석, 이차 다항회귀곡선식 및 반응표면분석법 등의 통계 방법을 이용 하였으며 통계분석은 SAS 9.3을 이용하였다(SAS Institute Inc., Cary, NC, USA).
Table 1.
Factors and levels of experiment for enzyme-assisted extraction of anthocyanin from Bokbunja.
| Factors |
Code value |
|
|
-1 |
0 |
1 |
| Concentration of Pectinex Ultra SP-L (mL/100 L) |
X1 |
0.5 |
1.0 |
1.5 |
| Reaction temperature (°C) |
X2 |
20 |
40 |
60 |
| Reaction time (hr) |
X3 |
2 |
5 |
8 |
Download Excel Table
총 안토시아닌 함량
총 안토시아닌 함량은 Watada 와 Abbott(1975)에 따라 분 자흡광계수 65.1을 사용하여 다음과 같이 측정하였다. 동결 건조한 복분자 분말 2 g에 1.5 N HCl-95% EtOH(15:85, v/ v) 50 mL를 가하고 sonicator에서 1시간 동안 추출한 후 원심분리하여 얻어진 상층액을 같은 용매 100 mL로 정용 한 후 실온에서 2시간 암소에 방치한 후 상등액을 20배 희석하여 535 nm에서 흡광도를 측정하였다.
DPPH radical 소거능
시료 1 g을 시험관에 넣고 4.0mL의 95%(v/v)의 ethyl alcohol을 가하여 실험용액을 제조하였다. 이 용액에 0.2mM 2,2-diphenyl-1-picrylhydrazyl(DPPH) 용액 1.0 mL을 넣고 상온에서 30분간 반응시킨 후 U.V. visible spectrophotometer (OPTIZEN POP, Mecasys Co., Ltd., Daejeon, Korea)를 이 용하여 517 nm에서 흡광도를 측정하였다. 대조구는 시료 대신 증류수를 이용하여 동일한 방법으로 수행하였고 각 시료에 대한 자유레디칼인 DPPH radical 소거능(%)은 아 래의 식을 이용하여 계산하였다.
DPPH radical scavenging activity
%
=
1
−
A
B
×
100
A : Absorbance of sample, B : Absorbance of blank
SOD-like 활성
일정농도의 시료 0.2mL, Tris-HCl buffer(50mM Tris (hydroxymethyl) aminomethane + 10mM EDTA, pH 8.5로 보 정) 3mL, 7.2 mM pyrogallol 0.2 mL을 첨가하여 25℃에서 10분간 반응시키고 1 N HCl 1 mL를 가하여 반응을 정지 시켰다. 반응액 중 산화된 pyrogallol의 양은 420 nm에서 흡광도를 측정하였으면 SOD-like 활성은 시료 용액의 첨가 구와 무첨가구 사이의 흡광도의 차이를 아래 식에 의하여 백분율로 나타내었다.
SOD-like 활성 (%) = (1−(시료 첨가구의 흡광도/무첨가 구 흡광도))×100
통계처리
통계분석은 SAS(Statistical Analysis System, version 9.3) program을 이용하였으며 분산분석(ANOVA)한 후 p<0.05 수준에서 Duncan's multiple range test를 하여 처리군 간의 유의성 검정을 하였다.
결과 및 고찰
총 안토시아닌 함량, DPPH adical 소거능 및 SOD-like 활성
세 가지 요인으로서 효소농도, 반응온도와 반응시간에 따른 복분자 추출물의 총 안토시아닌 함량, DPPH adical 소거능 및 SOD-like 활성을 분석한 결과 Table 2와 같다. 복분자의 주요 안토시아닌은 6가지로써 cyanidin 3-Osambubioside, cyanidin 3-O-xylosylrutinoside, cyanidin 3- O-rutinoside, pelargonidin 3-O-rutinoside, dephinidin 3-Orutinoside, dephinidin 3-O-glucuronide로 확인 되었다(Choung & Lim, 2012). 총 안토시아닌 함량의 경우 무처리 시에는 1.10 mg/100 g에 불과하였으나 본 실험의 효소처리의 흥미 영역 구간 실험 점에서 총 안토시아닌 함량의 범위는 2.93-8.77 mg/100 g로 나타났다. 효소농도 1.5 mL/100 L, 반 응온도 40℃ 및 반응시간 2 hr의 조건에서 8.77 mg/100 g로 가장 높았으며 무처리 시 총 안토시아닌 함량의 797% 수 준이었다. Pectinase는 세포벽의 펙틴질을 galacturonic acid 까지 분해시킴으로서 주스 생산 공정에 적용 시 추출수율 과 안토시아닌함량을 증가시킨다는 연구결과가 있다 (Buchert et al., 2005).
Table 2.
Central composite design for enzyme-assisted extraction of anthocyanin and its dependent variables.
| Coded levels of variable |
Responses |
| X1 |
X2 |
X3 |
Total anthocyanin contents (mg/100 g) |
DPPH radical scavenging activity (%) |
SOD-like activity (%) |
| 0(1.0) |
-1(20) |
1(8) |
5.29±0.08f |
33.10±4.49g |
9.03±0.65ef |
| 0(1.0) |
1(60) |
-1(2) |
5.77±0.18d |
51.52±4.09d |
8.77±0.65ef |
| 0(1.0) |
0(40) |
0(5) |
3.43±0.09k |
48.88±1.06de |
8.25±1.75f |
| 0(1.0) |
-1(20) |
-1(2) |
3.98±0.09i |
51.39±2.85d |
9.16±0.46ef |
| -1(0.5) |
0(40) |
1(8) |
2.93±0.04l |
49.50±0.18de |
10.32±0.09d |
| -1(0.5) |
-1(20) |
0(5) |
6.61±0.16b |
55.27±2.70c |
12.90±0.61b |
| -1(0.5) |
0(40) |
-1(2) |
4.50±0.20h |
51.14±2.49d |
38.32±0.56a |
| 0(1.0) |
0(40) |
0(5) |
4.40±0.02h |
42.74±1.54f |
9.03±0.65ef |
| 1(1.5) |
1(60) |
0(5) |
6.08±0.01c |
56.52±2.00c |
10.19±0.82d |
| 0(1.0) |
0(40) |
0(5) |
3.30±0.01k |
46.23±1.62e |
8.51±0.65f |
| 1(1.5) |
0(40) |
-1(2) |
8.77±0.27a |
61.16±2.91b |
8.90±1.20ef |
| 1(1.5) |
0(40) |
1(8) |
3.81±0.03j |
60.27±1.52b |
9.68±0.46de |
| 1(1.5) |
-1(20) |
0(5) |
5.08±0.12g |
52.14±3.91d |
8.26±0.29f |
| 0(1.0) |
1(60) |
1(8) |
4.49±0.14h |
65.17±2.23a |
12.00±0.80c |
| -1(0.5) |
1(60) |
0(5) |
5.51±0.12e |
49.50±1.59de |
10.32±0.27d |
Download Excel Table
DPPH는 아스코르빈산, 토코페롤, polyhydroxy 방향족화 합물, 방향족 아민류 등에 의해 수소를 받아 불가역적으로 안정한 분자를 형성하여 환원되어짐에 따라 짙은 자색이 탈색되어지는 원리를 이용하여 다양한 천연소재로부터 항 산화물질을 탐색하기 위하여 많이 이용되고 있다(Jeong et al., 2009). DPPH radical 소거능은 무처리 시에는 11.76% 에 불과하였으나 효소농도 1.0 mL/100 L, 반응온도 60℃ 및 반응시간 8 hr의 조건에서 65.17%로 가장 높은 값을 보 였으며 무처리 시의 554% 수준이었다. Cellulase, papain, pectase 등 혼합효소를 이용하여 자주개자리(alfalfa)로부터 다당류를 추출하여 DPPH radical 소거능을 측정한 결과 무처리 시에는 나타나지 않았으나 1.6 mg/mL의 효소농도 에서는 87.9%로 측정되었다는 연구결과가 있다(Wang et al., 2013).
SOD-like 활성 반응에서 pyrogallol은 물에 존재하는 superoxide radical에 의해 자동 산화가 일어나 갈색물질을 형성하며 이를 분광광도계로 분석하고, superoxide 포착활성 이 있는 물질이 존재 시 pyrogallol의 산화속도가 낮아지는 원리를 이용하여 superoxide 포착활성을 간접적으로 측정 할 수 있다. 따라서 SOD(superoxide dismutase)는 생체 내 에서 superoxide의 소거에 관여하는 효소이며 안토시아닌 과 같이 SOD-like 활성을 갖는 물질을 섭취함으로서 노화 억제와 더불어 산화적 장해를 방어할 수 있다(Cho et al., 2007). SOD-like 활성의 경우 효소농도 0.5mL/100 L, 반응 온도 40℃ 및 반응시간 2 hr의 조건에서 38.32%로 가장 높 았으며 무처리 시(1.10%)의 3484% 수준이었다.
이차 다항 회귀 곡선식
흥미구역 안에서 효소농도, 반응온도와 반응시간에 따른 복분자 추출물의 총 안토시아닌 함량, DPPH radical 소거 능 및 SOD-like 활성에 미치는 정도를 분산 분석한 결과 Table 3과 같다. 총 안토시아닌 함량에 영향을 미치는 요 인으로 효소농도가 가장 컸으며 반응온도, 반응시간 순으 로 나타났고 세 가지 요인 모두 5%내에서 유의성차이를 나타내었다. DPPH radical 소거능에서는 반응온도가 가장 컸으며 효소농도, 반응시간 순이었으며 반응시간은 5%내 에서 유의성 차이가 없었다. SOD-like 활성은 효소농도가 반응시간과 반응온도보다 큰 것으로 나타났으며 세 가지 요인 모두 5%내에서 유의성차이를 보였다. 처리 요인의 수준에 대하여 종속변수인 총 안토시아닌 함량, DPPH radical 소거능 및 SOD-like 활성을 예측하기 위한 이차다 항회귀곡선식의 회귀계수를 계산한 결과 Table 4와 같다. 총 안토시아닌 함량, DPPH radical 소거능 및 SOD-like 활 성에 대하여 이차다항회귀곡선식에의 일차다항회귀(linear), 이차다항회귀(quadratic) 및 교차회귀(cross product)의 기여 도를 검정한 결과(Table 5) 총 안토시아닌 함량의 기여도는 이차다항회귀, 일차다항회귀 및 교차회귀 순으로 나타났으 며 DPPH radical 소거능의 기여도는 교차회귀, 이차다항회 귀 및 일차다항회귀 순이었다. SOD-like 활성 기여도는 일 차다항회귀, 교차회귀 및 이차다항회귀 순으로 나타났으며 이차다항회귀곡선식 적합성 검정에서의 total regression은 모두 5% 이내에서 유의성 차이를 보였다.
Table 3.
Analysis of variance for the effects of three variables on total anthocyanin contents, DPPH radical scavenging activity and SOD-like activity of enzyme-assist extracted anthocyanin from Bokbunja.
|
|
Factors |
Total anthocyanin contents (mg/100 g) |
DPPH radical scavenging activity(%) |
SOD-like activity (%) |
| X1 |
Fvalue |
4.88 |
5.92 |
10.87 |
| Prob>F |
0.0065 |
0.0026 |
<.0001 |
| X2 |
Fvalue |
5.04 |
8.16 |
6.08 |
| Prob>F |
0.0056 |
0.0005 |
0.0023 |
| X3 |
Fvalue |
2.97 |
0.84 |
8.34 |
| Prob>F |
0.0446 |
0.5156 |
0.0004 |
Download Excel Table
Table 4.
Regression coefficients of second degree polynomials for total anthocyanin contents, DPPH radical scavenging activity and SOD-like activity of enzyme-assist extracted anthocyanin from Bokbunja.
| Parameters |
Estimate |
| Total anthocyanin contents (mg/100 g) |
DPPH radical scavenging activity (%) |
SOD-like activity (%) |
| Intercept |
9.852 |
109.635 |
70.878 |
| X11) |
-7.136 |
-55.136 |
-72.745 |
| X22) |
-0.193 |
-0.945 |
0.354 |
| X33) |
0.529 |
-9.359 |
-10.543 |
| X1*X1 |
4.455 |
25.268 |
17.769 |
| X2*X1 |
0.053 |
0.254 |
0.113 |
| X2*X2 |
0.002 |
0.003 |
-0.007 |
| X3*X1 |
-0.566 |
0.125 |
4.796 |
| X3*X2 |
-0.011 |
0.133 |
0.014 |
| X3*X3 |
0.020 |
0.361 |
0.418 |
Download Excel Table
Table 5.
Determination coefficients and probability of second degree polynomials for total anthocyanin contents, DPPH radical scavenging activity and SOD-like activity of enzymeassist extracted anthocyanin from Bokbunja.
|
|
Regressions |
Linear |
Quadratic |
Cross product |
Total regress |
| Total anthocyanin contents (%,dry weight) |
R2 |
0.24 |
0.24 |
0.18 |
0.65 |
| F value |
4.59 |
4.64 |
3.42 |
4.22 |
| Prob>F |
0.0134 |
0.0128 |
0.0369 |
0.0035 |
| DPPH radical scavenging activity (%) |
R2 |
0.22 |
0.19 |
0.31 |
0.73 |
| F value |
5.42 |
4.75 |
7.57 |
5.92 |
| Prob>F |
0.0068 |
0.0116 |
0.0014 |
0.0005 |
| SOD-like activity (%) |
R2 |
0.28 |
0.19 |
0.27 |
0.75 |
| F value |
7.47 |
5.14 |
7.13 |
6.58 |
| Prob>F |
0.0015 |
0.0085 |
0.0019 |
0.0002 |
Download Excel Table
효소처리공정 최적화
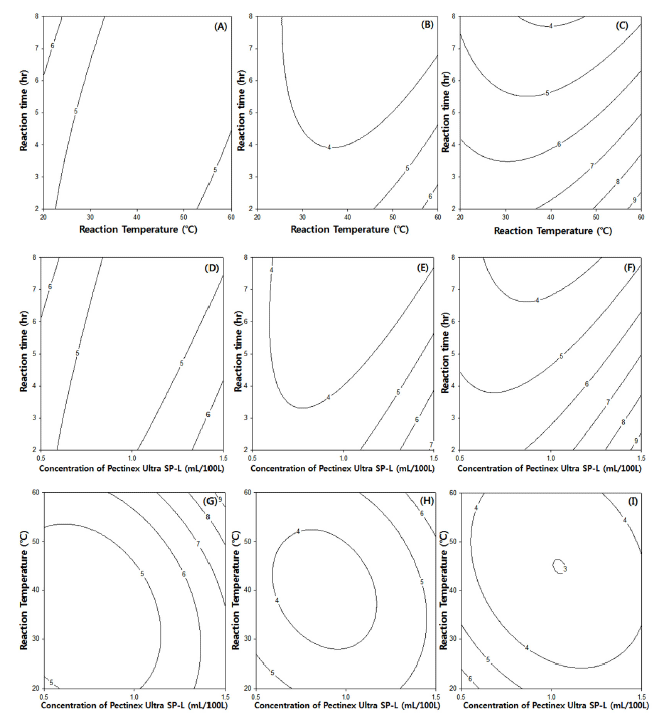
효소농도, 반응온도 및 반응시간에 따른 복분자 추출물 의 총 안토시아닌 함량에 미치는 영향을 반응표면분석법으 로 분석한 결과 Fig. 1과 같다. 효소처리공정에서 반응시간 보다는 반응온도(Fig. 1-A, B, C)와 효소농도(Fig. 1-D, E, FF)에 영향을 크게 받는 것을 알 수 있으며 반응온도와 효 소농도는 비슷한 영향력을 보였다(Fig. 1-G, H, I). 효소처 리 흥미영역에서의 반응평균(response mean) 값은 4.9 mg/ 100 g이었다. 효소농도, 반응온도와 반응시간에 따른 복분 자의 총 안토시아닌 함량을 반응 표면 분석한 결과 일반적 으로 효소농도와 반응온도가 높을수록 총 안토시아닌 함량 이 증가하는 경향을 나타내었으며 효소농도 1.42 mL/ 100 L, 반응온도 60℃ 및 반응시간 2.00 hr 일 때가 최적 효소처리조건으로 8.8 mg/100 g으로 예측되었다.
Fig. 1.
Contour plot for total anthocyanin contents (mg/100 g) of Bokbunja anthocyanin by enzyme-assisted extraction.
(Conc. of Pectinex Ultra SP-L, A: 0.5 mL/100 L, B: 1.0 mL/100 L, C: 1.5 mL/100 L, Reaction temperature, D: 20°C, E: 40°C, F: 60°C; Reaction time, G: 2 hr, H: 5 hr, I: 8 hr
Download Original Figure
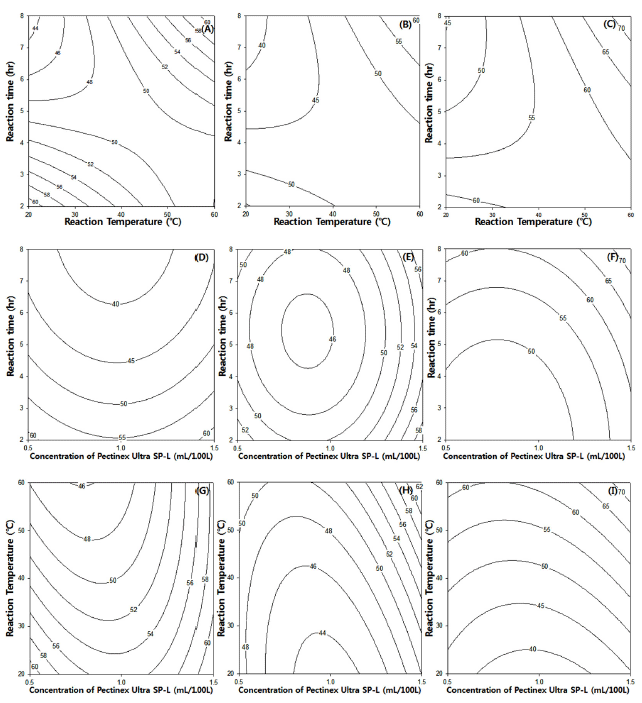
효소농도, 반응온도와 반응시간에 따른 복분자 추출물의 DPPH radical 소거능에 미치는 영향을 분석한 결과 Fig. 2 와 같으며 효소처리 흥미영역에서의 반응평균 값은 51.64% 이었다. 효소농도, 반응온도 및 반응시간이 증가함에 따라 서 DPPH radical 소거능은 증가하는 것으로 나타났다. 복 분자 추출물의 DPPH radical 소거능의 최적 효소처리조건 은 효소농도 1.41 mL/100 L, 반응온도 56.69℃ 및 반응시 간 7.37 hr 일 때 65.1%로 예측되었다.
Fig. 2.
Contour plot for DPPH radical scavenging activity (%) of Bokbunja anthocyanin by enzyme-assisted extraction.
(Conc. of Pectinex Ultra SP-L, A: 0.5 mL/100 L, B: 1.0 mL/100 L, C: 1.5 mL/100 L, Reaction temperature, D: 20°C, E: 40°C, F: 60°C, Reaction time, G: 2 hr, H: 5 hr, I: 8 hr)
Download Original Figure
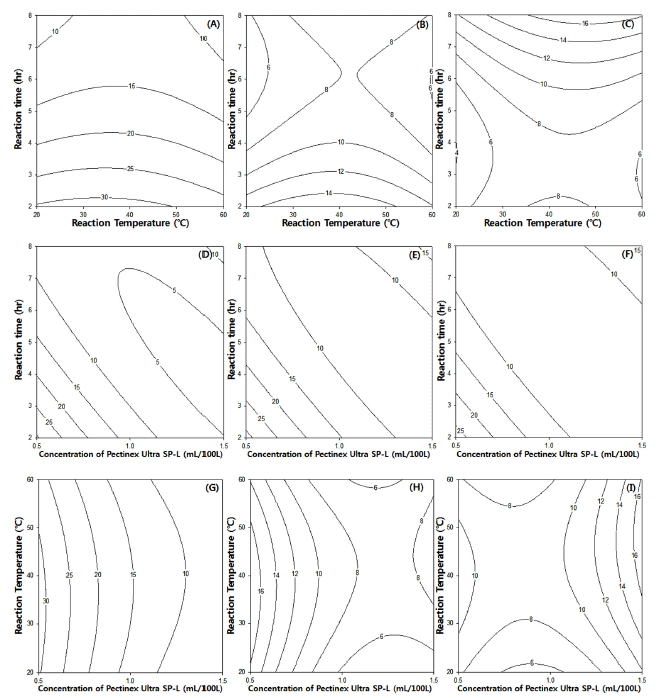
효소농도, 반응온도와 반응시간에 따른 복분자 추출물의 SOD-like 활성에 미치는 영향을 분석한 결과 Fig. 3과 같으 며 흥미영역에서의 반응평균 값은 11.58%이었다. 효소농도, 반응온도 및 반응시간이 낮을수록 SOD-like 활성은 증가하 는 것으로 나타났으며 최적 효소처리조건으로 효소농도 0.50mL/100 L, 반응온도 20.67℃ 및 반응시간 2 hr 일 때 복 분자 추출물의 SOD-like 활성은 30.59%로 예측되었다.
Fig. 3.
Contour plot for SOD-like activity (%) of Bokbunja anthocyanin by enzyme-assisted extraction.
(Conc. of Pectinex Ultra SP-L, A: 0.5 mL/100 L, B: 1.0 mL/10 L, C: 1.5 mL/100 L, Reaction temperature, D: 20°C, E: 40°C, F: 60°C, Reaction time, G: 2 hr, H: 5 hr, I: 8 hr)
Download Original Figure
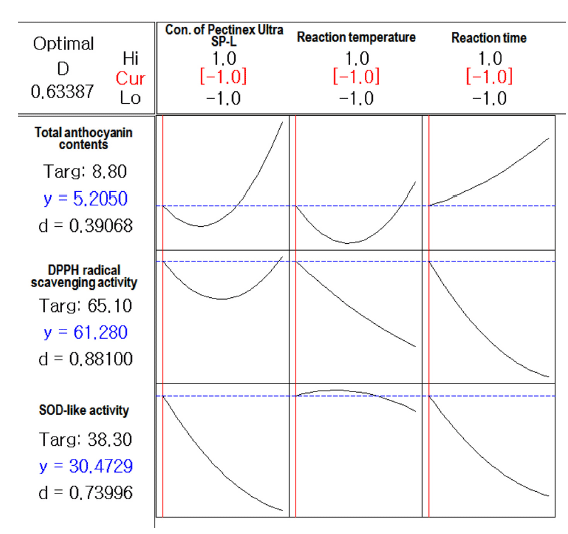
효소농도, 반응온도와 반응시간에 따른 복분자 추출물의 총 안토시아닌 함량, DPPH adical 소거능 및 SOD-like 활 성을 다중반응표면의 최적화방법으로써 만족 함수 (desirability function)를 이용하여 종속변수들의 가중치를 1 로 놓고 종합적으로 판단한 결과(Fig. 4) 최적 효소처리 조 건은 효소농도 0.50 mL/100 L, 반응온도 20℃ 및 반응시간 2 hr의 조건이었으며 이때의 총 안토시아닌 함량, DPPH adical 소거능 및 SOD-like 활성은 각각 5.2 mg/100 g, 61.3% 및 30.5%이었고 전반적인 만족도(overall desirability) 는 0.63이었다.
Fig. 4.
Response optimization for multi-response surface of Bokbunja anthocyanin by enzyme-assisted extraction.
Download Original Figure
요 약
본 연구는 복분자의 안토시아닌을 추출한 후 수율 및 생 리활성의 향상을 위하여 Pectinex Ultra SP-L을 사용하였 으며 효소처리공정으로서 효소농도, 반응온도 및 반응시간 에 따른 복분자 추출물의 총 안토시아닌 함량, DPPH adical 소거능 및 SOD-like 활성을 반응표면분석법에 의하 여 최적화하였다. 총 안토시아닌 함량의 경우 효소처리 흥 미영역에서의 반응평균(response mean) 값은 4.9 mg/100 g 이었으며 무처리(대조구)는 1.1 mg/100 g이었다. 최적 효소 처리조건으로 효소농도 1.4mL/100 L, 반응온도 60℃ 및 반응시간 2 hr 일 때 8.8 mg/100 g으로 나타났다. DPPH adical 소거능의 경우 반응평균 값은 51.6%이었으며 대조구 는 11.8%이었다. 최적 효소처리조건으로 효소농도 1.41 mL/ 100 L, 반응온도 56.69℃ 및 반응시간 7.37 hr 일 때 65.1% 로 나타났다. SOD-like 활성의 경우는 반응평균 값이 51.6%이었으며 대조구는 1.1%이었다. 최적 효소처리조건으 로 효소농도 0.5 mL/100 L, 반응온도 20.67℃ 및 반응시간 2 hr의 조건일 때 30.6%로 나타났다. 다중반응표면의 최적 화방법으로써 만족함수를 이용하여 종속변수들의 가중치를 1로 놓고 분석한 결과 흥미구역 안에서의 최적 효소처리 조건은 효소농도 0.5 mL/100 L, 반응온도 20℃ 및 반응시 간 2 hr의 조건이었으며 총 안토시아닌 함량, DPPH adical 소거능 및 SOD-like 활성은 각각 5.2 mg/100 g, 61.3% 및 30.5%로 나타났고 전반적인 만족도는 0.63이었다.
감사의 글
본 연구는 농림수산식품기술기획평가원 고부가가치식품 기술개발사업(과제번호: 111136-03-2-HD110)의 지원에 의 한 연구결과로 이에 감사드립니다.
REFERENCES
Buchert J, Koponen JM, Suutarinen M, Mustranta A, Lille M, Torronen R, Kalsa P. Effect of enzyme-aided processing on anthocyanin yield and profiles in bilberry and black currant juices. J. Sci. Food Agr. 2005; 85:2548-2556.

Cho MJ, Park MJ, Lee HS. Nitrite scavenging ability and SOD-like activity of a sterol glucoside from Chrysanthemum coronanium L. var. spatiosum. Korean. J. Food Sci. Technol. 2007; 39:77-82.

Choi SJ. The difference of anthocyanin pigment composition and color expression in fruit skin of several grape cultivars. Korean. J. Food Preserv. 2010; 17:847-852.

Choung MG, Lim JD. Antioxidant, anticancer and immune activation of anthocyanin fraction from Rubus coreanus Miquel fruits (Bokbunja). Korean. J. Medicinal Crop Sci. 2012; 20:259-269.

Ducasse MA, Llauberes RMC, Lumley M, Williams P, Souquet JM, Fulcrand H, Doco T, Cheynier V. Effect of macerating enzyme treatment on the polyphenol and polysaccharide composition of red wines. Food Chem. 2010; 118:369-376.

He J, Giusti MM. High-purity isolation of anthocyanins mixtures from fruits and vegetables-A novel solid-phase extraction method using mixed mode cation-exchange chromatography. J. Chromatogr. A. 2011; 1218:7914-7922.

Ivanovic J, Tadic V, Dimitrijevic S, Stamenic M, Petrovic S Zizovic. Antioxidant properties of the anthocyanin-containing ultrasonic extract from blackberry cultivar "Cacanska Bestrna". Ind. Corp. Prod. 2014; 53:274-281.

Jeong HS, Han JG, Ha JH, Kim Y, Oh SH, Kim SS, Jeong MH, Choi GP, Park YU, Lee HY. Antioxidant activities and skin-whitening effects of nano-encapsulated water extract from Rubus coreanus Miquel. Korean. J. Medicinal Crop Sci. 2009; 17:83-89.

Konczak I, Zhang W. Anthocyanins-more than nature colors. J. Biomed. Biotechnol. 2004; 2004:239-240.

Krammer D, Claus A, Schieber A, Carle R. A novel process for recovery of polyphenols from grape (
Vitis vinifera L) pomace. J. Food Sci. 2005; 70:C157-C163.

Metivier RP, Francis FJ, Clydesdale FM. Solvent extraction of anthocyanins from wine pomace. J. Food Sci. 1980; 45:1099-1100.

Teng H, Lee WY, Choi YH. Optimization of microwaveassisted extraction for anthocyanins, polyphenols, and antioxidants from raspberry (Rubus Coreanus Miq) using response surface methodology. J. Sep. Sci. 2013; 36:3107-3114.

Vatal T, Skerget M, Knez Z. Extraction of phenolic compounds from elder berry and different grape marc varieties using organic solvents and/or super critical carbon dioxide. J. Food Eng. 2009; 90:246-254.

Watada AE, Abbott JA. Objective method of estimating anthocyanin content for determining color grade of grapes. J. Food Sci. 1975; 40:1278-1279.

Wang S, Dong X, Tong J. Optimization of enzyme-assisted extraction of polysaccharides from alfalfa and its antioxidant activity. Int. J. Biol. Macromol. 2013; 62:387-396.

Wrolstad RE, Wightman JD, Durst RW. Glycosidase activity of enzyme preparations used in fruit juice processing. Food Technol. 1994; 48:90-98.