서 론
참당귀(Angelica gigas Nakai)는 미나리과(Umbelliferae) 에 속하는 다년생 초본으로 주로 한국, 중국, 일본에 분포 하고 있으며, 한방에서는 빈혈치료와 혈액순환 장애로 인 한 어혈증과 혈전증, 반신불수 등에 처방되는 중요한 생약 재로 사용되고 있다. 참당귀의 약효성분으로는 decursin, decursinol, decursinol angelate, nodakenetin, nodakenin, umbelliferone, β-sitosinol, α-piene, limonene 등이 함유되 어 있다. 이들 성분은 항산화 작용, 항암작용, 알코올 대사 촉진작용 및 간질환 개선작용을 가지고 있는 것으로 보고 되었다(Ahn et al., 1996; Ahn et al., 1998; Park et al., 2009). 그 외에도 참당귀는 다당류 고분자물질과 함께 면 역력 증진과 같은 기능을 제공하기 때문에 기능성 식품소 재로 이용되고 있다(Kelly, 1999).
특히 참당귀의 주요 성분인 decursin, decursinol angelate 는 중국당귀(Angelica sinensis Diels) 및 일본당귀(Angelica acutiloba Kitagawa) 보다 많이 함유되어 있는 것으로 분석 되었다(Hwang and Yang, 1997). 이러한 주된 이유는 기원 종의 차이와 재배지 환경에 따른 약효성분의 함량변이로 추측되고 있으며, 국내에서 재배되고 있는 참당귀는 중국 당귀와 일본당귀보다 기능성 물질을 다량 함유하고 있어 한약재와 식품의 원료, 기능성 화장품의 소재로 많이 사용 되고 있다(Lim et al., 2009).
그리고 참당귀와 같은 구근류 작물의 식물 세포벽은 셀룰 로오스(cellulose), 헤미셀룰로오스(hemicellulose), 펙틴(pectin), 리그닌(lignin) 및 당 단백질(glycoprotein) 등의 구성성분으로 이루어져있으며 이들 구성성분들은 서로 유리된 상태로서 존재하는 것이 아니라 대부분 공유결합, 수소결합, 이온결 합, 소수결합 등을 통하여 강하게 연결되어 식물조직에 외 부로부터의 공격에 대한 자체방어능력을 부여한다(Dey and Brinson, 1984). 이러한 세포벽 구조를 이완시키기 위해 세포 벽의 수용화 공정 중 cellulase, hemicellulase, pectinase 등의 효소를 사용하여 세포벽 성분을 가수분해 시킬 수 있는 효 소적 방법이 있다(Renard et al., 1991). 효소적 방법은 수 용성 식이섬유 함량을 증가시키며 각종 혈중 콜레스테롤 함량 감소의 생리활성 효과를 제공하게 된다. 현재 효소처 리를 하는 여러 종류의 추출 병용법이나 전처리법이 연구 되고 있으며 추출물의 수율을 높이는 연구도 많이 행해지 고 있다. Sun et al.(2005)은 cellulase를 이용하여 아스파라 거스 주스에서 페놀성물질의 추출 수율을 높인 연구결과를 보고하였으며, Guan와 Yao(2008)은 viscozyme을 이용하여 오트밀 겨에서 단백질추출 수율을 향상시킨 결과를 보고한 바 있다.
따라서 본 연구는 참당귀를 이용한 기능성 신소재 개발 을 위하여 세포벽 및 전분 분해, 단백질 저분자화 기능을 가지는 상업적 효소들을 사용하여 간편하게 참당귀의 다당 류 추출을 극대화할 수 있는 방법을 연구하였으며, 이와 같은 결과는 참당귀 등의 약용식물을 활용한 원가절감형 제품 개발 및 산업적 소재 개발에 널리 사용될 수 있을 것으로 기대된다.
재료 및 방법
본 연구에 사용된 참당귀(Angelica gigas Nakai)는 2009 년 강원도 진부에서 GAP 표준재배지침서에 따라 재배·생 산된 것으로 시중에서 판매되고 있는 제품을 구입하였다. 참당귀 뿌리를 흐르는 물에 3회 세척하여 절단한 다음, 동결 건조한 후 60 mesh 미분쇄하여 4°C에 보관하면서 사 용하였다.
산업적으로 사용되고 있는 효소를 다당체 분리에 사용하였 다. Denmark에서 수출하는 Novo사의 Pectinex 5XL (Novozyme Nordisk), Viscozyme L, Alcalase와 Flavourzyme, Termamyl 120L(α-amylase)효소를 사용하여 실험하였다.
일반성분 시험법은 AOAC법(AOAC, 1990)에 따라 수분, 회분, 조지방, 조단백질 함량을 분석하였다. 수분함량은 105°C 상압가열 건조법, 회분은 직접회화법, 조지방 함량은 Soxhlet 추출법, 조단백질은 semi-micro Kheldahl법으로 측 정하였다.
참당귀의 세포벽 분해를 위한 최적 효소 선정을 위하여 상업적으로 가장 많이 사용되고 있는 Pectinex 5XL와 Viscozyme L 및 Pectinex 5XL와 Viscozyme L(1:1)을 사 용하여 다당체의 수율을 확인하였다. 참당귀의 세포벽 분 해를 위한 효소처리별 수율은 처음 투입된 참당귀 미분 중 량대비 효소처리에 의해 회수된 다당류 추출물의 중량 백 분율로 계산하였다.
참당귀 시료 25 g에 100% methanol 500 mL를 첨가하여 상온에서 2시간 동안 추출하여 분리하였다. 각 추출물은 여과지(Whatman No.4)에 여과한 후 지질과 색소 성분은 각각 500 mL의 hexane과 acetone을 첨가하여 상온에서 2 시간씩 교반하여 추출하였다. 각 성분이 제거된 시료는 자 연 건조하여 다음 추출단계에 사용되었다.
참당귀의 기능성 다당체 분리를 위한 최적의 효소처리 방법을 선정하기 위하여 세포벽 분해 효소처리에서 선정된 Viscozyme L을 이용하였으며, Alcalase과 Flavorzyme(1:1), Termamyl 120 L등 복합효소들의 순서를 달리하여 처리하 였다. 분리된 다당체의 이화학적 특성 평가를 통하여 효소 처리의 최적 방법을 선정하였다. Alcalase와 Flavorzyme은 단백질을 분해하는 효소로서 Alcalase는 단백질 중간부분에 서 무작위로 분해하는 endoprotease에 속하고 Flavorzyme은 단백질 말단에서 아미노산 단위로 분해하는 exoprotease이 다. Termamyl 120 L은 전분의 α-1,4-glycoside 결합을 선 택적으로 가수분해하는 특성이 있다.
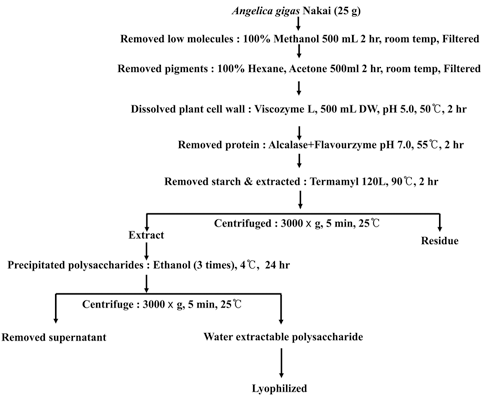
저분자 물질이 제거된 참당귀 고형분 25 g에 물 500 mL 을 첨가하여 Viscozyme L를 기질의 1% 농도로 첨가하고 최적 pH 5.0과 최적반응온도 50°C에서 2시간 동안 반응시 켰다. 다음으로 단백질 분해효소인 Alcalase와 Flavorzyme 1:1 혼합액을 기질의 1% 첨가한 후 pH 7.0과 55°C의 최적 조건에서 2시간 반응시킨 후, 전분 가수분해효소인 Termamyl 120 L을 첨가하여 반응시켰다. Termamyl 120 L 은 100°C 부근에서 효소가 실활됨으로 90°C 환류냉각장치 에서 2시간 동안 열수추출과 효소처리를 동시에 실시하였 다. 마지막으로, 효소의 불활성화를 위해 100°C에서 5분간 반응시킨 후 실온으로 냉각시켰다. 참당귀 수용성 분획에 용적비로 3배의 100% 에탄올을 가하여 4°C 저장고에 24 시간 침전시켰다. 3,000 × g, 25°C, 5분간 원심분리하여 침 전물을 수거한 후 이를 동결건조하여 수용성 다당체 추출물 시료로 이용하였다. 참당귀 다당체에 Termamyl 120 L의 효 소처리 표기는 T로, Alcalase, Flavorzyme(1:1)과 Termamyl 120 L의 효소처리 표기는 AFT로, Viscozyme L, Alcalase, Flavorzyme(1:1)과 Termamyl 120 L의 순차적 효소처리는 VAFT로 표기하였다. 대조구로 사용된 수용성 다당체 추출 물 시료는 100°C에서 2시간 동안 교반하면서 환류냉각장 치에서 열수추출하였다. 참당귀 수용성 다당체 분리를 위 한 최적의 효소처리 방법은 Fig. 1에 나타내었다.
참당귀의 수용성 다당체 수율은 추출을 위해 처음 투입 된 참당귀 미분 중량대비 효소처리에 의해 회수된 다당체 추출물의 중량 백분율로 계산하였다. 효소처리 추출물 (extract)의 총당 함량은 phenol-sulfuric acid법(Dubois et al., 1956)에 의해 측정하여 계산하였다. 총담 함량은 시료 0.5 mL에 5% phenol 0.5 mL를 가하여 최종부피를 1 mL로 만든 후, 여기에 2.5 mL의 sulphuric acid를 가하여 교반하 고 30분간 실온에서 방치한 후, 490 nm에서 흡광도를 측 정하였으며, glucose를 이용하여 작성한 표준곡선으로부터 계산하였다. 효소처리에 의해 제거된 전분함량은 효소처리 추출물에 에탄올을 첨가하여 회수된 상등액의 총당 함량을 측정하여 계산하였다.
참당귀에서 분리한 수용성 다당체의 분자량 분포도는 Gel permeation chromatography(Shodex Series, Showa Denko K.K., Tokyo, Japan)를 이용하여 분석하였고, 분석 조건은 Table 1에 나타내었다. 시료를 0.3% NaCl에 용해 시켜 GPC column(Shodex SB-806 HQ, Showa Denko K.K., Tokyo, Japan)를 사용하여 유속 1.0 mL/min, 온도 30°C 조건에서 측정하였다. 표준 분자량은 Shodex standard P-82 pullulans(2.0 mg/mL)로써 분자량 78.8×104, 40.4×104, 21.2×104, 11.2×104, 4.73×104, 2.28 ×104, 1.18×104과 glucose를 사용하였다.
분리된 수용성 다당체의 구성 성분 분석은 Uppsala method(Theander et al., 1995)을 변형시켜 실시하였으며, 각 단계 추출액의 성분 분석을 통하여 전분, 비전분다당체 (NSP, non-starch polysaccharide), 우론산, 리그닌 함량을 측정하였다.
다당체의 전분 함량은 Uppsala method의 첫 단계에서 분리된 다당체 300 mg을 α-amylase(Termamyl 120 L)와 amyloglucosidase(Sigma, USA)와 반응시켜 99.5% 에탄올 용액을 가하여 전분 분해물을 제거하는 과정에서 총당 분석 을 통해 측정하였다. 비전분다당체 함량은 황산을 이용하여 다당류를 가수분해하는 두 번째 단계에서 만들어진 황산 가 수분해액을 이용하여 총당 분석을 통해 측정하였다. 우론산 함량은 비전분다당체 함량 분석 시료와 동일한 다당체의 황산 가수분해액을 시료로 사용하여 carbazole reaction법 (Southgate, 1976)에 의하여 측정하였다. 시료 0.5 mL에 Borate H2SO4 2.5 mL를 가하여 100°C 항온수조에서 10분 동안 반응시켰다. 여기에 0.1 mL carbazole를 가하여 교반 하고 30분간 실온에서 방치한 후, 530 nm에서 흡광도를 측정하였다. 이때 galacturonic acid를 이용하여 작성한 표 준곡선으로부터 계산하였다. 리그닌 함량은 다당체의 황산 가수분해액을 여과하여 회화한 후 glass filter에 남아있는 성분을 처음 시작한 시료의 건조중량 대비 회수된 리그닌 함량으로 계산하였다.
참당귀 비전분다당체의 당조성 분석을 위하여 Uppsala method을 이용하여 제조한 황산 가수분해액을 alditol 유도 체화하여 가스크로마토그래피로 당조성을 측정하였다. 가 스크로마토그래피의 분석조건은 Table 2와 같다. 컬럼은 SP-2330(Supelco, Bellefonte, PA, USA)을 장착하여 Hewlett Packard chromatograph(Agilent 6890 Series; Wilmintion, DE, USA)을 사용하였다. Oven 온도는 230°C, Detector 온도는 240°Cα, 표준물질로는 myo-inositol(Sigma Chemicals Co., St. Louis, MO, USA)를 사용하였다. 참당 귀 다당체 함량은 검출된 다당체에 5탄당은 0.88, 6탄당은 0.9의 factor를 곱하여 계산하였다.
결과 및 고찰
참당귀의 일반성분을 분석한 결과는 Table 3과 같다. 일 반성분은 건조시료를 기준으로 수분함량 1.07%, 지방함량 8.60%, 회분함량 5.73% 단백질 함량 13.8%으로 나타내었 다. Lee(2006)와 Oh et al.(1990)이 보고한 참당귀 일반성 분 결과와 비교할 때 수분 11.0%, 조단백질 13.5%, 조지 방 2.6%, 회분 6.4%로 단백질과 회분 함량은 유사한 결과 를 나타내었다.
| Content | |
|---|---|
| Moisture (%) | 1.07±0.05 |
| 1.07±0.05 | 8.60±0.32 |
| 8.60±0.32 | 5.73±0.02 |
| Protein (%) | 13.8±0.01 |
참당귀 수용성 다당체 분리를 위한 최적 효소선정 단계 에 있어서 세포벽 분해 효소처리별 수율은 Table 4에 나타 내었다. Viscozyme을 처리한 참당귀 다당체의 수율이 12.20%로 pectinex 5XL와 viscozyme L(1:1)을 혼합하여 처리한 시료의 수율 2.97%보다 76%정도 유의적으로 높게 나타났으며(p<0.05), pectinex 5XL을 처리한 시료의 수율 0.79%보다 94% 정도 유의적으로 높게 나타났다(p<0.05). 이와 같은 결과로 참당귀 다당체 분리를 위한 최적의 효소 는 수율이 가장 높게 나타난 viscozyme L로 선정하였다. Viscozyme L은 식물 세포벽 성분을 분해하는 효소로 arabanase, cellulase, β-glucanase, hemi-cellulase, xylanase를 포함하고 있어 다양한 분해효소의 복합작용으로 pectinex 5XL와 viscozyme L 등의 다른 분해 효소들에 비해 효과적 으로 세포벽을 분해한 것으로 사료된다. Choi et al.(2009)은 마치현 다당체의 수용화 증진을 위해 viscozyme L, pectinex 5XL, pectinex 5XL와 viscozyme L(1:1) 혼합 효 소를 처리하여 다당체 추출율을 비교한 결과, viscozyme L 효소처리구에서 분해특성이 가장 우수하게 나타났다고 보 고하였는데, 이는 본 연구 결과와 비슷한 결과로 식물체 세포벽 성분 분해에 viscozyme L이 효과적으로 작용하는 것을 확인할 수 있었다. 이러한 연구결과는 Suh et al.(2002)의 연구에서 viscozyme L이 양파의 수용성 다당체 추출에 효과적이었다고 보고한 결과와 유사한 경향이였다.
| Viscozyme | Pectinex+Viscozyme | Pectinex | F-value |
|---|---|---|---|
| Yield (%) 12.20±0.15 | 2.97±0.60 | 0.79±0.01 | 865.23*** |
참당귀 수용성 다당체 분리를 위해 전분 및 단백질 제거 효소와 세포벽 분해 효소 처리 단계별로 수율과 총당, 제 거된 전분함량은 Table 5에 나타내었다. 수율은 효소처리 구 VAFT(12.20%)가 다른 효소처리구 T와 AFT 대비 각각 55.8%, 82.1% 정도 유의적으로 증가하였으며(p<0.001), 총 당 함량도 비슷한 경향을 나타내었다. 대조구의 수율이 18.04%로 효소처리구들에 비하여 높게 나온 것은 제거되지 않은 전분까지 모두 수용화되었기 때문으로 판단되었다. 제 거된 전분 함량 역시 효소처리구 VAFT(29.62%)가 대조구 (9.60%), 효소처리구 T(25.32%)와 AFT(26.57%)에 비해 10~67% 정도 유의적으로 높게 나타났다(p<0.001). 참당귀 수용성 다당체의 총당 함량은 추출물의 당 함량을 제시하 는 것으로, 총당 함량이 높고 제거된 전분 함량이 낮을수 록 순수한 수용성 다당체가 추출되었다고 볼 수 있다. 따 라서 참당귀 수용성 다당체의 수율을 극대화하기 위해서는 첫번째로 세포벽의 성분을 분해한 후, 단백질과 전분을 순 차적으로 저분자화하여 제거하는 VAFT 처리 방법이 가장 효과적이라고 판단되었다.
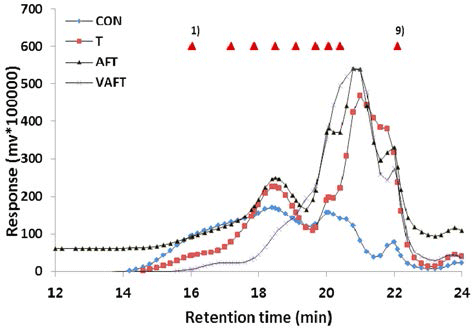
참당귀 수용성다당체의 분자량 분포는 효소처리에 의해 분해된 성분들의 분자량과 함유량을 Table 6에 나타내었으 며, 이를 도식화하여 Fig. 2에 제시하였다. 효소처리 하지 않은 대조구의 분자량 491,000 Da에 비해 T, AFT, VAFT 효소처리구에서 각각 282,000, 265,000 및 16,000 Da의 분 자량을 나타내어 세포벽 및 전분 효소처리에 의해 참당귀 다당체의 분자량이 감소하면서 저분자화된 것을 확인할 수 있었다. 특히 VAFT는 대조구보다 97% 감소한 분자량을 나타내었고, 이러한 현상은 효소처리에 따른 참당귀 고분 자 다당체의 붕괴와 비전분성 탄수화물의 수용화 효과에 의한 것으로 예측할 수 있다. 메밀의 고분자 수용성 다당 체는 소화효소인 trypsin과 chymotrypsin의 활성을 현저히 저하시켰지만 저분자 수용성 다당체일 때는 약간의 감소만 보여 다당체가 저분자일 때 소화흡수율이 향상된다고 보고 된 바 있다(Lee et al., 1996). 본 실험에서 사용한 가수분 해효소는 단일한 정제효소가 아닌 복합효소이다. 식물세포 벽 성분은 많은 종류의 복합성분으로 구성되어 있어 단일 한 효소보다는 본 연구와 같이 복합적인 효소를 사용하는 것이 보다 효율적일 수 있다.
효소처리에 의해 추출하여 건조한 분말형태의 참당귀 수 용성 다당체의 주요성분인 전분, 비전분다당체, 우론산, 리 그닌 함량을 Table 7에 나타내었다. 전분 함량은 효소처리 구 T(33.88%), AFT(24.90%), VAFT(31.95%)가 대조구 (52.33%)에 비하여 31.5~52.4% 정도 유의적으로 낮게 나 타났다(p<0.001). 이러한 결과로 효소처리에 의해 전분이 제거되기는 하였으나, 소량의 전분은 완전히 제거되지 않 고 수용성 다당체에 잔존하는 것을 확인할 수 있었다. 전 분 함량을 제외하고 비전분다당체, 우론산, 리그닌 함량은 T, AFT, VAFT 효소처리구가 대조구보다 유의적으로 높게 나타났다(p<0.001). 기능성 다당체에 해당하는 비전분다당 체 함량은 효소처리구 T(20.78%), AFT(21.98%), VAFT (22.58%)가 대조구(12.84%)에 비하여 38.0~48.0% 정도 유 의적으로 높게 나타났다(p<0.001). 우론산 함량 또한 효소 처리구 T(8.70%), AFT(10.58%), VAFT(8.36%)가 대조구 (2.38%)에 비하여 유의적으로 높게 나타났으며(p<0.001), 리그닌 함량은 T 효소처리구를 제외하고 AFT와 VAFT 효 소처리구에서 대조구보다 유의적으로 높게 나타났다 (p<0.001). 이와 같은 결과로 세포벽, 전분, 단백질 제거를 위한 단계별 효소처리에 의해 비전분다당체와 우론산 함량 이 높은 참당귀 수용성 다당체를 분리할 수 있음을 확인할 수 있었다. 일반적으로 식물 세포벽을 구성하고 있는 비전 분다당체 중 중성당이 가장 높은 비중을 차치하고 있으며, 우론산은 다당체의 물리화학성과 용해도를 변화시켜 식품산 업에서 기능성분, 겔화, 농화 및 안정화 물질로 많이 사용 되고 있으며(Gancz et al., 2005; Roudsari et al., 2006), 이 와 같은 성분들은 면역력 증진 등 다양한 기능성을 나타내 는 것으로 알려져 있다. 따라서 비전분다당체와 우론산 함 량이 높은 참당귀 다당체 성분 또한 식품 및 화장품 등의 제품개발에 기능성 소재로 활용될 수 있을 것으로 사료된다. 참당귀 비전분다당체의 구성 성분 중 전분의 함량이 적고 비전분다당체와 우론산의 함량이 높으며, 리그닌 함량이 낮 은 VAFT 효소처리구가 참당귀에서 수용성 다당체의 수율 을 극대화하기 위한 가장 효과적인 방법이라고 판단된다.
참당귀의 효소처리에 따른 다당체 중성당의 구성당 조성 을 살펴본 결과, Table 8에 나타난 바와 같이 AFT와 VAFT에서 arabinose, galactose를 높은 비율로 함유하고 있 었으며, ramnose, ribose, xylose, mannose 등을 소량 함유 하고 있었다. Ahn et al.(1996)은 당귀의 다당체의 당 조성 을 분석한 결과 arabinose와 galactose이 다량 함유되어 있 으며, 그 외에 ramnose, xylose, mannose가 소량 함유되어 있다고 보고하였는데. 본 실험에서도 유사한 결과를 나타 내었다. 중성 다당체의 주성분인 arabinose, galactose의 함 량은 효소처리구에서 대조구보다 유의적(p<0.001)으로 높 게 나타났으며, 반면 glucose의 함량은 대조구(59.5%)대비 T(31.8%), AFT(23.7%), VAFT(21.7%) 효소처리구에서 유 의적(p<0.001)으로 낮게 나타났다. 참당귀의 다당체 성분인 Angelan은 arabinose, galactose, galacturonic acid 등이 포 함되어 있으며, glucose는 함유하고 있지 않다고 하여 본 연구와 유사한 결과를 나타내었다(Han et al., 1998). 이와 같은 결과는 효소처리에 의해 참당귀 세포벽의 다당체와 단백질의 분해와 전분을 임의로 절단하는 과정을 거치면서 참당귀 세포벽 다당체의 분해의 수용화가 극대화 되는 것으 로 판단된다. 또한 arabinose와 galactose의 함량이 증대된 것 은 불용성 세포벽의 가지부분, 즉 주로 arabinogalactan 부분 으로 이루어진 분획이 다량 수용화되었다는 것을 의미한다. 저분자 형태의 arabinogalactan은 항염증, 항보체 활성 및 항알러지 효과를 제공하고, 고분자 형태의 arabinogalactan 은 자연살해세포 파괴능과 세망내피세포 의 식균작용 증가 시키는 작용을 하는 것으로 보고되었다(Kelly, 1999). 참당귀 뿌리의 다당체 성분은 galacturonic acid, arabinose 그리고 galactose가 주성분인 pectin으로 구성되었으며 이들은 고등 식물에서 주로 세포벽과 세포질 간에 존재하는 다당체로서 분열조직과 연조직에 특히 많이 존재한다(Strong et al., 1973). 따라서 참당귀의 비전분당인 중성당의 전체 수율보다 는 arabinogalactan을 구성하는 arabinose와 galactose의 수율 증대에 VAFT 효소처리가 최적임을 확인할 수 있었다. 결론 적으로 VAFT 효소처리에 의한 공정이 참당귀 다당체의 분 자량을 감소시켜 참당귀 수용성 다당체 수율 및 총당의 증 가를 가져왔으며, 제거된 전분함량도 높게 나타내었다. 뿐만 아니라 VAFT 효소처리가 참당귀 내의 중성당인 arabinose와 galactose를 유리시키는데 매우 효과적임을 증명하였다.
요 약
본 연구는 생약재로 이용되는 참당귀의 다용도 기능성 소 재 개발을 통한 이용가치를 높이기 위하여 효소처리를 활용 한 기능성 다당체 분리방법에 대한 연구를 수행하였다. 참당 귀의 세포벽 성분 분해를 위한 최적의 효소는 Viscozyme L 로 선정되었다. 다당체 분리를 위한 효소처리는 단백분해 효소(Alcalase 및 Flavorzyme)와 전분분해효소(Termamyl 120L)를 Viscozyme L과 함께 복합적으로 처리한 VAFT 처리구가 추출 수율과 총당 함량이 각각 12.20%, 76.80% 로 다른 효소처리구(T, AFT 처리구)에 비하여 가장 높았 으며, 제거된 전분 함량 역시 29.62%로 가장 높게 나타났 다. 또한 비전분다당체 함량이 22.58%로 T 처리구의 20.78%과 AFT 처리구의 21.98%에 비하여 유의적(p<0.001) 으로 가장 높게 나타나 참당귀 다당체 분리를 위한 최적 효소처리 조건으로 선정되었다. 비전분다당체의 주성분인 arabinose, galactose의 함량은 대조구보다 T, AFT, VAFT의 모든 효소처리구에서 유의적(p<0.001)으로 높게 나타났다. 또한 참당귀 다당체의 분자량 분석을 통하여 대조구 (491,000 Da)에 비하여 VAFT 효소처리구가 13,000 Da로 가장 저분자화되는 것을 확인할 수 있었다. 따라서 VAFT 효소처리에 의한 참당귀 기능성 다당류의 효율적인 분리방 법은 참당귀를 활용한 새로운 산업적 기능소재 및 제품 개 발에 활용 가능성이 높을 것으로 기대되었다.







