서 론
비만(obesity)은 체내 지방이 과도하게 축적된 상태로 제 2형 당뇨병, 이상지질혈증, 고혈압, 심혈관질환과 같은 대 사질환의 대표 위험인자이다(Cheng et al., 2021;Rosengren, 2021). 대한비만학회는 체질량지수(body mass index, BMI)를 기준으로 23 kg/m2 이상은 비만 전단계, 25 kg/m2 이상은 비 만으로 진단한다(KSSO, 2024). 최근 10년 간 국내 비만 유 병률은 지속적으로 증가하여, 2022년 기준 남성은 47.7%, 여성은 25.7%를 기록하였다(KDCA, 2022). 이러한 증가 추 세로 인해 국내에서는 대규모의 사회경제적 손실이 발생하 고 있는 실정으로, 2021년 기준 총 약 16조원의 사회경제적 손실이 나타났고 이 중 비만 관련 진료비로 약 217억원이 소요되었다(Ra et al., 2024). 현재 미국 식품의약국(Food and Drug Administration, FDA)에서 승인한 비만 치료제는 올리 스탯(orlistat), 펜타민(phentermine), 부프로피온(bupropion), 리 라글루티드(liraglutide), 세마글루티드(semaglutide), 세트멜라 노티드(setmelanotide) 등이 있다(NID, 2024). 그러나 이러한 치료제들은 지방변, 심계 항진, 구강 건조, 고혈압, 구토, 설 사, 두통 등의 위장장애나 신경 정신적 부작용으로 인하여 지속적인 사용에 제약이 있다(Perdomo et al., 2023). 이에 대 응하여 현행 치료법의 한계를 극복하고 부작용 위험이 적 은 천연 생리활성 물질에 대한 관심이 높아지고 있다. 항비 만 효과를 가진 생리활성 물질을 기반으로 한 기능성 식품 은 비만의 치료와 예방뿐만 아니라 사회경제적 비용을 줄 여 국민 건강 증진에 기여할 수 있다. 따라서, 항비만 효과 를 가진 생리활성 소재의 발굴과 이를 통한 세부 신호 기전의 이해는 매우 중요한 과제이다.
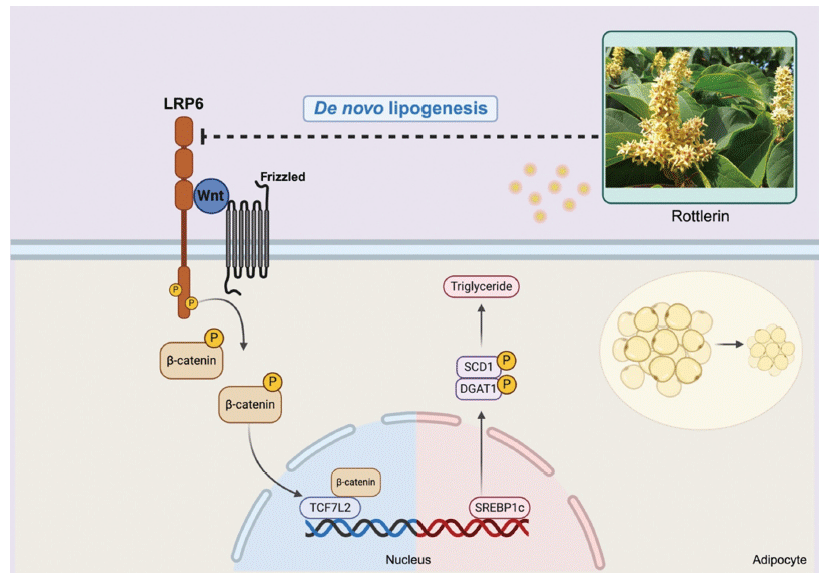
비만은 지방조직 내 지방구의 저장 효율을 극대화하기 위해 세포의 크기와 수를 증가시키며 악순환을 일으킨다(Suganami et al., 2012). 한정된 지방세포 내에서 지방이 과도하게 축적되면 지방조직에서 분비되는 호르몬인 아디포카인과 같은 지질 매개체(lipid mediator)가 방출되어 간, 신장, 췌장 등 비지방 조직 내에 지질이 축적되는 이소성 지방(ectopic fat)이 생성된다. 이러한 지질대사의 이상은 비만뿐만 아니라 심혈관계 대사증후군의 발병율까지 높일 수 있다(Opazo-Ríos et al., 2020;Zhang et al., 2022). 특히, 지질대사에서 Wnt/β-catenin 경로가 활성화되면 지방세포의 형성을 부정적으로 조절하는데 관여한다고 알려져있다(Gustafson & Smith, 2006). LDL 수용체 중 하나인 low-density lipoprotein related protein 6 (LRP6)는 Wnt의 공동수용체로 인산화되면 전사 활성인자인 β-catenin의 인산화를 억제하여 지질대사를 조절한다(Liu et al., 2012). 또한, Wnt 신호전달경로의 주요 조절자인 LRP6에 영향을 주는 단백질이나 효소를 억제하는 연구도 보고되고 있다(Yamamoto et al., 2008). 이렇듯 지방세포 분화의 촉진과 지질생합성에 기여하는 Wnt/β-catenin 신호전달경로 억제는 비만의 개선에 직접적으로 영향을 줄 수 있어 주요 조절자인 LRP6를 조절하는 것이 비만과 대사증후군의 치료에 주된 표적이 되고 있다(Wada et al., 2013).
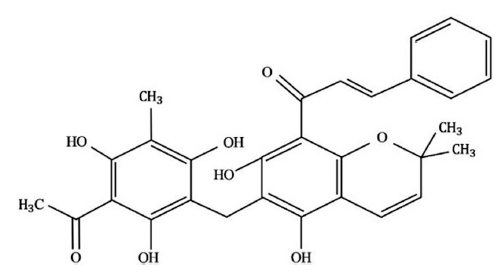
로틀린(Rottlerin)은 대극과 약용 식물인 예덕나무(Mallotus japonicus)에서 발견되는 대표적인 유효성분이다(Rai et al., 2021). 로틀린의 화학식은 C30H28O8이며, 분자량은 516.54 g/mol이다(Fig. 1). 이 화합물은 dimethyl sulfoxide (DMSO), 클로로포름(chloroform), 에탄올(ethanol)과 같은 유기용매에 용해되는 특징이 있다(Maioli et al., 2012). 로틀린은 주로 지방세포 분화 시 발현되는 protein kinase C delta (PKCδ)에 영향을 받지 않으면서도, 에너지를 열로 방출하고 세포 대사를 조절할 수 있는 대표적인 mitochondrial uncoupler이다(Kayali et al., 2002). 최근 로틀린의 LRP6와 Wnt/β-catenin 신호전달경로 억제 효능이 보고되었지만 이는 암세포주 중심으로 연구되어 지질대사 측면에서 수행된 연구는 부족한 실정이다(Lu et al., 2014). 로틀린의 AMP-activated protein kinase (AMPK) 활성 촉진은 로틀린의 항비만 효능 가능성을 뒷받침한다(Kojima et al., 2008). 이외에도 로틀린은 항염증, 항암 효능을 가지며(Ma et al., 2018;Lee et al., 2020), 활성 형태를 유지한 채 표적 조직까지 도달 가능하여 물질의 안정성이 입증된 바 있다(Lu et al., 2013). 따라서 로틀린은 질병의 치료와 예방을 위한 기능성 소재로서 높은 잠재력을 보이는 것으로 판단된다.
현재까지 로틀린은 지질대사에 관여하는 LRP6, PKCδ를 억제하고 AMPK를 촉진시키는 효과가 보고되었다. 그러나 로틀린의 다양한 생리활성에 비해 체지방 감소 효능에 대한 근거는 아직 부족한 실정이다. 비만은 지질대사의 이상과 관련된 대사질환으로 로틀린의 지방형성 유전자 억제 기능은 항비만 활성으로부터 기인한 것일 수 있다. 따라서 본 연구는 로틀린이 3T3-L1 분화지방세포 내에서 지질축적을 억제하는 능력을 평가하고, 지질생합성 및 지질대사를 조절하는 세부기전을 구명하고자 하였다.
재료 및 방법
본 실험에 사용된 로틀린은 100% dimethyl sulfoxide (DMSO; Daejung, Seoul, Korea)에 용해시켜 20 μM의 stock solution을 제조하였다. 본 연구에서 사용된 지방전구세포 3T3-L1은 American Type Culture Collection (Manassas, VA, USA)에서 분양받았다. Dulbecco’s modified Eagle’s medium (DMEM), phosphate-buffered saline (PBS), fetal bovine serum (FBS), penicillin-streptomycin 및 trypsin-ethylene-diamine-tetraacetic acid (EDTA)는 Welgene (Gyeongsan, Korea)에서 구입하였다. Insulin, 3-isobutyl-1-methylxanthine (IBMX), dexamethasone, oil Red O reagent 및 3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide (MTT)는 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하였다. Western blotting 실험에 사용한 ACC1, ACC1-pS79, FAS, SCD1, DGAT1, SREBP1, LRP6, LRP6-pS1490, β-catenin, transcription factor 7 like 2 (TCF7L2), β-actin는 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였고, 2차 항체인 horseradish peroxidase (HRP)-conjugated goat anti-rabbit IgG은 Bio-Rad (Hercules, CA, USA)에서 구입하였다.
지방전구세포 3T3-L1은 1% penicillin-streptomycin, 10% FBS가 포함된 DMEM 배지를 사용하여 37°C 세포배양기에서 5% CO2 조성으로 배양하였다. 세포는 세포수 증식으로 인한 과밀도 현상을 방지하기 위해 세포의 confluency가 70-80% 정도 차면 0.25% trypsin-EDTA solution으로 2-3일에 한 번씩 계대배양하였다. 지방전구세포의 confluency가 충분히 밀집되었을 때 0.5 μM IBMX, 1 μM dexamethasone, 10 μg/ mL insulin, 10% FBS를 첨가한 배지로 2일간 배양하였다. 이후 10 mg/mL insulin, 10% FBS를 첨가한 배지로 이틀마다 교체하여 총 8일만에 지방세포로 분화가 완료되었다.
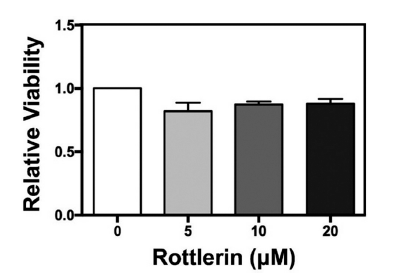
로틀린의 세포 독성 여부를 평가하기 위해 MTT assay 법으로 세포 생존율을 측정하였다. 지방전구세포 3T3-L1을 96-well plate에 배양한 후 로틀린을 농도별(0, 5, 10, 20 μM)로 48시간 동안 처리하였다. 처리가 완료된 후, 세포에 세포배양액의 20배로 희석한 MTT 용액을 첨가하여 37°C 세포 배양기에서 2시간 동안 배양하였다. 이후 세포배양액을 제거하고, MTT 용액에 의해 유래된 formazan 결정체를 100% DMSO로 용해시켜 분광광도계(BioTek, Winooski, VT, USA)로 540 nm의 파장에서 흡광도를 측정하였다.
지방전구세포 3T3-L1을 분화시킨 후, 독성평가 결과에 따른 안전한 농도의 로틀린을 48시간 동안 처리하였다. 처리가 완료된 분화지방세포를 10% formalin (Duksan, Ansan, Korea)으로 고정한 후 oil Red O 염색 용액으로 10분 동안 처리하여 염색하였다. 이는 광학 현미경(Leica Application Suite EZ, Wetzlar, Germany)을 사용하여 100배로 확대한 후 관찰하였다. 이후 염색된 분화지방세포에 100% isopropanol (Daejung)을 첨가하여 oil Red O 색소를 용해시킨 후, 500 nm 파장의 흡광도를 측정하여 축적된 지방구를 정량하였다. 위 실험을 동일하게 3회 이상 반복하여 결과값을 산출하였다.
로틀린 처리 후의 분화지방세포 3T3-L1은 phosphatase inhibitor와 protease inhibitor (Cell Signaling Technology)가 첨가된 RIPA buffer (CellNest, Tokyo, Japan)를 넣고 bullet blender (Next Advance, NY, USA)를 이용하여 세포를 분쇄한 후 단백질을 추출하였다. 추출한 단백질은 Bradford assay (Bio-Rad)를 사용하여 단백질 농도를 측정한 후 2x Laemmli sample buffer (Bio-Rad)와 혼합하였다. 준비된 시료는 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) 전기영동을 통해 분자량에 따라 단백질을 분리하고 polyvinylidene difluoride membrane (PVDF) (Bio-Rad)으로 옮겼다. 실온에서 5% bovine serum albumin (BSA) (GenDEPOT, Katy, TX, USA)에서 50분 동안 blocking 한 후 1차 항체를 4°C에서 18시간 처리하였다. 이후 0.1% tris-buffered saline with 0.1% tween® 20 detergent (TBST)로 세척한 후, HRP-conjugated 2차 항체를 실온에서 1시간 처리하였다. 다시 0.1% TBST로 세척한 후, 화학 발광시약(ECL) (Bio-Rad)을 사용하여 Image Lab (Bio-Rad)으로 단백질의 양을 정량하였다. 각 효소 단백질은 β-actin으로 표준화하여 비율로 나타내었다.
결과 및 고찰
MTT assay는 살아있는 세포 내 미토콘드리아 탈수소효소가 황색의 MTT tetrazolium을 자색의 formazan으로 환원시키는 반응을 이용한 분석법이다(Rai et al., 2018). 지방전구세포 3T3-L1에 대한 로틀린의 독성을 확인하고 적절한 처리 농도를 설정하기 위해 MTT assay를 진행하였다(Fig. 2). 본 연구에서 로틀린을 0, 5, 10, 20 μM으로 처리하였을 때 모든 농도에서 세포 생존율은 유의적인 차이가 나타나지 않았다. 이는 10 μM 이하 농도의 로틀린 처리에 따른 세포 생존율 감소가 관찰되지 않은 선행연구의 결과와 유사하며(Brenner et al., 2010;Song et al., 2018a), 차후 실험에서 독성평가의 결과에 기반하여 로틀린 처리 농도를 0, 5, 10, 20 μM으로 설정하여 실험을 진행하였다.
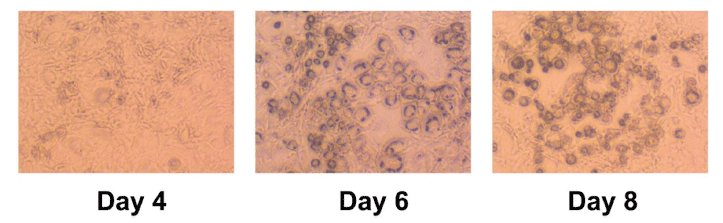
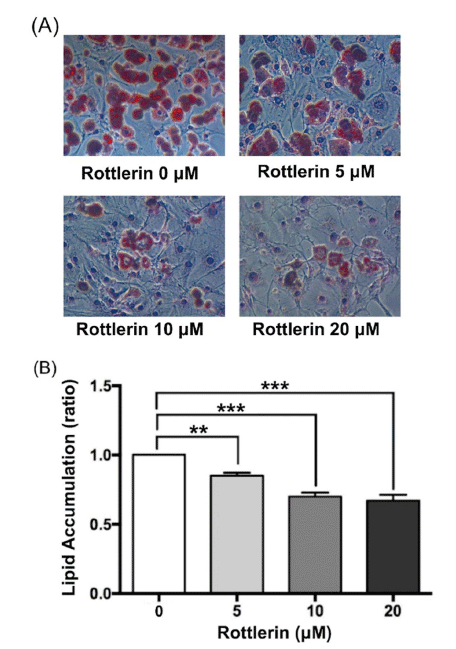
본 연구에서는 세포독성이 관찰되지 않은 범위 내에서 로틀린의 분화지방세포 내 지질축적 억제능을 평가하였다. 지방전구세포 3T3-L1의 분화를 유도하였고, 4일 후 육안으로 관찰 가능한 지방구가 형성되었다. 분화 8일차에 지방구가 약 80% 이상 축적된 것을 확인하고 지방세포 분화를 종료하였다(Fig. 3). 이후 oil Red O 염색법으로 로틀린의 지질축적 억제능을 검증하였다. Oil Red O 염색법은 분화지방세포 내 중성지방과 cholesteryl esters를 조직화학적으로 빠르고 간단하게 염색하여 지방축적을 정성 및 정량적으로 측정하는 염색법이다(Green & Meuth, 1974). 분화지방세포에 로틀린 0, 5, 10, 20 μM을 48시간 처리한 후 oil Red O 염색법을 통해 지질축적 억제능을 평가하였다. 실험 결과, 로틀린 처리에 의해 분화지방세포의 크기와 염색된 양이 줄어들어 지방구 형성이 감소하였음을 육안상으로 확인하였다(Fig. 4A). 정량분석 결과, 로틀린 5 μM 처리 시 약 20% (p<0.01), 10, 20 μM에서는 약 30%의 지질축적이 억제되었다(p<0.001)(Fig. 4B). 이와 같은 결과를 종합하여 로틀린이 분화지방세포 내 지방구 축적 감소를 유의적으로 억제시킴을 검증하였다.
본 연구는 분화지방세포 3T3-L1에서 로틀린 처리로 인한 지방구 축적 감소를 확인한 후 세부기전을 분자생물학적 기법을 통해 확인하였다. 선행연구에 따르면, 로틀린은 지방산 합성을 억제하는 주요 지질대사 조절자인 AMPK (Gómez-Galeno et al., 2010)의 활성을 촉진하여 소포체 내 지질축적을 감소시킨다(Soltoff, 2007). 비만을 유도한 마우스에게 지방세포 억제 효능이 알려진 추출물 급여 시 비만의 표현형이 감소함과 동시에 AMPK의 인산화 수준이 증가한 선행연구 또한 AMPK의 활성이 지질축적을 억제하는 효과를 뒷받침한다(Zou et al., 2020). 이를 기반으로 본 연구에서는 로틀린이 지질합성과 지질축적을 억제할 것으로 예측하여 관련 유전자들의 발현 변화를 분석하였다.
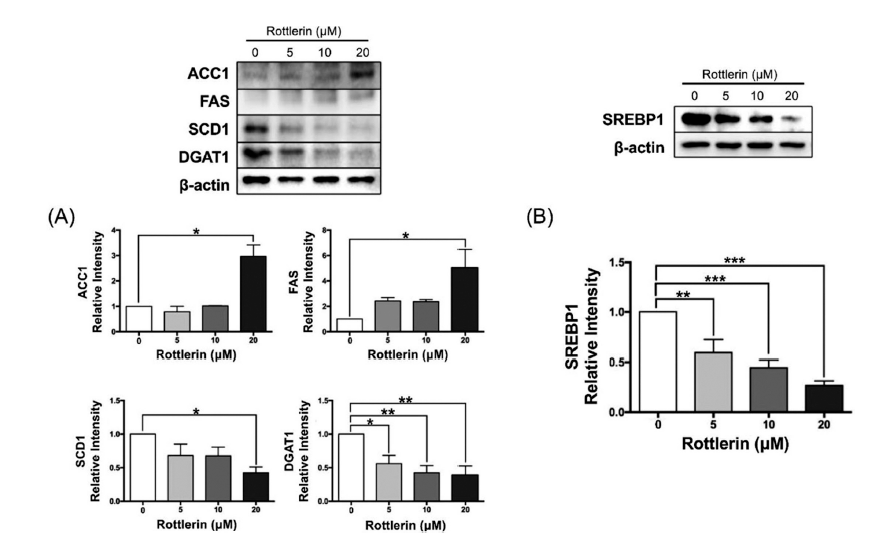
과잉의 영양소 유입은 간과 지방조직 내에서 lipogenic 유전자들의 발현을 증가시켜 지질생합성(de novo lipogenesis) 과정을 촉진한다(Kersten, 2001). Sterol regulatory element-binding protein 1 (SREBP1)은 지방전구세포의 분화를 촉진하는 전사인자로서 adipogenic 유전자의 발현을 증가시킬 뿐만 아니라(Price et al., 2016), 소포체에서 합성되어 골지체로 이동한 후 핵으로 유입되어 lipogenic 유전자인 acetyl-coA carboxylase-1 (ACC1), fatty acid synthase (FAS), stearoyl-coA desaturase-1 (SCD1), diacylglycerol acyltransferase-1 (DGAT1)의 발현을 촉진시킨다고 알려져있다(Lim et al., 2021;Fang et al., 2022). 지질생합성의 첫 단계로 SREBP1에 의해 발현이 증가된 ACC1은 acetyl coA를 카르복실화하여 malonyl CoA로 전환시킨다. De novo lipogenesis (DNL)의 중요한 기질인 malonyl CoA는 FAS에 의해 팔미트산으로 바뀌고 SCD1 은 포화지방산인 팔미트산과 스테아릭산을 각각 단일 불포화지방산인 팔미톨산과 올레산으로 전환시킨다. 최종적으로 DGAT1에 의해 디아실글리세롤(diacylglycerol, DAG)에 지방산이 결합되어 중성지방이 합성된다(Nakamura et al., 2014;Song et al., 2018b;Fang et al., 2019;Lally et al., 2019;de la Rosa Rodriguez et al., 2021).
따라서 본 연구에서는 지질생합성에 관여하는 효소들의 발현량을 측정하였다. 분화지방세포 3T3-L1에 로틀린 0, 5, 10, 20 μM을 48시간 처리한 결과, ACC1과 FAS의 발현은 로틀린 20 μM 처리 시 각각 3배, 5배 증가하였다(p<0.05)(Fig. 5A). 선행연구에 따르면 평활근 세포 내에서는 로틀린의 처리에 따른 ACC1의 활성 억제가 확인되었다(Kojima et al., 2008). 또한 PKCδ knock out 마우스의 간 조직에서 ACC1, FAS의 발현이 감소되었다. 본 연구에서 PKCδ 억제제인 로틀린에 의해 ACC1, FAS의 발현이 증가한 것은 선행연구와 상이하지만 표적 조직이 다르다는 점을 고려할 때 추가적인 검증이 필요하다고 판단된다(Bezy et al., 2011). 반면 SCD1의 발현은 로틀린에 의해 농도 의존적으로 감소하였고, 특히 로틀린 20 μM 처리 시 약 2배 정도의 유의적인 감소를 보였다(p<0.05). DGAT1의 발현은 로틀린 5 μM 처리 시 약 50% 정도 유의적으로 감소하였고(p<0.05), 10, 20 μM에서는 약 60% 정도 감소하였다(p<0.01) (Fig. 5A). 따라서 본 연구에서는 3T3-L1 세포의 분화과정 중 로틀린의 처리 시 SCD1과 DGAT1 발현 수준을 감소시켜 결과적으로 지질생합성을 억제한 것을 확인한 후, 지방산과 중성지방 합성의 상위 조절자인 SREBP1의 발현량을 측정하였다. 로틀린 처리 시 SREBP1 발현이 농도 의존적으로 감소하였으며, 특히 20 μM 처리 시 약 80% 정도 감소하였다(p<0.001) (Fig. 5B). SREBP1의 억제를 통한 지질축적량의 감소는 다른 연구에서도 보고되었는데, 항비만 효능 물질을 처리한 분화지방세포에서 SREBP1의 발현이 유의적으로 감소한 바 있다(Kim & Go, 2023). 또한 고지방식이 유도 비만 마우스에서 SREBP1의 차단은 지질축적을 억제하여 비만을 개선하였다(Yu et al., 2023). 상위 결과들을 종합하였을 때, 로틀린은 지질합성 초기에 관여하는 ACC1, FAS의 발현을 감소시키지는 않았지만 후기의 주요 인자인 SCD1, DGAT1을 효과적으로 감소시켜 지질축적을 억제하였고, 이는 SREBP1의 발현 억제에 기반함을 입증하였다.
로틀린이 SREBP1과 하위 효소를 감소시켜 지질대사를 조절했음을 검증하였다. 이후 지질생합성의 또다른 핵심 신호전달경로인 Wnt 기전의 관련 인자의 발현 변화를 분자생물학적 기법으로 확인하였다. 선행연구를 통해 LRP6가 증 가하면 Wnt/β-catenin 신호전달 경로가 활성화되어 지방생성 및 지질합성 등의 지질대사에 영향을 미치는 것이 보고되었는데, 특히 Wnt가 LRP6 손상으로 인해 증가한 지질합성 관련 인자들을 회복시켜 LRP6가 지질대사의 핵심인자인 Wnt의 하위조절자임을 확인하였다(Go et al., 2014). 선행연구에 따르면, 로틀린은 부신피질 암세포주(NCI-H295R, SW-13) 내에서 Wnt/β-catenin, LRP6, LRP6-pS1490 발현량을 유의하게 억제한 바 있다(p<0.05) (Zhu et al., 2017). 또한 임파선 암세포주(HEK293)에 4 μM의 로틀린을 24시간 동안 처리한 결과, 암 세포의 생존과 증식에 관여하는 LRP6와 Wnt의 발현을 농도 의존적으로 차단시켰다(Lu et al., 2014). 이처럼 암세포주 내에서 로틀린이 LRP6를 억제하는 선행연구가 보고되어 본 연구에서는 3T3-L1 세포 내에서 로틀린의 LRP6 발현 억제 효과를 확인하여 Wnt/β-catenin 신호전달경로에 미치는 효과를 검증하고자 하였다. 분화지방세포 3T3-L1에 로틀린을 처리하였을 때 LRP6는 농도 의존적으로 감소하였고 특히 로틀린 20 μM에서 약 70% 정도의 유의적인 감소를 나타냈다(p<0.001) (Fig. 6A). LRP6의 활성형인 LRP6-pS1490의 발현 또한 농도 의존적으로 감소하였으며, 로틀린 10, 20 μM에서 각각 약 40%, 60% 유의적으로 감소하였다(각각 p<0.05, p<0.01). 로틀린의 LRP6 감소에 따른 지질합성 억제에 대한 선행연구는 아직 부족하지만 암세포주 내 결과와 동일하게 로틀린은 LRP6의 발현량을 감소시켰다. 이에 따라 로틀린의 LRP6 억제능이 Wnt/β-catenin 신호전달경로에 영향을 미치는지를 평가하기 위하여 차후 실험을 진행하였다.
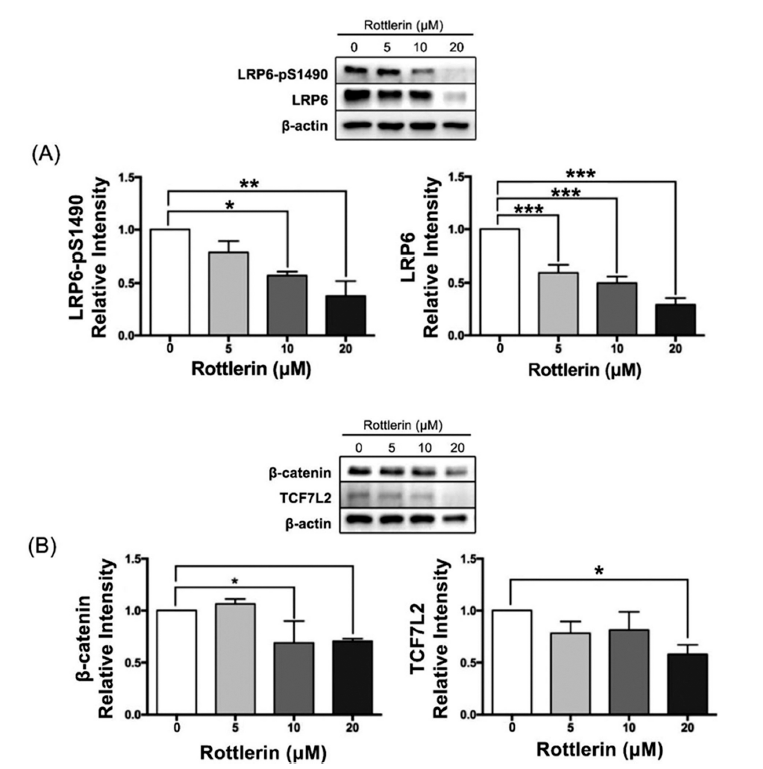
Wnt 신호전달경로에서 Wnt 리간드가 LRP6 공동수용체 복합체에 결합하면 세포질 내 β-catenin은 핵 내로 이동하여 안정화된다. 이후 β-catenin은 T-cell factor (TCF) family에 결합하여 성장 및 발달과 관련된 유전자를 발현시킨다 (Marinou et al., 2012;Jung et al., 2017). T-cell factor 4 (TCF4)는 transcription factor 7 like 2 (TCF7L2)로도 불리며 지방전구세포 내에서 TCF7L2의 감소는 지질분화와 축적을 조절한다. 지방세포의 생성에 부정적 조절자인 tumor necrosis factor alpha (TNF-α) 또한 TCF7L2에 의존적으로 전사 활동이 증가되는 것으로 보아 TCF7L2의 조절은 지질대사에 중요한 영향을 미치는 것을 알 수 있다(Cawthorn et al., 2007;Zhang et al., 2021). 이에 로틀린의 처리에 따라 LRP6의 하위 기전인 β-catenin/TCF7L2의 발현 변화를 측정하였다. 로틀린 10, 20 μM에서 β-catenin의 발현이 약 30% 억제되었으며(각각 p<0.05, p<0.01), TCF7L2의 발현은 로틀린 20 μM에서 약 40% 억제되었다(p<0.05) (Fig. 6B). 선행연구에 따르면, 전립선암 세포주(PC-3, DU145)와 유방암 세포주(MDA-MB-231, T-47D)에 0, 0.25, 0.5, 1, 2, 4 μM의 로틀린을 24시간 동안 처리한 결과, LRP6와 β-catenin 발현을 농도의존적으로 감소시켰고 이는 본 실험의 결과와 유사하며(Lu et al., 2014) 처리로 TCF7L2 발현 변화를 분석한 연구는 부족한 실정이다. 결론적으로 로틀린에 의해 지질생합성에 관여하는 SREBP1 전사인자 발현이 감소되었고, 그 결과로 SCD1과 DGAT1의 발현이 감소되었다. 또한 로틀린은 지질항상성의 조절자인 LRP6를 β-catenin/TCF7L2 기전을 통해 감소시켰다. 따라서 로틀린은 지질생합성에 관여하는 효소 및 전사인자의 발현을 감소시켜 3T3-L1 세포 내에서 지질축적 억제능을 나타낸 것을 검증하였다.
요 약
본 연구에서는 분화지방세포 3T3-L1을 이용하여 로틀린에 의한 지질대사 개선 효과를 검증하였다(Fig. 7). 이를 위해 지방전구세포에 로틀린을 처리하고 세포 독성을 측정한 결과, 5, 10, 20 μM의 로틀린 모두 생존율 감소를 보이지 않았다. 이후, 로틀린의 지질축적 억제능, 지질생합성과 지질대사에 관여하는 효소의 발현량 변화를 분석하였다. 먼저 로틀린은 분화지방세포 3T3-L1 내 지질축적을 농도 의존적으로 감소시켰다. 이에 세부기전 검증을 위하여 지질생합성 경로에 관여하는 효소의 단백질 발현량을 분석하였다. 로틀린 처리에 따라 주요 지질생합성 효소인 SCD1과 DGAT1의 단백질 발현량이 유의적으로 감소하였고 이를 조절하는 전사인자인 SREBP1 발현량 또한 로틀린 처리 농도에 비례하여 유의적으로 감소하였다. 지질대사의 주요 조절자인 LRP6/β-catenin 기전도 유의적으로 감소하여 로틀린의 지질축적 억제 능력은 LRP6/β-catenin에 의한 것으로 나타났다. 결론적으로 예덕나무의 대표 유효성분인 로틀린은 3T3-L1 분화지방세포에서 LRP6/β-catenin/SREBP1c 경로를 통해 지질합성 전사인자 및 관련 효소를 억제하여 지방구 형성을 억제하였다. 본 연구의 결과는 로틀린을 이용한 항비만 소재 기반의 건강기능식품 개발을 위한 중요한 기초자료로 활용될 것으로 판단된다. 특히, 이는 기존 로틀린의 항염 및 항암 효과에 대한 연구에서 나아가, 지방세포 내에서 Wnt 신호전달경로에 관여하는 LRP6/β-catenin/TCF7L2 억제 효능을 검증한 첫 연구로서의 의의를 지닌다.