Article
건조방법에 따른 무의 식이황화합물 성분변화
정경아, 이창주*
Changes in the Composition of Dietary Sulfur Compounds in Radish According to Different Drying Methods
Gyeong A Jeong, Chang Joo Lee*
Author Information & Copyright ▼
Department of Food Science and Biotechnology, Wonkwang University
* Corresponding author: Chang Joo Lee, Department of Food Science and Biotechnology, Wonkwang University, Iksan 54538, Korea Tel: +82-63-850-6825; Fax: +82-63-850-7308 E-mail:
cjlee@wku.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Sep 13, 2023; Revised: Oct 11, 2023; Accepted: Oct 18, 2023
Abstract
Radish is a sulfur-containing compound containing the -S group, having bioactive functions such as anticancer, antithrombotic, antioxidant, and antibacterial properties, and is used as a health supplement and pharmaceutical material. This study aimed to compare changes in sulforaphane (SFN) content according to freeze-drying or hot-air drying conditions in Korean radishes. The color of frozen or hot-air-dried radish underwent a browning reaction due to heat treatment; the brightness (L) decreased from 89.3 to 56.1, and the redness (b) increased. The SFN content of freezedried radish was 13.2565 mg/g, the SFN of radish dried at 50°C was 2.64372 mg/g, and the SFN of radish dried at 80°C was 0.0678 mg/g, which was the highest in freeze-dried radish. Therefore, the SFN of radish was found to be insufficient in thermal stability, and freeze-drying was considered a suitable method for drying radish.
Keywords: radish; sulforaphane; freeze-dried; hot-air dried
서 론
우리나라는 1970년대 이후 지속적인 국민소득 증가로 경제성장에 따른 환경오염 및 미세먼지, COVID-19와 같 은 환경변화로 건강에 대한 관심이 높아지고 있다(An & Kim, 2001;Hwang et al., 2011). 이에 따라 다양한 기능 성 원료를 통한 건강 기능성식품의 소비 증가와 이와 관련 한 연구가 활발히 진행되고 있다(Hwang et al., 2021). 그 중 황 함유화합물이 항암성, 항혈전성, 항산화성, 항균성 등의 생리활성 기능을 가지고 있다고 보고되면서 관련 건 강 보조 식품 및 의약품의 소재로 활용되고 있다(Song et al., 2009).
황 함유화합물은 -S기를 가지고 있는 화합물로, 특히 무 (Choi et al., 2009), 적양배추(Ha & Lee, 2014), 브로콜리 (Kim et al., 2009), 마늘(Choi et al., 2007), 양파(Kwak et al., 2000), 부추와 파(Kim et al., 2012) 등과 같은 십자화 과(Cruciferae) 및 백합(Lilliaceae) 채소류에 존재한다. 국내 에서 재배되는 농산물 중 무는 항산화작용을 나타내는 생 리활성 물질이 다량 함유되어 있으며, 황을 포함하는 sulforaphane 성분이 포함되어 있다(Choi et al., 2009).
Sulforaphane (SFN, 1-Isothiocyanato-4-(methylsulfinyl)- butane)은 isothiocyanate과 유사한 화학구조를 가지고 있어 강력한 항암 및 항산화 효과가 있다(Im et al., 2010). Sulforaphane은 발암성 원인물질저하와 배출을 돕는 Phase I (cytochrome P-450)과 Phase II (glutathione transferase와 qui-none reductase 등) 효소들의 강력한 유도체로 알려져 있다(Kim et al., 1997;Choi et al., 2008). 최근 연구결과 에 따르면 sulforaphane는 인체내의 암세포에서 세포주기 진행과정을 교란하면서 암세포 증식을 억제한다고 보고되 었다(Chiao et al., 2002;Pham et al., 2004;Singh et al., 2004). 이에 따라 항암작용에 영향을 주는 sulforaphane에 대한 관심이 증대되고 있다. 하지만 무에 관한 연구로는 Kim & Rhee (1985)의 한국산 무의 휘발성 함유화합물 항 산화 변화, 가공방법에 따른 제주산 월동무의 이화학적 특 성 변화(Hong et al., 2021), 열처리 무 추출물의 이화학적 특성과 항산화 활성(Lee et al., 2009), 인체 페암 세포주 (A-549)에 대한 무 에탄올 추출물의 세포 독성 연구(Yim et al., 2004) 등과 같이 무 추출법에 의한 항산화 활성에 대한 연구가 주를 이루고 있을 뿐 건조 방법에 따른 sulforaphane 함량에 관한 연구는 부족한 실정이다. 따라서 본 연구에서는 건조 방법에 따른 무의 식이황화합물 sulforaphane의 성분 변화를 조사하여 최적 건조방법을 확 립하여 식품산업화에 필요한 기초 분석 자료를 확보하고자 하였다.
재료 및 방법
실험 재료
본 실험에 사용된 무는 2022년 국내에서 생산된 것으로 강원도에서 수확한 운두령 무(Gangwon-do, South Korea)를 구매하여 사용하였다. 무는 동결건조(RF), 50°C 열풍건조 (R50), 80°C 열풍건조(R80)로 각각 건조하여 실험에 사용하 였다. 건조한 무는 디클로로메탄(Dichloromethane, Samchun, Gyeonggi-do, South Korea)용매를 이용해 sulforaphane 성 분을 추출하였다. 분석 연구에 사용된 표준 시약은 DLSulforaphane (S4441, Sigma-Aldrich, St. Louis, MO, USA) 을 이용하였다.
무의 건조
무의 건조는 동결 건조기(LP10, IlShinBioBase Co., Ltd., Dongducheonsi, Gyeonggido, South Korea), 열풍 건조기 (C-DF3, Changshin Science, Seoul, South Korea)를 사용하 였고 열풍 건조의 온도는 50°C, 80°C로 하였다. 구매한 무 를 초음파세척기(AY-1500, Anyone, Suwon, Gyeonggi-do, Korea)로 흙과 같은 불순물을 제거한 뒤 2 × 2 cm로 절단 하여 수분함량 10% 이하가 될 때까지 건조하였다. 수분함 량은 적외선 수분측정기(ML-50, A&D Co., Tokyo, Japan) 를 이용하여 105°C 상압 가열 건조법으로 측정하였다. 건 조한 시료는 grinder (HMF-3800, Hanil Electric, Seoul, Korea)에 넣고 분쇄하여 sulfate인 sulforaphane (SFN)의 추 출에 사용하였다.
색도 측정
건조한 무의 색도는 분쇄한 시료 10 g을 petri dish에 담 아 색도계(Model CM-5, Minolta Co., Tokyo, Japan)로 측 정하였다. 색도는 Hunter 값인 명암도(L; lightness), 적색도 (a; redness), 황색도(b; yellowness) 값을 표준 백색판으로 보정한 후 측정하였다. 색도차(∆E)는 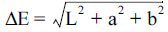 로 계산하였다.
로 계산하였다.
무의 sulforaphane 추출
건조한 무의 식이황화합물 추출은 Lee & Kyung (2011) 의 방법을 변형하여 진행하였다. 각 건조 시료 10 g에 D.W 250 mL, dichloromethane 80 mL을 첨가하여 1시간 동안 교반 추출하였다. 추출된 시료를 5°C 원심분리기(Supra R22, Hanil Scientific Inc., Gimpo, Korea)에서 13,000×g로 15분간 원심 분리하여 유기 용매 하층액(dichloromethane) 을 분취하였다. 하층액은 -70°C deep freezer (DF8517, IlshinBiobase Co. Ltd., Seoul, Korea)에서 2시간 이상 보 관 후 centrifugal evaporator (CVE-3100, EYELA, Tokyo, Japan)로 진공 농축 건조하였다. 추출된 시료는 -70°C 이 하의 온도에서 보관하며 실험에 사용하였다.
Sulforaphane 표준 용액의 조제
Sulforaphane 표준 시약을 5 μg/mL의 농도가 되도록 제 조한 후 이를 희석하여 최종 농도가 100, 75, 50, 25, 0 ng/mL 비율이 되도록 제조하여 HPLC 분석을 통해 표준 곡선(calibration curve)를 얻었다. 표준 용액 제조에는 HPLC grade의 acetonitrile과 water를 사용하였다.
식이황화합물 Sulforaphane 분석
무로부터 추출된 식이황화합물은 HPLC (Jasco LC-4000, Tokyo, Japan)를 이용하여 분석하였다. 무에서 존재하는 식 이황화합물 sulforaphane은 Nakagawa et al. (2006)의 방법 을 변형하여 분석하였다. 분석 시료는 진공 농축한 시료 10 mg과 1 mL ACN (acetonitrile)을 혼합한 뒤 0.45mm nylon filter로 filtering하여 분석에 사용하였다. Sulforaphane 분석에 사용된 HPLC column은 C18 (250×4.6mm×5 μm, YMC-Pack, ODS-AQ)이며, 이동상은 gradient 방식으로 HPLC grade solvent 60:19 v/v (water: acetonitrile)으로 gradient를 주다가 40:60 v/v (water:acetonitrile) 비율로 isocratic하였다. Flow rate: 1 mL/min, Injection volume: 10 μL, UV-detector (254 nm, 230 nm)로 하여 Sulforaphane 물질을 분석하였다. 자세한 분석 조건은 Table 1에 나타냈다.
Table 1.
HPLC analyzer operating condition of radishes
| HPLC |
|
Jasco LC-4000 |
|
|
| Column |
|
C18 (250 × 4.6 mm × 5 μm, YMC-Pack ODS-AQ) |
|
|
| Mobile phase |
|
A: ACN (Acetonitrile), B: Water (D.W) |
|
|
| Detector |
|
UV-vis detector (230 nm) |
|
|
| Run time |
|
28 min |
|
|
| Flow rate |
|
1 mL/min |
|
|
| Injection volume |
|
20 μL |
|
|
| Column temperature |
|
30°C |
|
|
| Method conditional (gradient) |
Time (min) |
Mobile phase A (%) |
Mobile phase B (%) |
|
| 00.00 |
19 |
81 |
| 05.00 |
19 |
81 |
| 20.00 |
60 |
40 |
| 20.01 |
100 |
0 |
| 25.00 |
100 |
0 |
| 25.01 |
19 |
81 |
| 28.00 |
19 |
81 |
Download Excel Table
통계분석
모든 실험값은 S PS S ( 23.0 f or w indows, S PS S I nC., Chicago, IL USA) 프로그램을 이용하여 분산분석(ANOVA) 을 실시하였다. 실험값은 Mean±SD로 표시하였으며, 각 측 정 평균값은 p<0.05 수준으로 Duncan’s multiple range test 를 실시하여 유의 수준을 검증하였다.
결과 및 고찰
색도 측정
동결 또는 열풍 건조된 무의 색도는 Table 2에 나타내었 다. 동결 건조된 무는 열이 가해짐에 따라 갈변 반응이 진 행되어 명도 L 값은 RF (83.3), R50 (78.7), R80 (56.1)로 감소하는 경향을 보였다. 황색도인 b 값은 RF (7.42), R50 (18.1)로 증가하다가 R80 (14.1)로 감소하는 경향이 나타났 다. 적색도인 a 값이 R80 (6.60)으로 가장 높게 나타났으며 이는 높은 온도처리로 인한 갈빈 현상으로 보인다. Jeon et al. (2016)에 따르면 전반적으로 건조 온도가 높을수록 명 도는 감소하고 적색도가 증가한다는 보고와 일치한 결과이 다. Hwang et al. (2011)에 따르면 식품 열처리 가공은 열 에 민감한 활성 물질의 손실 등이 발생한다고 보고하였다. 이에 따라 건조 온도에 따른 무의 sulforaphane 함량에 변 화가 있을 것이다.
Table 2.
Hunter’s color values of dried radish powder
| Sample2) |
Hunter’s color value1) |
| L |
a |
b |
∆E |
| RF |
89.3±0.68c |
-1.02±0.30a |
7.42±1.05a |
89.86±0.63c |
| R50 |
78.7±1.34b |
2.49±0.58b |
18.1±0.69c |
80.84±1.14b |
| R80 |
56.1±3.32a |
6.60±0.43c |
14.1±2.49b |
58.23±3.83a |
Download Excel Table
HPLC에 의한 sulforaphane 함량 분석
Sulforaphane 표준 곡선
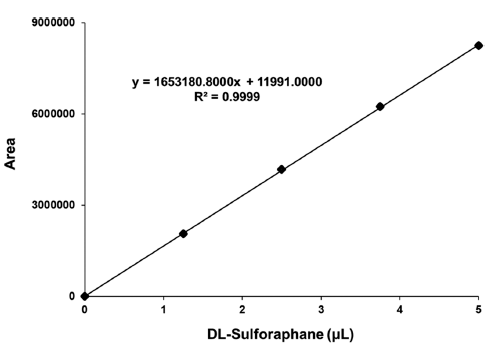
무의 sulforaphane 함량을 측정하기 위해 S igma에서 판 매하는 표준 시약(sulforaphnae, Sigma, USA)를 이용하여 표준 검정 곡선을 작성하였다. Sulforaphane의 표준 시약은 5 μg/mL를 기준으로 0, 25, 50, 75, 100 ng/mL으로 희석하 여 HPLC (high performance liquid chromatography)로 측 정하였다. 이에 따른 검량선의 Linearity는 y = 1653180.8x + 11991이었으며, R2 = 0.9999로 나타났다. 자세한 그래프는 Fig. 1에 나타내었다.
Fig. 1.
DL-Sulforaphane standard solution of radishes by drying method. HPLC chromatogram of standard crude sulforaphane detected by absorbance at 230 nm.
Download Original Figure
무의 sulforaphane 함량
건조 온도에 따른 무의 SFN (sulforaphane)의 함량은 Table 3에 나타냈다. Im et al. (2010)의 연구 결과에 따르 면 십자화과 채소류에 속하는 브로콜리, 무의 S FN의 함량 은 품종별, 지역별로 매우 다양하게 나타나며, 가공처리(온 도, 추출 용매 등)에 따라서도 황을 함유하는 S FN 함량이 다양하다고 보고하였다. 본 연구에서 동결건조 무(RF)의 SFN 함량은 13.2565 mg/g이며, 열풍건조한 무의 S FN 함 량은 R50 (2.64372 mg/g), R80 (0.0678 mg/g)으로 나타났 다. 열처리 온도가 높아질수록 감소하는 경향을 보였으며, 이는 Kim et al. (1997)의 연구와 동일하게 S FN은 열처리 가 진행될수록 감소하였다. 따라서 무로부터 S FN을 얻기 위한 최적 건조 조건은 동결 건조(RF)로 판단된다.
건조 온도에 따른 sulforaphane 함량의 변화
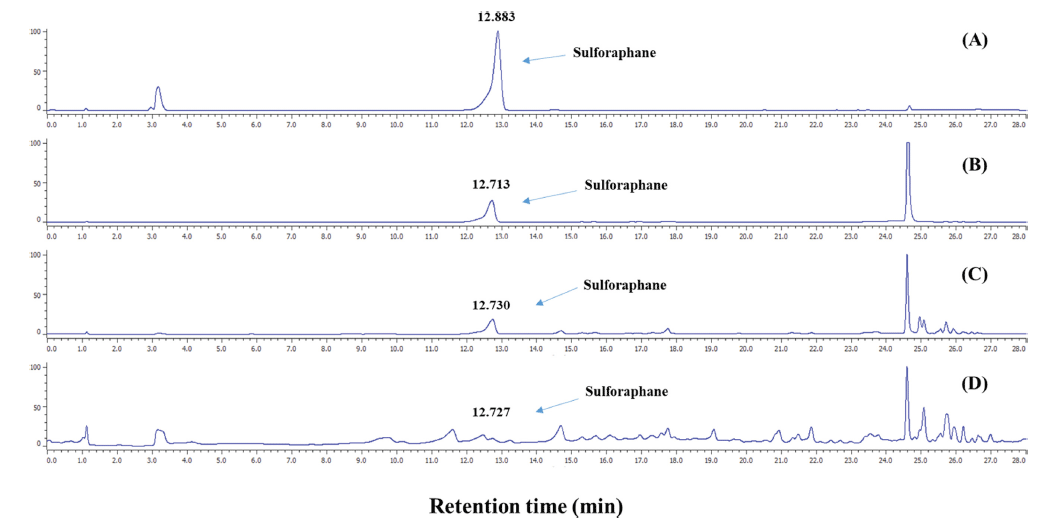
Nakagawa et al. (2006) 건조 조건에 따른 무의 HPLC 분석결과는 Fig. 2에 나타냈다. (A)는 S FN s tandard solution 으로 retention time (RT) 12.883에 단일 peak가 나타났다. 동결 및 열풍 건조한 시료에서도 오차 범위 안으로 동일한 RT 값을 가졌다. 무를 온도별로 건조한 결과는 열처리 및 온도가 높아질수록 S FN함량이 감소하는 것으로 나타났다 (Table 3). Kim et al. (2009)에 따르면 sulforaphane은 myrosinase라는 효소로 인해 glusinolate가 가수 분해되면서 생성되는데, 열을 가하면 이 효소가 불활성 된다고 보고하 였다. HPLC 분석결과 높은 열로 건조하였을 경우 S FN의 함량은 감소하였으며, SFN의 구조가 파괴 및 변환되면서 다양한 RT 값에서 새로운 peak가 형성되었다.
Fig. 2.
HPLC chromatogram of crude sulforaphane extract from radish detected by absorbance at 230 nm. (A) sulforaphane standard (B) RF; freeze-dried of radish, (C) R50; radish dried at 50°C, (D) R80; radish dried at 80°C. The arrow indicates the peak of sulforaphane.
Download Original Figure
요 약
본 연구에서 무로부터 동결 건조 또는 열풍 건조 조건에 따른 S FN 함량의 변화를 비교하고자 하였다. 무에 동결 또는 열풍 건조를 진행하였을 경우 색도는 열처리된 열풍 건조 시료에서 갈변반응으로 인해 명도가 감소하고 적색도 가 증가하였다. 또한 S FN의 함량은 건조온도가 높아짐에 따라 감소하는 경향이 나타났다. 동결 건조한 무에서의 SFN 함량은 13.2565 mg/g이었으며, 50°C에서 건조한 무의 SFN은 2.6437 mg/g, 80°C에서 건조한 무의 S FN은 0.0678 mg/g으로 동결 건조한 무에서 가장 높았다. 따라서 무의 SFN은 열에 민감하여 동결 건조가 적합한 것으로 판단된다.
감사의 글
본 논문은 농촌진흥청 연구사업(과제번호: RS-2022- RD010244)의 지원에 의해 이루어진 것임.
정경아: 원광대학교 식품생명공학과 박사과정
이창주: 원광대학교 식품생명공학과 교수
References
An SJ, Kim MK.2001. Effect of dry powders, ethanol extracts and juices of radish and onion on lipid metabolism and antioxidative capacity in rats. J. Nutr. Health. 34: 513-524.
Chiao JW, Chung FL, Kancherla R, Ahmed T, Mittelman A, Conaway CC.2002. Sulforaphane and its metabolite mediate growth arrest and apoptosis in human prostate cancer cells. Int. J. Oncol. 20: 631-636.


Choi AR, Lee GS, Chae, HJ.2008. Effects of ultrasonication on the analysis of sulforaphane content in vegetables. J. Korea Academia- Industrial Cooperation Soc. 9: 794-799.

Choi SJ, Choi A, Cho EH, Kim SY, Lee GS, Lee SS, Chae HJ. 2009. The glucosinolate and sulforaphane contents of land race radish and wild race radish extracts and their inhibititory effects on cancer cell lines. J. East Asian Soc. Dietary Life. 19: 558-563.
Choi YH, Shim YS, Kim CT, Lee C, Shin DB.2007. Characteristics of thiosulfinates and volatile sulfur compounds from blanched garlic reacted with alliinase. Korean J. Food Sci. Technol. 39: 600-607.
Ha HJ, Lee CB.2014. Antioxidant and anti-inflammation activity of red cabbage extract. Culin. Sci. Hosp. Res. 20: 16-26.

Hong SJ, Boo CG, Heo SU, Jo SM, Yoon S, Jeong HY, Lee YS, Park SS, Shin EC.2021. Physicochemical characteristics of wintering radish produced in Jeju island by different processing methods. J. Korean Soc. Food Sci. Nutr. 50: 748-755.

Hwang CR, Oh SH, Kim HY, Lee SH, Hwang IG, Shin YS, Lee JS, Jeong HS.2011. Chemical composition and antioxidant activity of Deoduk (Codonopsis lanceolata) and Doragi (Platycodon grandiflorum) according to temperature. J. Korean Soc. Food Sci. Nutr. 40: 798-803.

Hwang KA, Hwang HJ, Hwang YJ.2021. Antioxidant effect of Raphanus sativus L. through the suppression of reactive oxygen species production. J. Korean Soc. Food Sci. Nutr. 50: 1145-1151.

Im JS, Lee EH, Lee JN, Kim KD, Kim HY, Kim MJ.2010. Sulforaphane and total phenolics contents and antioxidant activity of radish according to genotype and cultivation location with different altitudes. Korean J. Hort. Sci. Technol. 28. 335-342.
Jeon A, Park YM, Kim HS.2016. Impact of drying temperature and steaming treatment on the browning and antioxidant activity of hot-air dried Platycodon grandiflorum. Food Eng. Prog. 20: 232-239.

Kim JY, Park SH, Lee KT.2009. Sulforaphane content and antioxidative effect of cooked broccoli. J. East Asian Soc. Dietary Life. 19: 564-569.
Kim KH, Kim HJ, Byun MW, Yook HS.2012. Antioxidant and antimicrobial activities of ethanol extract from six vegetables containing different sulfur compounds. J. Korean Soc. Food Sci. Nutr. 41: 577-583.

Kim MR, Lee KJ, Kim HY.1997. Effect of processing on the content of sulforaphane of broccoli. Korean J. Soc. Food Sci. 13: 422-426.
Kim MR, Rhee HS.1985. Volatile sulfur components from fresh radishes of Korean origin. Korean J. Food Cookery Sci. 1: 33-39.
Kwak HJ, Kwon YJ, Jeong PH, Kwon JH, Kim HK.2000. Physiological activity and antioxidative effect of methanol extract from onion (Allium cepa L.). J. Korean Soc. Food Sci. Nutr. 29: 349-355.
Lee JY, Kyung KH.2011. Purification of S-Alk(en)yl alka/enethiosulfinates of garlic (Allium sativum L.) by using recycling preparative HPLC. Food Sci. Biotechnol. 20: 1167-1170.

Lee SH, Hwang IG, Lee YR, Joung EM, Jeong HS, Lee HB. 2009. Physicochemical characteristics and antioxidant activity of heated radish (Raphanus sativus L.) extracts. J. Korean Soc. Food Sci. Nutr. 38: 490-495.

Nakagawa K, Umeda T, Higuchi O, Tsuzuki T, Suzuki T, Miyazawa T.2006. Evaporative light-scattering analysis of sulforaphane in broccoli samples: quality of broccoli products regarding sulforaphane contents. J. Agric. Food Chem. 54: 2479-2483.


Pham NA, Jacobberger JW, Schimmer AD, Cao P, Gronda M, Hedley DW.2004. The dietary isothiocyanate sulforaphane targets pathways of apoptosis, cell cycle arrest, and oxidative stress in human pancreatic cancer cells and inhibits tumor growth in severe combined immunodeficient mice. Mol. Cancer Ther. 3: 1239-1248.


Singh AV, Xiao D, Lew KL, Dhir R, Singh SV.2004. Sulforaphane induces caspase-mediated apoptosis in cultured PC-3 human prostate cancer cells and retards growth of PC-3 xenografts in vivo. Carcinogenesis 25: 83-90.


Song HP, Shim SL, Jung IS, Kim JH, No GM, Seo HY, Kim DH, Kim, KS.2009. Analysis of volatile organosulfur compounds in Korean Allium species. Korean J. Food Preserv. 16: 929-937.
Yim, HB, Lee, GS.2004. Cytotoxicity of ethanol extract of Raphanuse sativus on a human lung cancer cell line. J. Korean Soc. Food Sci. Nutr. 33: 287-290.

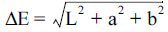 로 계산하였다.
로 계산하였다.