서 론
염증성 장질환은 크론병과 궤양성 대장염의 두 가지 형 태로 분류되는데 이들은 만성적으로 호전과 악화가 반복되 거나 염증이 위장관 전체와 장점막에 영향을 미치며 대장 암 발병 위험율을 높이는 것을 특징으로 한다(Kaser et al., 2010). 궤양성 대장염은 일종의 반복적으로 발생하는 난치 성 소화기계통의 장 질환으로 임상에서는 흔히 복통, 설사 및 농혈 점액변이 주요한 증상이며, 병변은 점막 및 점막 하층에서 주로 나타난다(Porter et al., 1998;Ahn et al., 2001;Lakatos et al., 2003). 염증과 면역은 매우 깊은 관 련이 있으며 염증은 감염 및 상처, 면역 등의 외부자극에 의해 유도되는 과정으로 신체 방어기전 중 하나이며 손상 부위를 회복시키는 역할도 하는과 동시에 외부자극이 가해 지면 대식세포가 활성화되어 염증매개물질을 분비하고 세 균이나 바이러스 등을 인지하여 탐식작용(phagocytosis)을 일으켜 제거하는 면역의 과정에서 염증도 일어난다(Yee et al., 2000). 염증 반응은 대개 급성 반응인 경우가 많으나 때로는 체내에 다양한 종류의 염증세포들이 축적되어 만성 염증성 질환을 야기하기도 하는데 이러한 만성 염증은 몇 몇 염증관련 매개물질이나 lipid mediator, protease 및 cytokine 등의 분비에 의해 발생 된다(Cho et al., 2009). 버섯의 항산화 활성은 버섯류 추출물의 polyphenol 함량에 따라 free radical 제거 활성, Fe2+ 이온의 chelating effect 등이 농도 의존적으로 증가하며 버섯류로부터 추출한 단백 다당체에 대한 free radical 제거 활성도 보고 되었다(Kim & Kim, 1995;Shon et al., 2006). 또한, 버섯은 다당체인 β-glucan이 다량 함유되어 면역증강을 통한 항암작용, 콜레 스테롤 저하 등의 약리 효과가 알려졌기 때문에 이러한 다 양한 생리활성에 관한 연구가 활발히 진행되고 있다(Yu & Oh, 2016). 버섯 유래 β-glucan은 항산화능, 항종양 효과 및 면역증강 효과 등이 보고되었고(Mizuno et al., 1998;Nakajima et al., 2002), 능이버섯과 노랑느타리버섯 등의 항고혈압성 활성(Jang et al., 2011;Kang et al., 2011), 영 지버섯의 콜레스테롤 저하 효과(Kabir et al., 1998), 노루 궁뎅이 버섯의 항치매 활성(Kawagishi et al., 2002), 구름 버섯과 표고버섯의 항암 면역증강 효과(Chihara et al., 1970;Tsukagoshi & Ophashi, 1974) 등이 보고되었다. 목 이버섯(Auricularia auricula)은 담자균류(Basidiomycetes)의 목이과(Auriculariales) 진균으로, 한약제로서 각종 약리작용 에 의한 민간요법제로 사용되어 왔고, 특히 피를 활성화시 키는 등 피를 맑게 하는 작용이 뛰어나다고 알려져 있다 (Lee et al., 1981;Kim & Kim, 1995). 하지만 흑목이버섯 은 상대적으로 흰목이버섯에 비해 생리활성에 대한 연구가 적고 유효성분들에 대하여는 불분명한 점들이 많은 등 여러 측면에서 알려진 바가 미미하다(Kim et al., 2011). 따라서 본 연구는 목이버섯 에탄올 추출물(Auricularia auricula-judae ethanol extract, AEE)의 항상화 활성을 분 석하고 이에 따른 DSS (dextran sulfate sodium)로 대장염 이 유발된 동물모델에서 염증 억제 효과를 보고자 한다.
재료 및 방법
본 실험에 사용된 시약은 lipopolysccharide (LPS, Escherichia coli 0111: B4), 5-dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide (MTT), sodium nitrite, eosin solution은 Sigma-Aldrich (St. Louis, MO, USA)의 제품을 사용하였으며 trypsin-EDTA, dimethylsulfoxide (DMSO), phosphate buffered saline (PBS), RPMI medium 1640, trypsin-EDTA solution, fetal bovine serum (FBS), antibiotics 는 Gibco (NewYork, NY, USA)제품을 사용하였다. 96- well plates와 배양접시 및 15 mL tube는 Falcon (Corning, NY, USA)의 제품을 사용하였다.
본 실험에 사용한 RAW264.7 세포는 한국 세포주 은행 (Korea Cell Line Bank, Korea)에서 분양받아 실험에 사용 하였다. RAW264.7 세포는 10% FBS 및 1% penicillin이 첨가된 RPMI 1640 배지(GIBCO, NY, USA)에서 배양하였 다. 세포는 37 °C, 5% CO2 세포 배양기(Thermo scientific, Waltham, MA, USA) 조건에서 배양하였으며 2회 이상의 계대 배양을 거쳐 세포를 안정화시켰다.
세포독성(cytotoxicity)은 각 세포의 세포 생존율(cell viability)을 MTT 방법으로 측정하였다. RAW264.7 세포를 48-well plate에 2 × 105 cells/well 농도로 3시간 동안 안정 화 후 50, 100, 200, 500 μg/mL 농도의 시료를 24시간 동 안 처리하였다. 이어서 새로운 배지로 교환한 후 50 μL의 MTT (5 mg/mL) 용액을 첨가하고 30분간 배양하여 formazan 생성을 유도하였다. 생성된 formazan은 일정량의 DMSO를 첨가하여 용해 시키고, 용해액의 100 μL을 취하 여 96-well plate에 분주하였다. 이어서 ELISA 리더기 (Molecular Devices)로 540 nm 파장에서 용해된 formazan 의 광학밀도(optical density, OD)를 측정하였다. 아무것도 처리하지 않은 대조군(control)에서 측정된 OD 값을 세포 생존율 100%로 하여 시료 처리군에서 측정된 OD 값에 따라 세포 생존율 %를 계산하였다.
RAW264.7 세포(5 × 105 cells/mL)에 시료를 50, 100, 200, 500 μg/mL 농도별로 처리하고 여기에 1 μg/mL LPS를 처 리 후 24시간 배양하였다. 생성된 NO양은 Gri ess 시약[1% (w/v) sulfanilamide, 0.1% (w/v) naphylethylenediamine in 5% (v/v) phosphoric acid]을 이용하여 NO량을 간접적으로 측정하였다. 세포배양 상등액 50 μL와 0.1 mM Griess 시약 50 μL를 혼합하여 96 well plate에 5-10분간 반응시킨 후 ELISA 리더기로 540 nm에서 흡광도를 측정하였다. 생성된 NO양은 NaNO2를 표준물질로 비교하였다. NO 생성 억제 량은 AEE를 100, 200, 400 μg/mL 농도별 처리 후 LPS를 처리하여 측정된 실험군의 흡광도 값에서 시료-을 각각 농 도별로 처리하고 LPS를 처리하지 않는 대조군과의 흡광도 값의 차를 구하여 계산하였다.
본 실험에 사용 되어진 재료는 2017년에 전라북도 익산 에서 재배한 흑목이버섯(Auricularia auricula-judae)을 건조 후 완전히 분쇄한 후 80% 에탄올에 2시간 동안 환류 냉 각 추출과정을 거친 후 그 여액을 filter paper (150 mm, Whatman)를 이용하여 d ebri s를 제외한 용액을 동결건조 (lyophilizer, 48 hr, Il-Shin Co., Seoul, Korea)한 후 시킨 분말을 -4 °C의 저장고에 보관하면서 실험에 사용하였다.
총 폴리페놀 함량은 Folin-Denis 방법을 응용하여 측정하 였다(Folin and Denis, 1992). 각각의 시료 0.2mL와 증류 수 1.8mL 혼합한 후 2 N Folin-Ciocalteau regent 0.2 mL 가하여 6분간 정 치시킨 후, 20% sodium carbonate 2 mL 를 가하고 60분간 방치한 혼합액을 1시간 동안 정치한 다 음 분광광도계를 사용하여 750 nm에서 흡광도를 측정하였 다. 총 폴리페놀 함량은 gallic acid를 이용하여 작성한 표 준 곡선으로부터 환산하였다.
DPPH 자유라디칼 소거활성은 Faller & Fialho (2010)의 방법을 이용하여 측정하였다(Faller & Fialho, 2010). DPPH 는 80% MeOH에 400 μM로 용해하였고, 시료를 50mg/ mL 농도로 3차 증류수에 녹여 사용하였다. 시료 0.3mL과 400 μM DPPH 11.7 mL를 혼합한 뒤 15분간 방치하고 ELISA reader (SPECTRA max M2, St. Molecular Devices Co, CA, USA)를 이용하여 517 nm에서 흡광도를 측정하여 계산식을 이용해 소거 활성을 계산하였다. 양성 대조군 (A.A)으로는 0.5M L-아스코르브산을 희석하여 사용하였으 며, 시료 첨가군과 비첨가군의 흡광도 차이를 백분율(%)로 환산하여 나타내었다.
본 실험에서 사용한 실험동물은 5주령 수컷 Balb/c mouse를 샘타코 (Osan, Korea)에서 구입하여 일주일 간 순 화기간을 거친 다음 사용하였다. Balb/c mouse의 평균 무 게는 23.13±1.45 g으로 시료를 매일 1회 경구로 투여하였 다. 실험동물 사육실은 12시간 간격으로 명암을 조절하였 고, 온도는 23±2 °C, 습도는 50-60%를 유지하였다. 본 동 물실험은 원광대학교 동물실험가이드(Guide for Animal Experimentation)를 준수하여 시행되었으며, 원광대학교 동 물실험윤리위원회의 승인을 받아 시행하였다(Approval NO. WKU17-117). 실험동물은 4개 군으로 분류되었으며 아무 처리도 하지 않고 증류수를 투여한 정상군(CON), 증 류수를 투여하고 장염을 유발한 대조군(DSS), 목이버섯 추 출물 100 mg/kg 투여군(AEE100), 목이버섯 추출물 300 mg/kg 투여군(AEE300)으로 분류하였다(Table 1). 군 구성 마리수의 산정은 3R의 원칙에 준하여 통계적 의미를 가리 는 최소수를 사용 하였다.
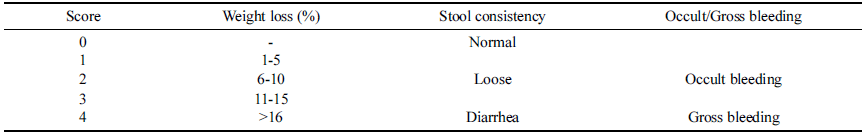
장 질환은 체중감소, 출혈과 점액을 동반하는 설사 등의 징후로 측정되고, 결장을 짧게 한다(Myung, 2015). 이전의 연구결과에 의하면 DAI에는 3가지 주요한 임상 징후가 있 는데, 체중감소, 설사, 직장 출혈이다(Okayasu et al., 1990). 체중감소는 초기와 현재의 체중 차이로 산출된다. 설사는 직장에 배설물의 알갱이 형성물이 없고, 직장에 지 속적으로 부드러운 배설물이 있는 것으로 정의된다. 직장 출혈이 보이는 것은 출혈을 동반한 설사나 총 직장출혈, 그 밖의 설사와는 별개의 것이다. DAI는 Murthy et al. (1993)의 방법을 참고하여 다음과 같이 산출하였다(Table 2).
3주간 각 군별로 시료투여 후 대장염의 유도는 정상 대조 군은 D.W를 자유 섭취하게 하였다. 대장염 유발군 및 실험 군은 3.0% DSS (dextran sulfate sodium)를 1주일간 자유 섭취하였으며 대장염 유발 후 매일 체중 및 음수 섭취량을 확인하였다. 대장 상피에 직접 독성이 있는 황화다당류를 처리하면 대장 상피 세포 손상을 유발하고 이에 따른 면역 반응이 대장 상피 전반에 걸쳐 점막장벽능을 바꾸게 된다 (Patricia et al., 2015). DSS 투여 후 7일째 되는 날 마우스 를 희생시켜 대장을 적출 하여 대장염으로 인해 나타나는 대장 길이 변화를 확인하고 조직을 formalin으로 고정하여 H&E 염색으로 염증 정도 및 조직 상태를 관찰하였다.
혈청 내 사이토카인은 E LISA k i t (R&D S ystems, Minneapolis, USA)을 이용하여 TNF-α와 IL-6의 생성을 측정 하였다. 항체가 붙어있는 각 well (R&D system, Mineapolis, USA)에 각 ADS (assay diluent solution) 50 μL를 첨가 후 시료 50 μL를 각각 첨가하여 실온에 2시간 방치한 후, wash buffer 400 μL로 4회 세척하였다. 세척 후 각 well에 항체로 mouse TNF-α, IL-6 100 μL를 넣고 상온에서 2시 간 배양 후, 제거하고 4회 세척하였다. 각 well에 기질용액 (substrate solution) 100 μL를 넣고 30분 상온에 방치 후, 반응정지액(stop solution) 100 μL를 첨가하여 Molecular Devices사의 ELISA reader (SPECTRA max M2, St. California, US)로 450 nm에서 흡광도를 측정하였다.
실험군 모두를 실험 종료 후 호흡 마취하에 대장염 모델 동물을 희생하고 복부 절개 후 대장의 말단에서 맹장 부분 까지 절제하여 적출한 후 맹장 아래서 1 cm의 조직과 대 장의 말단 부분에서 위로 1 cm의 조직을 절개하여 생리식 염수로 세척한 다음 여과지로 수분을 제거한 후 병리조직 학적 검사를 위하여 10% 중성 포르말린에 고정하고 파라 핀 포매한 후, 4 μm의 두께로 절편한 뒤 슬라이드 제작한 후 Hematoxyline & Eosin (H&E) 염색을 마친 뒤 Carl Zeiss Microscopy Axio Imager M1 (ZEISS, Germany) 광 학 현미경 100배의 배율에서 측정하였다.
결과 및 고찰
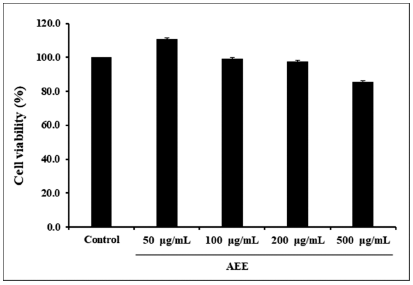
세포독성을 알아보기 위해 RAW264.7 세포에 AEE를 50, 100, 200, 500 μg/mL 농도로 24시간 처리한 다음 MTT 분석 방법으로 세포 생존율을 측정 결과 독성에 의 한 세포 수 감소는 나타나지 않았다(Fig. 1).
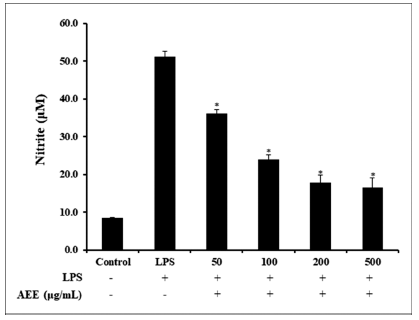
LPS에 의한 대식세포의 활성은 염증성 사이토카인을 유 도 시켜 NO 생성 과정으로 이어지게 된다(Shin et al., 2003;Yang et al., 2009;Hwang et al., 2018). 생체 내의 NO 생성을 조절하는 것은 염증을 억제하는 중요한 방법으 로 보고되고 있다(Brown, 2003). RAW264.7 세포에서 AEE의 NO 생성량을 측정한 결과 AEE는 NO 생성량을 농도 의존적으로 유의하게 감소시켰으며, 특히 100 μg/mL 부터 높은 감소를 나타내었다(Fig. 2).
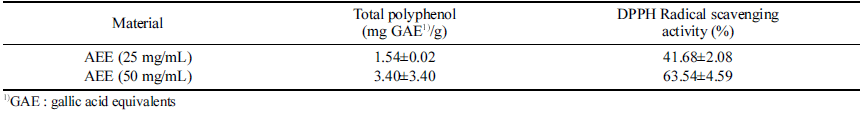
AEE의 총 폴리페놀 함량을 측정한 결과는 다음과 같다 (Table 3). AEE 25 mg/mL과 50mg/mL 각각 1.54±0.02와 3.40±3.40 mg GAE/g으로 이는 Yu & Oh (2016)의 연구결 과에서 목이버섯 에탄올 추출물 100 mg/mL에 대한 총 폴 리페놀 함량 5.23±0.18 mg GAE/g과 유사하거나 다소 높은 수치를 나타냈다. 운향과 식물인 운향의 항염증과 항산화 효과를 검정한 실험에서도 항산화 효과와 항염증 효과는 양적인 상관관계를 가진다는 보고가 있으며(Pacifico et al., 2016), 녹차의 폴리페놀, dehydroepiandrosterone 등 항산화 물질은 대장염의 증세의 악화를 완화시키는데 효과적이라 는 것이 확인되었다(Ko et al., 2008). 이는 본 실험에서 검증한 폴리페놀 함량 및 NO 생성량 측정을 통한 항산화 효과와 항염증 효과에 대한 연관성과 유사하였다.
활성산소 및 과산화물 제거에 항산화물질이 몇몇 버섯에 존재한다는 사실이 밝혀져 버섯에 서도 항산화제 개발을 위한 연구가 이뤄지고 있다(Diolock et al., 1998). 항산화 능을 확인하는 방법 중의 하나인 환원력은 철 이온을 Fe+++에서 Fe++로 환원시키는 강도가 클수록 환원력 즉 항 산화능이 강하다고 판단하며 발색의 정도로 측정할 수 있 다(Yildirim et al., 2011). 식물 유래의 phenolic compounds, carotenoids, flavonoids, tocopherol 등의 생리활성 물질 은 천연 항산화제로 널리 알려져 있다(Cha et al., 2001), AEE에 대한 DPPH 라디칼 소거능은 각각 41.68±2.08% 와 63.54±4.59의 소거능을 나타내었다(Table 3). 이는 Yu & Oh (2016)의 연구결과에서 목이버섯 에탄올 추출물 100 mg/mL에 대한 58.7±4.37% 보다 높은 수치를 나타 내었다.
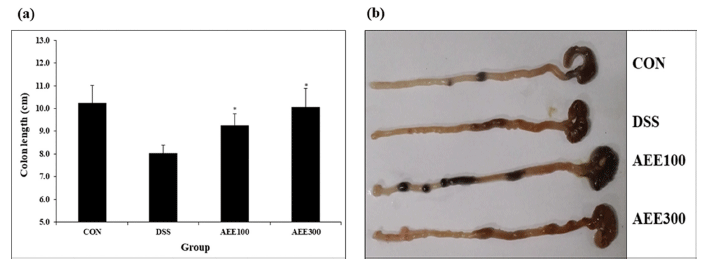
DSS는 설치류 실험동물에 구강으로 투여할 경우 급성 대장염을 유발하며, 마우스에서 DSS를 이용하여 급성 대 장염을 유도할 경우 질병의 임상적 특징이 사람의 대장염 과 유사하게 나타난다(Eichele & Kharbanda, 2017). 또한, 대장염 동물모델의 초기 증상으로는 체중감소와 대장 길이 가 축소된다고 알려져 있다(Akiyama et al., 2012). DSS 투여 후 7일째 되는 날 희생시킨 마우스의 대장을 적출 하여 그 길이를 확인한 결과 DSS만 투여한 대조군의 대장 의 길이는 8.0±0.4 cm로 정상군 10.3±0.4 cm 대비 21.7% 감소하였다. 시료 투여군인 AEE100군과 AEE300군의 장 길이는 각각 9.3±0.5 cm, 10.1±0.8 cm로 대조군에 비해 장 길이 감소를 억제하였다(Fig. 3). 이는 Yoo & Kang (2021) 의 백목이버섯에 관한 연구와 유사하게 대조군 대비 15% 이상의 감소를 나타내었다.
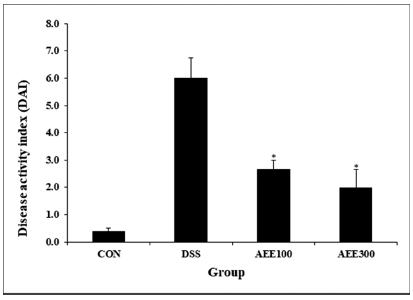
3-10% 사이의 DSS를 섭취한 마우스에서 대식세포 기능, 대장 상피에 대한 독성 효과로 인해 점막의 염증성 궤양 변화가 발생하며 체중감소, 심한 직장 출혈, 설사 등 임상 적인 증상을 나타내는 것으로 보고 되어있다(Okayasu et al., 1990). AEE 투여 후 이러한 임상 증상에 미치는 영향 을 DAI를 이용하여 측정하였다. 정상군(CON)에서는 아무 런 증상이 측정되지 않았으며, DSS를 공급한 군 모두에서 DAI가 증가하였다. 시료 투여군은 AEE100과 AEE300 각 각 2.7±0.3 (point), 2.0±0.7 (point)으로 DSS군 6.0±0.8에 비해 전체적으로 감소하는 것을 확인하였다(Fig. 4).
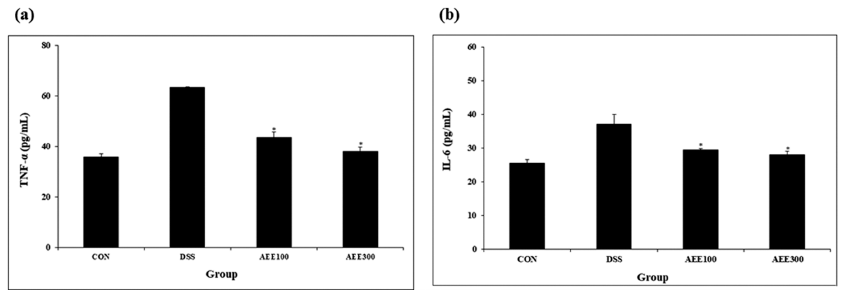
대장염이 발생하였을 때 성장 인자 및 TNF-α 그리고 여러 사이토카인들에 의해 산화적 스트레스인자인 ROS와 NO의 생성이 증가하여 산화적 스트레스 상태를 유도하게 되며 과도한 NO의 생산이 세포의 산화적 손상을 일으켜 종양 생성을 유발하는 데 중요한 역할을 한다(Coussens & Werb, 2002). 또한, IL-6는 크론병과 궤양성 대장염 모두와 관련이 있는 것으로 알려져 있다(Neurath et al., 2002;Duerr et al., 2006;Mudter & Neurath, 2007). DSS 투여 후 7일째 되는 날 희생시킨 마우스의 혈액을 채취하여 염 증성 사이토카인을 확인한 결과는 다음과 같다(Fig. 5). 혈 청 내 TNF-α 수치를 측정한 결과 시료 투여군 AEE100과 AEE300 각각 43.60±2.12 pg/mL, 38.13±1.67 pg/mL으로 대 조군 63.33±0.23 pg/mL에 비해 수치 감소하였으며, IL-6 수치 또한 29.36±0.45 pg/mL, 27.94±1.04 pg/mL으로 대조 군 37.04±3.01 pg/mL에 비해 수치 감소하였다. 이는 Yoo & Kang (2021)의 백목이버섯에 관한 연구와 유사하게 대 조군 대비 20% 이상의 감소를 나타내었다.
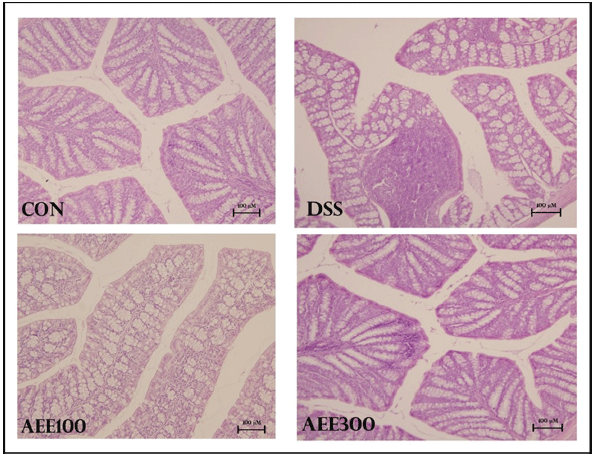
대장염의 경우 상피세포의 괴사와 궤양에 따른 결장 손 상부위에 호중구의 침윤을 그 특성으로 하며 crypts 손실, 무뎌짐(blunting)과 점막층의 궤양을 보여준다(Stadnichi & Cloman, 2003). DSS는 염증반응을 통하여 활성산소를 생 성하고 세포의 DNA에 산화적 손상을 초래한다(Ko et al., 2008). DSS에 의해 대장염이 유도된 마우스의 대장 조직을 H&E 염색 후 광학 현미경으로 관찰하여 평가한 결과는 다 음과 같다(Fig. 6). CON군을 제외한 나머지 군에서 대장조 직 손실 및 기저막 부위에 염증이 나타났으며, AEE 투여 한 군에서 대조군(DSS)에 비해 염증세포 침투가 완화되었 으며 기저막 부위에 염증 또한 완화되었음을 알 수 있었다.
요 약
본 연구에서는 목이버섯 에탄올 추출물(Auricularia auricula-judae ethanol extract, AEE)의 항산화 및 항염증 효과와 동물모델에서의 대장염 예방 효과를 확인하고자 하 였다. AEE는 총 폴리페놀과 DPPH 라디칼 소거 활성을 증가시켰다. 또한, RAW264.7 세포에서 세포 생존율을 측 정한 결과 세포독성을 보이지 않았으며, 독성을 보이지 않 는 농도에서 NO 생성량을 측정한 결과 농도 의존적으로 NO 생성량이 감소 되었음을 확인하였다. 이는 AEE가 NO 생성을 감소시킴으로써 염증 발생을 억제할 수 있다는 것 을 확인하였다. DSS를 통해 실험적 대장염이 유발된 동물 모델에서 AEE 100mg/kg 투여군(AEE100)과 300 mg/kg 투여군(AEE300) 모두에서 장 길이 감소를 억제하였으며, 질병 활성도 점수를 감소시켰다. 대장조직을 적출하여 병 리조직학적 분석 결과 AEE100군과 AEE300군 모두에서 부종, 점막 손상 및 DSS에 의해 장 손상을 억제한다는 것 을 보여주었다. 혈청에서 염증성 사이토카인 수치를 측정 한 결과 AEE100군과 AEE300군 모두에서 TNF-α 및 IL-6 의 수치를 억제하였음 확인하였다. 또한, 병리조직학적 분 석을 통해 DSS에 의한 장내 손상이 완화되었음을 확인하 였다. 따라서, AEE는 항산화 물질 및 항염증 활성을 증가 시키며 동물모델에서 대장염의 임상적 증상을 감소시키는 효과를 확인하였고, 대장염 예방에 효과적으로 도움을 줄 수 있다고 생각된다.