서 론
글루텐은 밀, 보리, 호밀 등 곡물에 존재하는 불용성 단 백질로서 크게 수용성 알코올에 녹는 글리아딘(단량체 프 롤라민)과 녹지 않는 글루테닌(고분자 글루테닌)이 결합한 형태이다. 글리아딘은 아미노산 서열, 구성 및 분자량에 따 라 ω5-, ω1,2-, α/β-, γ-글리아딘 4가지 종류로 세분화된다 (Scherf et al., 2016;Desheva et al., 2020). 이 중 ω-5글리 아딘(50,000)의 경우 ω1,2-글라이딘(40,000)의 보다 상대적 으로 분자량이 크다. ω-글리아딘의 경우 시스테인이 없어 이황화 결합(disulfide bond)이 존재하지 않고, 대부분이 글 루타민과 프롤린으로 구성되어 있다. 반면, α/β-, γ-글리아 딘의 경우 분자량이 28,000-35,000 사이이며 ω-글리아딘과 반대로 글루타민과 프롤린의 함량이 낮다(Wieser, 2007;Solé-Jamault et al., 2022).
글루텐은 밀가루에 물을 넣고 반죽을 하게 되면 글리아 딘과 글루테닌이 물과 결합하여 망상구조를 형성하고, 이 는 밀가루 반죽의 점성, 탄성 및 신장성을 부여한다(Yun et al., 2017;Wieser et al., 2023). 또한, 효모 발효 시 생성되는 가스를 가두어 반죽의 부피를 팽창시키는 역할 을 하므로 제빵공정에서 글루텐은 구조를 형성하는데 필 수적이다. 하지만 이러한 특성을 가지고 있는 글루텐은 알러지원으로 작용하면서 셀리악병(celiac disease), 밀 알 러지(wheat allergy), 비셀리악 글루텐 과민성(non-coeliac gluten sensitivity) 등을 유발하는 것으로 알려져 있으며 (Biesiekierski, 2017), ω5-글리아딘이 아이들에게 과민 반응 을 나타내는 주요 알레르기 항원으로 밝혀졌다(Palosuo et al., 2001). 글루텐 알레르기에 대한 관심이 증가함에 따라 글루텐 프리(gluten-free)라는 식품 규격이 미국, 유럽 등 각 국가에 신설되어 글루텐 프리 제품들이 판매되고 있으 며, 대한민국도 글루텐 함량이 20 ppm 이하인 경우 글루텐 프리 식품으로서 인정을 하고 있다. 반면 상대적으로 글루 텐 함량이 높은 식품으로는 밀이 주 원료인 면류와 빵류로 알려져 있지만 글루텐 함량이 정확하게 나와있지 않은데 이는 퍼센트 단위의 높은 농도의 글루텐 분석 및 원료가 아닌 가공 제품의 글루텐 분석을 위한 적절한 분석법이 전 무하기 때문이다.
현재 글루텐 분석 방법은 크게 효소결합면역흡착검사 (ELISA, Enzyme-linked immunosorbent assay), PCR (Polymerase Chain Reaction), LC-MS (Liquid Chromatography- Mass Spectrometry), SDS-PAGE (Sodium Dodecyl-Sulfate PolyAcrylamide Gel Electrophoresis) 및 NIR (Near-Infrared Spectroscopy) 등이 있다(Immer and Haas-Lauterbach, 2012;Mena et al., 2012;Scharf et al., 2013;Fiedler et al., 2014;Radman et al., 2018). 하지만 PCR, SDS-PAGE, NIR 및 LC-MS의 경우 정량보다는 정성 및 단백질 유전자 분석에 더 적합하고, 정량 분석 중 ELISA를 활용한 분석법만이 AOAC 공식 분석법으로 등록되어있다. 그 중(AOAC 2012.01)의 sandwich ELISA 분석법이 가장 많이 활용되 고 있는데, 분석 원리는 Gliadin R5 단일클론항체를 분석 하는 것으로 5-80 ppb 표준물질 농도에서 정량한다. 이 분 석법은 가공식품에 적용하여 분석가능하나 원물 그대로에 더 적합하다고 안내하고 있다. 이 외에 열, 변성에 강한 33-Mer peptide(G12 단일클론항체)를 타겟으로 분석하는 ELISA 시험법이(AOAC 2014.03)으로 등재되어 있고 정 량 한계가 200 ppm으로 (AOAC 2012.01)과 비교하여 상 대적으로 높은 농도에서 분석이 가능하다는 장점이 있지 만, ELISA 분석의 경우 공통적으로 식빵과 같은 고농도 샘플을 분석할 때 500배 이상 희석이 필요해 이에 따른 오차를 배제할 수 없으며, 가공 시 열처리에 의한 단백질 의 변성에 대한 분석법의 유효성 검증이 미비하다는 한계 가 있다.
따라서 본 연구에서는 열처리에 의해 변성된 식품 및 고 농도의 글루텐을 함유한 식품의 최적 전처리 조건과 신뢰 성 있는 정량 분석법을 HPLC-PDA를 활용하여 확립하고, 정량법의 유효성 검증을 통해 분석법을 개발하고자 하였다.
재료 및 방법
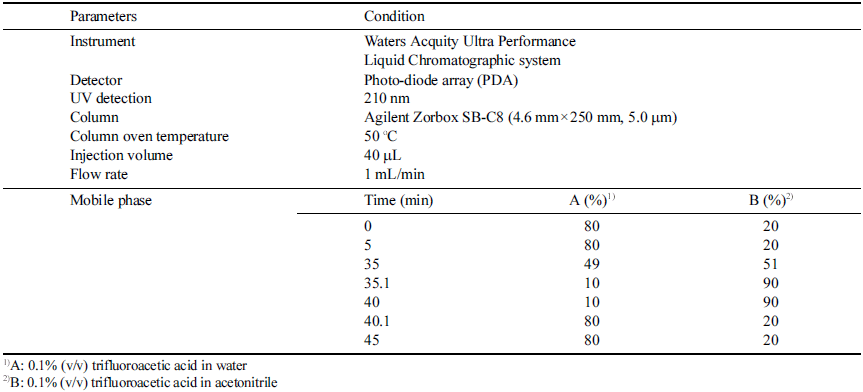
본 실험에 사용된 밀가루는 (주)밀다원(Sejong, Korea)에서 제공받은 식빵전용분을 사용하였으며, 식빵은 시중에 유통 되는 베이커리와 슈퍼마켓에서 구입하였다. 글리아딘 추출 정제에 사용된 petroleum ether과 ethanol은 Samchun pure chemical (Pyeongtaek, Korea)에서 구입하였다. HPLC 분석 을 위해 사용한 용매와 시약은 HPLC급으로 acetonitrile (Supelco, MA, USA)과 trifluoroacetic acid (Sigma-Aldrich, MO, USA)를 사용하였고, 물은 초순수제조장치 (Millipore, MA, USA)를 이용하여 탈이온화 하여 사용하였다.
글루텐 정량 표준물질인 gluten (G5004)과 gliadin (G3375) 은 Sigma에서 구입하였다. 밀가루에서 글루텐은 AACC International Method 38-10.01 방법으로 추출하였다. 추출 한 글루텐을 동결건조기(Eyela, Tokyo, Japan)로 건조하여 비교하였다. 글루텐 정량을 위해서는 ELISA 방법(AOAC 2012.01)에서 사용하는 방식인 글리아딘의 함량을 정량하 여 2배수(CODEXALIMENTARIUS FAO-WHO, 2008)하는 방법을 이용하였다. 추출한 글루텐의 순도를 확인하기 위 해 Leco FP628 protein analyzer (Leco, MI, USA)를 이용 하여 단백질함량을 분석하였다. 제빵 과정 중 가해지는 열 에 의한 단백질 변성이 분석에 미치는 영향을 확인하기 위 해 추출한 글루텐을 열탕가열, 스팀가열, 밀폐가열 방식으 로 다양한 열처리한 후 동결건조하여 비교 분석하였다. 열 탕가열은 추출한 글루텐을 물에 넣고 100 °C로 30분간 가 열하였고, 스팀가열은 글루텐을 찜기에 넣고 30분간 가열 하였다. 밀폐가열은 글루텐을 밀폐용기에 넣고 끓는 물에 넣어 30분간 가열하였다. 글루텐 정량은 동결건조 글루텐 을 26mg/mL이 되도록 제조한 후 60% ethanol로 희석하 여 13, 6.5, 3.25, 1.625 mg/mL이 되도록 하여 분석하였다.
빵 100mg을 정밀히 취하여 1mL의 petroleum ether를 가하여 5분간 vortex 믹서로 추출한 후 원심분리기 Sorvall Legend Micro 17R (Thermo Fisher Scientific, MA, USA) 로 7,000 rpm, 3분간 원심분리하여 상층액을 버려 지방을 제거 하는 과정을 2회 반복한다. 0.4 mol/L NaCl을 1mL 넣어 vortex 믹서로 15분간 추출한 후 7,000 rpm으로 3분간 원심 분리한 후 상층액을 버려 수용성 방해물질을 제거하는 과정을 2회 반복한다. 남은 시료에 60% ethanol 300 μL 넣은 후 30분간 vortex하여 글리아딘을 추출하고 7,000 rpm으로 3분간 원심분리하여 상층액을 정용 플라스크에 모은다. 이 과정을 3회 반복하여 상층액을 합친 후 1mL 이 되도록 정용하여 0.45 syringe filter로 여과하여 시험액 으로 사용하였다.
글루텐 분석을 위한 글리아딘 정량을 위하여 Waters Acquity Ultra Performance Liquid Chromatographic system (Waters, MA, USA)를 사용하였고, 분석 컬럼은 Agilent Zorbax SB-C8 (4.6 mm × 250 mm, 5.0 μm) (Agilent, CA, USA)를 이용하였다. 분석 조건은 Table 1과 같다.
결과 및 고찰
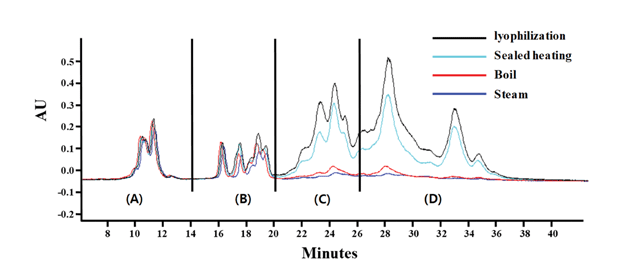
글루텐을 정량하기 위해 글리아딘을 분석하여 2배수 하 는 방법을 사용하는데(Urade et al., 2017), 글리아딘은 각 각의 구조적 특징에 따라 ω5-, ω1,2-, α/β-, γ-로 나뉘고, 구조나 결합에 따라 용해도와 극성이 다르기 때문에 역상 컬럼에 의해 피크가 분리 된다. 본 연구에서 글루텐을 분 석하고자 하는 샘플은 빵이므로 열처리에 과정에 의해 변 성되지 않는 글리아딘을 선택적으로 정량하여 글루텐의 함 량을 정량하였다. 각각의 열처리 방식으로 글루텐을 가열 하여 글리아딘을 분석한 결과 Table 2과 같이 ω5-gliadins 피크는 열처리에 의한 피크 면적 변화가 0.2-3.4%로 가장 적었고, ω1,2-gliadins와 α/β-gliadins, γ-gliadins는 열처리에 의해 최대 98.5% 피크 면적이 줄어드는 것을 확인하였다. 따라서 글루텐 정량을 위해서 열처리에 안정한 ω5-gliadins 피크를 선택적으로 정량하여 검량선에 대입하여 농도를 산 출하였다(Fig. 1).
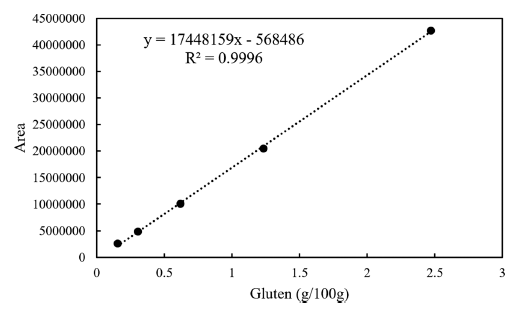
분석법의 유효성 검증은 식품의약품안전처 유효성 확인 및 검증 안내서(KMFDS, 2021)을 따라 특이성(specificity), 직선 성/범위(linearity/range), 검출한계(LOD, limit of detection), 정량한계(LOQ, limit of quantitation), 정확도(accuracy), 정 밀도(precision)를 확인하였다. 특이성은 글루텐이 첨가되지 않은 매질(글루텐프리 식빵 제품)에서 인접한 피크들과의 분리도를 확인하였고, 직선성과 범위는 글루텐 표준물의 농도와 피크 면적과의 상관관계(R2)를 확인하였다(Fig. 2). 검출한계와 정량한계는 검출한계와 인접한 농도를 포함하 여 3가지 농도에서 7반복 분석하여 농도가 0일 때 표준편 차 (S0)를 추정하여 평균시료 바탕값에 3 x S0를 더하여 LOD로 하였고, 10 x S0을 더한 값을 LOQ로 산출하였다. 정확도와 정밀도는 일정 농도에 대하여 회수율(recovery)실 험과 일내(intra-), 일간(inter-) 평가를 진행하였다.
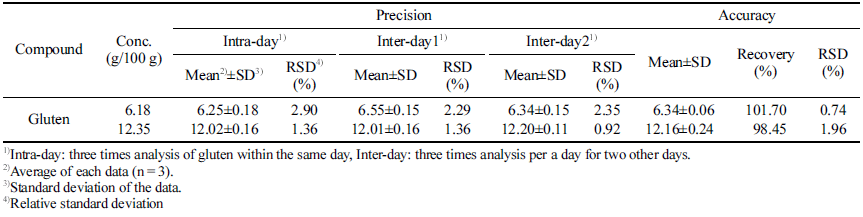
특이성 확인을 위해 글루텐을 함유하지 않은 글루텐프리 빵에 대해 동일한 실험과정을 거쳐 불순물과 피크 간섭 영 향을 확인하였고, ω5-gliadin이 나오는 피크 머무름 시간대 에 불순물이 검출되지 않는 것을 확인하였다. 또한 샘플 크로마토그램에서 UV 스펙트럼대조, 피크 머무름 시간대 가 일치하는 것을 확인하였다. 직선성은 글루텐을 5가지 농도로 단계적으로 희석하여 ω5-gliadin의 농도별 피크 면 적 직선성 측정결과 상관계수 R2은 0.9996로 높은 직선성 을 나타내는 것을 확인하였다. 검출한계(LOD)와 정량한계 (LOQ)는 반복 분석의 표준편차를 이용하여 산출하였고 각 각 0.30 g/100 g, 0.99 g/100 g이었다(Table 3).
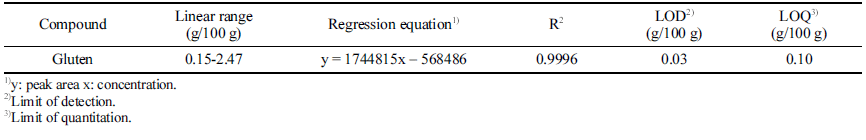
|
정확성은 글루텐을 함유하지 않은 글루텐프리 빵에 알고 있는 농도로 글루텐을 첨가한 후 회수율 측정실험을 통해 확인하였고, 정밀성은 글루텐 분석 실험을 각각 다른 농도 에 대하여 하루에 3반복(intra-day) 실험 한 것과, 각기 다 른 날 3반복 한 것을(inter-dary) 평균값과 표준편차를 산출 하여 재현성 평가 하였다. 회수율 확인결과 두 가지 농도 에 대하여 각각 101.7%, 98.5%로 높은 회수율을 나타내었 고, 정밀성 또한 RSD가 2.90% 이내로 신뢰할 수 있을 수 준의 분석법임을 확인할 수 있었다(Table 4).
확립한 분석법을 이용하여 시중에서 유통되는 식빵 4종 을 대상으로 글루텐을 분석한 결과 5.52-6.53%으로 나타났 다(Table 5). 이는 일반적인 식빵 제조 시 밀가루 함량이 50%인 것을 고려하였을 때 이론 값과 유사하게 나온 것으 로 생각할 수 있으며 brown pan bread가 white pan bread 보다 글루텐 함량이 낮은 것은 일반적으로 brown pan bread의 원료인 전립분이나 wheat bran 등에 의해 글루텐 함량이 다소 떨어졌기 때문이라 생각된다.
요 약
본 연구는 빵에서의 글루텐 함량을 정량하기 위해 분석 법 유효성 검증을 하였다. 열처리에 안정한 ω5-gliadins을 선택적으로 정량하였으며 ω5-gliadins 분석에 대한 직선성 은 상관계수 R2는 0.9996으로 높게 나타났으며, 검출한계 와 정량한계는 각각 0.30 g/100 g과 0.99 g/100 g이였다. 회 수율 실험결과 98.5-101.7%로 높은 정확성을 나타내었고, 정밀성은 intra-, inter-day로 평가한 결과 각각 RSD 값이 1.36-2.90%, 0.92-2.35%로 신뢰할 수 있을 수준의 값으로 확인되었다. 따라서 본 연구를 통해 가공을 거친 식품, 특 히 제과 제빵 분야에서의 글루텐을 정량할 수 있는 분석법 으로 사용 가능할 것으로 기대된다.