서 론
최근 프로바이오틱스의 소비가 현저하게 증가하고 있는 데 이는 프로바이오틱스의 장내 작용 및 장내 미생물의 중 요성에 대한 소비자들의 인식이 상당히 높아지고 있기 때 문이다. 프로바이오틱스란 ‘체내에 들어가서 건강에 좋은 효과를 주는 살아있는 균’으로 정의되며(FAO/WHO, 2002) 다양한 기능성을 나타내는데, 가장 잘 알려진 것이 유익한 유산균 증식, 장내 유해균의 생육 저해, 배변활동 원활 등 의 정장작용을 한다는 것이다(Sender et al., 2016). 인간의 장내 미생물은 개인별로 다양한 군집 구조를 가지게 되는 데 이러한 유전자 집합체를 장내 마이크로바이옴(intestinal microbiome)이라고 정의한다(Spor et al., 2011). 최근 연구 에 의하면 프로바이오틱스의 섭취 시 불균형 상태의 장내 미생물군집의 구조를 복원할 수 있는 것으로 알려져 있다 (Choi, 2019). 프로바이오틱스는 식품의 보존성 및 영양성 을 높일 뿐 아니라 인체의 건강에 이로운 역할을 한다. 특 히 프로바이오틱스는 항균활성, 면역 증진 효과, 장운동 촉 진 효과 등을 바탕으로 다양한 질환에 대해 예방 및 치료 효과를 가지는 것으로 알려져 있다(Tang & Lu, 2019). 또 한 장내 프로바이오틱스의 종류와 생균수는 인간의 인지 능력에도 영향을 미친다고 보고되었다(Eastwood et al., 2021). 프로바이오틱스로 이용되는 대표적인 유산균으로 Lactobacillus, Bifidobacterium, Enterococcus, Bacillus 속 등의 균주가 있다(Seo et al., 2010). Lactobacillus와 Bifidobacterium은 발효식품이나 유제품에서 오랫동안 안전성 을 보여 일반적으로 Generally Recognized As Safe (GRAS) 로 분류되어 있으며(Butel, 2014) 그 중에 Bifidobacterium animalis subsp. lactis (B. lactis, BB-12)는 유해균 억제 및 혈중 콜레스테롤 감소, 면역조절 작용(Savard et al., 2011) 을 하며 일반 젖산균과는 달리 담즙에 비교적 높은 저항력 이 있고 내산성과 내염성의 특성을 가지고 있는 균주도 있 다(Kim et al., 2003). 또한 프락토올리고당과 이눌린을 치 즈에 첨가하였을 경우에 균수가 증가하였다는 보고(Gomes et al., 2009)에서와 같이 프리바이오틱스를 이용하여 생존과 활성에 긍정적인 영향을 주어 신바이오틱스로의 활용도 가 능하다(de Vrese & Schrezemir, 2008). 프로바이오틱스로서 유산균이 갖추어야 할 중요한 특성 중 하나가 가공과정과 섭취 후 생존력이 높아야 한다는 점이다(Fuller, 2012). 장내 에서 프로바이오틱스의 건강 기능성을 나타내기 위해서는 일정 수준 이상의 생균수가 유지되어야 한다. 그러므로 유 통기한 내에 일정 생균수가 유지되는 것은 매우 중요하다. 이러한 프로바이오틱스의 생존력 향상을 위해 프리바이오틱 스의 공급을 통해 Lactobacillus spp.와 Bifidobacterium spp.의 생육을 선택적으로 증진할 수 있다고 보고되어 있 다(de Vrese & Schrezemir, 2008). 주요 프리바이오틱스로 inulin, fructo-oligosacchride, galacto-oligosaccharide 등이 있으며, 이들은 미생물 성장과 활동의 기질로 작용하여 숙주의 건강에 도움을 준다(Yoon & Shin, 2017;Chen, 2018;Cunningham et al., 2021). 대두는 난소화성 성분인 galacto-oligosaccharide가 풍부하여 프리바이오틱스로써 유 용한 식품 원료이지만(Gourineni et al., 2011) 필수아미노 산 중에 methionine과 같은 제한 아미노산이 있어 대두에 쌀을 혼합하게 되면 대두와 쌀에 부족한 아미노산을 보완 할 수 있을 뿐만 아니라 쌀 소비 촉진에도 도움이 된다 (Maeng & Hong, 2007). 최근에는 프로바이오틱스와 프리 바이오틱스를 함께 섭취하게 되면 각각의 생리활성이 동시 에 나타나게 되어 시너지가 발생한다는 장점이 있어(Kim, 2016) 신바이오틱스에 대한 새로운 영역이 확장되고 있다. 신바이오틱스는 장 건강(Chouraqui et al., 2008;O’Bryan et al., 2013), 면역(Kanamori et al., 2006), 항암 효과(Van Loo et al., 2005)와 같은 기능성을 갖는다고 알려져 있다.
전통적으로 프로바이오틱스의 공급원으로는 치즈, 요구르 트 등의 유제품이 주류를 이루고 있는데 최근에는 프로바 이오틱스와 프리바이오틱스의 효과적인 공급을 위해 유제 품뿐만 아니라 사탕류, 제빵류, 음료 등의 다양한 형태의 제품이 개발되고 있다. 메주에서 분리한 Lactobicillus를 첨 가하여 제조한 사과 발효 음료(Heo et al., 2016), 김치에서 분리한 유산균을 첨가한 단호박 발효음료(Roh & Kim, 2009) 등과 같은 제품이 보고되어져 있다. 푸딩은 우유, 설 탕, 계란 등을 섞어 제조하는 반고체 상태의 겔 제품으로 부드러운 texture를 가지고 있어 소화 흡수가 쉽고 유아나 고령층에게도 쉽게 접근할 수 있는 대표적인 디저트로 다 양한 계층에서 이용되고 있다(Ko & Lee 2014). 쌀가루나 이눌린이 첨가된 푸딩을 저장하는 동안 Lactobicillus acidophilus의 생존율이 유지될 수 있다는 연구도 보고되어 져 있다(Han & Lim, 2021). 우유를 기본 베이스로 하고 곡류인 두유, 이눌린, 쌀 등을 첨가하여 발효시킨 요구르트 를 이용하고 설탕 대신 프리바이오틱스로 잘 알려진 프락 토올리고당을 첨가한 푸딩은 비만, 당뇨 등 다양한 만성질 환 예방과 프로바이오틱스의 생존율을 촉진하는데 이바지 할 수 있을 것으로 기대된다. 따라서 본 연구에서는 프로 바이오틱스의 성장을 향상시킬 수 있으며 보호 효과도 높 여줄 수 있는 프리바이오틱스를 공급하기 위하여 곡류를 첨가하고 프로바이오틱스인 B. lactis (BB-12)로 발효시킨 요구르트를 활용한 푸딩을 제조하여 냉장 저장하는 동안 푸딩의 품질 특성과 BB-12의 생존율에 대하여 비교 분석 하고자 한다.
재료 및 방법
푸딩의 재료인 우유(Seoul Milk Co., Seoul, Korea), 설 탕(CJ Cheiljedang, Incheon, Korea), 프락토올리고당(CJ Cheiljedang, Incheon, Korea), 젤라틴(Chungeun F&B, Ansan, Korea), 대두(Yuginongchon, Gwangju, Korea) 등은 시판품을 구입하여 사용하였으며 이눌린(inulin)은 NOW FOODS (Bloomingdale, IL, USA), 비타민 C는 SERIMFOOD (Bucheon, Korea), 프로바이오틱스인 Bifidobactrium lactis (B. lactis, BB-12)는 Chr Hansen (Hoersholm, Denmark)에서 구입하였고 쌀가루는 2019년에 수확한 분질 미(수원 542호, Namil(SA)-flo2)를 국립식량과학원(Wanju, Korea)으로부터 제공받아 사용하였다.
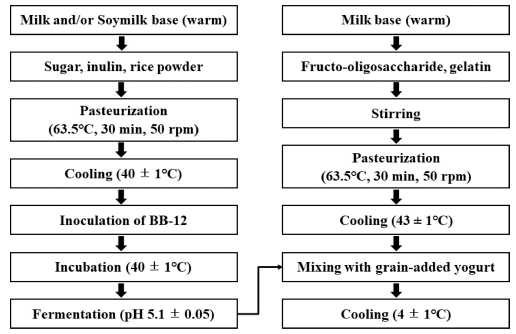
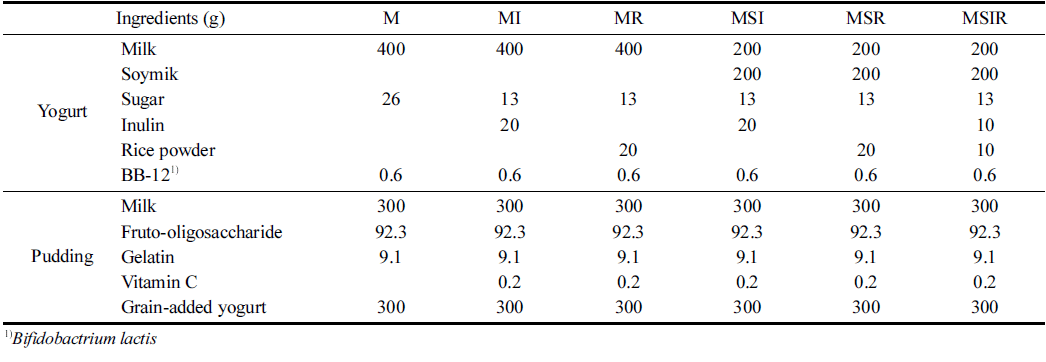
푸딩은 우유 또는 우유와 두유 혼합물을 기본으로 하고 주요 원료인 이눌린 또는 쌀가루를 첨가하거나 이눌린 쌀 가루를 동시에 첨가하여 프로바이오틱스인 B. lactis (BB- 12)를 접종하여 발효시킨 요구르트와 프락토올리고당, 젤라 틴, 비타민 C를 첨가한 푸딩 베이스에 혼합하여 제조하였 다(Fig. 1). Table 1에 나타난 바와 같이 주요 원료의 첨가 여부에 따라 M, MI, MR, MSI, MSR, MSIR 6가지 푸딩 으로 제조하였으며 각 푸딩의 원료 배합비는 Tab le 2에 나 타내었다.
대조구(우유 베이스만 사용한 푸딩)를 포함한 곡류 첨가 푸딩은 4주 동안 4±1°C에서 냉장보관하면서 1주 간격으로 pH와 산도를 측정하였다. 푸딩의 pH는 pH meter (S20 SevenEasyTM pH meter, Mettler Toledo Inc., Columbus, OH, USA)로 측정하였으며, 적정산도는 Jeon et al. (2005)의 방 법에 따라 측정하였다. 푸딩 10 g을 100 mL 메스플라스크 에 증류수와 함께 정용한 후 20 mL를 취한 후 지시약으로 1% 페놀프탈레인 2~3방울을 첨가하고 0.1 N NaOH로 적정 하여 색의 변화가 일어나는 즉시 적정에 소비된 0.1 N NaOH의 mL수를 측정하였다. 적정산도는 다음의 계산식을 이용하여 젖산에 대한 양으로 환산하여 산출하였다.
푸딩의 물성은 pH 및 산도와 마찬가지로 4주 동안 4±1°C에서 냉장 보관하면서 1주 간격으로 측정하였다. TA-XT2 texture analyzer (TMS-Pro, Food Technology Co., Rockville, MD, USA)를 이용하여 푸딩의 질감인 경 도(hardness), 검성(gumminess), 씹힘성(chewiness)을 측정 하였다. 물성 측정의 조건은 force in compression 모드를 사용하였고 load cell value 25 N, trigger type은 auto 0.1 N이었다. 푸딩은 직경 5 cm, 높이 2 cm의 크기의 용기에 담아 flat cylindrical probe (25 mm diameter)를 사용하여 측정하였다.
푸딩의 냉장 저장 중 BB-12의 생존율은 4주 동안 4±1°C에서 냉장 보관하면서 1주일마다 유산균 수를 계측 하여 나타내었다. 채취한 시료 10 g을 멸균 펩톤수 90 mL에 넣어 균질화한 후 십진 희석법으로 희석하여 희석배 수별로 petri dish에 분주하였다. 유산균 배지(MRS agar, Oxoid Ltd., Basingstoke, Hampshire, England)에서 표준 평판법으로 37±1°C에서 48시간 배양한 후에 30-300 colony가 나타나는 평판의 colony수를 계측하여 colony forming unit (CFU)/mL로 유산균 수를 표시하였다(Yang et al., 2012).
결과 및 고찰
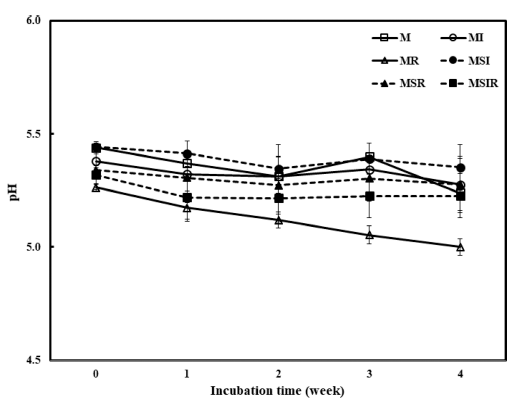
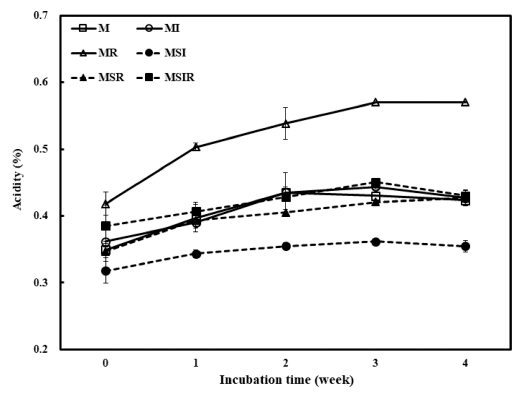
제조되어진 푸딩을 냉장 저장하는 동안 pH와 산도의 변 화를 Fig. 2와 Fig. 3에 각각 나타내었다. 대부분의 푸딩에 서 접종 후 4주 동안 pH의 변화는 거의 나타나지 않았으 며 우유에 쌀가루를 첨가한 푸딩(MR)의 경우에 저장 초기 에는 다른 샘플들과 차이가 나타나지 않았지만 점차 감소 하여 3주 후부터는 다른 제품들에 비해 유의적으로 낮은 pH를 나타내었다. 산도의 결과는 pH와 반대의 경향으로 나타났는데 pH 결과와 부합되는 경향으로 저장 기간이 길 어짐에 따라 대부분의 샘플은 산도가 일정하게 유지되었지 만 MR은 저장 1주 후부터 상당히 높아졌으며 저장기간이 길어질수록 점차 증가하여 유의적인 차이를 나타내었다 (Fig. 3). BB-12로 발효시킨 요구르트를 첨가한 푸딩에서 쌀가루의 첨가가 pH 감소와 산도의 증가를 촉진시키고 두 유의 첨가는 pH 감소와 산도의 증가를 늦추는 것으로 나 타났다. 이러한 결과는 Han & Lim (2021)의 Lactobacillus acidophilus로 발효시킨 푸딩에서의 연구 결과와 유사하였 으며 올벼쌀의 첨가량이 증가할수록 푸딩의 pH가 낮아지 고 산도가 높아지는 결과와도 일치하였다(Rhee & Sim, 2018).
|
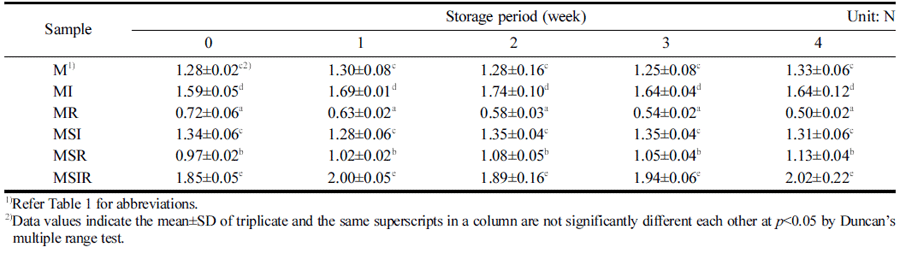
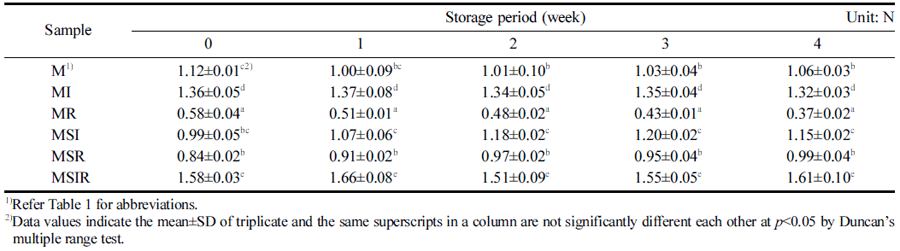
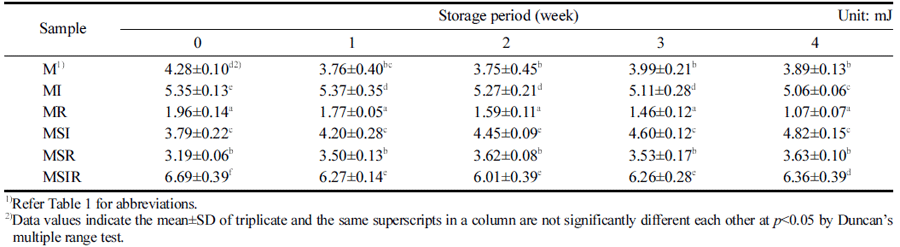
우유와 두유를 기본재료로 하여 이눌린, 쌀가루 등을 첨가하고 BB-12를 접종하여 발효시킨 요구르트를 첨가 한 푸딩을 냉장 저장하는 동안 경도(Hardness), 씹힘성 (Chewiness), 검성(Gumminess)을 1주 간격으로 측정하여 Table 3, 4와 5에 각각 나타내었다. 냉장 저장 기간과 푸딩 의 texture 변화에는 유의적인 차이를 보이지 않았지만, 원 료에 따라서는 차이가 나타났다. 두유, 이눌린, 쌀가루를 모두 첨가한 푸딩인 MSIR은 유의적으로 가장 높은 경도 를 나타내었으며 MSI, MI는 그 다음으로 경도가 높았다 (Table 3). pH가 푸딩의 겔 형성에 중요한 영향을 미치는 데 푸딩의 겔 형성을 결정하는 젤라틴은 등전점이 pH 4.8- 5.2인 양친매성 단백질로 pH 5에서 최대의 겔 형성능을 나타낸다(Mo et al., 2007). 하지만 본 연구에서는 MR을 제외하고는 저장 중 pH의 변화가 거의 없었으며 경도도 같은 샘플에서는 유의적 차이가 나타나지 않아 pH의 영향 이라기보다는 곡류의 첨가로 인해 전분이 견고한 구조를 형성하여 경도가 상승하는 것으로 추론된다. Rhee & Sim (2018)은 전분의 겔화가 푸딩의 구조를 견고하게 할 것이 가 높게 나타난 것도 이러한 원인에 의한 것으로 생각된 다. 우유와 두유 혼합물 푸딩에서는 이눌린을 첨가하였을 때의 경도가 쌀가루를 첨가한 푸딩과 비교하여 유의적으로 높은 값을 나타내었다. 이눌린은 수용성 물질로 대두 단백 질과 복합체를 형성할 것이라고 보고되어져 있는데(Kip et al., 2006) 이눌린과 두유를 첨가한 푸딩에서는 이러한 복 합체의 형성으로 경도가 높은 값을 나타내는 것으로 보인 다. 이러한 결과는 이눌린을 첨가한 대두 요구르트의 경도 가 증가한 결과(Bedani et al., 2014)와도 일치하는 경향을 보였다.
|
|
|
Table 4에서 보는 바와 같이 푸딩의 검성도 경도와 마찬 가지로 저장기간 동안 유의적인 차이가 거의 없었으며 MSIR은 모든 샘플들 중에 유의적으로 가장 높은 검성을 나타내었다. 우유 푸딩 중에서는 MI가 유의적으로 높게 나 타나 이눌린의 첨가가 검성을 증가시키는 것을 알 수 있었 으며 우유와 두유 혼합물 푸딩에서는 MSIR이 유의적으로 높게 나타나는 것으로 보아 두유, 이눌린, 쌀가루를 모두 첨가하는 것이 검성을 높이는데 효과적이라는 것을 알 수 있었다. 따라서 이눌린과 쌀가루의 첨가가 검성을 증가시 킨 결과는 대두 요구르트에 이눌린을 첨가한 경우에 검성 이 유의적으로 증가했다는 보고(Bedani et al., 2014)와도 일치하는 결과이며, Han & Lim (2021)의 Lactobacillus acidophilus로 발효시킨 이눌린과 쌀가루를 첨가한 푸딩에 서의 연구와 유사한 결과를 나타내었다.
푸딩의 씹힙성도 검성과 유사한 경향이 나타나긴 하였지 만 MR은 저장 기간이 늘어날수록 감소하였으나 MSI는 증가하는 경향이 나타나 검성의 결과와는 약간의 차이가 있었다(Table 5). 하지만 MSIR은 모든 샘플들 중에 유의적 으로 가장 높은 값을 나타내어 경도와 검성의 결과에서도 가장 높은 값을 나타낸 것과 유사하였다. 쌀가루의 경우 MR이 M보다 전 기간에서 유의적으로 낮게 나타나 경도 와 유사한 경향을 나타냈다. 우유 베이스나 우유와 두유 혼합물에 이눌린 또는 쌀가루를 첨가한 푸딩의 경우 MI 나 MSI가 MR이나 MSR보다 유의적으로 높은 값을 나타 내어 이눌린의 첨가가 씹힘성을 증가시킨다는 것을 알 수 있었다. 이러한 경향 또한 경도와 유사한 결과인데 Chung & Lee (1994)는 생선을 첨가한 겔의 씹힘성과 경 도가 상관관계를 가진다고 보고하여 씹힘성과 경도가 서 로 같은 경향을 나타내는 본 연구결과와 일치한다는 것을 알 수 있었다.
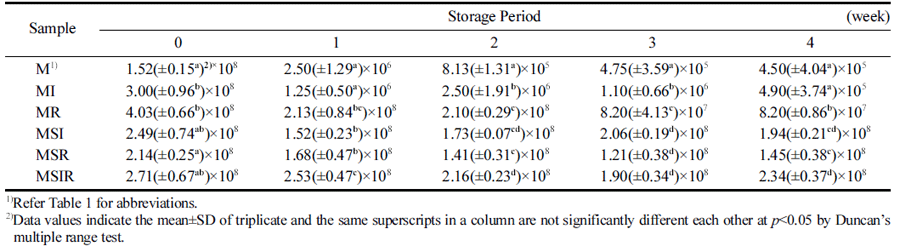
프로바이오틱스 균주를 포함하는 식품은 요구르트나 치 즈와 같은 유가공품이 대부분인데 치즈는 경도가 높고 제 조 과정에서 유청 단백질이 많이 배출되어 균의 보존이 어 렵고(Buriti et al., 2005) 요구르트는 저장 기간이 길어질수 록 pH가 낮아져 오히려 프로바이오틱스의 성장을 저해시 키는 것으로 알려져 있다. 그러나 Irkin & Guldas (2011) 가 카카오를 첨가한 푸딩에서 저장 25일까지 프로바이오틱 스가 106 CFU/g 이상 생존하였다는 결과를 확인한 바와 같이 푸딩의 경우 요구르트나 치즈에 비해 온도에 민감하 지 않아 저장하기가 용이하고 프리바이오틱스와 같은 원료 를 혼합할 경우 유산균을 보호할 수 있는 작용을 하는 효 과가 있어 프로바이오틱스의 균수를 유지하는데 도움이 되 는 식품 매개체의 하나로 사용할 수 있는 것으로 보고되었 다(Han & Lim, 2021). 우유를 기본재료로 하고 두유, 이 눌린, 쌀가루 등의 곡류를 첨가하여 BB-12로 발효시킨 요 구르트로 제조한 푸딩을 냉장 저장하는 동안 BB-12의 생 존율에 대한 결과를 T ab le 6에 나타내었다. 모든 샘플은 접종 초기에는 유의적인 차이를 보이지 않았으나 저장 1주 부터 M과 MI가 유의적으로 낮은 생존율을 나타내었으며 저장 기간이 늘어날수록 균수가 점점 감소하였다. 저장 3 주부터는 MR의 생존율이 우유와 두유를 혼합 첨가한 샘 플에 비해 유의적으로 낮아지는 경향을 보여 두유가 BB- 12의 생존율을 유지하는데 도움이 되는 것으로 나타났다. 또한 쌀가루나 이눌린과 같은 프리바이오틱스가 존재할 때 BB-12의 생존율이 높아지는 것으로 나타났으나 우유 베이 스의 푸딩에서는 쌀가루를 첨가하였을 때 BB-12의 생존율 이 더 높아지는 것으로 나타났다. 이눌린이 발효와 저장기 간 동안 유산균에 대한 보호 작용을 하는 것으로 알려져 있지만(Donkor et al., 2007) 요구르트 제조 시에 이눌린이 분해되어 보호 효과가 감소하는 것으로 생각된다. 프리바 이오틱스로 잘 알려진 이눌린과 비교 시 쌀가루를 첨가한 MR이 MI보다 BB-12의 생존율이 유의적으로 높게 나타나 쌀가루가 이눌린보다 BB-12의 생존율을 높이는 것으로 나 타났으며 두유의 첨가로 인해 생존율을 상승시키는 효과가 있는 것으로 나타났다.
|
이러한 결과는 Han & Lim (2021)의 Lactobacillus acidophilus로 발효시킨 푸딩에서 이눌린보다 쌀가루를 첨가하 였을 때 생존율이 유지된다는 결과와는 유사하였으나 두유 의 첨가가 오히려 생존율을 저하시킨다는 결과와는 다르게 나타나 어떤 종류의 프로바이오틱스 균주로 발효시키느냐 에 따른 차이인 것으로 생각된다. 두유를 첨가한 푸딩에서 BB-12의 생존율이 유지된다는 본 연구 결과와 Farnworth (2007)이 보고한 대두 요구르트에서 균주의 차이는 있었지 만 Lactobacillus의 생존에 도움이 된다는 결과와 유사하였 다. 또한 두유, 이눌린, 쌀가루를 함께 첨가한 푸딩에서 BB-12의 생존 효과를 높인 본 연구의 결과와 곡류인 귀 리, 메밀, 쌀, 보리 등이 첨가된 요구르트에서 유산균수가 증가하여 프로바이오틱스의 생존율을 높일 수 있다는 연구 보고(Bakr, 2015)와도 일치하였다. 다만 프리바이오틱스의 경우 소화 효소에 의해 분해되는 과정을 거쳐야 하므로 (Cunningham et al., 2021) 쌀가루는 소화 과정에서 분해될 것이므로 인체 적용에서는 이러한 효과를 기대하기 어려울 수도 있을 것이다. 하지만 본 연구의 결과를 종합하여 볼 때 두유, 쌀가루, 이눌린, 올리고당 등을 첨가하여 프로바 이오틱스와 프리바이오틱스를 적절하게 혼합한 형태로 제 조한 제품의 경우 저장하는 동안 프로바이오틱스의 생존율 을 유지시킬 수 있으며 프리바이오틱스가 프로바이오틱스 를 보호하여 장에 도달하게 되면 장 기능의 정상화로 인한 과민성 장 질환 및 변비 개선 등의 유익한 효과가 나타날 수 있을 것으로 기대된다(Rhyou, 2017). 따라서 곡류를 첨 가하여 BB-12로 발효시킨 요구르트를 첨가한 푸딩의 경우 BB-12의 생존율 유지에 도움이 되는 결과로 나타나 프로 바이오틱스와 프리바이오틱스를 함께 섭취하여 시너지를 발생시킬 수 있는 신바이오틱스로서의 가능성을 확인하여 유용하게 사용할 수 있을 것으로 기대된다.
요약 및 결론
본 연구에서는 프로바이오틱스의 생존율을 유지시키기 위한 목적으로 우유 또는 우유와 두유의 혼합물을 기본으 로 곡류를 단독 또는 혼합물로 첨가하여 BB-12로 발효시 킨 요구르트를 첨가하여 6종류의 푸딩을 제조하였다. 푸딩 의 pH는 저장하는 동안 거의 차이가 없었으나 MR의 경 우 저장 3주 후부터 유의적으로 pH가 낮아졌으며 산도는 pH와는 반대의 경향으로 나타났는데 pH 결과와 부합되는 경향으로 MR이 저장 1주 후부터 산도가 높아지기 시작하 여 2주 후부터는 다른 샘플들과 유의적인 차이를 나타내었 다. 경도, 검성, 씹힘성은 원료를 모두 첨가한 MSIR이 유 의적으로 가장 높은 값을 나타내었으며 쌀가루의 첨가보다 이눌린을 첨가하였을 때 모든 texture에서 유의적으로 높은 값을 나타내었다. 프로바이오틱스인 BB-12의 생존율에서는 M과 MI가 유의적으로 낮게 나타났으며 저장기간이 늘어 날수록 MR의 생존율이 우유와 두유를 혼합 첨가한 샘플 에 비해 유의적으로 낮아지는 경향을 보여 두유가 BB-12 의 생존율을 유지하는데 도움이 되는 것으로 나타났다. 우 유 베이스의 푸딩에서는 쌀가루를 첨가한 MR이 이눌린을 첨가한 MI보다 BB-12의 생존율이 유의적으로 높게 나타 나 쌀가루가 이눌린보다 BB-12의 생존율을 높이는 것으로 나타났다. 결과적으로 대두, 이눌린, 쌀가루와 같은 프리바 이오틱스 기능을 가진 원료와 함께 제조된 푸딩은 프로바 이오틱스를 매개하는 식품으로서 가치가 있다고 판단되며 푸딩의 경도, 검성, 씹힘성 등의 증가와 함께 프로바이오틱 스의 생존율도 증가시킬 수 있어 유익한 효과가 있을 것으 로 기대된다. 하지만 단독 균주를 사용하여 균주의 특성에 따른 한계를 가질 수 있어 두 가지 정도의 프로바이오틱스 균주를 혼합하였을 때는 프로바이오틱스의 생존율에 어떠 한 영향을 미치는지에 대한 추가 연구가 필요할 것으로 생 각된다.








