서 론
요구르트는 우유를 유산균으로 발효시켜 유당을 유산으 로 전환하면서 peptone, peptide 등이 생성될 뿐만 아니라 유산균이 장에서 정장작용 등의 효과로 인해 우유보다 영 양적 가치가 우수하며 소화율이 향상된 유제품으로 다양한 건강 기능성을 가지고 있는 식품이다(Ko et al., 2008;Kim et al., 2009). 유산균은 장내 유해물질 생성 억제, 혈중 콜 레스테롤 저하와 면역력 상승 등의 건강 증진에 효과가 있 는 균으로 알려져 있으며 Lactobacillus acidophillus, L. casei, L. bulgaricus 등 다양한 미생물이 존재하는 것으로 알려져 있다(Kim et al., 1999;Bang & Jeong, 2007). 우 유 발효에 유산균을 사용하는 주요한 목적은 유통기한의 연장뿐만 아니라 건강 증진의 효과를 향상시키는데 있으나 (Widyastuti et al., 2014), 국내에서 판매되고 있는 요구르 트의 설탕 함유량은 상당히 높은 수준으로(Kim, 2015) 유 산균을 섭취하고자 선택하고 있는 발효유가 오히려 당류 섭취를 늘릴 수 있다는 불안감을 조성시킬 수 있어 소비자 들이 발효유의 섭취를 꺼려하는 경우가 발생하고 있다 (Zhang et al., 2016). 따라서 설탕의 단점을 보완하기 위한 대체 감미료를 사용하고자 하는 많은 연구 중 하나인 타가 토스는 설탕과 유사한 단맛을 가지고 있으나 칼로리는 1.5 kcal/g으로 설탕의 1/3 수준이며 혈당지수(Glucose Index, GI) 값은 3으로 설탕(GI 68)의 5%로 건강과 맛을 동시에 만족시킬 수 있는 저칼로리 감미료로서의 활용 가치가 높은 것으로 알려져 있다(Ryu et al., 2003;Kang et al., 2013). 또한 타가토스는 대장에서 유산균의 증식을 선택적으로 증 가시켜 주어 synbiotics의 특징을 나타내어 probiotic 작용 을 증진하는 효과를 가지고 있을 뿐만 아니라 장에서 탄수 화물이 포도당으로 분해되어 흡수되는 것을 억제할 수 있 으며 간에서 포도당이 글리코겐으로 전환되는 것을 도와서 혈당 상승을 억제하는 효과가 있어(Donner et al., 1996;Chiu et al., 2011;Kang & Lee, 2016) 요구르트 제조에 설 탕 대체 감미료로 사용하는데 효율적이다(Ryu et al., 2003;Koh & Seung, 2013;Son et al., 2019). 하지만 요 구르트 제조 시 L. bulgaricus 균주의 경우에는 타가토스를 단독으로 사용할 경우 발효 속도를 현저하게 떨어뜨려 설 탕을 사용했을 때보다 발효 시간이 길어지는 단점이 있어 개선이 필요한데(Sung & Lim, 2019) 곡류 또는 커피 추 출물 등의 다른 원료들의 첨가가 요구르트의 발효 속도를 향상시킬 뿐만 아니라 유산균수의 증가와 생존 기간을 연 장시킬 수 있다는 연구 보고가 있어(Bae et al., 2010;Seo, 2018;Lim, 2020) 설탕 대신 타가토스만을 첨가하였을 때 발효 속도가 저하되는 단점을 개선시킬 수 있는 가능성이 있을 것으로 생각된다.
커피는 그 자체가 지니는 독특한 맛과 향으로 인하여 전 세계에서 가장 많이 소비되는 음료 중의 하나로(Perez- Martínez et al., 2010;Caporaso et al., 2014) 급격한 소비 량을 보이고 있으며 그 시장규모는 해마다 성장하고 있다 (Kim et al., 2013). 커피는 맛과 향뿐만 아니라 커피 자체 의 생리활성 기능으로도 주목받고 있는데 커피에 포함된 생리활성의 대표적인 성분들은 카페인(Caffein), 트리고넬린 (Trigonelline), 클로로젠산(Chlorogenic acid) 등이 있다. 카 페인의 섭취는 알츠하이머와 파킨슨병의 발병을 낮추는데 관련이 있고 트리고넬린은 신경세포의 축삭과 수상돌기를 성장시키는 작용(Tohda, 1999)이 있어 이를 통한 치매 치 료약으로 가치가 있다고 알려져 있다(Benzie, 2000;Kim et al., 2013). 커피내의 강력한 항산화제로 알려진 클로로 젠산(chlorogenic acid)은 커피내에 0.02-0.1 g/L 존재하는 계피산 유도체와 퀸산의 에스테르 성분이다. 폴리페놀인 클로로젠산은 발암억제, 항균활성, DNA 메틸화 억제, hydroxyl 라디컬 제거, 라디컬 생성 억제 등의 항산화 작 용에 효과가 있다는 것이 밝혀져 있다(Lee et al., 2011).
최근 커피시장이 점차 확대되면서 물에 희석하여 바로 마실 수 있는 콜드브루 커피(cold brew coffee)가 주목받고 있으며 전체 커피 시장에서 콜드브루 커피 시장이 차지하 는 비율과 소비가 점차 증가하고 있는 추세이다(Kim & Kim, 2014). 콜드브루 커피는 대표적인 냉수 추출커피로 추출 시 뜨거운 물을 사용하는 것이 아니라 차가운 물을 사용하여 오랜 시간 천천히 추출하는 특징을 가진다(Ha & Cho, 2012). Hwang et al. (2013)에 따르면 낮은 온도에서 추출하기 때문에 신맛이 적고 특유의 향과 맛을 나타낼 수 있는 장점이 있지만 추출 시 시간이 오래 걸리고 보관 과 정에서 가열하지 않아 세균의 오염에 쉽게 노출될 수 있는 문제점을 해결하기 위해 최근에는 압력을 이용하여 빠른 시간에 추출하는 방법이 개발되어 콜드브루 커피의 장점인 시간이 경과한 후에도 맛의 변화가 적으며 카페인 함량과 신맛이 적고, 유기산의 휘발량이 적어 풍부한 향미를 가지 고 있으면서(Park, 2017) 장시간 동안 추출하지 않아 미생 물 오염을 방지할 수 있는 콜드브루 커피가 개발되어 많은 사람들이 즐겨 찾고 있다. 하지만 콜드브루 커피의 경우 이 화학적 특성에 대한 분석 연구(Song et al., 2019)와 미생물 변화 및 품질 특성(Park et al., 2020)에 대한 연구가 주를 이루고 있으며 항산화 성분을 다량 함유한 콜드브루 커피 를 가공식품에 접목하고자 하는 체계적인 접근은 매우 부 족한 실정이다. 따라서 본 연구에서는 항산화 활성의 향상 뿐만 아니라 타가토스 요구르트의 발효 시간을 단축하기 위하여 다양한 생리활성 성분을 함유한 콜드브루 액상 커 피를 첨가하여 L. bulgaricus로 발효시킨 요구르트의 항산화 활성 및 발효 속도를 포함한 품질 특성을 분석하고자 한다.
재료 및 방법
요구르트 제조에 사용된 주재료인 우유(Seoul milk Co., Seoul, Korea), 타가토스(tagatose, CJ Cheiljedang, Incheon, Korea)는 시판품을 구입하여 사용하였으며 콜드브루 액 상 커피는 서울 은평구 소재 ㈜칼디하우스에서 제공받아 사용하였다. 발효에 사용된 균주인 L. delbrueckii subsp. bulgaricus는 중앙대학교(Ansung, Korea)에서 분양받아 사용 하였으며, 보존용 배지로는 Lactobacilli MRS broth (Difco Laboratories, Becton, Dickinson and Company, Sparks, MD, USA)에서 37±1°C, 24시간 동안 2회 계대 배양하여 종균 으로 사용하였다. 1차 균주 배양은 5.2% MRS 배지에 0.2% 접종하여 37±1°C에서 24시간 배양하였으며, 같은 조 건에서 2차 계대 배양한 균주를 콜드브루 요구르트의 제조 에 스타터로 사용하였다.
우유 무게 대비 7%의 타가토스를 첨가하여 마그네틱 교 반기(Hot Plate & Magnetic Stirrer, Misung Scientific Co., Yangju, Korea)를 사용하여 교반 후 90°C에서 30분간 살균 한 믹스를 40-45o C 정도로 냉각되었을 때 0.5%의 L. bulgaricus을 접종한 뒤 37±1°C incubator에서 24시간 발효 한 후 starter culture로 사용하였다. 각 요구르트 시료의 배 합비를 Table 1에 나타내었다. 전체 무게 대비 7%의 타 가토스와 콜드브루 액상 커피(0, 6, 8, 10%)를 첨가하고 마그네틱 교반기로 교반 후 90°C에서 30분간 살균한다. 상온에서 40-45°C 정도로 냉각시킨 후에 stater culture를 10% (v/v) 비율로 접종하여 37±1°C incubator에서 20시간 동안 발효시키면서 분석하는데 사용하였다. 콜드브루 액상 커피의 첨가 여부에 따라 4가지 시료(C: yogurt without cold brew liquid coffee, CB 6: Yogurt with 6% cold brew liquid coffee, CB 8: Yogurt with 8% cold brew liquid coffee, CB 10: Yogurt with 10% cold brew liquid coffee)를 20시 간 동안 발효시키면서 5시간마다 샘플을 채취하여 pH, 적 정산도, 점도, 및 유산균 수를 측정하였고, 색의 변화를 알 아보기 위하여 발효 전과 후의 색도를 측정하였으며 발효 가 끝난 후에는 4±2°C 냉장고에서 48시간 동안 보관 후 항산화 활성을 측정하여 비교 분석하였다.
콜드브루 요구르트의 pH는 pH meter (S20 SevenEasyTM pH meter, Mettler Toledo Inc., Columbus, OH, USA)로 20시간 동안 발효시키면서 5시간 간격으로 측정하였으며, 적정산도는 Jeon et al. (2005)의 방법에 따라 요구르트 10 mL를 100 mL 메스플라스크에 증류수로 정용한 후 그 중 20 mL를 취하여 1% 페놀프탈레인 2-3방울을 넣고 0.1 N NaOH로 적정하여 색의 변화가 일어나는 즉시 적정에 사 용된 0.1 N NaOH의 소비 mL수를 측정하여 다음의 계산 식을 이용하여 산출하였다.
점도는 Brookfield viscometer (DV-2, Brookfield Engineering Lab. Inc., Middleboro, MA, USA)로 spindle No. 4 를 사용하여 시료의 torque 값이 70-80% 정도 나오도록 60 rpm (revolutions per minute)으로 설정하여 20시간 발 효시키는 동안 5시간 간격으로 측정하였다. 안정된 점도 값이 나오도록 점도계의 spindle을 60초간 작동시킨 후 3 회 반복 측정한 값의 평균값을 cP (centipoise)로 나타내었 다. 색도는 유산균 접종 전과 20시간 동안 발효 후 각각 의 시료를 색차계(CM-5, Konica Minolta, Tokyo, Japan)를 사용하여 L*값(lightness), a*값(+red/-green), b*값(+yellow/- blue)으로 3회 반복 측정하여 평균±표준편차로 나타내었다.
요구르트의 배양 중 유산균 수 측정은 20시간 동안 배 양하면서 5시간마다 채취한 시료를 멸균 생리식염수에 넣 고 균질화한 후 십진 희석법으로 희석하여 희석배수별로 petri dish에 분주하고, 유산균 배지(MRS plate count agar, Difco Laboratories, Detroit, MI, USA)를 이용하여 표준평 판법으로 37±1°C에서 48±1시간 배양한 후에 나타난 colony 수를 계측하여 colony forming unit (CFU/mL)으로 환산하여 유산균 수를 표시하였고(Yang et al., 2012) 균수 의 계측은 30-300 colony가 나타나는 평판을 가지고 산출 하였다.
요구르트의 Free radical 소거 활성은 2,2-diphenyl-1- picrylhydrazil (DPPH, Sigma-Aldrich Co., St. Louis, MO, USA)법에 의하여 전자공여를 통한 유리라디칼 소거능으로 항산화 활성을 측정하였다. 요구르트 시료 10 g을 99% 에 탄올 90 mL에 넣고 교반하여 추출한 후 1,000 rpm으로 4°C에서 15분간 원심 분리하였다. 그 후 상등액 1mL를 다시 99% 에탄올 9mL와 혼합한 시료에 0.2mM DPPH 용액 1mL를 가하여 교반하고, 실온에서 30분간 방치한 후 517 nm에서 흡광도를 측정하여 시료 첨가구와 무첨가 구의 흡광도 차이를 아래의 계산식을 이용하여 백분율(%) 로 나타내었다. 이 때 무첨가구에는 에탄올 10mL에 0.2 mM DPPH 용액 1mL를 첨가하여 흡광도를 측정하였다 (Yu et al., 2002). ABTS 라디칼 소거 활성 측정을 위해 각 시료 10g을 absolute ethanol 90 mL와 혼합하여 shaking incubator에서 24시간동안 교반하여 원심 분리 후 상등액을 요구르트 추출물로 사용하였다. 시약은 7.4 mM ABTS와 potassium persulfate 2.6 mM로 ABTS radical 생성 stock solution을 혼합하고 12시간 이상 실온, 암소에 방치하여 청록색의 ABTS+ radical을 형성시킨 ABTS solution을 phosphate buffered saline으로 희석하여 732 nm에서 흡광 도가 0.70±0.03이 되도록 하였으며 요구르트 추출물 0.2 mL에 ABTS solution 1.8 mL를 혼합하여 암소에서 20분 간 반응시킨 후 732 nm에서 흡광도를 측정하여 아래의 식 에 의해 계산하였고 대조구로는 증류수 0.2 mL를 이용하 였다(Proteggente et al., 1999).
총 polyphenol 함량의 측정은 E u n et a l. ( 2014)이 사용 한 Folin-Ciocalteu 방법을 약간 변형하여 사용하였다. 각 요구르트 시료 1 g에 증류수 9 mL를 혼합하여 원심 분리 (1,000 rpm, 15 min)하고 상등액만을 취하여 다시 증류수 9 mL와 혼합한 시료 0.25 mL를 취하고 Folin-Ciocalteu’s phenol regent (Sigma Chemical Co., St. Louis, MO, USA) 0.1 mL를 혼합하여 3분간 실온에서 반응시킨다. 여기에 sodium carbonate (Na2CO3) 포화용액 0.15 mL를 첨가하고 실온에서 30분간 반응시킨 후 증류수 0.5 mL를 더 첨가하 여 총 부피를 1mL로 맞춘 후 760 nm에서 흡광도를 측정 하였다. Total polyphenol 함량은 측정된 흡광도를 galic acid (Daejung Chemical & Metals Co., Ltd.)로 작성한 표 준곡선을 이용하여 시료 1 g당 mg gallic acid equivalent (GAE)로 환산하여 나타내었으며 모든 실험은 3회 반복 측 정하여 평균±표준편차로 나타내었다. Total flavonoid 함량 측정은 Moreno et al. (2000)의 방법에 따라 측정하였다. 각 요구르트 시료 1 g에 80% ethanol 4.3 mL와 10% aluminum nitrate 0.1 mL, 1M aqueous potassium acetate 0.1 mL를 넣어 혼합한 후 실온에서 40분간 방치한 뒤 510 nm에서 흡광도를 측정하였다. 시료의 total flavonoid 함량 은 quercetin을 표준물질로 하여 시료 100 g 당 quercetin mg 당량(mg QE/100 g)으로 나타내었으며, 3회 반복 측정 한 후 평균±표준편차로 나타내었다.
Hydrogen peroxide (H2O2) radical에 대한 소거활성은 각 요구르트 시료 0.4 mL에 10 mM H2O2 0.1mL와 0.1M phosphate buffer 0.5 mL를 혼합하여 37°C incubator에서 5 분간 반응시킨 후 1.25mM ABTS 0.15mL와 PBS에 녹인 peroxidase (1 unit/mL) 30 μL를 첨가하여 37°C의 incubator 에서 10분간 반응시킨 다음 405 nm에서 흡광도를 3회 반 복 측정하여 계산한 결과를 평균±표준편차로 나타내었다 (Muller, 1985). 환원력(reducing power)은 Oyaizu (1986)의 방법을 변형하여 측정하였다. 각 요구르트 시료 1 g에 1 mL의 0.2 M sodium phosphate 완충액(pH 6.6)과 1 mL의 1%(w/v) potassium ferricyanide를 가하여 혼합한 후 50°C 의 항온수조에서 20분 동안 반응시켰다. 이 반응액에 1 mL의 10%(w/v) trichloroacetic acid를 가하여 반응을 정지 시킨 후 원심 분리(3,000 rpm, 10 min)하였다. 상층액 1.5 mL에 1.5 mL의 증류수와 0.3 mL의 0.1%(w/v) FeCl3 용 액을 혼합하여 10분 동안 실온에서 방치한 후 700 nm에 서 흡광도를 측정하여 요구르트 1 mL에 해당하는 환원력 을 BHT (Butyl hydroxytoluene)의 용량(mg)으로 표시하였 다. 표준곡선은 BHT의 최종농도가 0, 0.1, 0.3, 0.5, 0.7 mg/mL이 되도록 하여 위와 같은 방법으로 700 nm에서 흡광도를 측정하여 작성하였다.
결과 및 고찰
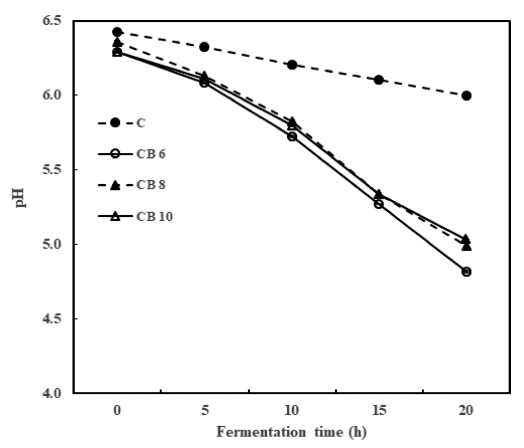
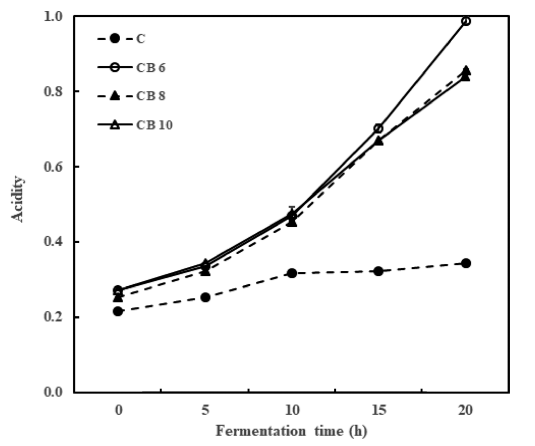
우유에 타가토스와 콜드브루 액상 커피를 첨가한 시료에 L. bulgaricus를 접종한 후 20시간 동안 발효시키면서 5시 간 간격으로 pH를 측정하여 Fig. 1에 나타내었다. 요구르 트의 발효 중 pH는 발효 진행 상황, 성분 변화 및 산미 정도를 알 수 있는 중요한 품질 지표로써 활용되고 있는데 (Yang et al., 2010) 타가토스만을 첨가한 요구르트(대조구) 의 경우 20시간 동안 pH가 거의 감소하지 않고 pH가 6.0 정도에 머무는 것으로 보아 20시간의 발효로는 요구르트의 적정 pH인 4.5 근처에 도달하지 못하였다(Fig. 1). 하지만 콜드브루 액상 커피를 6% 이상 첨가하였을 경우에는 대조 구와는 다르게 발효 20시간에는 pH 4.5 근처에 도달하는 결과가 나타나 콜드브루 액상 커피의 첨가가 요구르트의 발효 속도를 높이는데 도움이 되는 결과를 보여주고 있다. Fig. 2에서 보는 바와 같이 산도의 경우에는 pH 결과와는 반대의 경향을 나타내었는데 pH의 결과와 부합되게 대조 구에서는 발효 20시간이 되어도 산도가 거의 증가하지 않 았으나 콜드브루 액상 커피의 첨가로 인해 산도가 급격하 게 증가하는 현상을 나타내었다. 일반적으로 한국인의 기 호에 맞는 발효유의 적정산도가 0.85-1.20%를 나타낸다고 보고된 바 있는데(Lee et al., 2006) 대조구에서는 20시간 후에도 산도가 0.35% 정도로 발효유의 적정산도에 도달하 지 못하였으나 콜드브루 액상 커피를 6% 또는 그 이상 첨 가하였을 경우에는 20시간 후에 산도가 0.85% 이상으로 도달하여 발효유에 부합하는 적정산도를 나타낸 것으로 보 아 액상 커피의 참가로 인해 L. bulgaricus 균주가 발효 중 에 생성하는 젖산의 양이 증가하여 pH는 감소하고 산도가 증가하였다고 생각된다. 이와 같은 결과는 Lim (2020)의 타가토스 요구르트에 보리를 첨가하였을 경우 산생성과 pH 저하가 빠르게 나타난 결과와 부합되는 경향을 보여 커피, 쌀, 보리 등의 영양분의 첨가가 유산균의 발효 속도 를 향상시켜 산 생성 촉진 현상이 일어난 것으로 추론할 수 있다.
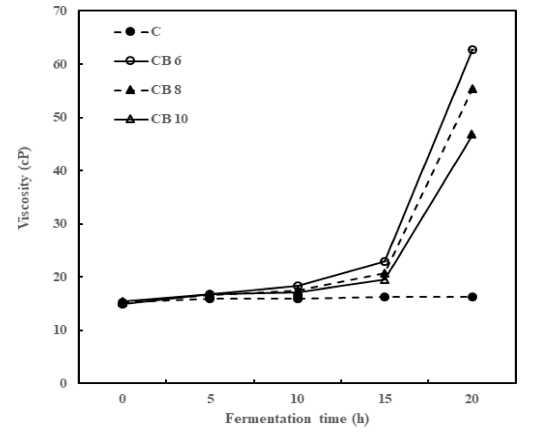
대조구에서는 발효시간이 경과함에 따라 점도의 변화가 거의 나타나지 않았으나 콜드브루 액상 커피가 첨가되었을 경우에는 발효 15시간 이후부터 점도가 급격하게 증가하기 시작하였으며 특히 20시간 발효 후에는 대조구보다 유의적 으로 점도가 증가하여 확연하게 차이가 나는 것을 알 수 있었다(Fig. 3). 이 결과는 요구르트에 쌀, 탈지분유, 전분, 옥수수, 감자와 팽화미 등을 첨가하였을 때 점도가 증가하 였다(Paik et al., 2004)는 연구와 β-glucan 추출물을 첨가 한 요구르트의 점도를 상승시킨다(Gee et al., 2007)는 보 고와도 유사한 결과를 나타내었다. 본 연구에서도 요구르 트의 점도가 증가하는데 타가토스만 첨가하였을 때보다 콜 드브루 액상 커피의 첨가가 도움을 주는 동시에 탈지분유 등과 같은 다른 유고형분을 첨가하지 않아도 점도가 증가 하는 효과를 기대할 수 있을 것으로 보인다.
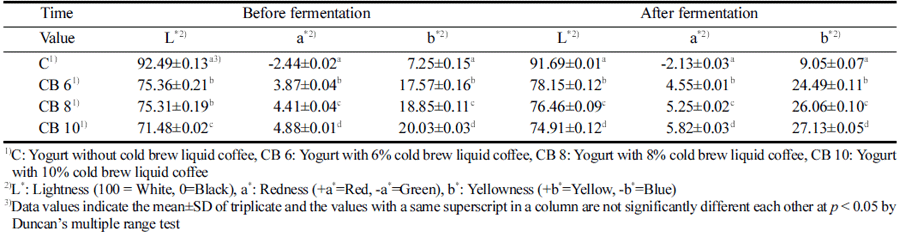
콜드브루 액상 커피를 첨가한 요구르트의 발효 전후의 색 차이를 알아보기 위하여 명도(L*; lightness), 적색도(a*; redness), 황색도(b*; yellowness)를 3회 반복 측정하여 평균 값과 표준편차를 Table 2에 나타내었다. 색도는 요구르트 의 선택과 품질에 큰 영향을 미치는 중요한 특성 중에 하 나로(Han, 2005) 전반적으로 콜드브루 액상 커피의 첨가량 이 늘어날수록 밝기의 L*값은 무첨가군에 비하여 감소하였 으며 황색도와 적색도는 증가하는 경향으로 나타났다. 이 러한 결과는 콜드브루 액상 커피 첨가량의 증가가 색의 변 화에 관여하는 것으로 Lim (2020)과 Lee et al. (2013a, 2013b, 2015)의 연구와 유사한 경향을 나타내었다. 또한 콜드브루 액상 커피의 첨가 여부에 따른 색의 차이는 나타 났으나 발효 전과 후에 요구르트의 색의 유의적 차이는 거 의 없는 것으로 나타나 발효가 요구르트의 색상 변화에는 영향을 미치지 않는 것으로 판단된다.
|
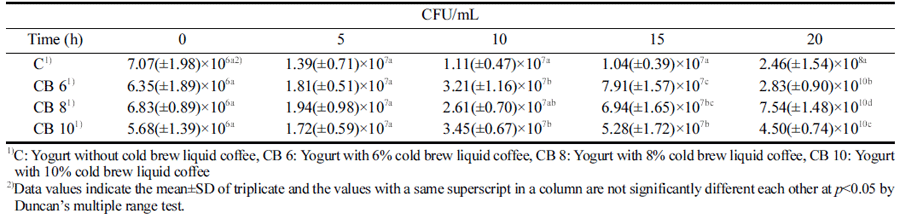
발효유의 중요한 특징 중 하나인 유산균 수는 요구르트 의 풍미뿐만 아니라 요구르트의 품질을 결정하는데 영향 을 미치는 것으로 알려져 있다. 콜드브루 액상 커피를 첨 가한 요구르트를 발효시키면서 20시간 동안 유산균 수의 변화를 Table 3에 나타내었는데 유산균 수는 대조구를 포 함한 모든 샘플에서 시간이 경과할수록 지속적으로 증가 하는 경향을 보였으며 접종 후 15시간까지는 비슷하게 증 가하는 경향을 보였으나 15시간이 지난 이후에 콜드브루 액상 커피를 첨가한 요구르트에서는 빠른 속도로 성장하 는 것으로 나타나 액상 커피의 첨가가 유산균의 성장 속 도를 높이는데 도움이 되는 것을 알 수 있었다. 특히 대조 구의 경우에는 발효 20시간이 경과되었을 때 유산균수가 2.46±1.54×107 CFU/mL로 측정되어 호상 요구르트의 유산 균 수를 108 CFU/mL 이상으로 정한 현행 축산물 가공기 준 및 성분 규격(MFDS, 2013)의 기준에 도달하지 못하였 으나 콜드브루 액상 커피를 6-10% 첨가한 타가토스 요구 르트의 유산균 수는 이 기준을 초과했을 뿐만 아니라 대조 구와도 유의적인 차이가 나타나 액상 커피의 첨가가 유산 균의 성장 속도를 증가시키는데 도움이 된다는 것을 알 수 있었다(Table 3). Lee et al. (2013b)은 보리 가루를 첨가한 요구르트의 유산균 수가 무첨가구에 비해 감소하였다고 보 고하였는데 이는 단일 균주로 20시간 발효시킨 본 연구에 서와는 달리 혼합 균주를 사용하여 24시간 동안 발효한 결과인 반면에 Bae et al. (2010)이 보고한 쌀 분말을 첨가 한 요구르트와 Lim (2020)의 보리를 첨가한 타가토스 요 구르트의 유산균 수가 대조구와 비교하여 유의적으로 높게 나타난 결과와 유사하여 콜드브루 액상 커피의 첨가도 요 구르트의 발효 속도를 향상시키고 유산균 수가 증가하는데 기여하는 것으로 생각된다.
|
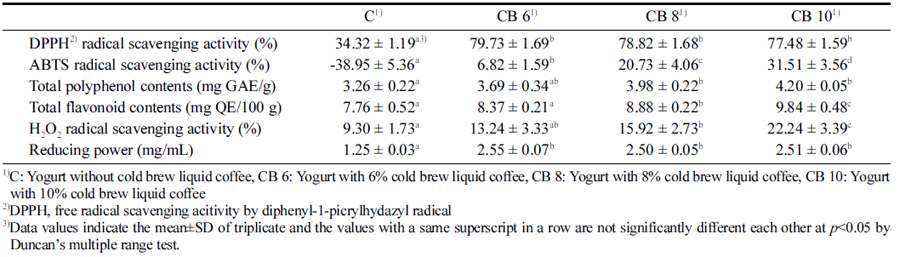
일반적으로 커피에는 다양한 항산화 성분들이 존재하는 것으로 알려져 있는데 요구르트 발효에서도 항산화 활성이 유지되는지에 대한 측정을 위하여 콜드브루 액상 커피를 첨가한 요구르트를 제조 후 항산화 활성을 측정한 결과를 Table 4에 나타내었다. 콜드브루 액상 커피의 첨가량이 증 가할수록 대조구에 비해 항산화 활성이 증가하는 경향이 나타났는데 DPPH 유리 라디칼 소거 활성의 경우에는 대조 구와는 유의적인 차이가 나타났으나 첨가량에 따른 차이는 크게 나타나지 않았다. Kim et al. (2016)은 Lactobacillus를 이용하여 발효를 진행한 커피에서 DPPH 소거 활성이 소 폭 증가하였다고 보고하였는데 이는 본 연구에서 콜드브루 액상 커피를 첨가한 요구르트의 DPPH 소거 활성이 증가 한 결과와 유사하였다. 하지만 콜드브루 액상 커피의 첨가 량이 증가할수록 ABTS 소거 활성은 높아지는 경향이 나 타났는데 이는 커피에 함유한 phenol성 물질에 의한 항산 화 작용 때문으로 여겨진다. Kim et al. (2008)은 홍삼을 첨가한 요구르트에서 발효를 진행하여도 홍삼의 함유량이 증가함에 따라 ABTS 소거 활성이 증가한다고 보고하였는 데 이는 본 연구에서 콜드브루 액상 커피를 첨가하여 발효 시키는 동안에 커피에 있는 항산화 성분을 잃지 않고 ABTS 소거 활성이 증가하는 결과와 유사하였다. Total polyphenol, total flavonoid, H2O2 radical에 대한 소거 활성 의 결과도 유사한 경향을 보였는데 대조구와 콜드브루 액 상 커피를 6% 첨가한 요구르트와는 유의적인 차이가 나타 나지 않았으나 8% 이상 첨가한 요구르트에서는 유의적으 로 높은 값을 나타내어 콜드브루 액상 커피를 첨가한 요구 르트에서 대조구와 비교하여 항산화 활성이 향상되어지는 액상 커피의 적정 첨가량을 정할 수 있는 방법을 제시할 수 있을 것으로 생각된다. 이와 같은 결과는 유자 첨가 요 구르트에서 유자의 polyphenol 화합물에 의하여 항산화 활 성이 증가한다고 보고한 연구 결과와(Lee et al., 2008) 유 사하게 커피에 함유되어 있는 폴리페놀 화합물이 발효되는 동안 분해되며 폴리페놀과 플라보노이드 양이 늘어난다는 보고와도 일치하였다(Kim, 2014). 폴리페놀은 식물에 많이 함유되어 있는 물질로 식물이나 식품이 가지고 있는 페놀 성 화합물에서 라디칼 소거능과 환원력이 발생한다고 알려 져 있는 바와 같이(Kang et al., 1995) 본 연구에서 측정한 H2O2 radical에 대한 소거활성도 8% 이상의 콜드브루 액상 커피를 첨가한 요구르트에서 대조구에 비해 유의적으로 높 은 값을 나타낸 것으로 생각된다. Shi et al. (2012)은 발효 콩 연구에서 폴리페놀의 분해로 인하여 플라보노이드 생성 을 초래한다고 하였는데 이는 본 연구에서 콜드브루 액상 커피를 첨가하여 발효시킨 요구르트에서 플라보노이드가 증가한 결과와 유사하였다. 또한 Table 3에 나타난 바와 같이 환원력의 경우에도 콜드브루 액상 커피의 첨가량이 증가할수록 대조구보다 유의적으로 높게 나타나 콜드브루 액상 커피의 첨가가 항산화 활성을 향상시키는데 도움이 되는 것으로 생각된다. 이러한 결과는 GABA 유산균 배양 추출물 첨가 요구르트에서 GABA 추출물의 첨가량이 증가 할수록 환원력이 높은 값을 나타냈다는 Yoo et al. (2019) 의 연구 결과와도 유사하였다. 따라서 콜드브루 액상 커피 의 첨가가 타가토스 요구르트의 항산화능을 향상시킬 수 있는 것으로 추론할 수 있다.
|
요약 및 결론
본 연구에서는 타가토스 요구르트의 발효 속도 및 항산화 활성을 향상시키기 위하여 콜드브루 액상 커피를 첨가하여 20시간 동안 발효시키면서 품질특성 및 항산화 활성을 분 석하였다. 전체 무게 대비 7% 타가토스와 콜드브루 액상 커피를 0, 6, 8, 10% 첨가하고 유산균주(L. bulgaricus)로 발효한 starter cultur를 접종한 후 배양하는 동안 pH, 적정 산도, 점도 및 유산균 수의 변화를 20시간 동안 5시간 간 격으로 측정하였고 색의 변화를 알아보기 위하여 발효 전 후의 색도를 측정하였으며 배양이 끝난 후에는 4±2°C 냉 장고에서 48시간 동안 보관한 후 다양한 방법으로 항산화 활성을 측정하였다. 배양하는 동안 타가토스만 첨가한 요 구르트(대조구)의 경우 pH가 거의 감소하지 않아 발효 20 시간이 되어서도 6.0 이상으로 유지되었으나 6% 이상의 콜드브루 액상 커피를 첨가하였을 경우에는 발효 20시간이 되었을 때 pH 4.5 근처에 도달하는 것으로 나타났다. 적정 산도의 경우도 pH의 결과와 부합되는 결과를 나타내었는 데 대조구에서는 거의 증가하지 않았으나 콜드브루 액상 커피의 첨가로 인해 발효 10시간 이후부터 산도가 급격하 게 증가하는 경향을 나타내었다. 점도의 결과도 대조구에 서는 거의 변화가 없었으며 콜드브루 액상 커피가 첨가되 었을 경우에는 배양 15시간 이후부터 점도가 급격하게 증 가하기 시작하여 20시간 경과 후에는 대조구와 유의적인 차이를 나타내었다. 색도는 콜드브루 액상 커피의 첨가량 이 늘어날수록 대조구에 비해 밝기는 낮아졌으며 황색도와 적색도는 증가하는 경향을 보여 액상 커피의 첨가량의 증 가가 요구르트의 색의 변화에는 관여하는 것으로 나타났지 만 발효 전후 색상의 유의적 차이는 없어 발효로 인한 색 의 변화는 나타나지 않았다. 유산균 수의 경우 대조구에서 는 배양하는 동안 서서히 증가하였으나 콜드브루 액상 커 피를 첨가한 요구르트에서는 배양 후 10시간이 지나면서부 터 대조구와 유의적인 차이를 나타내기 시작하여 20시간이 경과하였을 때는 현저한 차이를 나타내었다. 특히 콜드브 루 액상 커피를 8% 첨가하였을 때 가장 많은 균수가 측정 되었으며 10% 첨가구에 비해서도 유의적으로 높은 값을 나타내었다. 이상의 결과를 종합해 볼 때 타가토스의 첨가 로 인해 저해된 요구르트의 발효 속도가 콜드브루 액상 커 피의 첨가로 인해 개선되고 유산균의 성장 속도를 향상시 키는 역할을 하는 것으로 판단된다. 한편 콜드브루 액상 커피의 첨가량이 증가할수록 DPPH, ABTS, H2O2 radical 소거활성과 total polyphenol/flavonoid 함량이 증가하는 결 과가 나타났으며 환원력의 경우에는 대조구보다 액상 커피 첨가구가 유의적으로 높은 값을 보였지만 첨가량의 영향은 없는 것으로 나타나 콜드브루 액상 커피의 첨가가 타가토 스 요구르트의 항산화 활성을 향상시키는 효과가 있는 것 을 알 수 있었다. 따라서 6-8% 정도의 콜드브루 액상 커 피를 첨가하여 발효시킨 요구르트는 타가토스만 첨가했을 때 발효 속도를 저하시키는 단점을 개선할 수 있을 뿐만 아니라 항산화 활성도 향상되어 건강 증진 효과가 있는 요 구르트의 개발이 가능할 수 있을 것으로 생각된다.








