서 론
콩(Soybean, Glycine max L.)은 양질의 식물성 단백질 공급원으로 이용되어온 주요한 작물 중 하나로 이소플라본 (isoflavones), 식이섬유(dietary fiber), 올리고당(oligosaccharide), 단백질분해효소저해제(Kunitz & Bowman-Birk protease inhibitor), 피트산(phytic acid) 사포닌(saponins), 콩 단백질의 가수분해 펩타이드, 식물성 sterol과 phenol 화 합물(Coward et al., 1993;Anderson et al., 1995;Anderson & Wolf 1995;Kwoon et al., 1998;Messina, 1999)을 포 함한 다양한 생리활성을 가진 기능성 물질들을 함유하고 있다(Messina et al., 1994;Hendrich et al., 1994;Messina, 1995). 콩의 용도는 1990년 이전까지 장류콩이 중심이었으 나 이후 품질의 고급화가 뚜렷해져 크게 가공용(장류·두부· 두유), 나물용, 풋콩 및 착유용 등으로 용도가 다양화되었 다. 그 중 나물콩은 콩나물의 특성에 영향을 미치므로 단 시일 내에 빨리 자랄 수 있는 소립종 품종으로 발아력이 높고 부패율이 낮은 건실한 종자라야 하며, 가을에 수확한 콩을 다음해 콩나물이 생산될 때까지 이용해야 하기 때문 에 저장기간에도 싹이 잘 틀 수 있는 특성을 지녀야 한다. 따라서 양질의 콩나물을 공급하기 위해 나물콩의 발아특 성, 생육특성의 연구(Shin & Choi, 1996;Kim et al., 2002;Jeon et al., 2008)를 통해 여러 품종의 나물콩 개발이 진행 되어 왔으며 풍산나물콩(Punsannamul-kong, Glycine max L.)은 호남농업연구소에서 소립 다수성이면서 내병성인 나 물콩을 개발하고자 육성하여 1996년 주요농작물 종자협의 회에서 장려품종으로 결정된 대표적인 콩나물 원료콩이다. 나물콩은 콩나물 재배에 활용된 후 발아율 70%이하인 것 은 콩나물로 발아되지 못한 채 폐기되는데, 연간 약 10% 의 미발아 콩이 영양적 가치와 평가가 제대로 이루어지지 않은 채 버려지고 있는 실정이다. 또한 나물콩의 농가 생 산소득은 매우 낮아 국내의 나물 콩 수요량을 충당하기 위 해 다량의 외국산 콩나물 콩이 수입되고 있어 이와 같은 추세가 계속되면 국내 콩나물 콩의 생산기반도 붕괴될 위 험에 처해 있다. 따라서 미발아 풍산나물콩의 활용방안을 탐색하여 경쟁력을 갖춘 나물콩의 선별 및 이용화 기술개 발이 필요한 실정이다. 식품가공에서 로스팅(roasting)은 해 당 식품 자체의 고유한 향미와 색을 얻기 위한 원료의 가 공 방법으로 커피, 카카오콩을 이용한 코코아, 보리차 등에 주로 사용되고 있는 공정으로 원료에 로스팅 처리를 할 경 우, 분해, 합성, 축합 등의 반응에 의해 수용성 고형분 함 량의 증가를 비롯하여 다양한 성분의 변화가 일어나게 된 다(Suh & Chun 1981). 특히 환원성 당과 질소화합물은 로스팅에 의해 갈색화 반응의 촉진과 향기성분의 생성이 수반되며, 식품에서 생성된 amino-carbonyl 반응생성물들은 항산화성 외에도 여러 가지 생리활성을 나타낸다(Suh & Chun, 1981;Kim et al., 1981). 따라서 미발아 풍산나물콩 의 활용 연구에서 로스팅 공정 도입은 고소한 향을 통한 콩 비린내를 마스킹 할 수 있고 더불어 생리활성을 높여 기능성 식품 개발을 위한 원료로 활용할 수 있다. 이에 본 연구에서는 미 이용자원인 미발아 풍산나물콩의 로스팅 공 정 적용을 통한 생리활성 변화를 분석, 평가함으로서 나물 콩의 가공제품 원료 활용에 대한 근거자료를 마련하고자 한다.
재료 및 방법
본 실험에 사용한 콩(Soybean, Glycine max L.)은 풍산 나물콩(Pungsannamul- kong, Glycine max L.)으로서 2015 년 전주지역에서 재배된 콩 중에서 파종된 종자 수에 대한 발아 종자수 비율을 확인하는 발아율 검사를 통해 발아율 70% 이하인 것은 콩나물로 발아되지 못한 채 버려지는 적 채된 미발아 콩을 사용하였다. 풍산나물콩은 ‘전주콩나물영 농조합법인’에서 수급 받았으며, 색이 일정한 것으로 선별 하여 3회 세척과정을 거쳐 40°C에서 48시간 열풍 건조하 였다. 로스팅은 로스터기(CBR-101A, Gene café, Korea)를 이용하였으며 콩 200 g을 취해 100-180°C 사이의 온도에서 20°C 간격별로 30분간 로스팅 과정을 수행한 후 로스터기 에 장착된 공기 냉각기로 실온에서 충분히 식힌 후 시료로 사용하였다.
풍산나물 콩 200 g을 정확히 칭량하여 100~180°C 사이 의 온도에서 20°C 간격별로 30분간 로스팅 과정을 수행 후 무게를 측정하였다. 로스팅 수율(yield) 은 로스팅 시간 에 따른 무게의 감소량으로 정의하여 백분율(%)로 표시하 였다(Table 1).
색도는 색차계(Chromameter NE-4000, Tokyo Denshoku, Japan)를 이용하여 표준색판(X=82.94, Y=84.65, Z=94.34) 으로 보정 후 Hunter's Lab값 즉, 명도 L값(lightness), 적색 도 a값(redness) 및 황색도 b값(yellowness)을 측정하였다.
시료는 분쇄기(FM-860T, Hanil Electric, Seoul, Korea) 에서 50 mesh 이하로 분말화 한 후 20배(w/v)의 70% ethanol과 혼합하여 25°C에서 24시간동안 교반 후 60분 동 안 초음파(Sonicator, Power sonic 410, Hwa shin Co., Korea) 추출하였다. 초음파 추출은 25°C, 40 KHZ, Low- 1의 조건에서 시행되었다. 각 추출물은 filter papers (WhatmanTM No.2)로 여과한 뒤 여액을 55°C 수욕상에서 감 압농축기(Rotary evaporator, N-1000, EYELA, Rikakikai Co., Tokyo, Japan)로 농축하여 용매를 완전히 제거한 후 동결건 조(Freeze dryer, FDU-8606, Operon Co., Korea) 하였다.
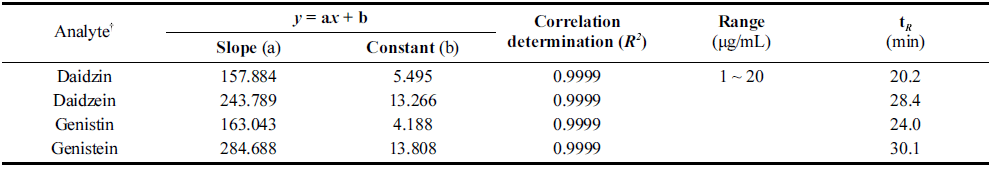
이소플라본 측정을 위한 시험용액의 제조방법과 정량분 석방법은 AOAC (1995) 법과 Lee et al. (2010)의 방법을 응용하여 실시하였다. 이소플라본 함량분석은 daidzin, daidzein, genistin, genistein을 표준 성분으로서 high perfomance liquid chromatography (HPLC, 1200 series, Agilent technology Co., California, USA)를 이용하여 분석 하였다. 각 표준성분에 대한 정량 평가는 이소플라본의 표 준물질에 대해 peak retention time (min)을 확인하였으며 검량선 작성 및 농도의 산출은 agilent chemstation (Agilent 1200 series)을 이용하였다. 표준물질에 대한 peak 면적비 와 조제 농도를 이용하고, 가중 최소자승법에 따르는 검 량선의 회귀식을 이용해 농도를 산출하였다(Table 2). Daidzin, daidzein, genistin 및 genistein의 정량 분석을 위 한 검량선 확인 결과는 Table 2과 같이 R2=0.999 이상으로 유의함을 확인하였다.
총 폴리페놀 함량은 Folin-Ciocalteu phenol reagent에 의 한 추출물의 폴리페놀성 화합물에 의해 환원된 결과 몰리 브덴 청색으로 발색하는 것을 원리로 분석하였다(Folin & Denis, 1912;Slinkard & Singleton, 1977). 시료는 10 mg 을 취한 후 distilled water 10 mL에 녹여 시료로 사용하였 다 시료 24 μL을 취해 distilled water 72 μL를 첨가한 후 Folin-Ciocalteu phenol reagent 24 μL을 넣고 1분간 교반한 후 5분간 실온에서 반응시켰다. 7% sodium bicarbonate 용 액 24 μL을 첨가하고 증류수 56 μL로 희석하여 1분간 교 반 한 후 암실에서 90분 반응시킨 후에 750 nm (Multilabel plate readers Victor2 1420, Perkinelmer Co., Waltham, USA) 파장에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid를 표준물질로서 작성한 표준 검량 곡선에 대입하여 μg gallic acid equivalent (GAE)/mg로 산출하였다. 총 플 라보노이드 함량은 Zhishen et al. (1999)의 변형된 방법에 따라 측정하였다. 시료 75 μg에 distilled water 50 μL를 첨 가한 후 5% (w/v) sodium nitrite 7.5 μL을 넣고 5분간 반 응시킨 후 10% (w/v) aluminium chloride 15 μL를 첨가, 6 분간 반응시키고 1 N sodium hydroxide 50 μL를 첨가하여 상온에서 10분간 반응시킨 후에 450 nm (Multilabel plate readers Victor2 1420, Perkinelmer Co., Waltham, USA) 에서 흡광도를 측정하였다. 총 플라보노이드 함량은 quercetin을 표준물질로서 작성한 표준 검량선에 대입하여 μg quercetin equivalent (QE)/mg로 나타내었다.
DPPH 라디칼 소거능은 1,1-diphenyl-2- picrylhydrazyl (DPPH)의 자유 라디칼 소거능을 통해 확인하는 방법으로, Blois (1958)의 방법을 변형하여 측정하였다. 에탄올에 DPPH를 용해하여 0.1 mM DPPH 용액을 준비한 후 DPPH 800 μL (mg/100 mL ethanol)에 시료 200 μL를 가하여 vortex mixer로 10초간 진탕한 후 실온에서 30분 반응시켜 517 nm (Multilabel plate readers Victor2 1420, Perkinelmer Co., Waltham, USA)에서 흡광도를 측정하였다. 시료를 첨 가하지 않은 대조군과 비교하여 산화를 억제한 정도를 라 디칼 소거능(free radical scavenging activity)으로 구해 양 성 대조물질 L-ascorbic acid에 대한 상대비율을 백분율(%) 로 나타내었다.
ABTS 라디칼 소거능은 2,2'-azino-bis-3-ethylbenzothiazoline- 6-sulfonic acid (ABTS)의 자유 라디칼 소거능을 통해 확인하는 방법으로 Pellegrin et al. (1998) 등의 방법으로 측정하였다. ABTS 7.4mM과 potassium persulphate 2.6mM 을 하루 동안 암소에 방치하여 ABTS 양이온을 형성시킨 후 이 용액을 735 nm에서 흡광도 값이 1.4-1.5가 되도록 증류수로 희석하였다. 희석된 ABTS 용액 1 mL에 추출물 시료 50 μL를 가하여 60분 후에 735 nm (Multilabel plate readers Victor2 1420, Perkinelmer Co., Waltham, USA)에 서 흡광도를 측정하였다. ABTS에 의한 총 항산화력은 trolox을 양성대조군으로 시료 첨가구와 비첨가구의 흡광도 차이를 백분율(%)로 표현하였다.
SOD 유사활성은 Marklund & Marklund (1974)의 방법 을 변형하여 실험하였다. Xanthine oxidase에 의해 발생한 superoxide anion이 시험에 사용된 콩에 의해 제거된 비율 을 분석함으로써 시료의 항산화 능을 평가하는 것으로 SOD assay kit (Sigma-Aldrich)를 사용하였다. 먼저 시료를 농도별로 96 well plate에 20 μL씩 분주한 후 reagent solution 20 μL를 넣고 섞어주었다. 이후 enzyme solution 20 μL를 넣고 37°C에서 incubation한 후 450 nm (Multilabel plate readers Victor2 1420, Perkinelmer Co., Waltham, USA) 에서 흡광도를 측정하였다.
본 실험에 사용한 RAW264.7 마우스 대식세포는 한국 세포주 은행(KCLB, Seoul, Korea)에서 분양 받았으며 10% fetal bovine serum (FBS) 및 100 U/mL penicillin이 첨가된 RPMI1640 Media에서 37°C, 5% CO2 incubator (Thermo scientific, Waltham, USA) 조건에서 배양하였다. 세포 생존력을 분석하기 위하여 시료 20, 100, 500 μg/mL 로 분주하고 LPS (1 μg/mL)로 자극하여 24시간 배양한 후 3-(4,5-dimethylthiazol–2-yl)-2,5-diphenyl tetrazolium bromide (MTT) assay로 세포 생존율을 측정하였다.
세포를 48 well plate에 2×105 cell/well로 CO2 incubator 24 시간 동안 배양한 후 시료 20, 100, 500 μg/mL로 처리하고 30분 후에 LPS 1 μg/mL 자극 조건에서 37°C, 5% CO2에서 24시간 배양하였다. 상등액은 Griess시약(1% sulfanilamide in 5% phosphoric acid, 0.1% naphthylethylendiamine in water)과 동일한 부피로 혼합하고, 실온에서 5분간 차광하 여 반응시켜 ELISA reader를 이용하여 520 nm의 파장에서 흡광도를 측정하였다. Sodium nitrate로 표준 곡선을 사용 하여 NO 함량을 산출하였다.
세포를 48 well plate에 2×105 cell/well로 CO2 incubator 24시간 동안 배양한 후 시료 20, 100, 500 μg/mL로 처리 하고 30분 후에 LPS 1 μg/mL 자극 조건에서 37°C, 5% CO2에서 24시간 배양하였다. 상등액을 회수하여 TNF-α, IL-6, IL-1β의 사이토카인 측정에 사용하였다. Capture antibody (1:250 dilution)를 4°C에서 overnight한 후 washing buffer (0.05% tween-20 in PBS)로 세척, assay diluent (10% FBS in PBS) blocking하였다. 배양 배지의 상등액과 standards를 100 μL 분주하여 2 h incubation, detection antibody (1:250 dilution)를 100 μL 분주하여 1 h incubation, HRP substrate solution를 100 μL 분주하여 30min incubation 하였다. 이 후 sTMB solution (Invitrogen, Carlsbad, CA, USA)를 100 μL 분주하여 30 min incubation 하였으며 stop solution을 100 μL씩 분주하고 ELISA reader를 이용하여 450 nm에서 흡광도를 측정하였다. TNF-α, IL-1β과 IL-6 ELISA kit는 BD Biosciences Pharmingen (Sandiego, CA, USA) 제품을 사용하였다.
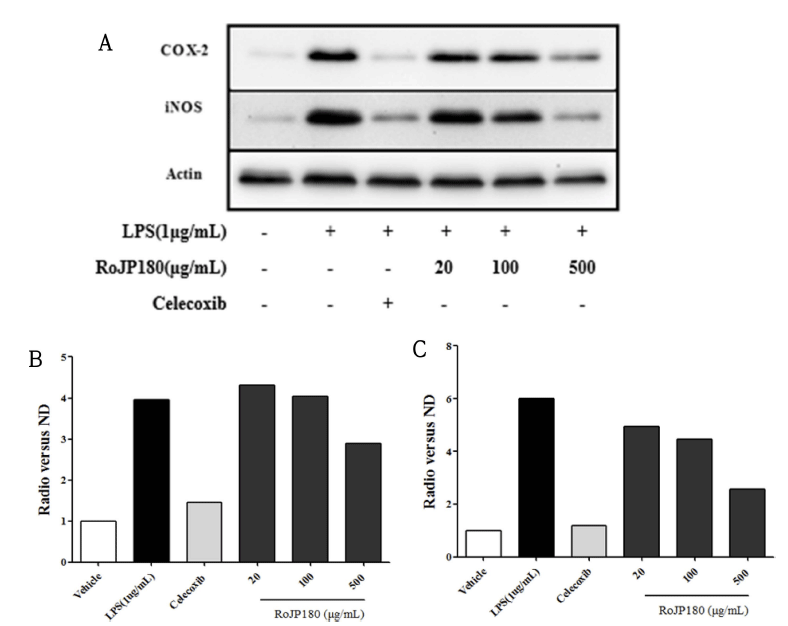
세포를 48 well plate에 2×105 cell/well로 CO2 incubator 24시간 동안 배양한 후 시료 20, 100, 500 μg/mL로 처리 하고 30분 후에 LPS 1 μg/mL 자극 조건에서 37°C, 5% CO2에서 24시간 배양하였다 세포를 회수하고 pellet에 lysis buffer (50 mM HEPES pH 7.0, 250 mM NaCl, 5 mM EDTA, 0.1% Nonident p-40, 1 mM phenylmethylsulfonyl fluoride, 0.5 mM dithiothreitol, 5 mM Na fluoride and 0.5 mM Na orthovanadate)를 첨가한 다음 원심분리 하여 상등 액을 얻었다. rad protein assay reagent (Bio-Rad, Hercules, CA, USA)를 이용하여 protein양을 정량 하였으며, 단백질 을 100°C에서 5분간 불활성화 시킨 후 이를 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDSPAGE) 에 loading하였다. 로딩 후, 균질화 된 단백질을 분 주하고 PVDF 막에 2시간 동안 옮긴 후 전달된 membrane 을 0.1% tween-20이 첨가된 tris-buffer saline (TBS-T)에 세척, 5% skim milk가 첨가된 TBS-T에서 2시간 동안 고 정하였다. 1차 항체 COX-2와 iNOS를 5% skim milk가 첨가된 TBS-T에 1:2000의 비율로 희석하여 첨가하여 4°C 에서 overnight 후, 2차 항체를 1:5000의 비율로 희석하여 상온에서 2시간 동안 처리하였다. 단백질 발현 수준은 enhanced chemiluminescence (ECL) kit를 사용하여 반응 밴드를 시각화하였으며 ECL kit는 Amersham Pharmacia Biotech (Piscataway, NJ, USA)에서 구입하여 사용하였다. 단 백질 발현 수준은 Fluor Chem E 분석기 (Cell Biosciences, CA, USA)를 사용하여 PVDF 막에서 포착된 신호를 분석 함으로써 결정하였다. 실험에 사용한 anti-COX-2 (sc- 166475), anti-iNOS (sc-7271) 항체는 Santa Cruz Biotech으 로부터 구입하였으며, rabbit anti-Goat IgG (H+L), rabbit anti-mouse IgG (H+L)은 Invitrogen (CA, USA)을 사용하 였다.
결과 및 고찰
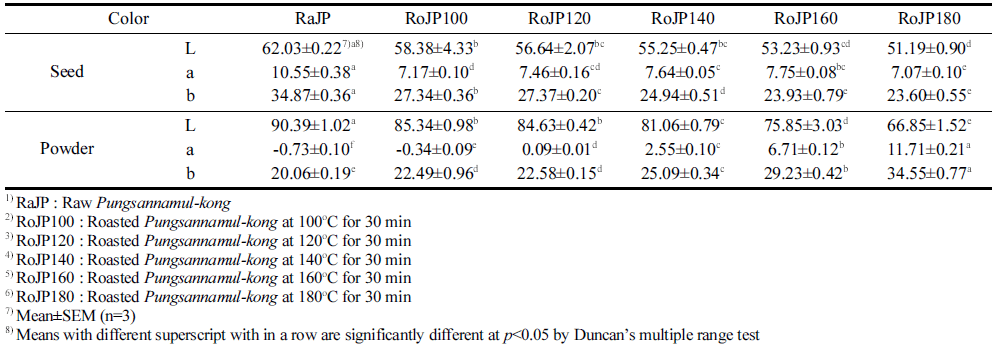
본 연구에서는 콩나물로 발아되지 못하고 버려지는 미 이용자원 나물콩의 가공식품 개발을 위한 효용가치를 입증 하기 위해 로스팅에 따른 품질변화 및 생리활성변화를 살 펴보았다. 풍산나물콩은 100-180°C에서 각 로스팅 처리 후 수율 측정결과는 Table 1에 나타내었다. 100°C에서 30분 로스팅 한 후 무게측정 결과 87.92%이었으며, 120°C에서 81.75%, 140°C에서 78.73%, 160°C에서 75.42%, 180°C에 서 73.97%의 무게로 로스팅 온도가 높아질수록 그 무게는 12.08-26.03% 감소하였다. 이는 로스팅 공정을 통한 수분 이 손실된 것으로 보이며, 120°C 이상의 로스팅 온도에서 는 콩 자체 수분(10.23-12.84%) 보다 더 많은 무게 감소로 콩 고형분 및 다양한 변화가 있을 것이라 보여진다. 또한 같은 조건에서 로스팅 한 후 풍산나물콩 자체와 50 mesh 이하로 분쇄한 풍산나물 콩의 색도 측정 결과 로스팅 온도 가 증가할수록 명도를 나타내는 L값, 적색도를 나타내는 a 값, 황색도를 나타내는 b값 모두 유의적으로 감소하였으며 (p<0.05) 50 mesh이하로 분쇄한 powder형 콩은 로스팅 처 리 및 로스팅 온도가 증가할수록 a값과 b값은 유의적으로 증가하였다(Table 3). 이는 로스팅 열처리에 의한 콩 종피 의 적색도 및 황색도는 감소한 반면 콩의 내배유 및 자엽 의 적색도 및 황색도는 증가한 것으로 이는 로스팅에 의한 갈색화 반응의 변화로 보여진다.
|
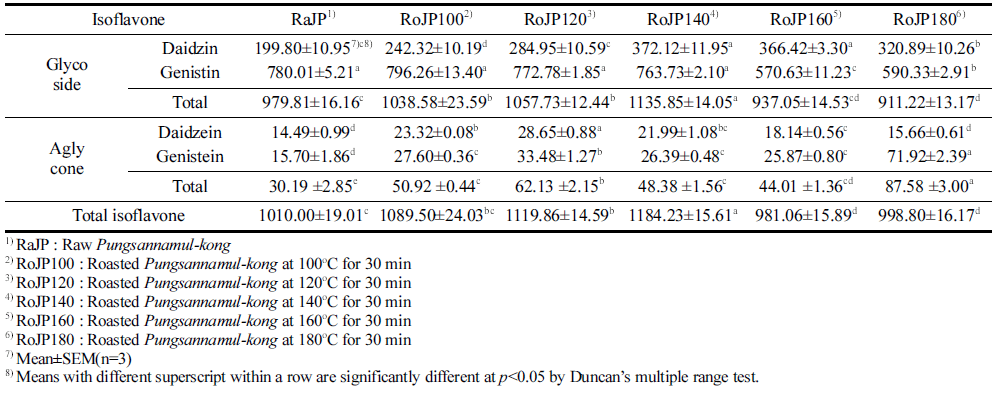
풍산나물콩의 로스팅 조건에 따른 이소플라본 함량변화 는 Table 4에 제시되었다. Daidzin과 genistin의 합인 배당 체 함량은 생콩(RoJP) 979.81 μg/g에서 140°C (RoJP140) 에서 로스팅 하였을 때 1135.85 μg/g을 나타내었으나 이후 온도에서 다시 감소하여 180°C (RoJP180)에서 911.22 μg/ g을 나타내었으며 이는 총 이소플라본 함량에 영향을 주었 다. Daidzein과 genistein의 합인 총 비배당체 함량은 생콩 (RoJP) 30.19 μg/g에서 로스팅 처리 후 그 함량이 증가하 여 120°C (RoJP120)에서 62.13 μg/g의 함량으로 생콩의 약 2배가 증가하였다. 반면 140°C (RoJP140) 이상의 온도에서 48.38, 44.01 μg/g으로 다소 감소하다 180°C (RoJP180)에서 87.53 μg/g 함량으로 생콩에 비해 약 2.9배 증가하였다. 총 비배당체 함량 변화는 로스팅 조건에 따른 genistein의 경 향과 비슷한 결과로 total aglycone의 함량에 영향을 준 결 과로 판단된다.
|
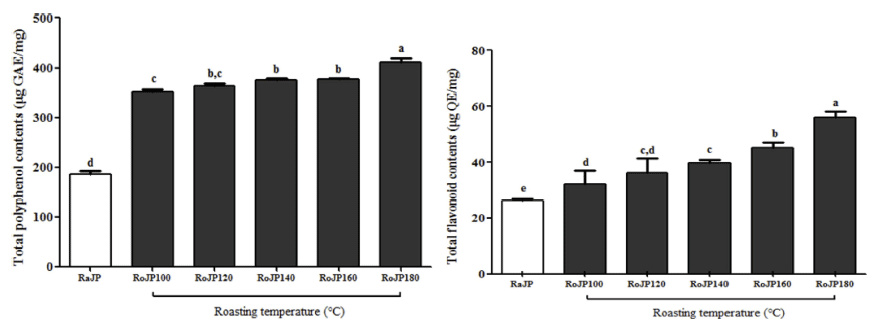
풍산나물콩의 로스팅 온도에 따른 총 폴리페놀 및 플라 보노이드 함량 변화는 Fig. 1에 나타내었다. 생콩(RaJP)의 총 폴리페놀 함량은 186.48 μg GAE/mg을 나타내었으며 180°C에서 로스팅 하였을 때 410.32 μg GAE/mg으로 생콩 과 유의적 차이(p<0.05)를 나타내었다. 총 플라보노이드 함 량은 생콩(RaJP) 26.27 μg QE/mg에서 로스팅 온도가 높아 질수록 유의적으로(p<0.05) 증가하여 RoJP180에서 56.04 μg QE/mg으로 2.13배 증가하여 가장 높은 함량을 보여주 었다. 로스팅에 따른 총 폴리페놀 함량의 증가는 Maillard 반응에 의해 생성되는 갈색 반응 생성물인 melanoidin의 증가(Do et al., 1989)에 의한 것으로 판단되며, 폴리페놀 함량이 높은 식물은 대부분 플라보노이드 함량도 높고, 로 스팅에 따른 폴리페놀과 플라보노이드의 함량이 증가하는 결과는 Jang et al. (2014)의 녹두를 110°C 조건에서 로스 팅 하였을 때 생 녹두에 비해 총 폴리페놀과 총 플라보노 이드 함량이 증가 한 연구결과와 Lee et al. (2014)의 쥐눈 이콩의 폴리페놀과 플라보노이드는 로스팅 온도가 높아질 수록 증가하였다고 보고한 연구결과와 일치하였다.
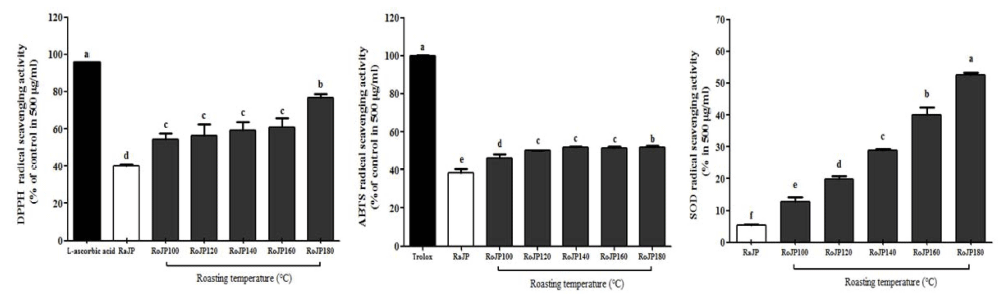
로스팅 온도에 따른 풍산나물콩의 항산화 활성은 DPPH, ABTS 라디칼 소거능 변화와 SOD 유사활성에 의해 분석 되었다(Fig. 2). 본 연구결과 DPPH 라디칼 소거능은 로스 팅 유무에 따라 유의적으로(p<0.05) 차이가 나타나 180°C 에서 로스팅 처리한 RoJP180에서 76.59%로 가장 높은 DPPH 라디칼 소거능을 보였고, ABTS 라디칼 소거능은 RoJP180에서 51.97%의 소거능을, SOD 유사활성은 RoJP180에서 52.63%의 활성으로 생콩(RaJP)의 비해 1.42- 9.76배 증가하였다. 이는 로스팅 처리에 의한 총 폴리페놀 및 플라보노이드의 함량이 항산화활성에 영향을 준 것이라 고 사료되며 이 결과는 Bae et al. (2010)의 맥문동을 로스 팅 처리하였을 때 로스팅 온도가 높아질수록 항산화 활성 이 증가되었다고 보고한 결과와 Kim et al. (2014)의 녹두 를 로스팅 하였을 때 로스팅 온도가 높아질수록 DPPH 라 디칼 소거활성이 유의하게(p<0.05) 증가되었다고 보고하여 본 연구결과와 일치하였다.
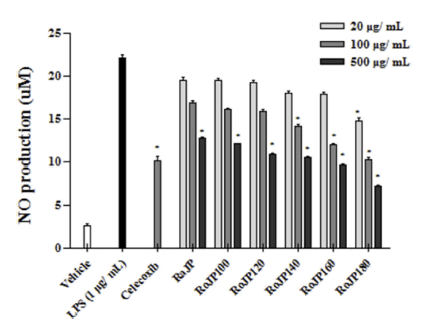
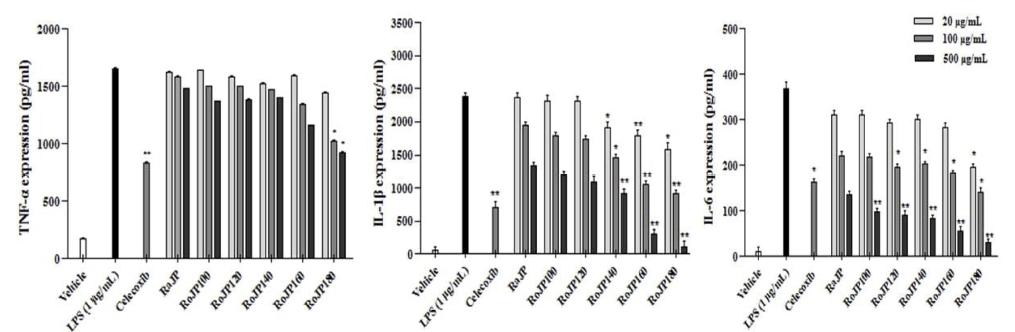
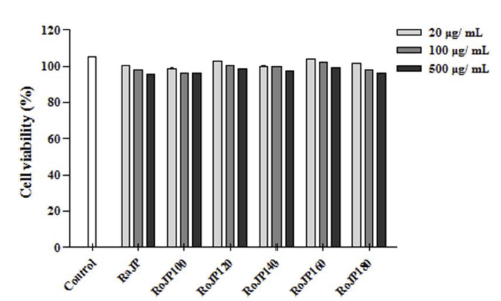
대표적인 free radical 중 하나인 NO는 생체 내에서 중 요한 세포신호전달물질로서 작용하나 과잉 생산 시 산화적 스트레스의 유발을 통해 염증 및 세포 손상의 원인이 된다 (Kalyanaraman, 2013), NO는 LPS, TNF-α, IL-1β등과 같은 염증유발인자 발생인자를 매개체로 관여하고 염증 반응을 조절하며 지속적인 NO의 과 발현은 점막을 손상을 촉진하 며, 암 발생 등의 질환을 유발한다. 로스팅온도에 따른 풍 산나물콩의 세포독성을 평가하고자 20, 100, 500 μg/mL의 농도별로 RAW264.7 세포에 전처리하고 30분 후 LPS (1 μg/mL)로 자극하여 24시간 배양, MTT로 세포 생존율을 측정한 결과 모두 500 μg/mL까지 세포독성이 없는 것을 확인하였다. 따라서 모든 실험에서 세포 독성이 나타내지 않은 500 μg/mL을 실험 가능한 농도로 정하여 항염증 효 과를 분석하였다. LPS로 유도한 RAW264.7 세포에서 NO 생성 정도를 확인한 결과 풍산나물콩 500 μg/mL 모두에서 LPS 처리군과 비교하였을 때 NO의 생성을 유의적으로 (p<0.05) 억제하였다(Fig. 3). 또한, 로스팅 온도가 올라감에 따라 NO의 생성 억제율이 증가하였으며 500 μg/mL에서 NO의 생성량은 celecoxib (1 mM)와 유사한 결과가 관찰되 었다(Fig. 3). TNF-α는 급성 또는 만성 염증성 질환의 면 역 병리학과 관련된 수많은 생물학적 활동을 보유한 염증 성 사이토카인으로 알려져 있으며 염증성 cytokine 생성 억제 활성을 평가한 결과는 Fig. 4에 나타내었다. 로스팅에 따른 풍산나물콩의 NO 생성 억제 효과가 세포 생존율에 의한 영향 때문인지를 알아보기 위해 실시한 MTT 분석에 서 대조군과 처리군 모두에 서 90% 이상의 세포 생존율을 보여주어 세포 독성이 나타나지 않음을 확인하였다(Fig. 5). TNF-α의 발현은 로스팅 온도가 가장 높은 RoJP180에 서 유의적으로 억제되었으며, IL-1β의 발현은 농도 의존적 으로 억제되어 LPS 처리군과 비교하였을 때 RoJP140 이 후의 시료에서 로스팅 온도가 올라감에 따라 유의하게 (p<0.05) 억제되었다. 또한 IL-6의 발현은 LPS 처리군과 비교하였을 때 로스팅 유무에 따라 유의적 차이가 나타났 으며 로스팅 온도가 올라갈수록 농도 의존적으로 유의하게 (p<0.05) 억제하는 것이 관찰되었다. 특히, 500 μg/ mL에 서 IL-6, IL-1β 발현이 celecoxib보다 우수한 결과가 관찰 되었으며 RoJP180은 TNF-α, IL-6, IL-1β를 모두 유의적으 로(p<0.05) 억제하였다.
지속적인 염증성 자극은 COX-2, iNOS, IL-6, IL-1β 등 과 같은 여러 종류의 pro-inflammatory agent의 분비를 유 도하여 다량의 NO의 생성을 촉진한다. NO의 생성을 억제 한 로스팅 풍산나물콩이 다양한 전염 증인자들의 조절에는 어떤 영향을 미치는지 확인하기 위해 세포내에서 합성되어 NO 분비를 조절하는 iN염증발현 단백질 COX-2와 iNOS 의 발현량을 western blot을 통해 측정하였다(Fig. 6A). 그 결과 LPS만 처리한 군에서는 COX-2 발현량이 무처리 군 보다 증가하였으나 180°C에서 로스팅 처리한 RoJP180 처 리 군에서는 LPS에 의한 COX-2 발현량이 현저히 감소하 였다(Fig. 6B). 또한 LPS 처리 시에는 iNOS 단백질이 발 현이 무 처리 군보다 증가하였으나 RoJP180은 LPS에 의 한 iNOS의 발현량이 현저히 감소되었다(Fig. 6C). 이는 로 스팅 풍산나물콩의 NO 생성 억제 효과와 일치되는 결과로 로스팅 풍산나물콩이 iNOS에 의해 NO 분비를 조절함으로 써 항염증 활성을 가지고 있음을 보여주는 것이며, 이러한 결과는 열처리 불가사리 추출물이 염증 매개 사이토카인 유전자 발현을 억제하여 염증성 반응을 차단함으로써 항염 효과를 발한다는 보고와 일치하였다(Park et al., 2020). 결 과적으로 180°C에서 로스팅 처리한 RoJP180은 LPS에 의 해 발현된 염증발현 단백질 COX-2와 downstream signaling molecule인 iNOS 발현을 감소시켜 항염증 효과를 확인하 였다.
요 약
본 연구는 콩나물로 발아되지 못한 채 버려지는 풍산나 물콩의 미 이용자원 활용에 대한 연구이다. 로스팅 공정을 도입하여 온도에 따른 생리활성변화를 분석한 결과 이소플 라본은 로스팅에 의해 비배당체 함량이 증가하여 RaJP (30.19 μg/g)에 비해 RoJP120(62.13 μg/g)에서 약 2배 증가, RoJP180 (87.58 μg/g)에서 약 2.9배 증가하였다. 총 폴리페 놀, 플라보노이드 함량 및 항산화활성은 로스팅 유무에 따 라 유의적 차이(p<0.05)를 나타내었으며 RoJP180에서 폴리 페놀 410.32 μg GAE/mg, 플라보노이드 56.04 μg QE/mg, DPPH 라디칼 소거능 76.59%, ABTS 라디칼 소거능 51.97%, SOD 유사활성 52.63%을 나타냈다. 항염증 효능 분석 결과 LPS로 유도한 RAW 264.7 세포에서 농도 의존 적으로 염증성 cytokine TNF-α, IL-6, IL-1β 생성을 감소시 켰다. 특히, 500 μg/mL에서 IL-6, IL-1β 발현이 celecoxib보 다 우수하였으며, TNF-α, IL-6, IL-1β를 모두 유의적으로 (p<0.05) 억제하였다. 또한 COX-2와 iNOS의 단백질 발현 량을 감소시켜 항염증 효과를 확인하였다. 이상의 결과, 콩 나물로 발아되지 못한 채 버려지는 풍산나물콩은 로스팅 공정 도입에 의해 항산화활성 및 항염증 효과 등이 증진되 어 기능적으로 우수성을 확보할 수 있었으며, 이는 긍정적 인 품질변화로도 이어져 기능성과 품질 특성이 우수한 가 공제품 원료로서 활용 가치가 충분하다고 판단된다.