서 론
콤부차(Kombucha)는 녹차/홍차 등을 우려낸 물에 종균 집합체인 SCOBY (Symbiotic Culture of Bacteria and Yeast)를 넣고 당을 발효시켜 만든 건강 탄산 음료로, 신 진대사 촉진, 항암, 노화방지, 디톡스 등의 효과가 있는 것으로 알려져 미국, 유럽 등지의 지역에서 많이 음용되고 있다(Dufresne & Farnworth, 2000). SCOBY는 다양한 식 음료의 제조에 사용되는 세균 및 효모의 발효 생성물이 며, 대표적으로 콤부차, 식초, 사워도우, 케피어 등의 재료 로 쓰인다(Gallegos et al., 2016;Link, 2018). 콤부차는 Saccharomyces와 Brettanomyces 종(genus)에 속하는 효모가 당을 흡수하여 알코올을 생성하고 이를 Acetobacter가 활 용하여 아세트산을 비롯한 다양한 유기산 생성함으로써 청 량음료 맛이 나며, 배양액 표면에 SCOBY의 균과 효모가 셀룰로오스(cellulose)를 생성하여 겔(gel)과 같은 막을 형성 하는 점이 특징적이다(Mayser et al., 1995; Zhu et al., 2014).
콤부차의 제조 과정은 크게 재료 첨가, 균 접종, 발효 단 계로 나뉜다(Pedersen, 2013). 어떤 찻잎을 우려내어 콤부 차를 생산하는지, 발효 단계에서 어떤 균총을 접종하는지, 발효 조건을 어떻게 설정하는지 등 제조과정 각 단계의 조 건에 따라 콤부차의 균총, 관능적 특성, 기능성이 달라질 수 있으며, 이 덕분에 콤부차는 다양한 종류의 제품이 출 시될 수 있다는 강점을 가진다(Dutta & Paul, 2019). 이는 달리 말하면, 콤부차 제조 시 단계별로 고려해야할 변인들 이 많기 때문에 이에 대한 충분한 연구, 검증과 분석이 선 행되어야만 원하는 제품을 완성할 수 있다는 것이다. 현재 까지의 총설들은 완성된 콤부차 자체의 구성 성분, 균총, 그리고 기능성과 관련된 연구들을 다루는 한편, 각 단계에 따라 완성된 콤부차의 특성이 달라질 수 있음을 짚어낸 총 설은 극히 드물다(Jayabalan et al., 2014;Villarreal-Soto et al., 2018;Martínez Leal et al., 2018). 따라서, 본 총설은 콤부차의 제조과정을 비롯한 다양한 생산 관련 요소을 이 전의 선행 연구들을 통해 정리함으로써 콤부차가 지닐 수 있는 미생물학적, 화학적 조성, 기능적 특성을 살펴보기 위 해 작성되었다.
콤부차 역사
콤부차는 차 문화가 발달한 동북아시아 지역에서 기원전 부터 유래한 발효 음료로 중국/한국, 일본, 러시아/독일, 유 럽, 미국/캐나다 순으로 전세계에 전파되었다고 알려져 있다(Troitino, 2017). 콤부차의 기원은 고대 중국 진시황 시대(기원전 220년)로 거슬러 올라가며, 신라의 의사 고 무하 선생이 일본왕 인교(A.D. 412-453)의 병을 고치기 위해 치료하였다고 하여 콤부차라 불렀다는 기록이 남아 있다(Hartmann et al., 2000). 전 유럽과 북미권으로 콤부차 가 전파된 계기는 러일전쟁(1904-1905)으로 보고 있다 (Jayabalan et al., 2014).
콤부차의 산업화와 상업화는 기원이 된 동아시아보다 북 미권에서 먼저 이루어졌다(Jelenchick, 2008). 1995년 미국 의 GT`S Kombucha 사의 설립 이후 상업용 콤부차 생산 업체가 다수 설립되었으며, 최근에는 코카콜라가 투자한 SUJA, 펩시가 인수한 KeVita의 약진을 바탕으로 글로벌 콤부차 시장은 매년 평균 17.4%의 급속한 성장세를 보이 고 있다(Grand View Research, 2018). 국내의 경우 2018년 을 기점으로 부루구루, 아임얼라이브, 티젠 등의 업체들이 시장을 주도하고 있다(한국경제, 2019).
콤부차의 제조
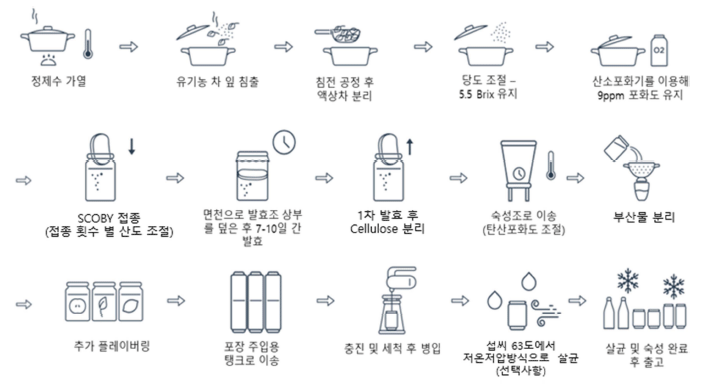
콤부차를 생산하는 과정은 Fig. 1과 같이 찻잎 우리기, 설탕 추가, SCOBY 접종, 발효, 탄산 조절, 부재료 추가로 나눌 수 있다(Chakravorty et al., 2016;Jayalaban et al., 2014). 찻잎 우리기 및 설탕 추가는 콤부차를 구성하는 미 생물들이 대사활동에 이용할 수 있는 먹이 즉, 기질을 제 공하는 단계로, 찻잎의 경우 대표적으로 녹차와 홍차가 가 장 많이 사용된다(Dutta & Paul, 2019). 녹차, 홍차 등의 찻잎이 미생물의 대사에 이용되고 생장을 돕는다는 사실은 선행논문을 통해 알려져 있다(Molan et al., 2009; Sun et al., 2015). SCOBY 접종은 콤부차에 미생물을 접종하는 단계로, SCOBY를 구성하는 세균이나 효모를 비롯한 우점 균들의 분포가 콤부차의 우점균 조성을 결정한다(Gaggìa et al., 2019). 이때 사용되는 SCOBY는 콤부차 제조 전에 새로 만들거나 이전에 사용했던 SCOBY를 재사용하기도 한다(Greenwalt et al., 2000). 접종 이후 발효 기간은 대략 7-14일까지 진행되며(Greenwalt et al., 2000), 유해균이 자 라는 것을 막기 위해 이전에 제조한 콤부차를 더해 pH를 낮춰주기도 한다(Jayabalan et al., 2014). 발효가 시작되고 며칠 후, 미생물들이 생성하는 겔과 같은 형태의 막이 형 성되는데 이를 cellulose라고 부른다(Jayabalan et al., 2014). Cellulose는 발효가 완료된 시기에 약 2cm정도의 두께가 만들어지며, 액상의 콤부차와 분리시킨다(Jayabalan et al., 2014). 발효 이후에는 오미자, 레몬, 블랙커런트 등 의 부재료를 첨가해 콤부차의 향미를 증진시켜 콤부차를 제품화한다(AVING, 2019).
콤부차는 다른 발효 음료 및 식품에 비해 제조과정이 단 순하지만 제조 시 SCOBY 형성과 곰팡이 발생에 주의하 여야 한다(Crum & LaGory, 2016).
일반적으로 콤부차를 제조하기 전에 SCOBY부터 만드는 데, 5일이 지나도 SCOBY가 성장하지 않거나 그 성장이 미약한 경우 발효 환경에 문제가 있다고 본다. 이러한 원 인으로는 너무 낮거나 높은 발효 온도와 잘못된 재료 비율 로 인한 미생물 생장 불균형이 있다(Crum & LaGory, 2016). 이상적인 콤부차 발효 온도는 26-27°C로, 18°C 미 만일 경우 향미가 약해지고 미생물 활동이 둔화되면서 곰 팡이가 쉽게 발생할 수 있다(Jayalaban et al., 2014). 또한, 42°C 이상의 고온에서 1시간 이상 보관할 경우 SCOBY 생성이 제대로 되지 않는다(Hassan & AL-Kalifawi, 2014).
SCOBY 내에는 효모, 세균 등 다양한 미생물들이 존재 하는데, 각기 생장에 이용하는 기질 종류 및 그 양이 다르 다(St-Pierre, 2019). 이용하는 기질들 즉, 녹차나 설탕과 같 은 재료들의 양이 불균형하게 존재하거나, 처음 접종하는 SCOBY 양이 부족한 경우 미생물 생장이 일정하지 못해 SCOBY 형성에 차질이 생긴다(Crum & LaGory, 2016). 이렇게 SCOBY 형성이 제대로 안될 경우에는 새로운 배 양균을 사용해서 발효를 시작해야 한다.
또한, 완성된 SCOBY에 세균이 너무 많거나 효모가 너 무 많은 경우 발효의 균형이 깨지기도 한다. 균이 과다하 게 존재할 경우 탄산이 부족해지고 맛의 깊이가 줄어들며, 이를 해결하기 위해서는 효모가 풍부한 액종을 첨가하거나 발효 기질인 찻물 사용량 증가시키기, 발효 온도 높이기 등을 활용해야 한다(Crum & LaGory, 2016). 효모가 너무 많은 경우에는 신맛과 함께 이취가 날 수 있는데, 이를 해 결하기 위해서는 SCOBY 액종을 여과하여 사용하거나 발 효 온도를 낮춰 24°C 정도로 유지하여 효모의 활동성을 줄이는 방법 등을 사용할 수 있다(Jayabalan et al., 2008).
콤부차 제조 시 곰팡이가 발생하기도 하는데, 곰팡이 생 성은 발효 환경이나 사용한 SCOBY에 문제가 있음을 의 미한다(Crum & LaGory, 2016). 곰팡이는 발효 및 보관 온도가 24°C 이하로 내려가 세균 활동이 둔화되면서 산성 화가 지연되는 경우, 발효 환경이나 재료가 농약 등 외부 요인에 오염된 경우, 습도가 높은 경우 등에서 발생한다 (Nummer, 2013). 곰팡이 발생을 방지하기 위해서는 적정 온도를 유지하고 발효실 멸균처리와 교차오염을 방지하 기 위한 도구의 살균 등을 통해 환경을 제어해야 한다 (Hammel, 2016).
재료에 따른 콤부차 특성 차이
콤부차는 발효 기질에 SCOBY를 넣어 해당 혼합물을 발효시켜 얻는 음료이며, 따라서 이때 사용되는 발효 기질 이나 SCOBY 종류에 따라 완성되는 콤부차의 관능적, 미 생물적 특성이 결정된다(McHugh & Sinrod, 2019). 발효 기질 종류는 홍차, 녹차 등 다양한 식물성 재료들이 있으 며, SCOBY 종류는 미생물, 첨가재료, 발효 방식에 따라 달라진다(St-Pierre, 2019). 다음 내용에서는 발효기질이나 SCOBY 등 첨가 재료들이 콤부차의 특성에 어떤 영향을 끼치는가를 알아본 연구들을 소개하고자 한다.
콤부차 구성 물질은 크게 폴리페놀, 유기산, 당, 단백질 등이 있다(Jayabalan et al., 2014). 사용되는 발효 기질 종류 에 따라 해당 조성을 변화시킬 수 있으며, 대표적인 콤부차 발효 기질로 홍차(Black Tea Kombucha)와 녹차(Green Tea Kombucha)가 있다(Jayabalan et al., 2014). 차는 여러 기능 성을 인정받은 식품으로(Higdon & Frei, 2003), 차를 구성 하는 폴리페놀의 일종인 카테킨이 차 특유의 씁쓸한 맛과 떫은 맛을 내는 것으로 알려져 있다(Kim et al., 2004). 선 행 연구들을 통해 녹차 콤부차와 홍차 콤부차에서 모두 카 테킨을 비롯한 폴리페놀들이 발견되었으며, 녹차 콤부차와 홍차 콤부차의 폴리페놀 함량을 비교한 논문들이 다수 존 재한다(Astill et al., 2001; Jayabalan et al., 2007;Chu & Chen, 2006). Jayabalan et al. (2007)에 따르면, 홍차 콤부 차와 녹차 콤부차에서 모두 콤부차 발효일 9일째까지는 카 테킨 양이 감소하다가 12일째부터 그 함량이 늘어났으며, 이중 녹차 콤부차에서는 에피갈로카테킨갈레이트(EGCG)와 에피갈로카테킨(EGC)가, 홍차 콤부차에서는 에피카테킨 (EC)와 에피갈로카테킨의 함량이 가장 높았다. 이는 콤부 차에 존재하던 카테킨들이 자연분해되다가 발효에 따른 pH감소로 인해 pH에 민감한 균들이 대사활동을 하여 카테 킨을 생성하였기에 발생한 현상으로 여겨진다고 해당 연구 진은 설명하고 있다(Jayabalan et al., 2007). 반면, Chu & Chen (2006)의 연구에서는 홍차 콤부차의 경우 발효일이 늘어날수록 총 폴리페놀 양이 증가한다는 점이 확인되었 다. 카테킨은 낮은 pH환경에서 안정적으로 존재하는 것으 로 알려져 있는데, 해당 연구진은 발효에 따른 콤부차의 pH 변화가 발효일에 따른 총 폴리페놀 양에 영향을 주었 을 것이라고 설명하고 있다. 이는 Jayalaban et al. (2007) 과는 다른 양상의 결과로, 따라서 기질과 발효조건이 폴리 페놀 함량에 미치는 영향을 정확히 파악하기 위해서는 pH 비교 분석을 포함한 더 많은 연구가 더 필요하다.
녹차 콤부차와 홍차 콤부차의 균총을 비교한 논문들도 존재한다(Marsh et al., 2014;Gaggìa et al., 2019). 콤부차 는 발효에 참여하는 구성 균총이 생성된 제품의 특성 결정 에 크게 기여하는데(Dutta & Paul, 2019), 콤부차 제조과정 중 미생물 접종(Fig. 1)은 SCOBY의 첨가를 통해서 이루어 지며, SCOBY가 세균과 효모로 주요하게 구성된 것과 같 이 콤부차도 세균과 효모가 주요 미생물 군집으로 자리 잡 고 있다(Jarrell et al., 2000). Marsh et al. (2014)에 따르면, 홍차 콤부차의 주요 균총 구성 종(genus)으로 균의 경우 Gluconoacetobacter, Lactobacillus, Lactococcus가 있으며 효 모는 Dekkera, Zygosaccharomyces, Pichia가 있다. Gaggìa et al. (2019)는 홍차 콤부차와 녹차 콤부차의 균총 비교를 해보았는데, 두 그룹 간의 균총 조성이 유사한 것으로 밝 혀졌으며, 우점하고 있는 과(family)는 Acetobacteraceae로 Marsh et al. (2014)의 연구와 동일한 양상을 보였으며, 이 를 종합했을 때, 발효 기질로 홍차를 사용했을 때와 녹차 를 사용했을 때 균총과 관련하여서는 큰 차이가 없음을 알 수 있다.
또한, 녹차 콤부차와 홍차 콤부차의 발효 산물 중 하나 인 유기산 함량을 비교한 논문들도 존재한다(Jayabalan et al., 2014; Jayabalan et al., 2007). 유기산은 아세트산에 한 해서만 발효일이 15일 지난 시점부터 녹차 콤부차가 더 높은 함량을 보였으며, 이를 제외한 나머지 D-글루쿠론산, 젖산, 시트르산은 녹차 콤부차와 홍차 콤부차 모두 유의적 인 차이를 보이지 않았다(Jayalaban et al., 2007). 아세트산 은 신맛 조절과 관련된 물질로(Li & Liu, 2015), 콤부차 제조에 있어서 발효 기질의 적절한 선택의 필요성이 대두 된다.
홍차와 녹차 외에도 콤부차 발효 기질로 쓰이는 식물 기 원 식품들이 있는데, 첫번째로 레몬밤이 있다. Velićanski et al. (2014)의 연구에서 레몬밤을 우린 차에 Saccharomycodes ludwigii, Saccharomyces cerevisiae, Saccharomyces bisporus, Torulopsis sp., Zygosaccharomyces sp., Acetobacter sp.를 접종한 후 28±1°C로 7일간 발효한 결과, 레몬밤 콤부차가 일반적인 홍차 콤부차에 비해서 pH와 적정산도가 더 감소 하였고 페놀성 화합물의 양이 홍차 콤부차보다 훨씬 많았 다. 페놀성 화합물 조성은 홍차 콤부차와 상이하였는데, 홍 차 콤부차는 갈산, 카테킨, 에피카테킨, 루틴, 쿠마르산으로 구성된 반면 레몬밤 콤부차는 로즈마린산, 커피산, 케르세 틴, 클로로겐산, 페룰산으로 조성되었다(Velićanski et al., 2014). 홍차 콤부차와 레몬밤 콤부차는 발효 기질로 각기 다른 물질을 사용하였고 이로 인해 발효 기질로부터 침출 되는 물질이 달랐기에 콤부차 조성 차이까지 나타난 것으 로 추정된다고 해당 연구진은 밝혔다(Velićanski et al., 2014).
두번째로, snake fruit 콤부차가 있다(Zubaidah et al., 2019a). Zubaidah et al. (2019a)에 따르면, snake fruit 과즙 에 콤부차 스타터를 넣고 실온에서 14일 배양하게 되면 총 페놀 양과 탄닌의 양이 증가한다. 총 페놀 양은 14일 발효 후 281.01±11.28 mg/L GAE (Gallic acid equivalent) 에서 535.59±1.96 mg/L GAE로 유의적으로 증가하였고, 타 닌 양은 496.67±7.64 mg/L TAE (Tannic acid equivalent)에 서 619.00±39.15 mg/L TAE로 유의적으로 증가하였다 (Zubaidah et al., 2019a). 타닌은 황색 또는 갈색을 띄는 떫은 맛을 내는 유기물의 일종이다(Xu et al., 2018). 해당 연구진은 관능 검사도 실시하였는데, 색, 맛, 향 세 가지 부문에서 5점 만점에 평균 3점 후반~4점 초반대를 기록하 며 snake fruit 콤부차가 특유의 관능적 특성들이 있으며, 이는 소비자 선호도가 높은 것으로 확인되었다(Zubaidah et al., 2018b).
세번째는 참나무 잎 콤부차다(Vázquez-Cabral et al., 2014). Vázquez-Cabral et al. (2014)은 참나무 잎을 끓이고 부유물을 제거한 액체에 설탕 10%와 콤부차 스타터를 접 종한 후 25°C에서 7일간 배양해서 만든 콤부차를 분석한 결과 갈산, 에피카테킨, 카테킨, 클로로겐산, 엘라그산의 존 재하는 것으로 확인됐으며, 관능평가 결과 이때 만들어진 참나무 잎 콤부차는 맛과 향이 소비자 기호도가 높은 것으 로 확인되었다.
찻잎과 같은 식물성 고체류 외에 식물성 액체류를 발효 기질로 사용한 콤부차 사례들이 있다. 첫번째로는 감귤 콤 부차가 있다(Ko et al., 2017). 해당 연구진은 녹차액과 감 귤액을 혼합한 후 Gluconobacter xylinus, Gluconobacter medellinensis, Gluconobacter oxydan 세 종류의 균주를 접종하였고, 30°C에서 15일간 배양 후 실험한 결과, 발효 기간에 따라 0일차에 3.79±0.02였던 pH가 15일차에는 2.99±0.02로 유의적으로 감소한 동시에 산도는 0일차에 0.17±0.00에서 15일차에는 1.51±0.00으로 유의적으로 증가 하였다(Ko et al., 2017). 이는 신맛의 증가로 인한 산성 환경 형성이 미생물 생장을 억제하고 균총 변화를 일으켰 을 가능성이 있다고 해당 연구진은 설명하고 있었다(Ko et al., 2017).
두번째로는 커피 콤부차가 있다(Watawana et al., 2015). Watawana et al. (2015)은 커피에 SCOBY를 접종한 후 7 일간 24±3°C에서 콤부차 발효를 진행하였으며, 그 결과 곱 게 갈은 커피를 재료로 사용할 경우 pH가 5에서 4로 유의 적으로 감소하고, 총 페놀양은 19.8 mg GAE/g에서 26.4 mg GAE/g로 유의적으로 증가하였고, 클로로겐산 함량은 약 11 mg/L에서 12.9 mg/L로 늘어났다. 인스턴트 커피를 사용하였을 경우에 pH는 약 5.3, 총 페놀의 양은 약 14.0 mg GAE/g, 클로로겐산 양은 약 9.0 mg/L 수준으로 유지되 었다. 이를 통해 해당 연구진은 사용되는 커피 종류에 따라 완성된 음료의 특성이 달라짐을 확인하였다(Watawana et al., 2015).
세번째는 산머루즙 콤부차가 있다(Kim & Choi, 2011). Kim & Choi (2011)는 산머루즙에 Gluconobacter hansenii TF-2를 접종한 후 29±1°C에서 15일간 배양시켜 콤부차를 만들었으며, 이후 실험을 통해 숙신산, 말산, 아세트산이 생성되며, 당 조성은 포도당, 과당, 설탕으로 구성됨을 확 인하였다(Kim & Choi, 2011). 15일 발효에 의해 pH는 3.39±0.0에서 2.12±0.09로 감소하는 경향, 적정산도는 0.14 ±0.00%에서 1.43±0.02%로 증가하는 경향을 보였다. 또한, 총당량은 617.5620 mg/mL에서 1092.5 mg/mL로 증가하였 고 과당이 우점하게 존재하였다. 총 유기산양은 117.2513 ppm에서 86.4310 ppm으로 감소하는 경향을 보였고, 이 중 숙신산은 60.4512 ppm에서 77.4148 ppm으로, 시트르산은 8.1591 ppm에서 9.0162 ppm으로 증가하는 경향을 보였다. 반면, 말산은 48.3020 ppm에서 non-detected로, 푸마르산은 0.3390 ppm에서 non-detected로 감소하는 경향을 보였다 (Kim & Choi, 2011).
마지막으로, 밀싹주스가 있다(Sun et al., 2015). 밀싹주 스는 슈퍼푸드의 일종으로, 영양분이 풍부하고 독소배출에 탁월하며, 신진대사를 높이고 콜레스테롤 수치를 낮추는 등 여러 효능을 가진 건강기능식품이다. Sun et al. (2015) 은 밀싹주스에 홍차를 섞은 후 Dekkera bruxellensis, Gluconacetobacter rhaeticus, Gluconobacter roseus로 구성 된 스타터를 넣어 29±1°C에서 12일간 배양시켜보았는데, 그 결과 밀싹주스를 첨가하지 않은 홍차 콤부차는 페놀성 화합물 함량이 갈산은 27.49±0.01 mg/100mL, 카테킨은 0.53±0.04 mg/100mL, 커피산은 49.98±0.07 mg/100mL, 페 룰산은 14.31±0.04 mg/100mL, 루틴은 15.99±0.11 mg/100 mL, 클로로겐산은 10.85±0.11 mg/mL인 것으로 조사되었 다. 밀싹주스 콤부차는 갈산 함량이 12.84±0.13 mg/100mL, 커피산 함량이 7.83±0.08 mg/100mL로 홍차 콤부차보다 유 의적으로 낮은 값을 보였고, 카테킨은 0.62±0.08, 클로로겐 산은 13.53±0.12, 페룰산은 31.89±0.11 mg/100mL, 루틴은 49.95±0.06 mg/100mL로 홍차 콤부차보다 유의적으로 높은 값을 보였다(Sun et al., 2015).
앞서 살펴본 연구들을 통해 발효 기질은 여러 종류의 찻 잎 뿐만 아니라 커피, 과즙 등 그 종류가 다양하며, 이에 따른 pH나 페놀성 화합물과 같은 구성 물질 및 특성이 달 라짐을 확인할 수 있었다(Ko et al., 2007; Watawana et al., 2015;Kim & Choi, 2011; Sun et al., 2015). 이를 통 해 발효 기질이 최종적으로 완성되는 콤부차의 특성에 영 향을 주며, 따라서 콤부차 제조 시 적절한 발효 기질을 선 택해야 함을 알 수 있다.
SCOBY는 콤부차의 균총을 결정하는 주재료로, 일반적 으로 Acetobacter와 Gluconobacter로 구성되었으나, 세부적 인 조성은 SCOBY 제조과정에 따라 다르다(Jayalaban et al., 2014;Chu & Chen, 2006). SCOBY 제조는 콤부차에 발효기질과 당을 첨가한 후 그늘에서 적정 온도로 일정기 간 발효시켜 만드는 간단한 과정이며, 이때 사용되는 재료 및 발효 조건에 따라 SCOBY 미생물적 구성이 다양해진 다(Jayalaban et al., 2014). Marsh et al. (2014)의 연구에서 캐나다 2종(이하 글에서는 캐나다1, 캐나다2로 지칭), 아일 랜드 1종(이하 글에서는 아일랜드1로 지칭),영국 1종(이하 글에서는 영국1로 지칭), 미국 1종(이하 글에서는 미국1로 지칭) 총 4개 지역의 SCOBY 5종을 수집하여 홍차 콤부 차를 제조하여 DNA서열 분석을 진행하였다. 그 결과 SCOBY 자체에서 캐나다1은 Gluconoacetobacter, 캐나다2 는 Gluconoacetobacter, Lactobacillus, Lactococcus, 아일랜 드1은 Gluconoacetobacter, Lactococcus, Acetobacter, 영국1 은 Gluconoacetobacter, Lactobacillus, Lactococcus, 미국1은 Gluconoacetobacter가 우점균으로 나타났다. 영국1과 아일랜 드1 같이 우점균 조성이 비슷하게 나타난 지역들도 각 균의 존재량이 다른 것으로 확인됐다(Marsh et al., 2014). 지역별 로 SCOBY 제조 과정 및 재료들이 달라 SCOBY 우점균이 다르게 나타난 것으로 여겨지며, 이러한 우점균 차이는 콤 부차 우점균 차이와도 연결되는 것으로 밝혀졌다(Marsh et al., 2014). 해당 연구진은 앞서 수집한 지역별 SCOBY로 홍차 콤부차를 만들어(23°C에서 10일간 발효시킴) 균총 변 화를 살펴보았는데, 그 결과 캐나다1은 Gluconacetobacter, Lactobacillus, Thermus, 캐나다2는 Gluconacetobacter, Lactobacillus, 아일랜드1은 Gluconacetobacter, Lactobacillus, Thermus, Lactococcus, 영국1은 Gluconacetobacter, Lactobacillus, Thermus, 미국1은 Gluconacetobacter, Lactobacillus 가 우점균으로 나타났다(Marsh et al., 2014). 캐나다1과 영 국1 같이 우점균 조성이 유사하게 확인된 지역들도 각 균 의 존재량은 다르게 나타났다(Marsh et al., 2014). 이를 통 해 SCOBY 균총 구성이 최종 콤부차 균총에도 영향을 끼 친다는 점을 확인할 수 있다(Marsh et al., 2014).
SCOBY 균총이 콤부차의 균총 뿐 아니라 콤부차 발효 대사산물에도 영향을 끼치는 것으로 밝혀졌다(Malbaša et al., 2011a). 해당 연구진은 그룹별로 다른 균조성을 가진 SCOBY를 접종하여 홍차 콤부차와 녹차 콤부차를 각각 제 조하였는데, 이때 대조군은 Acetobacter와 Saccharomyces, 그룹1은 Saccharomyces cerevisiae와 acetic acid bacteria, 그룹2는 Zygosaccharomyces와 acetic acid bacteria를 혼합 한 SCOBY를 사용하였다(Malbaša et al., 2011a). 그 결과, 홍차 콤부차의 경우 비타민C 함량이 그룹2, 대조군, 그룹1 순으로 높게 나타났으며, 이에 따른 항산화력 또한 그룹1 이 높은 수치를 보였다(Malbaša et al., 2011a). 또한, 총산 함량 또한 그룹2, 대조군, 그룹1 순으로 높았는데, 이는 SCOBY 종류가 콤부차 관능요소에 영향을 끼친다는 점을 보여주고 있다(Malbaša et al., 2011a).
발효 환경에 따른 차이
발효 과정에서의 생성물은 참여 미생물, 사용 기질, 발효 온도, 발효 시간과 같은 환경에 의해 결정된다(Kim et al., 2005). 콤부차 발효 환경 조건에 대한 연구들은 크게 시간이나 온도에 따른 차이를 알아보는 방향으로 진행되 었다(Chen & Liu, 2000;Srihari & Satyanarayana, 2012; Jayabalan et al., 2007; Sreeramulu et al., 2001; Jayabalan et al., 2008;Malbaša et al., 2011b). 콤부차 발효 시간의 경우, 발효 시간이 길어질수록 설탕이 분해되면서 그 함량 이 줄어들고 과당과 포도당 양이 달라졌으며, 글루쿠론산 과 아세트산이 더 생성되어 적정 산도가 증가하였다(Chen & Liu, 2000;Srihari & Satyanarayana, 2012; Jayabalan et al., 2007; Sreeramulu et al., 2001).
콤부차 발효온도도 콤부차 산물에 영향을 준다(Jayabalan et al., 2014). Malbaša et al. (2011b)에 따르면, 콤부차 발 효온도가 높을수록 포화지방산 함량이 낮아졌고 발효 온도 40°C와 43°C 중 43°C에서 불포화지방산 함량이 더 높게 나타났으며, 이는 온도에 따라 SCOBY 활성이 달라질 수 있기 때문에 이러한 차이가 발생한 것이라고 설명했다. 하 지만 현재까지 발효 온도가 콤부차에 끼치는 영향을 알아 본 연구들이 적고 더 나아가 발효 온도와 SCOBY 활성을 연결시키는 연구들은 더욱 부족하기 때문에 발효 온도가 콤부차에 끼치는 영향을 더 구체적으로 파악하기 위해서는 더 많은 후속 연구가 진행되어야 한다.
콤부차의 생리화학적 기능
콤부차는 발효 기간 동안 콤부차 균총이 생성하는 다양 한 부산물과 화합물들이 건강 증진 효능을 가지고 있어 인 공 화합물을 첨가하지 않은 건강 음료로 주목받고 있다 (Kim et al., 2016). 콤부차에는 유기산(아세트산, 글루콘산, 글루쿠론산, 시트르산), 비타민(B1, B2, B6, B12와 C), 페놀, 폴리페놀, 미네랄, 플라보노이드, D-saccharic acid 1,4- lactone (DSL) 등 여러가지 화합물들이 포함되어 있으며 이들의 각기 다른 건강 기능적인 효과는 지속적으로 연구 되고 있다(Jayabalan et al., 2014).
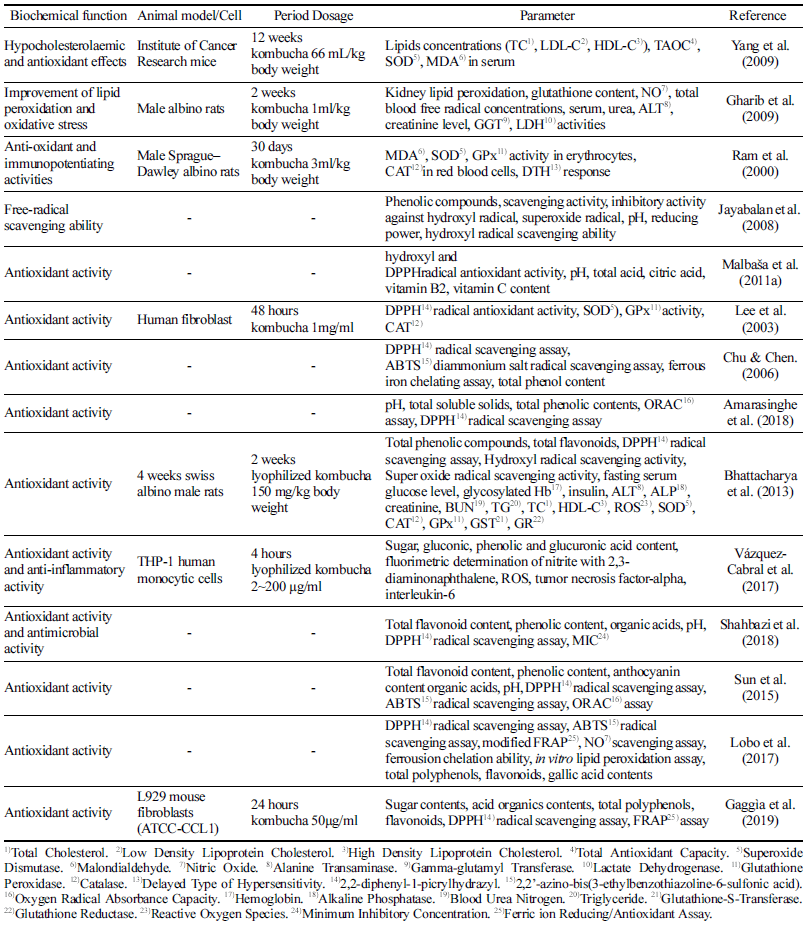
산화 스트레스란, 활성 산소종(자유 라디칼)과 항산화 방 어 기전 간의 불균형으로 인해 산화 기전이 더 우세하여 세포의 단백질, 지질, DNA의 손상이 일어나는 현상을 말 한다(Betteridge, 2000). 자유 산소이온(), 하이드록실라디 칼(•OH), 과산화수소(H2O2) 등의 자유 라디칼은 원자의 오 비탈을 홀로 점유하는 홀전자를 가지고 있어 화학적인 반 응성이 높은 상태로 산화환원반응을 통해 안정한 상태가 되려 하고 더욱 공격적인 라디칼종으로 전환되어 광범위한 세포손상을 유발할 수 있다(Betteridge, 2000). 활성 산소종 은 수명이 짧고, 끊임없이 생성되면서 인체 내의 항산화 물질과 반응하기 때문에 생체 내에서 직접 측정하기 어려 워, 간접적으로 초과산화물 불균등화 효소(Superoxide Dismutase, SOD), 카탈라아제, 글루타티온 과산화효소, 2,2-diphenyl-1-picrylhydrazyl (DPPH) 실험, 2,2’-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS) 실험, oxygen radical absorbance capacity (ORAC) 등의 방법으로 측정하거나 폴리페놀, 플라보노이드 등 항 산화력을 지닌 성분들의 함량을 분석하여 측정한다(Kim et al., 2006). 콤부차는 다양한 음료들 중 강한 항산화력을 가진 음료로 알려져 있으며, 그 기능성은 여러 논문을 통 해 검증되었다(Table. 1). 녹차로 16일동안 발효한 콤부차 의 총 페놀 화합물의 양을 갈산을 기준물질로 설정하여 측정한 결과, 발효기간 동안 유의적으로 증가한 것을 확 인하였으며 그 함량은 0.565 mg 갈산/ml였다(Shahbazi et al., 2018).
7일 동안 녹차를 이용하여 발효한 콤부차에서 총 폴리페 놀 함량은 100.33±2.36 mg/g DW (dry weight)으로 홍차나 루이보스차로 생산한 콤부차보다 높은 폴리페놀 함량을 보 였고, 14일 동안 발효한 콤부차에서의 총 카테킨 함량이 11.844 mg/g DW였으며 그 중 높은 함량을 보인 카테킨은 에피카테킨, 에피갈로카테킨, 에피갈로카테킨갈레이트였다 (Gaggìa et al., 2019). 카테킨은 폴리페놀의 일종으로 높은 항산화력을 가지고 있는 것으로 알려져 있다(Grzesik et al., 2018). 카테킨은 한 개 이상의 당에 하이드록실기가 연 결되어 있는 구조로, 하이드록실기의 개수가 항산화제로서 의 작용에 관여하며, 폴리페놀이 콤부차에서 항산화력의 주된 역할을 수행하고 있는 것으로 파악된다(Lim et al., 2015;Scalbert & Williamson, 2000;Pandey & Rizvi, 2009; Grzesik et al., 2018;Gaggìa et al., 2019).
콤부차에 함유되어 있는 플라보노이드의 고리 구조물에 부착되어 있는 페놀성 하이드록실기 그룹의 배열과 숫자에 따라 항산화제로서의 작용이 다르며, 이는 산화물에 전자 를 공여함으로써 항산화작용을 한다(Lee et al., 2007). 페 놀화합물, 플라보노이드 외에도 콤부차의 유기산, 비타민, DSL 등 다양한 화합물들이 항산화력을 발휘하는 것으로 알려져 있다(Jayabalan et al., 2014). Yang et al. (2009)의 연구에 따르면, 홍차를 이용하여 8일 동안 발효한 콤부차 의 총 폴리페놀 함량, 자유 라디칼 소거능, 하이드록실라디 칼 소거능, 슈퍼옥사이드라디칼 소거능을 확인한 결과, 발효한 콤부차의 폴리페놀 함량과 라디칼 소거능이 양의 상관관계를 보이는 것으로 확인됐다. 이는 본래 차에 존재 하였던 폴리페놀이 미생물들이 생산하는 효소에 의해 depolymerization이 일어나, 다양한 페놀성 화합물들이 증 가하여 콤부차의 항산화 효가가 증가하는 것으로 밝혀졌다 (Jayabalan et al., 2008).
콤부차의 산화적 스트레스 감소 효과를 확인하기 위해 홍차를 이용해 15일 동안 발효한 콤부차 배양액에 대한 DPPH, ORAC, ABTS 실험을 시행한 결과, 배양 시간에 따라 라디칼 소거능이 증가하였고(Chu & Chen, 2006), 기 존 항산화제인 아스코르빈산(0.01 mg/ml)은 약 90%의 라디 칼 소거능을 보여준 것에 비해 약 20-23시간 발효 시킨 콤 부차가 약 90%, 18일 동안 발효 시킨 콤부차가 약 88%의 라디칼 소거능을 보여주었다(Lee et al., 2003; Jayabalan et al., 2008)(Table 1). 멸균유에 36시간 동안 발효한 콤부 차 배양액을 인간 섬유아세포에 처리한 결과 항산화 효소 인 초과산화물 불균등화 효소는 감소하는 경향을 보여주었 고, 글루타티온 과산화효소와 카탈라아제는 유의적으로 감 소하여 콤부차가 노화를 유도한 세포에서 산화적 스트레스 억제 효과를 보여, 콤부차의 새로운 향장소재로의 가능성 을 시사하였다(Lee et al., 2003). 이는 콤부차 배양액 중에 는 글루쿠론산과 부티르산 등 유기산 종류가 다량 함유되 어있고(Pauline et al., 2001), 이 성분들은 노화방지를 위한 원료로 사용되기 때문에 노화 세포에 영향을 주었을 것으 로 설명하고 있었다(Lee et al., 2003).
다른 연구진은 당뇨병을 유도한 동물모델 실험에서 2주 동안 홍차로 14일간 발효해 동결 건조한 콤부차 분말을 처리한 결과 간, 신장, 췌장과 심장에서 활성 산소종의 생 성이 유의적으로 저해됨을 확인하였으며, 인체조직에서 작 용하는 산화방지제로 알려진 환원된 글루타티온(GSH)과 산화된 글루타티온(GSSG)의 비(GSH/GSSG)가 대조군과 유사한 수치로 회복되었음을 보여주어, 동물실험 수준에서 콤부차의 항산화 효과를 검증하였다(Bhattacharya et al., 2013). 이는 인체 내에서도 콤부차의 항산화 효과를 기대 할 수 있음을 시사하였다.
간은 에너지 대사, 독소 분해, 호르몬 대사 등 몸에서 여 러 역할을 수행하고 있으며 비만, 당뇨병, 고지혈증 등으로 인한 간 질환은 알코올성 지방간, 비알코올성 지방간이 있 다(Kim & Kwon, 2005). 지방간은 간 내 과도한 지방축적 을 특징으로 하며, 지속적인 지방축적과 지질의 과산화 등 에 따른 반응성 산소생성과 염증 증가는 간 섬유화로 인한 간 경변증이나 간암을 일으킬 수 있다(Diehl & Day, 2017;Kim & Kwon, 2005). 다수의 논문을 통해 동물모델 에 간손상을 일으킨 후 콤부차를 처리한 그룹의 혈장에서 아스파르테이트 아미노전달효소(Aspartate aminotransferase, AST), 알라닌 아미노전달효소(Alanine transaminase, ALT), 젖산 탈수소효소(Lactate dehydrogenase, LDH), 알칼리성 탈인산화효소(Alkaline phosphatase, ALP)가 감소한다는 점 을 확인하여 콤부차가 간독성을 완화하고 간세포 보호 효 과를 나타낸다는 점을 검증하였다(Murugesan et al., 2009; Abshenas et al., 2012; Kabiri et al., 2014; Ibrahim, 2013; Jayabalan et al., 2010).
Bhattacharya et al. (2011)은 홍차로 21일 동안 발효한 콤 부차의 간세포 손상 보호 효과를 알아보고자 산화스트레스 로 지질과산화를 일으키고 TBHP (tert-butyl hydroperoxide) 로 세포 독성을 유발과 세포 사멸을 일으켜 알비노 쥐의 간세포 손상을 유도한 뒤 콤부차를 처리해보았으며, 그 결 과 간세포의 ALT와 LDH 감소, 초과산화물 불균등화 효소 활성 증가, 산화스트레스 완화, caspases-3, caspase-9과 Apaf-1활성 감소를 확인하여 콤부차로 인한 apoptosis현상 저하를 확인하였다. MCD (methionine/choline-deficient)식 이로 비알코올성 지방간염을 유도한 db/db 쥐에서는 홍 차로 14일 동안 발효한 콤부차가 간세포에서의 과도한 지방 축적을 막고 베타 산화를 촉진시켜 지방구 크기를 작아지게 한다는 것을 확인하였으며, 간의 섬유화에서의 주요 활성 반응 경로인 Hedgehog signaling에서 Hedgehog receptor인 Smo의 mRNA발현가 감소하고 TNF-α, IL-1β, CXCL1, CXCL2와 같은 염증 인자 발현도 줄어들어 콤부 차의 섭취가 비알코올성 지방간염을 예방하고 치료하는 효 과가 있어 간질환 완화에 도움이 된다는 점을 시사하였다 (Lee et al., 2019; Hyun et al., 2016).
후속 연구에서 MCD식이와 홍차로 14일 동안 발효한 콤부차를 처리한 후 비알코올성 지방간염과 장내균총의 연관성을 살펴본 결과, Firmucutes 문(phylum)에 속하는 Erysipelotrichia 강(class)이 감소하고, Erysipelotrichia 강 (class)에 속하는 Allobaculum과 Turicibacter가 감소하였으 며, 이들은 장내 단쇄지방산을 생성하여 에너지대사에 영향 을 주는 것으로 알려져 있다(Jung et al., 2019). Clostridium 속(genus)은 대조군에서는 발견되지 않았지만 비알코올성 지방간염 유도 모델에서 증가하였다가 콤부차를 같이 처리 한 실험군에서 감소하였으며, 이는 Clostridium 속(genus)이 비만과 비알코올성 지방간의 심화에 연관성이 있음을 보여 준다(Jung et al., 2019). 또한, 이때 비알코올성 지방간염의 염증반응을 완화시키는 프로바이오틱스 균주 중 하나로 알 려진 Lactobacillus가 콤부차를 처리한 실험군 그룹에서 증 가하였는데, 이는 비알코올성 지방간염의 완화가 해당 균 총 변화와 연관 있음을 보여준다(Jung et al., 2019).
우리가 섭취하는 다양한 음식과 음료는 병원균, 병원성 바이러스, 독소들로 오염될 수 있으며, 병원체들은 오염 된 식품의 섭취나 교차오염 등 여러 경로를 통해 체내로 유입되어 장내에서 증식하고 대사 산물들을 생성함으로 써 세균성 식중독을 일으킬 수 있다(Daglia, 2012). 식품 안전나라 발표에 따르면, 국내 식중독 발생건수 기준 norovirus, enteropathogenic Escherichia coli, Salmonella, Bacillus cereus, Clostridium perfringens로 인한 식중독 발병이 가장 많으며, 이외에도 Staphylococcus aureus, Vibrio parahaemolyticus, Campylobacter jejuni 등이 식중독 의 원인체로 밝혀졌다(식품안전나라, 2018).
현재까지 여러 연구를 통하여 콤부차가 다양한 병원균에 대하여 항미생물적 효과를 보인다는 것이 입증되고 있다 (Steinkraus et al., 1996; Greenwalt et al., 1998; Sreeramulu et al., 2001; Ansari et al., 2017; Shahbazi et al., 2018; Battikh et al., 2013; Battikh et al., 2012). Steinkraus et al. (1996)에 따르면 Lipton 티백을 이용하여 10일 동안 발 효한 pH 2.5 콤부차로 디스크 확산 검사를(disk diffusion assay) 진행해 항균 효과를 확인한 결과, 위암의 발병의 중요 원인균 중 하나인 Helicobacter pylori에 대한 저해 환이 2 cm, Agrobacterium tumefaciens, Escherichia coli 와 Staphylococcus aureus에 대한 저해환이 각각 3.2 cm, 3.8 cm, 3.0 cm 관찰되었다. 그러나 pH 7.5의 콤부차에서는 저해환이 발견되지 않아 pH 2.5인 콤부차의 아세트산이 항균 효과를 발휘하였다고 확인하였다(Steinkraus et al., 1996). Greenwalt et al. (1998)의 연구에서는 녹차와 홍차로 9일 동안 발효한 콤부차가 Staphylococcus aureus NRRLB- 1317, Staphylococcus aureus NRRLB-1318, Escherichia coli serotype H10 NRRLB-2207, Escherichia coli serotype H48 NRRL B-3704, Salmonella enterica serotype typhimurium NRRL B-4420, Bacillus cereus NRRL B-14720, Bacillus cereus NRRLB-14725, Candida albicans NRRL Y-12983, Agrobacterium tumefaciens에 대하여 항균성을 지니는지 실 험해본 결과, Candida albicans을 제외한 모든 균들의 생 장을 저해하는 것으로 나타났다. 이 연구에 사용된 콤부차 는 약 7 g/L의 아세트산 함량을 보였으며, 중화된 콤부차에 는 이 효과가 나타나지 않았다는 점에서 Steinkraus et al. (1996)의 연구와 비슷하게 콤부차의 아세트산이 항균 효과 에 주요한 역할을 할 것이라고 결론지었다(Greenwalt et al., 1998). pH 2.5에서만 항미생물 효과를 보였던 이전 연 구(Steinkraus et al., 1996; Greenwalt et al., 1998)와는 달 리 Sreeramulu et al. (2001)의 연구에서는 Shigella sonnei, Escherichia coli, Salmonella enteritidis와 Salmonella typhimurium와 같은 주요 식중독균에 대하여 홍차를 이용 해 14일간 발효시킨 pH 7 콤부차에서도 항균효과가 나타 난 것을 확인하였다. 이는 아세트산과 같은 유기산 이외에 도 콤부차의 에탄올, 단백질과 소량의 탄닌 성분들이 함께 항미생물 효과를 상승시키기 때문이다(Sreeramulu et al., 2001). 이외에 Ansari et al. (2017), Shahbazi et al. (2018) 의 연구에서도 녹차를 이용해 각각 21, 16일 동안 발효한 콤부차가 주요한 식중독균 Staphylococcus aureus, Bacillus cereus, Escherichia coli과 Salmonella typhimurium에 대해 서 항균효과를 가진다는 점이 검증되었다. 항균 효과와 더 불어 홍차를 이용해 21일 동안 발효시킨 콤부차의 항진균 효과 연구 결과, 콤부차의 발효일수에 따라 Candida albicans, Candida krusei, Candida tropicalis, Candida parapsilosis, Candida glabrata, Candida dubliniensis, Candida sake 등과 같이 Candida 속도 항진균 효과가 있는 것으로 밝혀져 콤부차 또한 항진균 효과를 가지는 것으로 확인되 었다(Battikh et al., 2013; Battikh et al., 2012).
당뇨는 체내 대사작용이 원활히 일어나지 못해 혈당량이 높아지고 이로 인해 발생하는 체중감소, 다음(多飮), 다뇨( 多尿) 등과 같은 증상들을 일컫는다. 본래 체내 대사작용 들을 통해 혈당조절이 이루어지나, 당뇨 환자의 경우 체내 대사를 통한 당조절이 정상적으로 이루어지지 못하기에, 식이 조절을 통한 체내 유입 당량 조절이 불가피하다 (WHO, 1999). 이에 따라 혈당량 조절을 도울 수 있는 여 러가지 식품들이 연구되고 있으며, 그 중 하나로 콤부차가 있다(Zubaidah et al., 2019b).
당뇨병을 유도한 랫(rat)에게 홍차와 snake fruit을 이용해 14일간 발효시킨 콤부차를 먹였을 때, fasting plasma glucose (FPG)가 낮아졌으며(Dashti & Morshedi, 2000; Zubaidah et al., 2019a; Zubaidah et al., 2019b; Zubaidah et al., 2018a; Hosseini et al., 2016; Bhattacharya et al., 2013; Aloulou et al., 2012; Srihari et al., 2013), 혈당을 낮추는 호르몬인 인슐린을 생성하는 세포, 즉 β-pancreatic cell의 수가 증가하고(Zubaidah, 2019a; Zubaidah, 2019b), 이에 상응하는 결과로 혈중 인슐린 분비량 또한 증가하였 다(Bhattacharya et al., 2013). 또한, 고혈당이 지속될 경우 활성산소로부터 세포를 보호해주는 SOD activity가 줄어들 게 되는데(Ganjifrockwala et al., 2017), 콤부차를 먹인 당 뇨 유도 랫에서는 SOD 수치가 당뇨를 유도하지 않은 정 상 랫의 SOD 수치와 유사한 값을 보였다(Zubaida et al., 2019a; Zubaidah et al., 2019b; Zubaidah et al., 2018a). 이 뿐만 아니라, 콤부차를 먹인 당뇨 유도 랫에서 혈중 콜레 스테롤, 트리글리세라이드(triglyceride, TG), LDL (lowdensity lipoprotein)값이 감소하여 혈중 지질 성분 및 농도 가 콤부차 섭취를 통해 향상된다는 점이 여러 연구에서 확 인되었다(Zubaidah et al., 2019a; Zubaidah et al., 2019b; Hosseini et al., 2016; Bhattacharya et al., 2013;Koh & Choi, 1999, Aloulou et al., 2012).
앞서 제시한 다양한 연구들을 통해 콤부차가 당뇨병 증 세 완화 효과가 있음이 확인되었다. 콤부차에서의 페놀 화 합물과 유기산이 α-amylase와 α-glucosidase활성을 낮추고, 인슐린 수용기의 인산화를 통해 포도당이 세포로 수송되어 혈당수치를 낮출 것이라고 연구진들은 추정하였으나, 콤부 차의 어떤 성분이 어떠한 경로를 통해 당뇨증세완화 효과 를 나타내는지는 후속 연구들을 통해 더 알아보아야 할 것 으로 여겨진다(Dashti & Morshedi, 2000; Zubaidah et al., 2019a; Zubaidah et al., 2019b; Zubaidah et al., 2018a; Hosseini et al., 2016; Bhattacharya et al., 2013; Aloulou et al., 2012; Srihari et al., 2013;Koh & Choi, 1999, Aloulou et al., 2012).
염증반응은 병원균, 손상된 세포, 독소나 방사선 조사 와 같은 유해한 자극에 대한 면역 시스템의 반응으로 세 포손상을 억제하고 상처를 입은 조직을 제거함으로써 조 직을 재생하는 과정이라고 할 수 있다(Chen et al., 2017; Medzhitov, 2010). 이러한 염증반응에 대한 면역 반응은 우 리 몸의 항상성을 유지하고 급성 염증반응에 대한 손상을 회복시켜주는 중요한 방어기제라고 할 수 있다(Chen et al., 2017). 그러나 불균형한 면역반응 및 만성적인 염증반 응은 건강을 해치며 자가면역질환, 염증성 장염, 암 등의 질환을 유발시킬 수 있다(Chen et al., 2017; Zhou et al., 2016).
최근 콤부차는 항염증 효과를 가지고 있다는 연구결과가 발표된 바 있는데, Vázquez-Cabral et al. (2017)의 연구에 따르면 인체 유래 단핵구 세포인 THP-1에 염증 발현 물질 인 lipopolysaccharide (100 ng/ml)를 처리한 뒤, 홍차를 이 용해 7일간 발효한 콤부차의 항염증 효과를 실험한 결과, 만성염증과 급성 염증반응에서 주요한 염증성 사이토카인 인 tumor necrosis factor-α (TNF-α)와 인터류킨6(IL-6)의 발현이 유의적으로 감소한 것을 확인하였다. 또한, 염증 유 발 효소인 5-lipoxygenase (5-LOX)과 콤부차 농축액을 같 이 처리한 결과, 홍차를 이용해 21일간 발효한 콤부차가 유의적으로 5-LOX를 저해함을 확인해 콤부차 발효대사산 물들이 5-LOX의 저해제로 작용함을 확인하였다. 이는 비 스테로이드성 항염증제(non-steroidal drugs, NSAIDs)로의 개발 가능성을 시사하였다(Villarreal-Soto et al., 2019).
콜레스테롤은 지방의 한 종류로 우리 몸의 세포막에 필 수적이며 다양한 호르몬의 구성 성분으로 인체의 기능을 정상적으로 유지하는데 도움을 준다(Grummer & Carroll, 1988). 하지만 체내 혈중 콜레스테롤이나 중성지방의 수치 가 높을 경우, 콜레스테롤 축적으로 인한 고지혈증이 유발 될 수 있다(Varghese, 2014). 심혈관 질환 예방을 위한 치 료에서는 LDL 콜레스테롤의 저하를 최우선으로 삼으며, 많은 연구에서 LDL 콜레스테롤이 심혈관 질환에 위험인자 임이 잘 알려져 있다(Seo & Chung, 2008). Gordon et al. (1997)에 따르면, HDL(high-density lipoprotein) 콜레스테롤 의 수치가 높아질수록 성별에 관계없이 심혈관 질환의 확 률이 높았으며, LDL 콜레스테롤이 낮은 집단에서 심혈관 질환의 발생이 감소하는 양상을 보였다.
콤부차는 혈중의 총 콜레스테롤, LDL 콜레스테롤을 낮 춰주며, HDL 콜레스테롤 수치를 정상수치 범위로 유지하 도록 하여 심혈관 질환의 예방 가능성을 보여주었다. Yang et al. (2009)의 연구에 따르면, 홍차를 이용하여 8일 동안 발효한 콤부차를 섭취시킨 동물모델에서 간의 지방구 수가 유의적으로 줄어들었으며, 고지방식이를 한 동물모델의 혈 중 총 콜레스테롤 수치(11.02±0.71 mmol L−1)가 콤부차 섭 취그룹(9.04±1.34 mmol L−1)에서 유의적으로 감소하였다. LDL콜레스테롤 수치 또한 고지방식이 그룹(0.48±0.09 mmol L−1)보다 콤부차 섭취그룹(0.33±0.22 mmol L−1)에서 유의적으로 감소하여 대조군과 비슷한 수치로 회복된 것을 확인할 수 있었다(Yang et al., 2009). 이외에도 몇몇의 연 구에서 콤부차를 섭취시킨 동물모델에서 혈청의 중성지질, 총 콜레스테롤, LDL콜레스테롤의 농도 및 동맥경화지수를 낮추는 효과가 있어 콤부차가 지질대사를 부분적으로 개선 시키는 효과를 입증하였다(Bellassoued et al., 2015; Koh, 2003;Koh & Choi, 1999).
Yang et al. (2009)에 따르면, DSL을 섭취시킨 그룹 또 한 홍차를 이용하여 8일 동안 발효한 콤부차를 섭취시킨 그룹과 같은 혈중 콜레스테롤 저하 효과가 나타났는데, 콤 부차의 주요 성분인 DSL이 혈중 콜레스테롤 저하 효과에 요인이라는 것을 밝혀내었다. 혈중의 높아진 콜레스테롤 수치는 활성산소종으로 인한 조직 상피세포의 손상을 야기 시키는데(Warren & Ward, 1986), 콤부차의 항산화 효과 또한 심혈관질환의 완화에 긍정적인 효과를 발휘할 수 있 다고 설명하였으며(Yang et al., 2009), 콤부차의 어떠한 성 분이 어떤 경로를 통하여 혈중 콜레스테롤 감소 효과를 나 타내는지 추후 연구가 필요함을 강조하였다.
결 론
본 총설은 최근 해외 시장뿐만 아니라 국내 시장에서도 주목받고 있는 건강 음료인 콤부차의 역사, 제조과정, 다양 한 균총과 그 기능성을 이전의 선행 연구들을 통해서 정리 하여 알아보고, 콤부차의 제조 및 발효 조건과 접종 균총 등 여러 변인에 따라 달라질 수 있는 관능적, 미생물학적 특성을 살펴봄으로써 앞으로의 콤부차 연구에 대한 기초 자료로 활용하고자 작성되었다.
콤부차의 발효 기질은 주로 녹차와 홍차이며(Dufresne & Farnworth, 2000), 발효 기질이 무엇인지 따라서 콤부차 의 화학적 조성 및 관능적 특성이 다르다. 콤부차의 건강 기능성으로는 항산화, 간세포 보호, 항미생물, 혈당 감소, 항염증, 혈중 콜레스테롤 감소 효과가 대표적이라고 할 수 있는데, 특히 콤부차의 폴리페놀 성분으로 인한 항산화 효 과가 가장 우리 몸에 많은 영향을 주는 기능적 요소이며, 이는 다른 건강 기능성과도 큰 연관이 있다는 것을 알 수 있다.
현재까지 연구된 바에 따르면 콤부차의 건강 기능성은 앞서 언급된 효과 외에도 몸 속에서 다양한 효능이 있을 것으로 기대된다. 인공적인 감미료나 자극적인 맛에 익숙 해진 현대사회에서 콤부차와 같이 자연적인 재료로 생산된 건강 음료는 또 하나의 웰빙 식품이라고 할 수 있다. 따라 서, 콤부차의 발효 방법이나 그에 따른 발효 산물, 건강기 능성, 건강기능성 메커니즘에 대한 관련 연구가 더 많이 수행되어야 할 것이며, 콤부차는 건강 음료로 식품 영양학 적으로나 상업적으로나 다양한 방면에서 높은 성장 가능성 을 가지고 있어 지속적으로 연구할 가치가 있다.