서 론
인삼은 오가피나무과 또는 두릅나무과로 분류되는 인삼 속 식물로 panax ginseng C, A. Meyer 등 5-6종이 있으며, 이중 고려인삼인 panax ginseng C.A. Meyer는 예로부터 그 약리적 효능이 뛰어나 가장 고귀한 생약제로 사용 되었다. 인삼의 주요한 생리활성물질은 인삼사포닌(ginsenosides), polyacetylenes, 산성다당체, 인삼단백질, 페놀성 물질 등이 알려져 있다(Park,1996; Shibata et al., 1974; Yoshikawa et al., 1987). 그 중에서 인삼 사포닌은 연구에 의해서 그 화 학구조가 명확히 확인되었고(Shibata et al., 1974), 항당뇨 활성(Joo et al., 1977)을 비롯하여 항암작용, 항산화작용, 동맥경화 및 고혈압의 예방, 간 기능 촉진 및 숙취제거 효 과, 항피로 및 항스트레스 작용, 노화방지 작용, 두뇌활동 촉진, 항염증활성, 알레르기성 질환치료, 단백질합성 능력 의 촉진 등이 보고되었다(Park, 1996).
인삼의 약리효과를 나타내는 중요 물질은 ginsenoside로 이는 배당체로서 한국의 인삼에는 약 30종 이상의 ginsenoside가 들어있다. 인삼에는 간 기능 증진효과(Kwak & Joo, 1980; Jeon et al., 2005; Choi et al., 2002), 혈당의 강화작용 및 adrenaline 유발, 고혈당 억제 효과(Jung & Jin, 1996; Kim et al., 2005; Kim et al., 2009a) 등의 약 리효과가가 보고되었고, 인삼에 대한 암에 대한 유효성은 다당체 ginsan이 killer cell을 활성화시킴으로써 암세포를 사별시킬 수 있음이 보고된 바 있다(Kim et al., 1998). 인 삼의 사포닌은 저 농도에서는 혈압을 상승시키나 투여량이 많을수록 혈압을 강하시키는 효과가 있다고 보고되었다 (Jeon et al., 1999;Kang & Kim, 1992). 인삼의 산성 다 당체 성분은 비만 또는 고지혈증을 예방하고, 콜레스테롤 대사개선에도 효과가 있다고 보고하였다(Lee et al., 2008a; Kwak et al., 2000).
인삼은 전통적으로 가열처리 방법에 따라 백삼, 홍삼, 흑 삼으로 분류된다. 백삼은 수삼을 익히지 아니하고 햇볕, 열 풍 또는 기타방법으로 건조한 것을, 홍삼은 수삼을 수증기 또는 기타방법으로 찐 후 건조한 것을 말한다. 흑삼의 경 우 2011년부터 인삼 산업법에서 인삼류로 정식 분류되면서 “수삼을 수증기나 그 밖의 방법으로 쪄서 익히고 건조하는 과정을 3회 이상 반복한 것으로 담흑 갈색 또는 흑갈색을 띠는 것“으로 정의 되어있다. 흑삼은 수삼의 새로운 가공 인삼으로 반복적인 열처리와 건조공정에 의해 마이너 진세 노사이드 Rg3, Pk1, Rg5 등은 백삼과 홍삼보다 높은 함량 을 나타낸다(Jin et al., 2015). 또한 기존의 백삼이나 홍삼 에 비해서 항산화 활성, 항암 효과, 비만억제 효과, 혈당강 하 작용 등이 우수하다는 사실이 밝혀 진 바 있다(Kim et al., 2008a; Kim et al., 2009b).
최근 인삼은 다양한 제품으로 개발되고 있는데, 인삼이 나 홍삼에 효소를 이용한 발효를 통해서 특이 사포닌을 강 화시킨 발효인삼제품(Kong et al., 2008; Park et al., 2006), 인삼을 압출성형 시켜 농축액 제조시 전분질의 수 용화를 기할 수 있는 팽화홍삼 등(Kim et al., 2008b)의 제 품으로 개발되고 있다.
이러한 공정 방법들 중 압출성형 처리는 혼합, 가열, 성 형 등과 같은 공정으로 구성되어 다른 처리 방법과 비교 시 빠른 시간에 수행할 있는 효율적인 공정이며(Son & Ryu, 2009), 인삼 분말을 압출성형 처리를 하면 전분 분자 붕괴가 극대화되어 인삼 추출액의 침전 물질인 전분을 수 용화 할 수 있고, 인삼세포벽의 붕괴를 유발하여 산성다당 체 등과 같은 성분의 용출이 용이하여 그에 따른 수율을 높일 수 있을 것으로 기대된다.
백삼의 압출성형에 대한 연구는 압출성형 삼과 백삼, 홍 삼의 화학성분의 차이(Ha & Rhy, 2005)에 관한 연구가 있 었으며, 압출성형 조건에 따른 압출성형물의 침출속도 및 침전물의 특성에 관한 연구가 있었다(Hong et al., 2007).
홍삼제조 공정에서 단위공정인 증삼, 가열, 건조를 압출 성형공정을 이용할 경우 가열, 찌기 이외의 압력과 전단력 이 홍삼원료인 수삼에 적용하게 된다. 압출성형물의 성질 은 원료의 투입속도, 수분함량, 스크류 회전속도, 사출구와 스크류의 제원과 같은 공정변수의 조절에 따라 제어가 가 능하므로 수삼을 압출 성형할 경우 이와 같은 공정변수의 조절을 통해 압출성형 수삼의 특성변화가 가능할 것이다.
기존의 압출성형 연구 결과는 실험실 수준에서 압출성형 을 한 결과로서 본 연구에서는 본 대학의 extrusion 연구소 가 운영하는 pilot-sacle 설비인 TX-57 extruder (TX-57, Wenger Company, Sabetha, KS, USA)를 활용한 연구를 수 행하였다. Pilot-scale extruder TX-57은 생산량이 400- 800 kg/h인 pilot-scale 설비이다. 또한 압출성형전 원료전처 리가 가능한 preconditioner (DDC)를 사용함으로써 보다 효율적인 공정이 가능하다.
Extruder scale up 실험을 통해서 생산된 결과물의 특성 을 비교하여 산업화 가능성을 비교 검토하였다.
재료 및 방법
원료 수삼은 세척 후 24시간 60°C에서 건조 후 분쇄기 에서 50 mesh 분쇄하여 사용하였다. 원료 현미는 수삼과 마찬가지로 24시간 60°C에서 건조 후 분쇄기에서 50 mesh 분쇄하여 사용하였다. 이후, 분쇄된 건조 수삼과 현미를 Vmixer를 이용하여 1:9의 비율로 혼합하여 압출성형 원료로 사용하였다. 수삼 건조 분쇄물과 현미를 혼합한 것은 원료 투입량이 많아 현미를 혼합한 것이고, 이후 스낵 개발에도 활용하고자 현미 건조 분쇄물을 혼합하여 사용하였다.
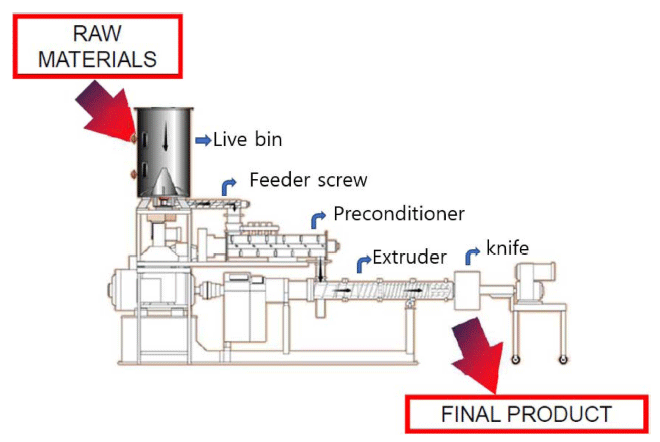
전주기전대학 extrusion 연구소에서 운영하는 extruder (TX-57, Wenger Company ,Sabetha, Kansas, USA)를 사용 하였다(Fig. 1).
파일럿 스케일 쌍축 압출성형기의 제원으로 생산량은 400-800 kg/h이고, live bin은 원료공급(일정한 흐름으로 원 료 투입 준비, 밀도측정 가능)장치이며 feeder screw는 일 정한 속도로 원료를 투입 한다.
Preconditioner (DDC: differential diameter cylinder)는 원 료입자 수화(hydration), 원료입자가열, 원료 혼합(수분첨가 방식: 수증기, 물 가능) 등의 기능을 한다.
쌍축 압출성형기는 바렐을 이용하여 외부 가열 및 냉각 을 한다. 나이프(knife)는 제품을 커팅 하면서 모양을 조절 한다.
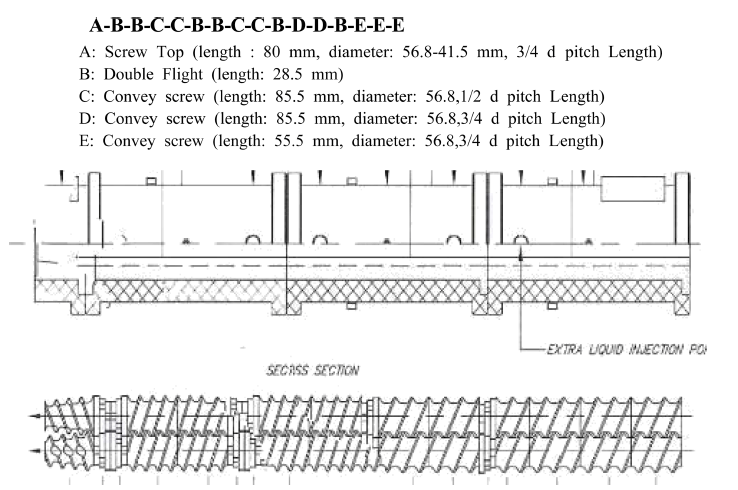
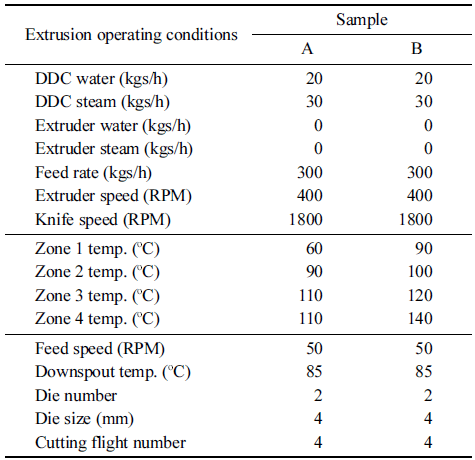
자동운전 시스템은 extruder 작동조건을 조절하는 자동화 장치이다. 파일럿 스케일 쌍축 압출성형기의 스크류 조합 은 Fig. 2와 같다. 파일럿 스케일 쌍축 압출성형기의 작동 조건은 Table 1과 같다.
시료 약 1 g을 정밀히 달아 250 mL 환류용 플라스크에 취한 후, 50% 메탄올 용액 50 mL를 가하여 70-80°C 수욕 에서 1시간 환류 냉각한다. 이후 식히고, 원심분리한 다음 상등액을 환저플라스크에 취한다. 잔류물에 대해서 1회 더 반복한다. 환저플라스크에 옮긴 상등액을 수욕중에서 60°C 이하에서 감압 농축 한다. 농축물을 증류수:아세토니트릴 혼합액(80:20) 2 mL에 용해한다. 멤브레인 필터(0.45 μm)로 여과하여 시험용액으로 사용 하였다.
시료 약 2 g을 정밀히 달아 50 mL 부피 플라스크에 취 한다. 완전히 용해시킨 후 증류수를 표선까지 채운다. 멤브 레인 필터(0.45 μm)로 여과하여 시험용액으로 사용하였다.
시료 3-4 g을 분액여두에 취하고 n-hexane 100 mL 및 70% 메탄올 100 mL를 가하여 3시간동안 진탕 추출한다. 층이 완전히 분리될 때까지 정치한 다음 하층을 환저플라 스크에 취하여 수욕중에서 감압 농축한다. 농축물을 증류 수 10 mL에 용해시킨다. 멤브레인 필터(0.45 μm)로 여과하 여 시험용액으로 사용하였다.
결과 및 고찰
압출성형 시료 A와 B의 평균 직경과 단면의 길이는 Table 4와 같다.
즉, 높은 바렐 온도에서 작동하여 만든 시료 B는 보다 큰 직경과 단면 길이를 나타내고 extruder 바렐 온도가 증 가할수록 팽화율이 증가 하는 결과를 나타냈다.
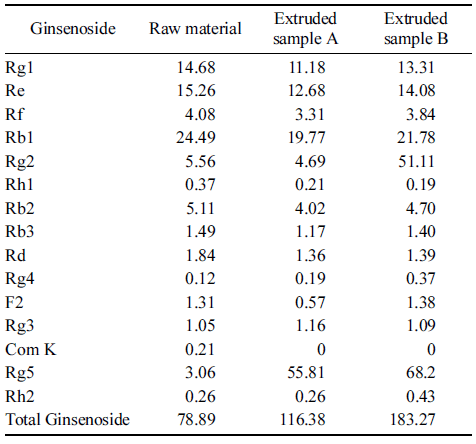
시료의 성분 분석 결과는 Table 5와 같다. 일반적으로 식물의 세포벽은 셀룰로오즈, 헤미셀룰로오즈, 펙틴, 리그 닌, 다당류 등의 고분자 물질로 구성되어 있으며, 이들 각 각의 성분들이 상호간에 이온결합, 공유결합, 수소결합 등 을 통해 서로 치밀한 결합조직을 이루고 있다. 따라서 인 삼 중 유효성분을 최대한 용출시키기 위해서는 인삼을 구 성하고 있는 세포벽의 강한 결합조직을 약화시켜 용매에 의해 용출시키는 것이 좋으며, 특히 세포벽을 수용화시키는 방법에는 화학적으로 산 또는 알칼리를 사용하거나 효소 처리하는 방법, 물리적으로 autoclaving, popping, blanching, extrusion하는 방법이 알려져 있다(Hwang et al., 1994).
압출성형 공정은 혼합, 분쇄, 가열, 성형, 건조와 같은 단 위조작 과정을 거치며 짧은 시간에 일련의 공정이 이루어 지므로 효율적이고 경제적이다. 압출성형 공정 중에 발생 하는 고열, 고압, 고전단력에 의해 고밀도 조직이 팽화하여 밀도가 낮아지고 내부에 기공이 형성되어 부드러운 조직이 되면서 표면적이 증가하여 용매와 이온 교환력이 향상되고 용해도가 높아지고 유효성분이 확산속도가 증가한다. 특히, 수용성 성분의 용출이 용이해져 각종 유효성분의 추출수율 이 증가하는 것으로 보고되었다(Yoon et al., 2005; Rhy et al., 2012).
Table 5의 분석 결과에서 Rg2와 Rh2의 함량이 시료 B 에서 높게 나타났다. 선행 연구 결과(Rhy et al., 2012)에 서 백삼보다 압출성형 온도가 높은 압출성형물에서 함량이 증가하는 결과와 일치한다.
즉, 이러한 결과는 protopanaxatriol (PT)계 사포닌인 Re 는 C-20의 위치에 glucose 1분자와 C-6 위치에 glucose와 rhamnose 1분자 씩을 가지고 있는데 C-20 위치의 glucose 는 산 또는 열에 의해 쉽게 분해되어 Rg2로 전환된다.
백삼이 압출성형 공정을 거치면서 물리적 에너지에 의해 고온 고압 처리되므로 백삼의 Re가 분해되어 Rg2로 전환 된 것으로 생각된다.
PT계 사포닌인 Rb2는 C-20 위치에 2개의 당과 결합하 고 있으며 C-3 위치에 2개의 glucose와 결합하고 있다. C- 20 위치의 당은 산 또는 열에 의해서 쉽게 분해되어 Rg3 를 생성하며 분해가 더욱 지속되면 Rh2로 전환된다는 결 과(Rhy et al., 2012)와 일치한다.
이상의 실험에서 인삼 중의 PD계 사포닌인 Rb2는 압출 시 가해지는 물리적 에너지에 의해 생성된 고온 고압에 의 해 C-20 위치의 당 부위가 가수분해 되어 Rg3를 생성하고 더 나아가 C-3 위치의 glucose 분자까지도 부분적으로 분 해시켜 Rh2로 전환되는 것으로 생각된다.
수삼을 쪄서 건조한 홍삼은 열에 의해서 생성되는 홍삼 특유의 성분인 Rg2, Rg3, Rh1, Rh2 등이 암 예방작용, 암 세포성장 억제작용(Keum et al., 2000; Kim et al., 1999b), 혈압강화 작용(Kim et al., 2000), 뇌신경세포 보호작용 (Bao, 2005), 항 혈전작용(Jung et al., 1998), 항 산화작용 (Keum et al., 2000)이 있다고 하여 홍삼만의 장점으로 주 목받고 있다.
홍삼 특유의 성분인 인삼사포닌 배당체가 열에 의해서 가 수 분해되어 생성되는 prosapogenin 형태의 인공물인데, 최 근에 열이나 압력과 같은 물리적 방법(Kwon et al., 2001) 과 효소를 이용한 생화학적 방법(Hasegawa et al., 1996; Hasegawa et al., 1997)에 의해서 고농도 인삼 prosapogenin 제재가 개발되고 있다.
홍삼 가공 시 찔 때 열에 의해서 생성되는 인공물인 진 세노사이드로서 주름 개선효능(Jeung et al., 2007)이 알려 진 진세노사이드 Rg2로 보고되었고, 홍삼 특유성분으로 항 암작용(Keum et al., 2003), 혈압강하작용(Kim et al., 1999a), 뇌신경 보호 작용(Yang et al., 2009), 항 혈전작용(Lee et al., 2009), 항산화작용(Keum et al., 2000)을 나타내는 진 세노사이드 Rg3의 연구결과가 있다.
특히, 흑삼의 주요 함유 성분인 진세노사이드 Rg5의 경 우 압출성형에 의해서 많은 함량의 증가를 보였다. 이러한 결과는 선행 연구결과와 유사한 결과를 나타낸다(Lee et al., 2012).
본 실험에 사용한 pilot-scale twin-screw extruder는 압출 성형전에 preconditioner (DDC)에서 steaming 처리에 의하 여 가열을 함으로써 인삼의 유효성분 함량이 증가하는데 많은 도움을 줄 수 있다. 이는 스팀처리 하지 않은 인삼의 ginsenoside 조성은 Rb1, Rb2, Rb3, Rc, Rd이며, 스팀 처 리 후 Rg3, Rg5, Rk1 나아가 Rh2, Rh3, Rk2 등 진세노 사이드 함량이 높은 홍삼을 나타낸 연구 결과(Wang et al., 2016)와 유사한 결과를 나타냈다.
Pilot-scale twin-screw extruder는 steaming에 의한 예비 가열과 extruder에서의 가공 공정으로 스팀처리와 extrusion 처리를 병행하여 공정이 진행되어 효과적인 공정으로 사용 될 수 있다.
압출성형 백삼에서 PT계 사포닌인 Re는 압출온도가 높 을수록 함량이 낮아진 반면, Re의 가수분해로 생성되는 Rg2의 함량이 지속적으로 증가하였다는 결과(Ryu, 2010)와 일치한다. Rh2 또한 압출 온도의 상승과 더불어 함량이 증가함을 알 수 있었다. Rg4와 Rg5에도 백삼보다 압출성 형 온도가 높은 압출성형물에서 함량이 증가하는 결과를 보였다.
이상의 결과에서 압출성형을 통하여 향후 제품 개발 시 높은 추출수율, 사포닌 량이 높은 제품을 만들 수 있는 가 능성을 보여주는 결과라 생각된다.
본 실험에서 흑삼에 존재하는 Rg5의 함량이 압출성형물 에서 많이 증가함을 알 수 있다. 이는 선행 연구(Lee, 2014) 의 결과와 일치하는 것으로 흑삼의 제조 특성 결과와 유사 한 결과를 나타냈다. 구증구포 후 함량 증가가 현저한 Rg5는 항염증 작용(Nah et al., 1997) 등의 약리효능을 가 지는 것으로 보고되었다. 특히, 흑삼의 연구에서 전염증성 매개체 및 사이토카인의 발현에 대해 더 우수한 억제효과 를 나타냈다(Lee, 2017). 이들 결과를 종합해 볼 때 흑삼 이 상대적으로 우수한 항염증작용 및 항통증작용을 나타 낸다.
본 실험의 결과는 pilot-scale twin-screw extruder 활용 시 흑삼의 특징적인 유효성분을 높일 수 있는 가공 공정으 로 활용이 가능함을 보여주는 결과라 사료된다.
요 약
압출성형 결과 최근 관심이 많은 구증구포 흑삼에 함유 되는 진세노사이드인 Rg2, Rg5 등의 함량이 바렐온도가 높은 조건에서 매우 많이 증가되는 결과를 볼 수 있다 기 존의 연구는 실험실 수준의 압출 성형기를 사용하였으나 산업화가 가능한 pilot-scale 설비를 사용하여 scale-up 공정 의 가능성을 확인하였다. 또한 preconditioner를 활용하여 압출성형 전에 수증기에 의한 수화 및 열처리를 통해서 보 다 효율적인 인삼 가공공정이 가능한 공정으로 운영하였다. 압출성형 결과 최근 관심이 많은 구증구포 흑삼에 함유되 는 진세노사이드인 Rg2, Rg5 등의 함량이 바렐온도가 높 은 조건에서 매우 많이 증가되는 결과를 볼 수 있다. 이는 pilot scale twin-screw extruder 설비를 활용한 공정이 인삼 의 가공 공정으로 산업화에 유용하게 사용될 수 있는 결과 라 사료된다.