서 론
최근 생활수준의 향상에 따른 식생활 패턴의 서구화로 인해 심혈관계 질환과 호르몬 관련 질환이 증가하고 있어 웰빙(wellbeing) 식생활에 대한 관심이 증가되고 있다(Kim, 1989). 미국 Health 잡지가 2006년 조사한 세계적인 건강 식품 5가지 중 3가지가 장류, 김치, 요구르트(yogurt)로 선 정되어 국제적으로 발효식품이 건강식품으로 인식되고 있 다(Park, 2012). 요구르트는 우유를 Lactobacillus bulgaricus (L. bulgaricus), Streptococcus thermophilus (S. thermophilus), Lactobacillus acidophilus (L. acidophillus)와 같은 유산균 의 발효에 의해 lactate, peptone, peptide 등의 미량활성물 질의 생성과 유산균의 장내 증식을 통한 정장 작용, 장내 유해 세균의 생육 억제, 설사와 변비의 개선, 유당 불내증 개선, 혈중 콜레스테롤 저하, 면역 증진 및 항암작용 등과 같은 다양한 건강기능성을 가지고 있는 식품으로 보고된 바 있다(Kim & Ko, 1990;Hood & Zoitola, 2006;Ko et al., 2008;Kim et al., 2009;Hwang et al., 2013;Sung & Choi, 2014). 하지만 한국소비자원에서 2015년에 국내에서 판매되고 있는 요구르트의 당류 함량을 조사한 결과 1회 제공량(150 mL)당 5.79-21.95 g 수준으로 평균 14.52 g 정 도가 함유되어 있어 평균 당류 함량이 WHO (World Health Organization)의 1일 섭취 권고량(50 g)에 29.0%나 차지하고 있으며, 특히 당이 높은 상위 4개 제품의 평균 당류 함량은 무려 40.2%를 차지하고 있는 것으로 보고하 였다(Kim, 2015). 우유를 가공하여 만든 요구르트의 특성 상 천연당인 유당이 함유되어 있는 것은 당연하나 대부분 의 조사 대상 제품에서는 제조 시 백설탕, 액상과당 등 정 제당을 첨가하여 당 함량이 현저히 높아진 것으로 알려져 있다. 최근 비만, 당뇨병, 고혈압, 고지혈증 등 대사증후군 환자수가 급격히 증가하고 있으며 그 원인으로 운동부족과 식이에 있어서 지방 및 당의 과다 섭취를 들 수 있는데 소비자들이 건강을 위해 유산균을 섭취하고자 선택하고 있 는 농후발효유가 오히려 당류 섭취를 늘리고 있는 결과를 초래하고 있다(Zhang et al., 2016). 이에 대한 대책의 하나 로 당류 저감화 정책이 펼쳐지고 있으며, 2014년 WHO는 설탕 섭취량을 하루에 5% 미만으로 조절할 것을 권고하였 다. 요구르트의 제조 시 단맛을 내기 위해 설탕을 주로 사 용하고 있으나, 다양한 생활습관병의 원인으로 설탕이 지 목되면서 이를 대체할 수 있는 대체감미료에 대한 요구가 증가하고 있다(Kim & Lee, 2016). 설탕은 체내 흡수가 빨 라 당뇨병의 원인 물질로 알려져 있고(Lee & Woo, 2001), 과다 섭취 시 비만이 유도될 수 있으며(Ludwig et al., 2001), 정상 아동에 비하여 설탕의 섭취량이 유의적으로 높은 아동이 주의력 결핍 과잉 행동 증후군(Attention Deficit Hyperactivity Disorder, ADHD)을 보인다는 연구 결과도 있다(Chung & Park, 1995).
설탕 대체 감미료는 칼로리가 낮고, 소량으로도 설탕의 단맛을 대신할 수 있다는 장점이 있으나, 적용하는 식품에 따라서는 설탕에 비해 기호성이 떨어질 수 있어 다양한 식 품에 활용하기 위해서는 많은 연구가 필요하다(Kim & Lee, 2012). 천연 당류 중 하나인 타가토스(tagatose)는 과 일, 우유, 치즈 등에 미량 존재하며 C-4 위치에서 과당의 epimer인 단당류로 백색, 무취의 비 흡습성 결정체로 설탕 대비 92%의 감미도를 가지며, 설탕보다 부드럽고 깔끔한 맛을 가지고 있으면서 칼로리가 설탕이 4 kcal/g에 비해 1.5 kcal/g으로 설탕의 1/3이며, 혈당지수(Glucose Index, GI) 값은 3으로 68인 설탕이나 24인 과당에 비해 매우 낮아 건강에 도움을 주는 유익한 물질로 알려져 있다(Livesey & Brown, 1996;Kang et al., 2013). 또한 타가토스는 체 내에서 거의 대사되지 않고, 과량을 섭취해도 설사를 유발 하지 않으며(Roh et al., 1999), 장에서 탄수화물이 포도당 으로 분해되는 것을 감소시켜 탄수화물의 흡수를 억제할 뿐만 아니라, 간에서 포도당이 글리코겐으로 전환되는 것 을 도와서 혈당이 상승하는 것을 억제하는 효과가 있는 것 으로 알려져 있으며(Donner et al., 1996;Kang & Lee, 2016), 타가토스를 섭취한 당뇨병 환자의 혈당이 낮아졌다 는 보고도 있다(Chiu et al., 2011). 안전성에 있어서도 이 미 미국 FDA에서 GRAS (Generally Recognized As Safe) 원료로 식품에 사용 가능하게 되었고, 2004년에는 WHO의 JECFA (Joint FAO/WHO Expert Committee on Food Additives), 2006년부터는 유럽식품안전국(EFSA)에서 식품 에 사용이 허가되었으며 국내에서도 2011년도에 한국식품 의약품안전처(KFDA)로부터 기능성과 안전성을 인정받았 다. 다양한 건강 기능성을 가지고 있는 타가토스는 설탕과 매우 유사한 단맛을 가지고 있기 때문에 여러 제품 적용 시 건강과 맛을 동시에 만족시킬 수 있으며 비만과 당뇨병 과 같은 현대사회의 질병환자에게 설탕을 대체할 수 있는 저칼로리 대체 감미료로서 활용가치가 높다(Livesey & Brown, 1996;Buemann et al., 1999;Ryu et al., 2003). 또한 타가토스는 열과 pH에 대한 안정성이 우수하며 설 탕과 같은 볼륨감, 조직감, 맛 등을 부여할 뿐만 아니라 prebiotics와 probiotics의 조합인 synbiotics의 특징을 나타 내어 장내 유용 균총의 성장 촉진에 상승효과를 나타내고, 이들의 probiotic 작용을 증진시키는 특징을 가지고 있어 설탕 대신 제과, 제빵, 아이스크림, 요구르트 및 유제품 등 에 사용될 수 있다(Ryu et al., 2003;Koh & Seung, 2013). 현재까지 타가토스에 관련된 대부분의 연구는 타가토스의 생산을 위하여 생물학적 제조법에 관해 많은 관심이 집중 되어 있었으며(Cheetham & Wootton, 1993;Rhimi et al., 2011;Men et al., 2014). 나아가서 일부 연구 그룹으로부 터 타가토스의 기능성에 대한 연구가 제한적으로 이루어지 고 있었다(Jørgensen et al., 2004). 하지만 타가토스의 식품 첨가에 대한 연구는 음료수에 관한 것이 주를 이루고 있 으며(Bell, 2015), 타가토스를 이용한 제품 제조에 있어서 타가토스가 미치는 영향에 대한 검토는 거의 이루어져 있 지 않고 있는 실정이다. 향후 타가토스가 저칼로리 감미 료로서 다양한 식품에 설탕을 대체하여 적용될 수 있다는 점을 고려한다면 타가토스를 식품에 적용하기 위한 연구는 매우 필요할 것으로 예상할 수 있다(Swanson et al., 1992;Storlien et al., 1993;Martinez et al., 1994).
따라서 본 연구에서는 설탕을 천연감미료로 대체하여 설 탕 대체제의 이용을 검토하기 위한 방안 및 당에 대한 부 담감을 줄여 대사성 증후군이나 당뇨병을 가진 환자들이 섭취할 수 있는 요구르트를 개발하고자 하는 일련의 연구 로서 설탕과 유사한 단맛을 가지며, 저칼로리, 저혈당지수, 다양한 기능성과 synbiotics 효과도 가지고 있는 타가토스 의 첨가가 S. thermophilus와 L. bulgaricus를 이용한 요구 르트의 발효 과정 및 제품의 품질 특성에 어떠한 영향을 미치는지를 알아보고자 하였다.
재료 및 방법
요구르트의 제조에 사용된 주재료인 우유(Seoul milk Co., Seoul, Korea), 타가토스(tagatose, CJ Cheiljedang, Incheon, Korea), 백설탕(sucrose, CJ Cheiljedang, Incheon, Korea) 은 시판품을 구입하여 사용하였다. 요구르트 제조에 사용 된 균주는 Lactobacillus delbrueckii subsp. bulgaricus (이 하 L. bulgaricus)와 Streptococcus thermophilus (이하 S. thermophilus) 2종의 균주를 중앙대학교(Ansung, Korea)에 서 분양 받아 사용하였으며, 보존용 배지로는 Lactobacilli MRS broth 배지(Difco Laboratories, Becton, Dickinson and Company, Sparks, MD, USA)를 사용하여 37±1°C, 24 시간 동안 2회 계대 배양하여 종균으로 사용하였다. 1차 균주 배양은 5.2% MRS 배지에 0.2% 접종하여 37°C에서 24시간 배양하였으며, 같은 조건에서 2차 계대 배양한 균 주를 요구르트 제조의 스타터로 사용하였다.
우유 60 mL에 7%의 타가토스(tagatose), 설탕(sucrose), 또는 타가토스와 설탕의 혼합물(1:1)을 첨가하여 마그네틱 교반기(Hot Plate & Magnetic Stirrer, Misung Scientific Co., Yangju, Korea)를 사용하여 교반 후 90°C에서 30분간 살균한다. 살균된 믹스가 40-45°C 정도로 냉각되었을 때 유산균(S. thermophilus or L. bulgaricus)을 접종한 뒤 37°C incubator에서 24시간 발효한 후 starter culture로 사 용하였다. 요구르트 제조를 위하여 우유 500 mL에 7%의 타가토스(tagatose), 설탕(sucrose), 또는 타가토스와 설탕의 혼합물(1:1)을 첨가한 후 마그네틱 교반기에서 교반 후 살 균하였다(90°C, 30 min). 살균이 끝나면 40-45°C 사이로 냉각시킨 샘플에 앞서 제조한 starter culture 50 mL를 혼 합하였다. 같은 방법으로 타가토스 첨가 유무와 접종 균 주에 따라 6가지 샘플(SST: sucrose with S. thermophilus, SLB: sucrose with L. bulgaricus, TST: tagatose with S. thermophilus, TLB: tagatose with L. bulgaricus, STST: sucrose + tagatose with S. thermophilus, STLB: sucrose + tagatose with L. bulgaricus)을 37°C incubator에서 24시간 동안 발효시키면서 6시간마다 샘플을 채취하여 pH, 적정 산도, 당도, 생균수를 측정하였고, 색의 변화를 알아보기 위하여 발효 전과 후에 색도를 측정하였으며 발효가 끝난 후에는 4±2°C 냉장고에서 48시간 동안 보관 후 관능검사 를 실시하여 비교하였다.
요구르트의 pH는 pH meter (Orion 3 star, Thermo Scientific Inc., Beverly, MA, USA)로 24시간 발효시키는 동안 6시간 간격으로 측정하였으며, 적정산도는 Jeon et al. (2005)의 방법에 따라 요구르트 10 mL를 100 mL 메스플라 스크에 정용한 후 그 중 20 mL를 취하여 페놀프탈레인 지 시약 2-3방울을 넣고 0.1 N NaOH로 적정하여 측정하였으 며 적정에 사용된 0.1 N NaOH의 소비 mL수를 다음의 계 산식을 이용하여 젖산으로 환산하였다.
당도는 굴절당도계(Master-M Series, ATAGO Co. Ltd., Tokyo, Japan)의 프리즘에 샘플 2-3 방울을 떨어뜨려 프리 즘 덮개를 닫은 후 접안렌즈를 통해 눈금을 읽어 측정하였 으며 유산균 접종 후 6시간 간격으로 24시간 동안 측정하 였다. 색도는 유산균 접종 직후와 24시간 동안 발효 후 각 각의 시료를 색차계(CM-5, Konica Minolta, Tokyo, Japan) 를 사용하여 L값(lightness), a값(+red/-green), b값(+yellow/- blue)으로 나타내었다. 모든 실험은 3회 반복 측정하여 평 균값과 표준편차로 나타내었다.
배양 중 유산균수의 변화에 대한 측정을 위하여 24시간 동안 배양하면서 각 6시간마다 채취한 시료를 멸균 생리식 염수에 넣고 균질화 한 후 십진 희석법으로 희석하여 희석 배수 별로 petri dish에 분주하고, MRS agar 배지를 이용 하여 37±1°C에서 48±1시간동안 배양 후 균수를 계측하여 30-300 colony가 나타나는 평판을 선택하여 산출하였다.
관능평가는 50명의 일반 패널을 대상으로 본 실험의 목 적과 평가 방법 및 측정 항목에 대해 충분히 설명한 후 실시하였다. 냉장 온도(4±2°C)에서 2일간 보관한 요구르트 를 50명의 패널들에게 강도 및 기호도에 대해 평가하였다. 강도에 대한 평가항목으로는 색(color), 풍미(flavor), 신맛 (sourness), 단맛(sweetness), 후미(aftertaste), 걸쭉한 정도 (thickness)에 대하여 1점으로 갈수록 약하게 표현하고 9점 으로 갈수록 강하게 느끼는 것으로 표시하도록 하는 9점 척도법으로 평가하도록 하였다. 또한 기호도에 대한 평가 항목으로 외관(apparence), 풍미(flavor) 맛(taste), 조직감 (texture) 및 전반적인 기호도(overall acceptability)에 대해 좋아하는 정도를 9점 척도를 이용하여 평가하였다.
결과 및 고찰
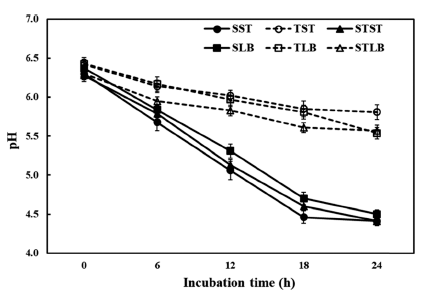
요구르트의 발효 중 pH는 발효 진행 상황, 성분 변화 및 산미 정도를 알 수 있는 중요한 품질 지표로서 활용되 고 있다(Yang et al., 2010). 우유에 타가토스 또는 설탕을 첨가한 시료에 S. thermophilus나 L. bulgaricus를 접종한 후 24시간 동안 발효시키면서 6시간 간격으로 pH의 변화 에 대하여 측정한 결과를 Fig. 1에 나타내었다. 모든 요구 르트는 배양시간이 증가함에 따라 pH가 감소하는 경향을 보였지만 타가토스 첨가량 및 균주에 따라 그 감소 정도에 차이가 있었다. Chamber (1979)는 양질의 요구르트를 생산 하기 위한 적정 pH가 3.27-4.53이라고 하였는데, 설탕을 첨가하여 발효시킨 경우 모두 발효 24시간 후에는 pH 4.5 근처에 도달하였지만, 타가토스만을 첨가하여 발효시킨 경 우 균주에 상관없이 모두 배양 24시간 후 pH가 5.6 이상 에 머무르는 결과가 나타났다. 설탕과 타가토스를 혼합 첨 가하여 발효시킨 경우 S. thermophilus는 설탕 첨가구(대조 구)와 유사하게 배양 18시간 이후부터 적정 pH에 근접할 수 있었지만 L. bulgaricus를 접종한 요구르트는 타가토스 첨가구와 마찬가지로 24시간 내에 적정 pH에 도달하지 못 하였다.
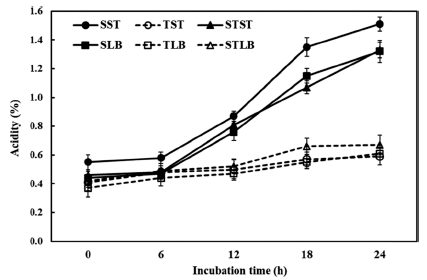
적정산도로 나타내어지는 젖산 생성량의 변화 역시 pH 변화와 유사한 경향을 보였는데(Fig. 2), 일반적으로 발효 유의 산도가 1.0-1.1%일 때 가장 좋은 품질을 나타내며, 한국인의 기호에 맞는 발효유의 적정산도는 0.85-1.20%라 는 보고된 바 있다(Shin et al., 1993;Lee et al., 2006). 설 탕만을 이용하여 발효시킨 요구르트는 S. thermophilus와 L. bulgaricus 접종 직후 0.44%였던 산도가 배양 6시간 후 부터 급격히 증가하여 발효 12-18시간 사이에 한국인의 기 호에 부합하는 0.85% 이상을 나타내었으며, 24시간 후에 1.51%의 산도를 나타낸 것과 달리, 타가토스만을 첨가하여 발효를 진행한 요구르트는 산도가 증가하지 않았으며 (0.59%), 양질의 요구르트를 생산할 수 있는 산도에 도달 하지 못하였다. L. bulgaricus로 발효시킨 타가토스와 설탕 혼합 첨가구는 24시간 내에 적절한 산도에 도달하지 못하 였으며, S. thermophilus로 발효시킨 경우 대조구와 유사하 게 적절한 산도에 도달할 수 있었다.
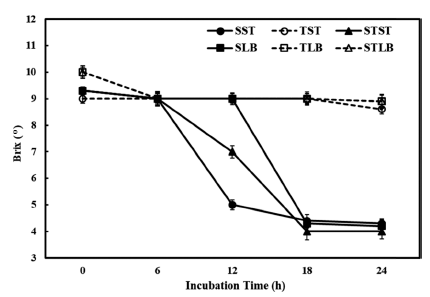
굴절당도계를 이용하여 측정한 요구르트의 발효 중 당도 변화의 결과를 Fig. 3에 나타내었다. 양질의 요구르트를 생 산하기에 적절한 pH 및 산도에 24시간 내에 도달하지 못 하였던 타가토스 첨가구(TST, TLB) 및 L. bulgaricus로 발 효시킨 설탕과 타가토스 혼합 첨가구(STLB)는 당도의 감 소 정도 역시 미미하였다(8.6 °Brix) 반면에, S. thermophilus 로 발효시킨 대조구(SST)의 당도는 6-12시간 사이에 급격 하게 감소하였으며, 설탕과 타가토스 혼합 첨가구(STST) 의 경우 6시간 이후부터 감소가 이루어지기 시작하여 18 시간까지 지속적인 감소가 나타났다. L. bulgaricus로 발 효시킨 설탕 첨가 요구르트(SLB)의 경우에 12시간까지는 변화가 거의 없다가 12-18시간 사이에 급격히 감소하였으 며, 접종 전 9.5 °Brix 이었던 당도가 배양 18시간에는 4.2 °Brix로 감소하였다. 요구르트의 발효 중 pH, 적정산도, 당도 변화에 대한 결과를 종합해 보았을 때, 유산균의 경 우 S. thermophilus가 L. bulgaricus보다 발효속도가 빨랐으 며, 두 유산균 모두 타가토스만을 이용해서는 정상적인 젖 산 발효가 일어나지 않은 것으로 보인다. 전체 유산균 중 약 5-10% 정도만이 타가토스를 이용할 수 있으며, Lactobacillus casei, Lactobacillus rhamnosus, Lactobacillus paracase는 타가토스를 이용할 수 있는 주요 유산균주로, Bifidobacterium 속은 타가토스를 이용할 수 없는 유산균주 로 보고되었다(Bertelsen et al., 2001;Kim, 2012b). 하지만 Bertelsen et al. (2001)은 S. thermophilus와 L. bulgaricus 의 경우에는 같은 균주라도 유래된 곳에 따라 타가토스를 이용할 수 없는 균주도 존재한다고 보고하였다.
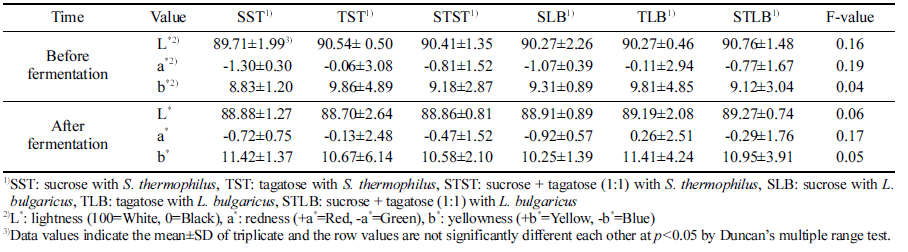
타가토스 또는 설탕을 첨가한 요구르트의 색 차이를 알 아보기 위하여 명도(L*: lightness), 적색도(a*: redness), 황 색도(b*: yellowness)를 색차계를 이용하여 3회 반복 측정 하여 평균값과 표준편차를 Table 1에 나타내었다. 색도는 요구르트의 선택과 품질에 큰 영향을 미치는 것으로 중요 한 특성 중에 하나인데(Han, 2005) 타가토스 또는 설탕을 첨가한 요구르트의 발효 전후의 색도 측정 결과를 비교해 봤을 때 명도(L*값)와 적색도(a*값)에서는 거의 차이를 보 이지 않았으나 황색도(b*값)의 경우 발효 후 모든 시료에서 증가하는 것으로 나타났다. 또한 요구르트의 발효 전후에 타가토스 첨가구와 대조구 사이에는 L*값, a*값, b*값 모두 유의적인 차이가 나타나지 않았다. Lee et al.(2017)의 연구 에 따르면, 다쿠아즈 제조 시 설탕을 대체한 타가토스 첨 가량이 증가할수록 적색도는 증가하였으며, 메일라드 반응 에 의한 갈변이 그 원인이었는데, 본 연구에서 사용한 요 구르트는 상대적으로 수분함량이 높고 메일라드 반응의 영 향을 적게 받는 낮은 온도에서 발효가 진행되었기에 타가 토스 유무에 따른 요구르트의 색상 변화가 없는 것으로 생 각된다. 따라서 타가토스의 첨가로 인한 색의 변화가 없어 요구르트 품질의 결정과 소비자들의 선택에 있어 색의 영 향은 없을 것으로 판단된다.
|
요구르트의 발효 과정 중 유산균수는 0, 6, 12, 18, 24시 간 배양할 때의 유산균수를 측정하여 Table 2에 나타내었 다. 배양 6시간에는 S. thermophilus를 접종한 경우에는 유 의적 차이가 나타나지 않았지만 L. bulgaricus의 경우에는 타가토스 첨가구가 1.03×105CFU/mL로 6.13×105CFU/mL 인 대조구의 경우보다 생균수가 유의적으로 적게 나타났다. 배양 12시간에서는 타가토스 첨가구가 대조구인 설탕 첨가 구와는 유의적인 차이가 없었지만 S. thermophilus를 접종 한 경우에는 4.63×108CFU/mL로 2.57×109CFU/mL인 타 가토스와 설탕을 혼합하여 첨가한 요구르트에 비해 생균수 가 유의적으로 적게 나타났다. 배양 18시간에는 6시간에서 와 같이 L. bulgaricus를 접종한 경우에만 타가토스 첨가구 가 5.33×109CFU/mL로 1.87×1010CFU/mL인 대조구의 경 우보다 생균수가 유의적으로 적게 나타났으나 24시간에 도 달하였을 때는 모든 요구르트 샘플에서 유의적 차이가 나 타나지 않았다. 타가토스 첨가구의 경우 발효 24시간 후에 pH, 적정산도 및 당도의 결과가 유산균수와 유사한 경향을 보이지 않았는데 이는 Bae et al. (2004)이 보고한 바에 따 르면 유산균의 종류별 생장 양상이 다르기 때문에 유산균 수나 산도, pH의 경향이 다르게 나타난다고 하였다. 또한 Bae et al. (2004)와 Lee et al. (2013)의 연구 결과에서도 대조군의 경우에 발효 후 pH 및 적정산도는 요구르트 생 산 기준에는 미흡하였지만 유산균 수는 정상적인 발효가 진행된 요구르트와 큰 차이가 나타나지 않아 본 연구에서 tagatose를 첨가한 요구르트의 결과와 유사하였다.

|
이상의 결과에서 나타났듯이 타가토스의 첨가가 S. thermophilus의 성장 속도에는 거의 영향을 미치지 않는 것 으로 나타났지만 L. bulgaricus의 경우에는 성장 속도를 저 해시키는 결과가 초래되었는데 이는 요구르트의 발효 속도 를 저해시키는 결과로 나타났다. 요구르트의 발효 과정 중 생균수는 모든 처리구에서 24시간 동안 지속적으로 증가함 을 볼 수 있으며, 처음 접종 후 6시간까지는 미미하게 증 가함을 보였으나 6-12시간 사이에는 급속히 성장하였다가 그 이후에는 완만하게 증가하여 24시간 후에는 모든 요구 르트가 1.33(±0.58) × 1011 이상의 생균수를 나타내었다. Kim et al. (2015)의 연구에 의하면 시중에서 판매되고 있 는 요구르트 제품의 유산균수를 측정하였을 때 평균값으로 6.3(±0.4) × 106에서 8.3(±1.4) × 109CFU/mL까지의 값을 나 타내었고, 요구르트 1병을 기준으로 하였을 때는 8.1(±0.4) × 108에서 1.4(±0.9) × 1011CFU/mL까지의 값을 나타내었다 고 보고하여 본 연구에서 제조된 타가토스 첨가 요구르트 의 유산균의 양이 시판되는 요구르트와 유사한 범위를 나 타내고 있는 것을 확인할 수 있었다. 또한 현행 우리나라 식품 공전 상 축산물 가공기준 및 성분 규격(MFDS, 2013)에 정해진 농후 발효유의 총 유산균수는 1×108CFU/ mL 이상으로 본 실험의 결과 제조된 요구르트의 유산균수 는 모두 적정치 범위 이상인 것으로 확인되었다. 유산균 접종 후 12시간 이후에 생균수가 완만하게 증가하는 이유 는 산의 생성으로 인한 pH 저하 등의 원인으로 인하여 균 의 생육이 어느 정도 억제되는 시기에 도달하는 것으로 판 단된다(Kim, 2012a). Kang et al. (2013)의 연구에 의하면 L. casei의 경우 타가토스를 탄소원으로 이용하여 유산균의 생육이 촉진되고 요구르트 제조 시 타가토스의 첨가가 L. casei를 선택적으로 증식시켜 유산균의 생육 및 산 생성을 촉진시키는 것으로 보고되고 있으나 본 연구에서 사용된 균주인 S. thermophilus와 L. bulgaricus의 경우에는 pH 및 적정산도의 결과를 종합해 볼 때 타가토스의 첨가가 오히 려 유산균의 성장 속도를 저해하여 요구르트 제조 시 발효 속도를 늦추는 것으로 사료된다. 하지만 설탕과 타가토스 를 혼합 첨가하였을 경우에는 대조구와 유의적인 차이가 나타나지 않아 유용한 생리 효과를 가진 타가토스를 단독 사용하는 것보다는 요구르트 제조 시 설탕과 혼합 첨가하 게 된다면 좋은 천연 소재로서의 활용이 가능할 것으로 판 단된다. 하지만 이를 위해서는 설탕을 대체하여 단독으로 사용하였을 경우에도 요구르트의 발효 속도를 향상시킬 수 있는 더 많은 연구가 필요할 것으로 생각된다.
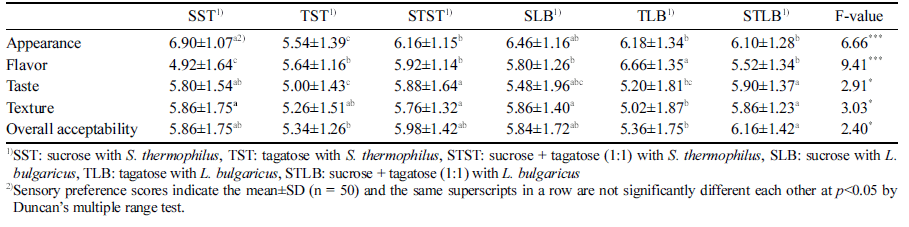
발효가 완료된 요구르트를 4°C에서 48시간동안 냉장 보 관한 후 관능적 강도 평가와 기호도 평가를 50명의 패널을 대상으로 실시하였다. 관능적 특성의 강도를 알아보기 위하 여 색(color), 향(flavor), 신맛(sourness), 단맛(sweetness), 후 미(aftertaste), 점도(thickness)에 대한 평가를 9점 척도법으 로 실시하여 강도가 클수록 높은 점수를 주도록 관능평가 를 실시한 결과는 Table 3과 같다. 요구르트의 관능적 강 도 평가 결과 색상(color)에 있어서는 설탕만 첨가한 대조 구에 비해 타가토스가 첨가된 요구르트에서 약간 진한색이 나타나는 것으로 평가되었고, S. thermophilus로 발효시킨 대조구가 가장 강한 신맛(sourness)을 나타냈으며 그에 비 해 타가토스 첨가구는 신맛의 강도가 유의적으로 약한 것 으로 평가되었다. 향(flavor)과 단맛(sweetness)의 경우에는 설탕과 타가토스의 첨가에 따른 유의적인 차이가 거의 나 타나지 않았으며 후미(aftertaste)는 설탕 첨가구가 타가토스 첨가구에 비해 높게 평가되었다. S. thermophilus로 발효시 킨 대조구의 점도(thickness)가 가장 높게 평가되었고 타가 토스 첨가구에 비해서도 유의적으로 높게 평가되었다. 또 한 외관(appearance), 향(flavor), 맛(taste), 조직감(texture), 종합적인 기호도(overall acceptability)에 대하여 9점 척도 법으로 기호도 평가를 실시한 결과는 Table 4에 나타내었 다. 외관(appearance)의 경우 대조구의 선호도가 타가토스 첨가구에 비해 약간 좋게 평가되었으나 향(flavor)의 경우 L. bulgaricus로 발효시킨 타가토스 첨가 요구르트의 선호 도가 유의적으로 가장 높게 평가되었고 S. thermophilus로 발효시킨 대조구가 가장 낮은 선호도를 보였다. 맛(taste)과 조직감(texture)에서는 대조구가 타가토스 첨가구에 비해 약 간 높은 선호도를 나타내었으나 설탕과 타가토스를 혼합하 여 첨가한 요구르트와는 유의적인 차이가 나타나지 않았다 (p<0.05). 종합적인 기호도(overall acceptability)에 대해서는 설탕과 타가토스 혼합 첨가구가 타가토스 첨가구에 비해 유의적으로 높은 점수를 받았고 대조구와는 유의적인 차이 가 나타나진 않았지만 평균값에서 더 높은 점수를 얻었다. 요구르트의 품질을 결정하는 중요한 관능적 요소로는 일반 적으로 외관(색상), 향미, 맛, 조직감을 들 수 있는데(Cho et al., 2008) 본 연구에서의 관능 평가 결과를 종합해 볼 때 외관(appearance)의 경우 설탕 첨가구의 선호도가 향 (flavor)의 경우 타가토스 첨가구의 선호도가 높은 평가를 받았으나 맛(taste), 조직감(texture), 종합적인 기호도(overall acceptability)에 대한 선호도에서는 전반적으로 설탕과 타 가토스 혼합 첨가구가 타가토스 첨가구에 비해 높은 점수 를 받았으며 대조구와는 유의적인 차이가 나타나지 않아 타가토스를 설탕과 혼합하여 사용한다면 설탕을 첨가한 요 구르트와는 관능적인 차이를 나타내지는 않으면서 칼로리 와 혈당지수(GI) 값을 낮춘 요구르트 제조에 이용할 수 있 을 것으로 판단된다.

|
|
요 약
타가토스의 첨가에 따른 요구르트의 발효 중 품질특성을 확인하기 위하여 2종류의 유산균주(L. bulgaricus, S. thermophilus)를 접종한 타가토스 또는 설탕(7%, w/v) 첨가 요구르트의 품질 특성을 평가하기 위하여 24시간 동안 배 양하는 동안 pH, 적정 산도, 유산균수의 변화를 6시간 간 격으로 측정하였고 발효 전후의 색의 변화를 알아보기 위 하여 색도를 측정하였으며 배양이 끝난 후에는 48시간 동 안 냉장(4±2°C) 보관한 후 관능평가(강도 및 기호도)를 실 시하였다. 배양시간이 경과함에 따라 모든 시료의 pH는 낮 아지고 적정 산도는 높아졌는데 설탕을 첨가하였을 경우에 는 배양 6시간 이후 pH가 가파르게 하강하여 24시간 후에 는 4.5 근처에 도달하였으나 타가토스 첨가구의 경우에는 완만하게 하강하여 배양 24시간에도 5.6 근처에 머무르는 결과가 나타났다. 설탕과 타가토스를 혼합 첨가한 요구르트 에서는 균주에 따라 다른 결과를 보였는데 S. thermophilus 를 접종한 경우에는 설탕 첨가구와 L. bulgaricus가 접종된 경우에는 타가토스 첨가구와 비슷한 경향이 나타났다. 적 정산도는 pH의 결과에 부합하여 타가토스 첨가구가 설탕 첨가구보다 그리고 L. bulgaricus가 S. thermophilus를 접종 하였을 때보다 낮은 값을 나타내었다. 또한 발효시간이 증 가함에 따라 당도는 감소하는 경향을 보였는데, 이는 발효 되는 동안 유산균에 의해 요구르트 내의 당이 분해되어 감 소되고 대신 유산 및 초산 등이 생성되는 젖산발효에 의한 것으로 여겨진다. 당도 또한 pH와 산도의 결과와 유사한 경향을 나타내었는데 타가토스를 첨가하거나 L. bulgaricus 를 접종하였을 경우에는 24시간 동안 당도가 거의 감소하 지 않는 것으로 나타났다. 이상의 결과를 종합해 볼 때 타 가토스와 L. bulgaricus는 요구르트의 발효 속도를 저하시 키는 특성을 가지고 있는 것으로 판단된다. 색도는 발효가 진행되면 밝기(L*), 적색도(a*)에서는 거의 차이가 나타나지 않았지만 황색도(b*)가 약간 증가하는 것을 알 수 있었으며 타가토스 첨가구와 대조구와의 유의적인 차이는 나타나지 않아 타가토스의 첨가가 요구르트의 색 변화에는 거의 영향 을 미치지 않는다는 것을 알 수 있었다. 요구르트의 발효 과정 중 생균수는 모든 처리구에서 24시간 동안 지속적으 로 증가하였으며, 타가토스의 첨가가 S. thermophilus의 성 장 속도에는 거의 영향을 미치지 않았지만 L. bulgaricus의 성장 속도를 저해시켜 요구르트의 발효 속도를 저해시키는 결과로 나타났다. 하지만 본 연구에서 제조된 요구르트의 유산균수는 축산물의 가공기준 및 성분규격의 108CFU/mL 이상으로 나타나 호상 요구르트의 유산균수에 모두 부합하 였다. 관능적 특성에 대한 선호도 평가 결과 맛(taste), 조 직감(texture), 종합적인 기호도(overall acceptability)에 대해 서는 전반적으로 설탕과 타가토스를 혼합 첨가한 요구르트 가 타가토스 첨가구에 비해 유의적으로 높은 점수를 받았 으나 설탕 첨가 요구르트와는 유의적인 차이가 나타나지는 않았다. 이상의 결과를 종합하여 볼 때 요구르트 제조를 위하여 설탕 대체 당으로 타가토스만 첨가하였을 경우에는 발효 속도를 저해시키는 특성이 나타났으며 관능 평가에서 도 설탕만을 첨가한 대조구에 비해 선호도가 떨어지는 측 면이 있었지만 타가토스를 설탕과 혼합하여 사용한다면 설 탕을 첨가한 요구르트와는 관능적인 차이는 나타나지 않으 면서 칼로리와 혈당지수(GI) 값을 낮춘 요구르트 제조에 이용될 수 있을 것으로 판단된다. 타가토스는 설탕에 비해 혈당 증가가 낮고, synbiotic 효과가 있어 설탕을 첨가하지 않는 것이 건강측면에서 더 효과적이나 본 연구의 결과에 따르면 타가토스만을 첨가하였을 경우에는 요구르트의 발 효 속도를 감소시키는 것으로 나타나 향후 타가토스만을 첨가하였을 때에도 발효 속도를 향상시킬 수 있는 방법에 대하여 더 많은 연구가 필요할 것으로 생각된다.







