서 론
현대인들은 생활문화와 환경의 변화에 의하여 정신적, 육체적 활동과 과도한 스트레스 등의 여러 가지 이유로 알 코올 섭취량이 증가하고 있으며 생활습관병과 더불어 국민 의 건강에 심각한 영향을 미치는 것으로 알려지고 있어 사 회문제를 야기하고 있다(Lee et al., 1999). 알코올은 스트 레스 해소나 사교 등을 목적으로 애용되는 기호품으로 소 량 섭취시 기분전환, 혈액순환에 도움이 되어 건강에 유익 할 수 있지만 과량의 알코올을 장기간 섭취하는 것은 간, 신장 및 뇌 등 여러 장기에 손상을 유발하며 특히 알코올 성 간염과 간경화를 유도해 사망을 초래하는 것으로 보고 되고 있다(Tsukamoto et al., 1989). 섭취된 알코올은 신속하 게 흡수되어 주로 간에서 alcohol dehydrogenase (ADH)에 의해 acetaldehyde로, 다시 aldehyde dehydrogenase (ALDH) 에 의해 acetic acid로 산화되어 에너지로 사용되거나 지 방으로 전환되어 저장되고(Ko et al., 2006), 일부는 소변 이나 땀을 통해 배출되거나 호흡을 통해 탄산가스의 형태 로 배출된다(Lieber, 1995). 에탄올의 과잉 섭취는 간 대 사에 부정적인 영향을 미침으로써 간 세포에 손상을 입히 는데 이는 에탄올 자체의 독성보다는 산화과정에서 생성 된 acetaldehyde와 NADH에 의한 것으로 알려져 있다 (Lieber et al., 1986; Paek, 1993; Kim, 1999; Lieber, 2004). 체내에 높은 농도로 축적된 acetaldehyde는 이상 증상인 맥박의 증가, 홍조, 오심, 갈증, 발한, 메스꺼움, 구토 뿐만 아니라 두통이나 속쓰림 등의 숙취현상을 나타낸다(Paek, 1993; Lieber, 1995; Kim, 1999). ADH와 ALDH를 동시에 활성화시킴으로써 에탄올과 acetaldehyde가 빨리 분해되도 록 하는 알코올 대사에 미치는 영향을 주는 천연물의 유용 물질을 탐색하는 연구가 수행되었으나, 대부분 ALDH에 비 해 ADH를 더 활성화시킴으로써 독성물질인 acetaldehyde 를 축적시키는 경우가 많았으며, 또한 천연물로부터 ADH 의 활성을 저해하는 물질을 탐색함으로써 acetaldehyde가 천천히 만들어지도록 하는 보고가 있으나(Lee & Lee, 1999; Moon et al., 2004), 이러한 천연물들이 acetaldehyde 를 제거해주는 효소인 ALDH의 활성을 저해 또는 촉진시 키는지에 대한 연구가 부족한 상태이다(An et al., 1999; Lee et al., 1999; Hwang, 2006; Yoo et al., 2009). 지금까 지 헛개나무, 동백나무, 민들레즙, 버섯 및 버섯 균사체 등에 대한 연구를 통하여, 천연물의 유용물질과 약용작물 추출물이 ADH와 ALDH의 활성에 미치는 영향과 체내의 항산화 작용에 미치는 영향에 대한 연구가 활발히 진행되고 있다(Song et al., 2005; Park et al., 2006; Noh et al., 2009; Sohn et al., 2010; Kim et al., 2016). 해조류는 극심한 환경 에서 생육하므로 육상식물과 다른 성분과 생리활성이 있을 것으로 추측되기 때문에 해조류 중의 하나인 감태의 경우 항산화, 항암, 항고혈압, 미용효능, 숙취해소 등과 같은 다양 한 기능성들이 밝혀지면서 해조류 이용에 관한 연구가 집중 되고 있다(Jimenez-Escring & Goni, 1999; Lee et al., 1999; Cho & Choi, 2010; Kim et al., 2012). 본 연구에서는 숙취 해소에 효과가 있는 음료를 개발하기 위해 복합추출물이 ADH 및 ALDH 효소 활성에 미치는 영향과 항산화 능력을 In vitro에서 분석하였고, 이를 알코올과 함께 마우스에 투여 하였을 때 나타나는 활동성의 변화를 관찰하고 독성 중간대 사산물인 acetaldehyde를 정량하여 알코올 섭취 후 나타나 는 숙취해소에 대한 효능을 규명하고자 하였다.
재료 및 방법
본 실험에서 사용한 해조류(톳, 모자반, 감태, 돌미역, 우 뭇가사리)와 식물(황칠, 헛개, 녹차)은 건조된 상태의 것을 주식회사 제주씨그린(Jeju, Korea)과 제주구좌농협(Jeju, Korea)에서 구입하였고, 열수 추출에 사용되는 용암해수 는 제주테크노파크 용암해수산업화지원센터(Jeju, Korea) 에서 구입하였다. 에탄올대사 효소활성의 측정을 위해 β- nicotinamide adenine dinucleotide (β-NAD+), 효모 유래의 alcohol dehydrogenase (ADH)와 aldehyde dehydrogenase (ALDH)는 Sigma-Aldrich (St. Louis, MO, USA)사의 제품 을, 그 외 활성 측정에 필요한 시약은 1급 이상의 제품을 사용하였다. 건조된 해조류와 식물 각각 100 g에 용암해수 2,000 mL를 가하여 열수 추출기에서 3시간 추출하여 얻은 추출액을 여과하고, 이를 감압 증류장치(Rotary evaporator, N-3010, Eyela, Tokyo, Japan)로 농축한 후, 동결 건조기 (FD8508, IlShin Lab Co. Ltd. Yangju, Korea)를 이용하여 해조류-식물 복합추출물(Algae-Plant complex extract; APCE) 을 제조하였고, phosphate buffered saline (PBS) (Sigma- Aldrich, St. Louis, MO, USA)를 이용하여 100 mg/mL로 조정 후 4°C에서 보관하며 사용하였다.
실험동물은 생후 10주령 된 음성 balb/c mouse를 ㈜오 리엔트바이오(Seongnam, Korea)로 부터 구입하여 2주간 제주대학교 실험동물센터(온도: 22±2°C, 습도: 50-55%, 명암주기: 12시간) 에서 적응시킨 후 실험에 사용하였다. 전 실험기간 동안 물과 사료는 자유롭게 섭취하도록 하 였다. 모든 동물실험은 제주대학교 동물실험윤리위원회 (ACUCC; Animal Care and Use Committee of Jeju National University)의 지침(Approval No. 2017-0006)에 따라 수행 하였다.
항산화 효과의 측정은 1,1-diphenyl-2-picrylhydrazyl (DPPH) (Sigma-Aldrich, St. Louis, MO, USA) 라디칼 소 거활성을 Blois 방법에 따라 측정하였다(Blois, 1958). 즉, 에탄올에 용해시킨 0.2 mM DPPH용액 950 μL에 추출물을 DMSO에 녹여 농도(0, 2, 10, 40, 80, 그리고 120 μg/mL)별 로 희석한 시료 50 μL를 가한 후 실온에서 30분간 incubation 후 517 nm에서 흡광도를 측정하였다. 항산화 활성은 아래와 같이 계산하였다.
항산화활성(%) = (1 - (시료 첨가군의 흡광도 / 시료 무첨가군의 흡광도)) × 100
In vitro에서 ADH의 활성 측정은 ethanol quantification assay kit (Megazyme, Wicklow, Ireland)를 사용하여 Megazyme protocol에 의거하여 측정하였다. 즉, 증류수 1 mL, buffer plus sodium azide (0.02% w/v) 0.1 mL, NAD+ 용액 0.1 mL와 20% ethanol 10 μL를 혼합하여 시료 를 1, 2, 4, 8, 그리고 16 μL/mL별로 가한 후 실온에서 2 분간 반응한 후에 340 nm에서 기본 흡광도(A1)를 측정하 였다. 이후 ADH 10 μL (1 assay unit)를 가하여 실온에서 5분간 반응한 후에 340 nm에서 NADH 생성 때문에 증가 된 흡광도(A2)를 측정하였다. 알코올 분해효소의 활성은 변화된 흡광도(A2-A1)를 기반으로 대조군에 대한 상대적 인 활성(%)으로 나타내었다. In vitro에서 ALDH의 활성 측정은 acetaldehyde quantification assay kit (Megazyme)를 사용하여 Megazyme protocol에 의거하여 측정하였다. 즉, 증류수 1 mL, buffer plus sodium azide (0.02%, w/v) 0.1 mL, NAD+용액 0.1 mL과 증류수에 녹인 20% acetaldehyde 10 μL를 혼합하여 4가지 시료를 1, 2, 4, 8, 그리고 16 μL/ mL별로 가한 후 실온에서 2분간 incubation한 후에 340 nm에서 기본 흡광도(A1)를 측정하였다. 이후 ALDH 25 μL (1 assay unit)를 가한 후 실온에서 5분간 반응한 후에 340 nm에서 NADH생성 때문에 증가된 흡광도(A2)를 측정 하였다. ALDH의 활성은 변화된 흡광도(A2-A1)를 기반으 로 대조군에 대한 상대적인 활성(%)으로 나타내었다.
혈중 acetaldehyde 정량은 마우스를 3개 군(군당 10마리) 으로 나누었다. Ethanol 및복합추출물의 경구투여량은 An et al. (2017)의 방법을 참고하여 선정하였다. 5개 군은 ethanol을 2 mL/kg 용량으로 경구투여 하고 30분이 지난 후에 물 또는 복합 추출물을 경구투여(4 mL/kg)하여 120분 이 경과한 후에 마우스들을 희생시켜 복대정맥에서 혈액을 채혈한 후 혈중 aldehyde농도를 정량하였다. 대조군의 경 우 물을 30분 간격으로 경구투여(4 mL/kg)하고 본 실험에 사용하였다. 채혈한 혈액은 상온에서 방치한 후 600×g로 15분간 원심분리로 혈청을 분리하고 -70°C에 보관하여 향 후 acetaldehyde 농도 측정에 사용하였다. Acetaldehyde의 정량은 acetaldehyde quantification assay kit (Megazyme, Wicklow, Ireland)를 사용하여 Megazyme protocol에 의거 하여 앞에 기술한 바와 같이 측정하였다.
Acetaldehyde 농도(c) = (V × MW) / (ε × d × v) × ΔAacetaldehyde [g/L]
V: final volume [mL]
MW: molecular weight of acetaldehyde (g/mol)
ε: Extinction coefficient of NADH at 340 nm = 6300(l × mol-1 × cm-1)
d: Light path (cm)
v: Sample volume (mL)
따라서,
c = (1.275 × 44.05) / (6300 × 1.0 × 0.05) × ΔAacetaldehyde [g/L] = 0.1782 × ΔAacetaldehyde [g/L]
혈중 alcohol의 농도는 ALDH 대신 ADH를 사용하여 위의 방법으로 산출하였다.
행동 약리 실험으로 locomotor activity cage set (Ugo Basile, Italy)를 사용하여 마우스의 활동성을 관찰하였다. 마우스를 6개 군(군당 10마리)으로 나누어 5개 군은 ethanol을 2 mL/kg 용량으로 경구투여 하고 30분이 지난 후에 물 또는 복합추출물을 경구투여(4 mL/kg) 하였다. 대 조군의 경우 물 4 mL/kg을 30분 간격으로 경구투여하고 본 실험에 사용하였다.
각 군의 마우스를 locomotor activity cage (54 cm × 50 cm × 37 cm)에 넣고 활동성을 관찰하였다. 마우스의 활동성은 activity cage 내에서 마우스가 움직이면서 일루미네이터에 서 센서로 비추는 photobeam의 차단하는 빈도수를 10 분 간 합산하여 720분 동안 관찰하였다.
결과 및 고찰
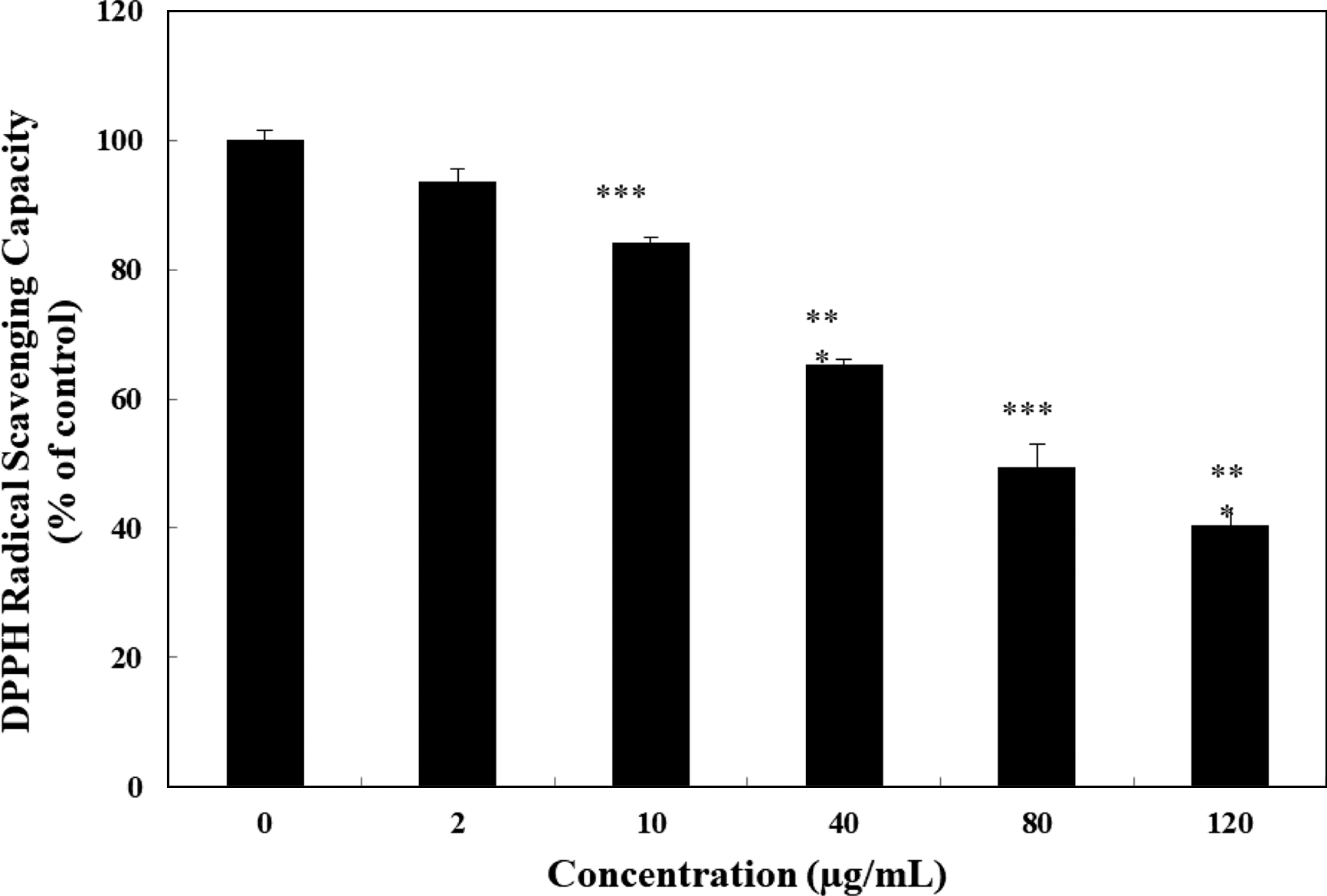
체내의 알코올 대사는 ADH, microsomal ethanol oxidation system (MEOS) 및 catalase 등에 의하여 조절되며 항 산화 시스템에 영향을 미치는 자유라디칼을 생성한다(Ko et al., 2006; Das & Vasudevan, 2007; Shin et al., 2008). 자유라디칼은 생물학적 손상의 주요 요인으로 잘 알려져 있으며, 이는 노화와 질병의 원인 중의 하나로 생체 내에 서 활성 산소종을 생성하게 된다(Wiseman, 1996). 인체 내 의 자유라디칼은 지질, 단백질 등과 반응하여 DNA 변이, 발암, 노화, 동맥경화 및 염증 등을 일으킬 수 있는 물질 로 이러한 자유라디칼을 제거할 수 있는 천연물질에 대한 연구가 활발히 진행되고 있다(Leelarungrayub, 2006). 천연 물의 superoxide anion radical, hydroxyl radical, DPPH radical을 소거하는 능력은 체내에서 활성산소에 의한 산화 적인 손상을 억제하는 척도이다. 특히, 1,1-diphenyl-2- picrylhydrazyl (DPPH) radical 소거법은 항산화 물질의 전 자 공여능을 이용하는 항산화 측정법으로 천연 항산화제의 자유라디칼 소거 활성을 평가하는데 일반적으로 사용된다 (Blois, 1958). 복합추출물의 free radical 소거활성 능력을 측정한 결과, 2, 10, 40, 80, 120 μg/mL 범위에서 항산화활 성은 농도 의존적으로 DPPH 라디컬 소거능이 증가하였다 (Fig. 1). 항산화효과(%)는 특히 120 μg/mL의 농도에서 최 대 59.48%의 free radical 소거능력을 나타내어 항산화 효 능이 있음을 확인하였다(Fig. 1). 해조류와 식물에 널리 분 포되어 있는 페놀성 화합물들은 다양한 기능을 하는 천연 화합물로서 항산화, 항돌연변이 등의 생리활성이 있는 것 으로 알려져 있다(Kim et al., 2004; Choi et al., 2005; Byun et al., 2007). 이는 추출액에 포함된 페놀성 화합물 및 미네랄에 의해 활성산소를 제거해 주는 역할을 하는 것 으로 생각된다.
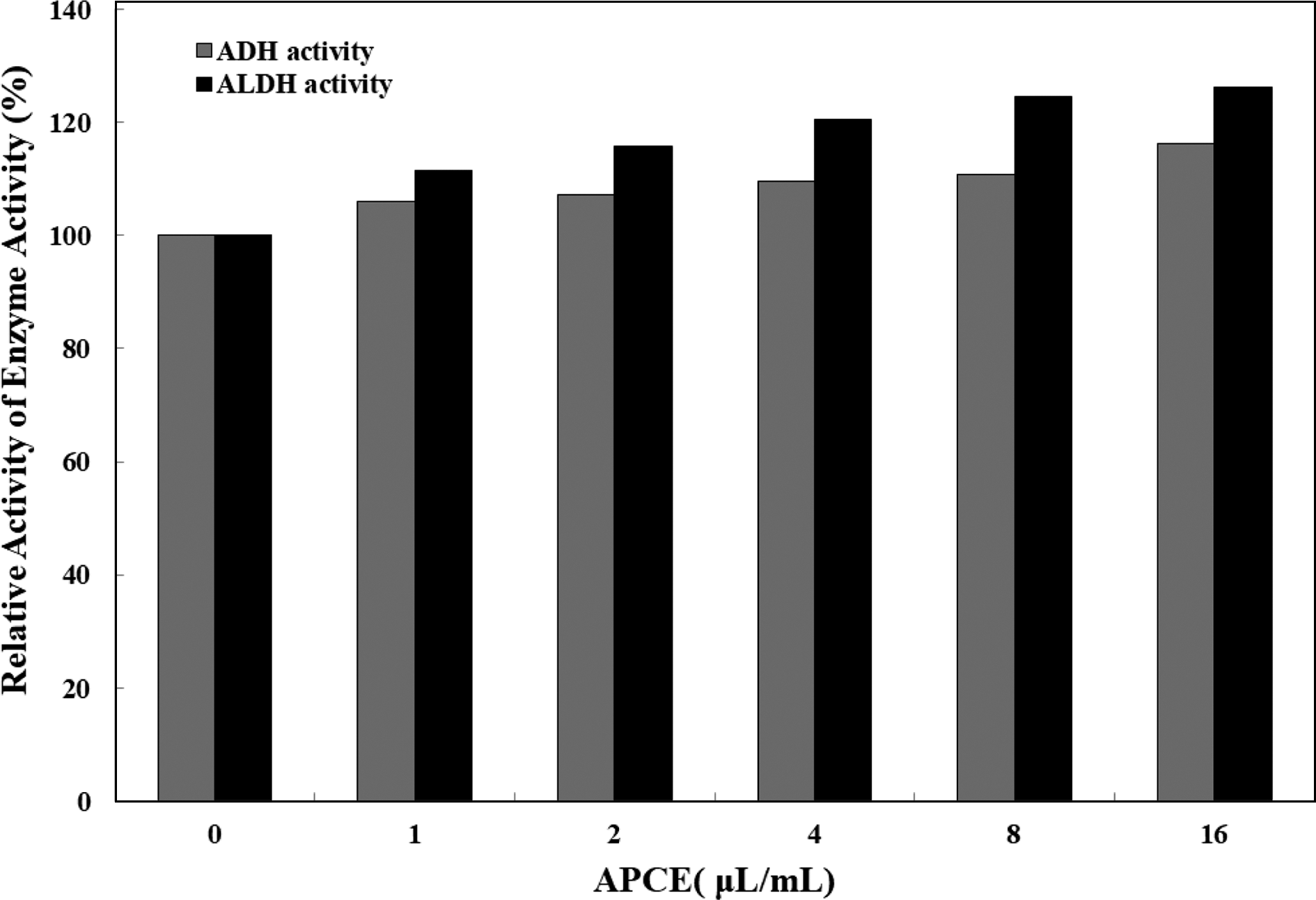
체내로 흡수된 알코올의 대부분은 위장과 소장에서 흡수 되어 간으로 이동된 후 대사과정을 거쳐 분해되는데, 만성 적인 알코올 섭취는 영양소의 흡수장애와 간 기능 손상을 초래할 수 있다(Peters, 1982). 간 조직에서 알코올 대사는 먼저 ADH 활성에 영향을 주는 요인들에 의해 조절될 수 있다. 체내에 들어온 알코올의 대부분은 간세포의 ADH 효 소에 의해 acetaldehyde 로 신속히 분해된 다음 ALDH 효 소에 의해 산화분해 되는 과정을 거치게 된다(Peters, 1982). 음주 후 실제적으로 느끼는 숙취 증상은 acetaldehyde의 독성 작용에 의한 것이므로 가장 바람직한 숙취 해소는 ALDH 효소 활성을 좀 더 촉진 시키는데 초점이 맞추어져 야 한다. 복합추출물의 알코올 분해효소(ADH) 및 알데히 드 분해효소(ALDH)의 활성에 미치는 효과를 확인한 결과, ADH 활성의 경우 대조군을 상대활성 100%로 나타냈을 때 추출물의 ADH 활성이 8 μL와 16 μL 농도에서 각각 110.7%와 116.3%의 활성을 나타내어 다소 증가하는 경향 을 나타내었으나, 유의성 있는 변화는 관찰되지 않았다 (Fig. 2). ALDH 활성의 경우 효소활성이 추출물의 농도 의존적으로 ALDH 활성이 다소 증가하는 경향을 나타내었 으나, 유의성 있는 변화는 관찰되지 않았다(Fig. 2). 특히, 복합추출액은 농도 8 μL에서 124.5%, 16 μL에서 126.3% 의 효소활성을 나타내었다(Fig. 2). 이상의 결과에서 복합 추출액은 ADH와 ALDH의 효소활성을 다소 증가시키는 경향이 있는 것으로 사료된다.
마우스를 3개 군(군당 10마리)으로 나누어 각 군에 에탄 올 2 mL/kg BW을 경구투여하고 30분 후 물 또는 복합추 출물(4 mL/kg)을 경구 투여하여 각 군의 마우스(10마리)를 locomotor activity cage (54 cm × 50 cm × 37 cm)에 넣고 활 동성을 관찰하였다. 물만 투여한 음성대조군의 경우 투여 후 400분대까지 왕성한 활동성을 나타내었으나, 알코올 투 여 후 물을 투여한 양성대조군의 경우 투여 후 110분대까 지 지속적으로 활동성이 지속적으로 감소하다가 30분대에 잠시 활동성을 거의 나타내지 않았다. 게다가 270분대까지 활동성을 잠시 나타낸 후 다시 활동성을 나타내지 않았다 (Fig. 3). 반면, 알코올 투여 후 복합추출물을 투여한 군의 경우 알코올 투여 후 물을 투여한 양성대조군에 비하여 활 동성이 현저히 증가됨을 관찰할 수 있었다(Fig. 4). 이들 복합추출물 투여군들은 알코올을 투여한 후 물을 투여한 양성대조군에 비해 투여 후 350분대까지의 활동성이 현저 히 증가함으로써 정상 수준으로 회복됨을 관찰할 수 있었 다(Fig. 3).
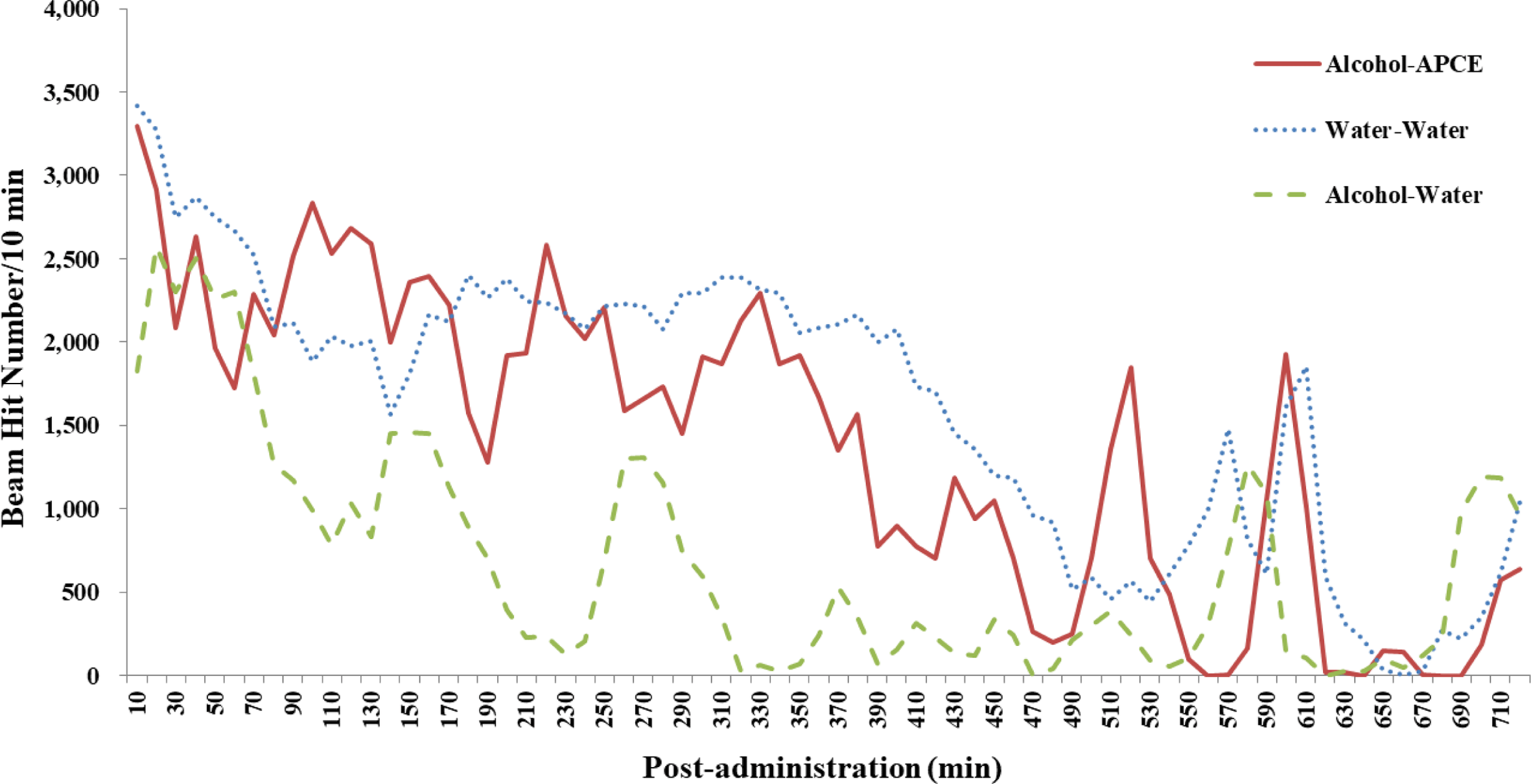
이상의 결과에서 복합추출물은 알코올을 투여한 마우스 에 있어서 350분간의 활동성을 현저히 개선하였으며, 복합 추출물에 의하여 증가한 마우스의 활동성은 감소한 혈중 알코올 및 aldehyde의 농도에 기인함을 알 수 있었다.
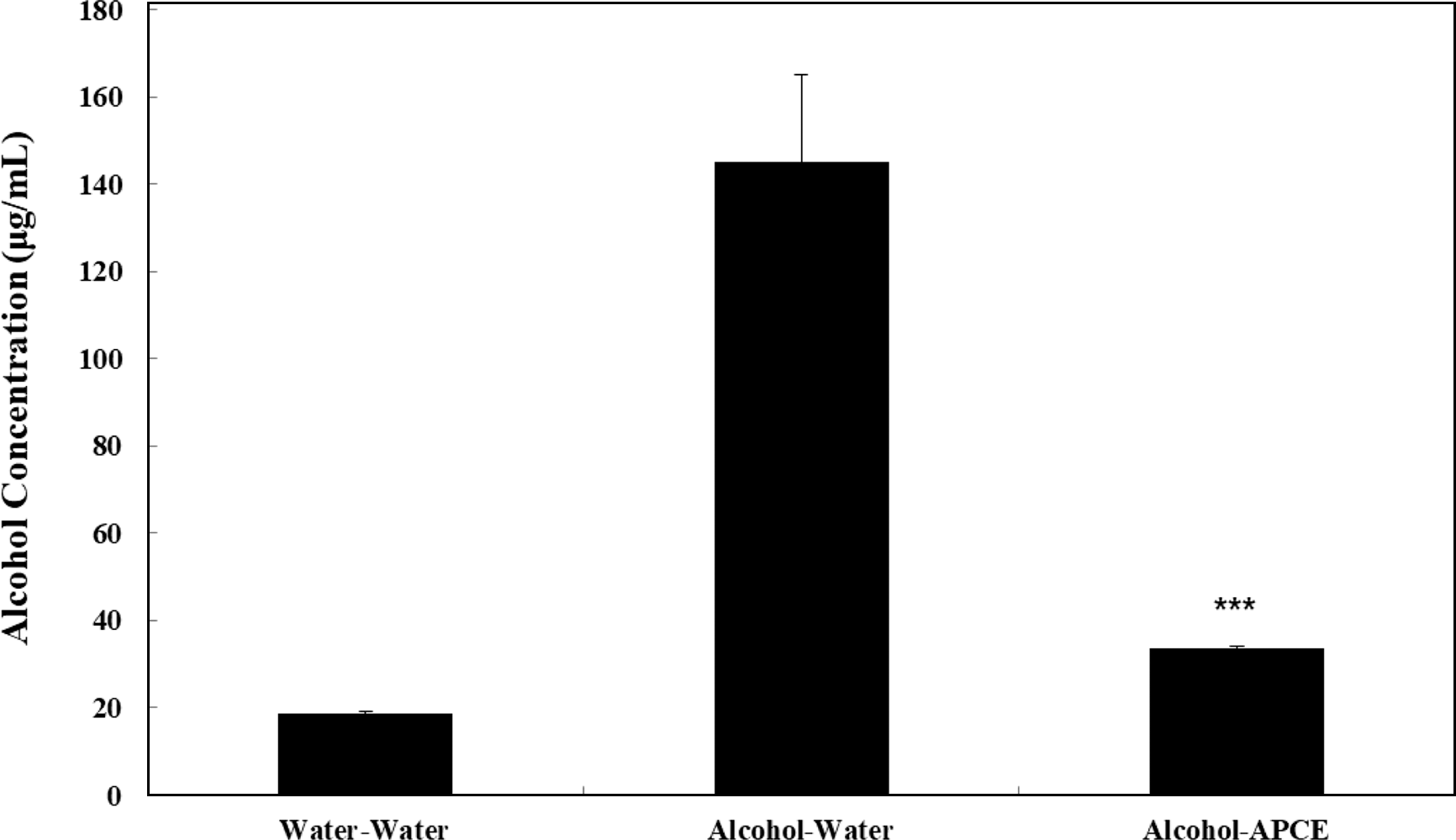
혈중 alcohol이 분해될 때 생성되는 acetaldehyde는 숙 취의 주된 원인으로 알코올 대사가 빠르게 진행되지 않아 축적되는 많은 양의 acetaldehyde는 뇌로 전해져 많은 유 해화합물로 전환되어 맥박증가, 오심, 구토 등의 숙취현상 을 초래하고, 만성적 축적은 체내에 자유라디칼을 생성함 으로서 산화적 스트레스를 유발하여 간조직을 손상시키게 된다(Mansouri et al., 2001; Yang et al., 2004; Choi et al., 2006). 마우스를 3개 군(군당 10마리)으로 나누어 각 군에 에탄올 2 mL/kg BW을 경구투여하고 30분이 지난 후 물 또는 복합추출물(4 mL/kg)을 경구 투여하여 120분이 경 과한 후 마우스들을 희생시켜 혈액을 채혈한 후 혈중 acetaldehyde 및 알코올 농도를 정량한 결과, 대조군의 경 우 혈중 alcohol 농도는 거의 나타나지 않았으나, 알코올 투여 후 물을 투여한 군의 경우 대조군에 비하여 현저히 높은 혈중 alcohol 농도(158.73±22.94 μg/mL)를 나타내었 다. 반면, 복합추출물 투여군(33.48±0.59 μg/mL의 경우 알 코올 투여 후 물을 투여한 군에 비하여 유의성 있게 감소 된(p<0.0001) 혈중 alcohol 농도를 나타내었다(Fig. 5)
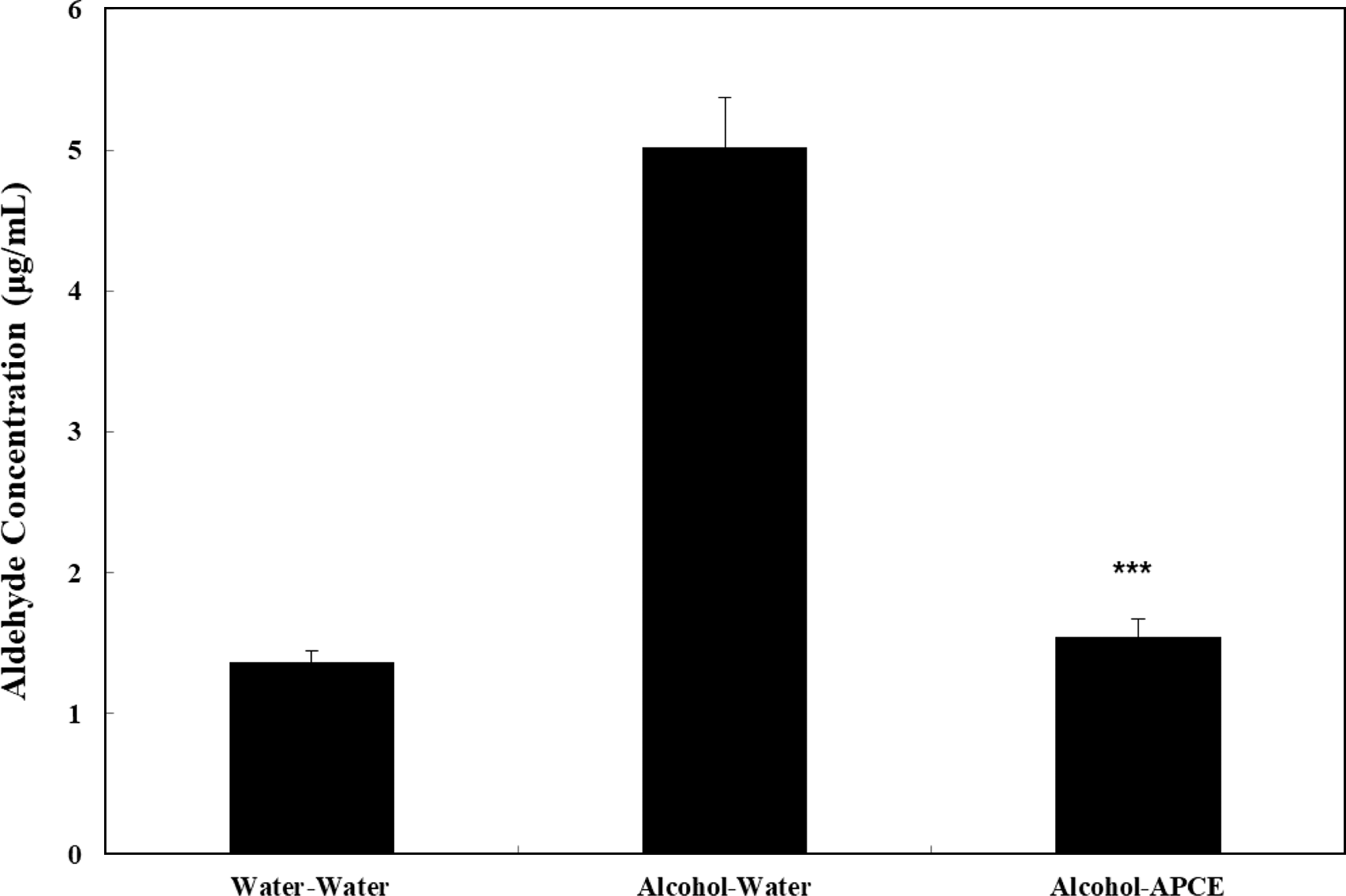
혈중 acetaldehyde 농도 정량 결과, 대조군의 경우 혈중 aldehyde 농도는 거의 나타나지 않았으나, 알코올 투여 후 물을 투여한 군의 경우 대조군에 비하여 현저히 높은 혈 중 aldehyde 농도(5.02±0.35 μg/mL)를 나타내었다(Fig. 5). 반면, 알코올 투여 후 복합추출물 투여한 군의 경우 알코 올 투여 후 물을 투여한 군에 비하여 유의성 있게 감소된 (p<0.0001) 혈중 aldehyde 농도를 나타내었다(Fig. 5). 따라서 복합추출물 투여군은 1.54±0.13 μg/mL의 혈중 acetaldehyde 농도를 나타내었다. 따라서 복합추출물에 의하여 증가된 마우스의 활동성은 감소된 혈중 acetaldehyde 농도에 기인 한 것으로 추정된다. 이상의 결과에서 복합추출물에 의해 서 높아진 ALDH 활성도는 혈중 acetaldehyde 농도를 낮 게 유지해 줄 것으로 기대되고, 투약 90분 이후에 관찰된 마우스의 혈중 acetaldehyde의 농도는 locomotor activity test에서 관찰된 마우스의 활동성과 연관성이 있는 것으로 보여 혈중 acetaldehyde 농도는 마우스의 활동성에 직간접 적으로 영향을 미치는 것으로 보인다. 결론적으로 복합추 출물은 알코올을 투여한 마우스의 혈중 알코올 및 acetaldehyde의 농도를 감소시킴으로써 활동성을 증가시키 는 것으로 생각된다. 향후 알코올을 투여한 마우스의 간에 서 ADH 및 ALDH의 활성도 변화를 측정하여 생체 내에 서 복합추출물의 효능에 대한 연구가 필요하며, 이러한 숙 취 해소 능력에 영향을 미치는 지표물질 규명에 관한 연구 가 진행되어야 할 것이다
요 약
본 연구에서는 복합추출물을 이용하여 ADH 및 ALDH 효소 활성에 미치는 영향과 항산화 능력을 In vitro에서 분 석하였고, 이를 알코올과 함께 마우스에 투여하였을 때 나 타나는 활동성의 변화를 관찰하고 혈중 aldehyde 농도를 정량하여 알코올 섭취 후 나타나는 복합 추출물의 숙취해 소 효능을 규명하였다. 복합추출물의 free radical 소거활성 능력을 측정한 결과, 농도 의존적으로 DPPH 라디칼 소거 능이 증가하였으며, 특히, 120 μg/mL의 농도에서 복합추출 물은 59.48%의 free radical 소거활성을 나타내어 항산화 효능이 있음을 확인하였다. ADH 및 ALDH 효소 활성을 측정한 결과, 복합추출물 농도 의존적으로 ADH 및 ALDH 효소 활성을 증가시켰으나, 유의성 있는 변화는 관 찰되지 않았다. Locomotor activity test를 실시한 결과, 마 우스의 활동성은 복합추출물-물을 투여한 군의 경우 투여 후 120분까지의 활동성이 알코올-물 투여군에 비하여 현저 히 증가됨을 관찰할 수 있었다. 복합추출물을 경구 투여하 여 120분이 경과한 후 혈중 alcohol과 acetaldehyde 정량결 과, 알코올 투여 후 복합추출물군을 투여군에서 양성대조 군인(알코올-물)군에 비하여 유의성 있게 감소된(p<0.0001) 혈중 alcohol 농도(33.48±0.59 μg/mL)와 aldehyde 농도(1.54 ±0.13 μg/mL)를 나타내었다. 이상의 결과에서 복합추출물이 ADH와 ALDH의 활성을 유의적으로 증가시키지는 않았으 나, 복합추출물에 의하여 증가된 마우스의 활동성은 혈중 alcohol과 acetaldehyde의 감소된 농도에 기인함을 알 수 있었다.







