서 론
식품산업에서 고압처리기술은 다양한 압력 범위에서 활 용되고 있다. 예를 들어 0-50MPa 범위에서는 고온·고압 (high pressure) 상태의 아임계 또는 초임계 기술을 활용한 유용성분의 추출(Herrero et al., 2007; Mustafa & Turner, 2011) 50-300MPa 범위의 중고압(medium high pressure) 영역에서는 포자의 발아(Setlow, 2003) 또는 효소의 활성을 조절(Ohmae et al., 2007; Kim et al., 2013)하거나 단백질 과 같은 식품의 성분 중 거대분자의 형태를 변화(Torres Bello et al., 2014)시킬 수 있는 기술로서 활용 범위를 넓 히고 있으며, 400-700 MPa 범위의 초고압(ultra high pressure)은 주로 식품 중의 유해 미생물의 살균목적(Heinz & Buckow, 2010; Torres Bello et al., 2014)으로 사용되어 져 왔다. 초고압 기술을 이용한 비열살균기술의 경우에는 1899년 Hite에 의해서 최초로 보고된 이후 약 100년이 지 난 1992년 일본의 미쯔비시 중공업의 수직형 초고압 처리 장치를 이용 초고압처리 jam이 시장에 출시되고, 1998년에 최초로 GEC ALSTOM ACB에서 개발한 수평형 초고압 처리 장치를 이용하여 스페인 육가공 회사인 Espufia에서 육가공 제품이 출시되었다(Jung et al., 2010). 즉, 초고압 처리장치 개발이 개발기술의 산업화를 견인한 사례로 볼 수 있다(Balda et al., 2012). 반면에 중고압 영역에서는 아 주 작은 규모의 처리 장치를 이용하여 Curl & Jansen (1950)이 pepsin 및 chymotrypsinogen에 미치는 고압의 영 향에 대한 보고 등 주로 반응기작 또는 반응속도론적 기초 연구에 치우치다 2000년을 전·후로 하여 효소를 이용한 가 수분해의 경우 처리되는 압력에 따라 단백질 가수분해효소 의 활성에 영향을 줄 수 있다는 연구 결과가 보고되면서 (Seyderhelm et al., 1996; Hurtado et al., 2002; Ohmae et al., 2007; Hernández-Andrés et al., 2008) 중고압을 이용한 효소가수분해에 대한 산업적 응용 가능성이 제시되었다. 특히, Okazaki et al. (2003)는 어류단백질의 자가소화에 In et al. (2016a,b)은 멸치의 효소가수분해에 중고압을 활용하 여 어간장과 유사한 가수분해물을 제조하였다고 보고 하였 다. 중고압을 이용한 유일한 산업화 사례는 일본에서 시판 되고 있는 저염간장이다.
단백질 가수분해물은 바이오산업에서 세포 배양을 위한 배지의 질소원(상업적으로는 peptone이라 함, Pasupuleti & Braun, 2010)으로 사료의 값싼 영양원(Kristinsson & Rasco, 2010)으로 상용화 되었지만 시장에서 특수 목적을 위한 고 품질의 가수분해물에 대한 수요 증가, 식품산업에서는 특 정 효소를 사용하여 특정 부위의 펩타이드 결합을 자르기 시작 (Mullally et al., 1994)하면서 가수분해물의 활용 영 역이 더욱 증가하고 있다. 특히, 자원의 효율적 이용 또는 환경적인 측면에서 어류단백질의 효소적 가수분해가 재조 명(Chalamaiah et al., 2012)되고 있으며 반응메카니즘에 대 한 많은 연구가 보고되었다(Mohr, 1978; Kristinsson & Rasco, 2000).
이와 같은 lab scale에서의 연구결과를 산업화하기 위해 서는 pliot plant scale로 규모를 확장시켜 전체 공정에 대 한 생산 효율성을 확인해야한다. Pliot plant scale 연구는 주로 생물자원을 가수분해하여 바이오매스를 생산하는 연 구에서 진행되어 왔으며(Ropars et al., 1992; Taherzadeh et al., 2007), Himonides et al. (2011)은 단백질 분해효소인 파 파인을 이용하여 대구 살과 뼈로부터 가수분해물의 산업적 생산 가능성을 검토하고자 pilot plant scale에서 연구를 하 였으나 아직까지 미미한 실정이다. 더구나 효소적 가수분 해에 고압을 활용한 경우는 거의 없는 실정이다.
따라서 본 연구에서는 전 보(In et al., 2016a,b)에서의 연구결과를 산업화 공정으로 개발하기 위하여 pliot plant scale로 규모를 확장시켜 생멸치 중고압효소가수분해물 생 산에 대한 가능성 및 효율을 확인하고, 가수분해물의 효용 성을 확대하기 위하여 10 kDa으로 cut-off 한 분획물을 분 말 제형으로 개발 하고자 분무건조 조건을 탐색하였다.
재료 및 방법
본 연구에서 사용한 멸치(Engralis japonica)는 동해수산 (Busan, Korea)에서 구입한 것으로 2013년 3월에 제주도 해역에서 어획된 것으로, -20°C에서 냉동 보관하여 실험에 사용하였다. 실험에 사용 된 효소는 Alcalase® 2.4 L (Novozymes, Bagsvard, Denmark)와 FlavourzymeTM 500MG (Novozymes)로 대종상사(Seoul, Korea)로부터 구입하였다.
중고압을 이용한 멸치 가수분해물의 제조는 전 보(In et al. 2016b)와 같은 순서로 규모가 다른 장비를 사용하여 제조 되었다. 멸치와 물을 1:2 (w/w)의 비율로 혼합하여 믹서기로 2분씩 세 번 분쇄한 후에 콜로이드밀(Super masscolloider, ZA10-15J, Masuko sangyo, Kawaguchi, Japan)로 균질화하 였다. Alcalase® 2.4 L와 FlavourzymeTM 500MG을 각각 1:5 비율로 혼합한 혼합효소를 균질화된 멸치 분쇄물에 원료 멸치 대비 1% (w/w)를 첨가한 후 pilot 규모의 고 압액화시스템(TFS 50 L, Dimapuretech, Incheon, Korea) 을 이용하여 50°C, 75 MPa의 압력 조건 하에서 12시간 동안 중고압 처리하였다. 중고압 처리 한 시료는 80°C에 서 20분 동안 중탕 처리를 하여 효소를 불활성화 시킨 후 4°C에서 12시간 이상 숙성하여 지방층을 제거하였다. 지방 층이 제거된 시료는 연속식 원심분리기(Tubular Centrifuge, A-V10675G, Tomoe Engineering, Osaka, Japan)를 이용하여 17,000 rpm에서 원심 분리하였으며, 원심 분리 전 시료를 멸치중고압효소가수분해물로 원심 분리 후 상층액을 APH 로 명명하였다. 각각의 일부를 동결건조하여 -4°C에서 저 온저장하면서 분석용 시료로 사용하였다.
APH를 10 kDa, 5 kDa 이하로 분획하기 위하여 사용된 한외여과장치는 Proflux M60 Tangential flow filtration system (Milipore, Bedford, MA, USA)으로 최대 용량은 30 L (launching tank 27 L+dead volume 3 L)로 이 시스템 에 10, 5 kDa 한외여과막(Pellicon 2 cassette Biomax 5 or 10, Milipore)을 장착하였으며, 250 Da 이하로 분획하기 위 하여 사용된 나노여과 시스템은 Prolab system (Milipore) 으로 최대 용량은 5 L (launching tank 4.5 L+dead volume 0.5 L)이고, 이 시스템에 Helicon-RO4 (Milipore)을 장착하 였다. 한외여과(10 kDa, 5 kDa) 및 나노여과(250 Da)는 Fig. 1의 순서대로 진행하여 분자량이 10 kDa 이상의 분획물은 APHU-1, 5 kDa에서 10 kDa 사이의 분획물은 APHU-2, 250 Da에서 5 kDa 사이의 분획물은 APHN-1으로 나머지 250 Da 이하의 분획물은 APHN-2로 명명한 후 일부를 동 결건조 하여 -4°C에서 저온저장하면서 분석용 시료로 사용 하였다. 동결건조된 시료를 2.5% w/v로 재 용해한 후에 전 보(Yun et al., 2015; In et al., 2016b)에서와 같은 방법으로 pH, 수용성 고형분 함량, 총 고형분 함량, 염도, Na 함량 및 질소함량 등과 같은 물리화학적 특성을 측정하였다.
원재료 및 멸치 가수분해 전과 후, 그리고 공정 전 과정 (아래의 각 step)에 있어 무게와 질소함량(Kjeldahl), 수분 또는 총 고형분 함량을 측정하였다. 1) 멸치, 물, 그리고 효소의 무게와 2) 멸치 가수분해물의 무게 3) 원심분리 후 상층액의 무게 4) 멸치중고압효소가수분해물의 조단백 함 량(N×6.25) 5) APH의 조단백 함량 6) APH의 고형분 함 량(drying at 105°C until constant weight) 및 7) UF/NF 전 후의 무게 및 조단백 함량을 단계별로 측정하고 계산하 였다.
Himonides et al. (2011)의 방법에 따라 가수분해 후에 달성된 단백질 용해도(the degree of protein solubilization) 를 나타내는 값으로 centrifuging index for protein (CIP)을 식 (1)에 따라 산출하였다. 원심분리 전 후의 질소함량은 pH 조절 없이 측정하였다.
APH 및 각 분획물에 대한 분자량 분포를 확인하기 위 하여 Gel permeation chromatography (GPC) 분석을 전 보 (In et al., 2016a)와 동일한 방법으로 수행하였다. 사용된 GPC system은 ӒKTAprime plus system (GE Healthcare Life Sciences, Buckinghamshire, UK)이었으며, 표준물질로 는 Vitamin B12 (MW 1355.37 Da, Sigma, St. Louis, MO, USA), Vitamin B1 (MW 337.27 Da, Yakuri Pure Chemicals Co. Ltd., Osaka, Japan), L-Glutamic acid (MW 147.13 Da, Samchun Pure Chemicals Co. Ltd., Pyeongtack, Korea)를 사용하였다.
결과 및 고찰
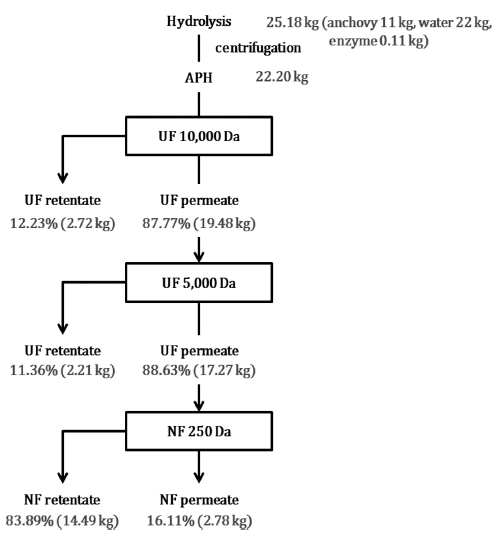
중고압에서 pilot plant 규모로 APH 생산 및 분획 과정에 따른 물질 수지는 Fig. 2와 같다. 멸치 11 kg과 물 22 kg 에 멸치 중량의 1%인 0.11 kg의 효소를 첨가하여 중고압 효소가수분해를 시킨 후에 제조된 가수분해물의 무게는 25.18 kg으로 생산 과정에서 초기 계산 무게(33.11 kg)보다 약 8 kg 정도가 손실되었으며, 원심분리 후 상층액의 무게 는 22.2 kg으로 약 3 kg 정도가 손실되었다. 이는 슬러지와 연속형 원심분리 장치 내에서 빠져나오지 못한 양으로 추 측된다. 한외여과 시스템(MWCO 10 kDa)을 통하여 분획한 10 kDa retentate 시료(10 kDa≤MW, APHU-1)와 permeate 시료(MW<10 kDa)의 비율은 각각 12.23%와 87.77%였으 며, 10 kDa permeate 시료를 한외여과 시스템(MWCO 5 kDa)을 이용하여 2차 분획한 결과 5 kDa retentate 시료(5 kDa≤MW<10 kD, APHU-2)와 permeate 시료(MW<5 kDa) 의 비율은 각각 11.36%와 88.63%로 나타났으며 5 kDa permeate 시료를 나노여과 시스템(MWCO 250 Da)을 이용 하여 3차 분획한 결과 250 Da retentate 시료(250 Da≤MW <5 kD, APHN-1)와 permeate 시료(MW<250 Da, APHN-2) 의 비율은 각각 83.89%와 16.11%였다. 각 분획물의 비율 은 사용한 여과장치의 특성상 시료가 dead volume 이하로 남았을 경우 물을 넣어 관에 남아있던 시료를 밀어주었기 때문에 여과장치 통과 후 시료의 양이 증가하였다. 따라서 각각의 시료를 건조하여 얻은 분말의 무게를 이용하여 retentate 시료와 permeate 시료의 비율을 계산하였다.
멸치중고압효소가수분해물로부터 APH로의 단백질 용해 도 또는 추출효율은 CIP 값을 계산하여 Table 1에 나타내 었다. 한 배치당 멸치 가수분해물의 원심분리 전 단백질 함량은 1 kg당 51.90±2.52 g으로 한 배치의 분쇄 혼합된 시료의 총 단백질 양은 1,306.84±63.45 g이었다. 멸치중고 압효소가수분해물의 soluble한 상태로 존재하는 단백질의 함량을 알아보기 위하여 원심분리 후 상층액의 단백질 함 량을 측정한 결과 총 830.43±9.73 g의 단백질이 상층액에 존재하여 가수분해 후 단백질 용해도(CIP 또는 rate of protein solubilization)는 63.54±3.12%로 계산되었다.
| Anchovy/water (1:2) | |
|---|---|
| Protein concentration of washed Anchovy (g/kg) | 51.90±2.521) |
| Soluble protein/total protein (CIP) (%) | 63.50±3.12 |
Table 2에는 멸치중고압효소가수분해물로부터 APH 및 각 분획물의 동결건조 후 중량에 따른 수율 및 질소함량을 기준으로 한 수율을 나타내었다. 각 시료의 동결 건조 후 측정한 수분함량을 기준으로 환산한 멸치중고압효소가수 분해물 8.39 kg당 건부량 기준의 멸치중고압효소가수분해 물 중량은 2.1 kg이었으며, APH의 건조 중량은 1,110.20 g 으로 멸치중고압효소가수분해물 대비 52.86%의 수율을 나타내었다. 각 분획물들의 건조 중량은 APHU-1 130.2 g, APHU-2 94.90 g, APHN-1 309.99 g, APHN-2 59.51 g이 었으며 멸치중고압효소가수분해물에 대한 수율로 환산 시 각각 6.20%, 4.64%, 14.76%, 2.83%로 APHN-1의 수율이 분획물들 중 가장 높게 나타났다. 즉, 가수분해물의 대부분 이 250 Da에서 5 kDa 사이의 분자량 분포를 하고 있음을 확인할 수 있었다. 단백질 함량을 기준으로 하는 경우에도 유사한 경향을 보이고 있다. 그러나 물질 수지를 이용하여 분석하면, 장치의 dead volume을 고려하여도 27% 이상의 손실이 발생되었다. Mohr (1978), Kristinsson & Rasco (2000) 그리고 Himonides et al. (2011)에 의하면 가수분해 첫 단계에서 주로 soluble material들이 대량으로 손실되며, 어류가수분해 제조에 참여하는 작업자들 또한 장비 및 원 료 처리 미숙에 의하여 회수율이 낮아지는데 일조한다고 하였다. 즉, 가수분해물의 산업화를 위해서는 장비 사용법의 훈련 또는 분획 공정의 재검토가 필요하다고 판단하였다.
Table 3에서는 APH 및 각 분획물을 동결건조 후 2.5% 로 재 용해하여 측정한 물리화학적 특성을 Table 4에는 유 리아미노산 함량을 측정하여 동결건조 시료 1 kg 당 mg으 로 나타내었다.
pH는 APHN-2시료가 5.9±0.2로 가장 낮게 나타났으며, 나머지 시료는 6.2±0.2에서 7.1±0.1 범위로 시판 간장 및 어간장과 유사하였다. 수용성 고형분 함량(°Brix) 역시 시 료별로 유사한 결과를 나타냈으며, 염도계로 측정한 salt의 양(%)은 APHN-2 시료가 다른 시료들보다 월등히 높게 나 타났다. 이것은 염이 나노 여과막을 모두 통과함으로써 APHN-2 분획물에 모두 모였기 때문이라고 사료된다. 즉, 나노 여과 시스템은 peptides의 분획뿐만 아니라 desalting에 도 큰 효과가 있다는 것을 확인할 수 있었다. Ion chromatography로 정량 분석한 sodium (Na) 함량과 염도계로 측정 한 염의 양이 일치하지는 않았지만, 공통적으로 APHN-2 시료에서 두드러지게 염의 농도가 높았으며, 짠맛 증진 peptides가 가장 많이 분포되어 있으리라 여겨지는 APHN- 1 시료에 가장 적은 sodium 함량을 나타내어 서로 유사한 경향성을 나타내었다.
Table 4를 보면, 쓴맛을 내는 tryptophane 함량은 APHN- 1 분획물에서 가장 낮게 나타났던 반면, 감칠맛을 내는 glutamic acid의 함량은 APHN-1 분획물에서 가장 높게 나 타났다. 따라서 분자량별로 분획한 가수분해물 중 APHN- 1 분획물은 짠맛 증진효과 뿐만 아니라 유리아미노산 함량 이 높아 그 자체의 정미성분과 상호작용하여 맛의 상승효 과 또한 가져올 것으로 판단되었다. 이 밖에도 단맛을 내 는 glycine, proline, alanine 및 serine은 APHN-2 분획물에 가장 많이 함유되어 있었다. 이와 같이 시료별 개별 유리 아미노산 함량에는 차이가 있었지만 유리아미노산 프로파 일의 경우에는 APH와 각 분획물이 일치하였다.
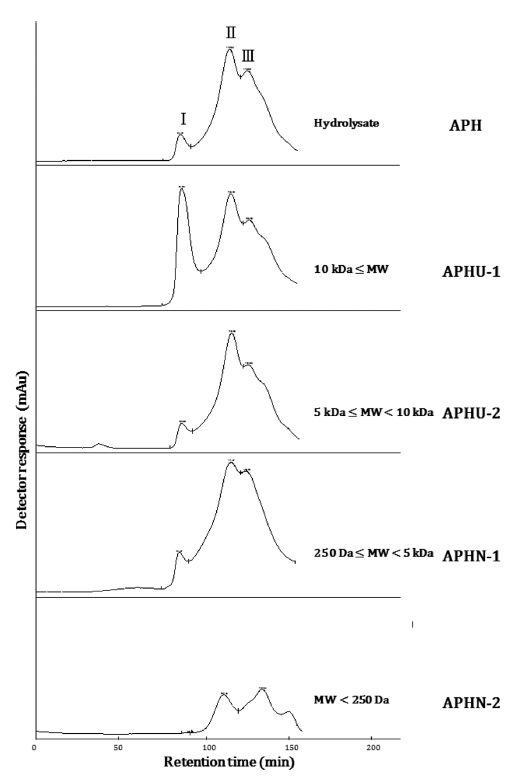
APH와 한외여과 및 나노여과하여 분획된 시료의 분자량 분포 결과는 Fig. 3과 같다. 주요 peak 3 개(peak I; 1,300 Da 이상, peak II; 250 Da-1,300 Da, 그리고 peak III; 250 Da 이하)가 나타났으며 이는 멸치 가수분해물에 대한 Yun et al. (2015)과 In et al. (2016a)의 GPC 결과와 매우 유사 한 패턴을 보였다. 또한 분자량이 1,300 Da보다 큰 분획물 (APHU-1, APHU-2, APHN-1)의 분자량 분포를 살펴보면 peak II와 peak III가 나타났다. 분자량을 기초로 하여 분획 된 분획물들은 1,300 Da 이하에서 서로 유사한 분자량 분 포 및 패턴을 보였으나, 분획에 사용된 막의 한계 분자량 에 따라 peak의 비율은 서로 차이를 보였다. APHU-1의 분자량 분포도에서 peak I의 비율은 24.6%로 APH 및 다 른 분획물에 배하여 높은 값으로 나타났다. 또한 막의 한 계 분자량이 낮아질수록 peak I이 차지하는 비율은 점차 감소되어 APHN-2에서 peak I의 비율은 0.0%로 나타난 반 면, 막의 한계 분자량이 낮아질수록 peak II와 III의 비율이 높게 나타났다. In et al. (2016a)의 연구를 살펴보면 짠맛증 진효과가 있는 arginyl dipeptides는 주로 peak II에 분포될 가능성이 높다고 하였으며, 이를 토대로 분자량 분포도 확 인 결과 APHU-2와 APHN-1에 짠맛증진물질인 arginyl dipeptides가 다량 존재할 것으로 추측되었다.
분무건조는 미세캡슐화 등 분말 제형을 만드는 상업화된 방법 중 가장 보편화 된 방법으로 여러 분야에서 다양한 목적으로 이용되고 있다. 미역과 다시마와 같은 해조류는 특별한 처리 공정을 거치지 않는 경우 비린내가 심하여 다 양한 용도 개발에 어려움이 따르나 분무건조의 경우 분무 탈취(deordorization by spray drying)에 의한 맛과 냄새의 masking 효과 및 최종산물의 안정성이 좋고 대량으로서 계 속적인 생산이 가능하며, 또한 산업 현장에서 쉽게 적용되 고, 저렴하게 적용될 수 있는 장점이 있다. 이러한 장점을 살려 10 kDa permeate 즉, APHU-2의 유용성을 증진시키 고자 분말 제형을 만들고자 4가지 조건으로 분무건조를 실 시하여 분무건조 수율과 수분 함량을 측정한 결과를 Table 5에 나타내었다.
| Condition 11) | Condition 22) | Condition 33) | Condition 44) | |
|---|---|---|---|---|
| Recovery ratio (%) | 34.01±1.055),a | 22.31±1.12b | 25.61±0.95c | 27.70±1.03d |
| Moisture (%) | 9.11±1.05a | 9.33±1.22a | 9.66±2.52a | 9.44±1.30a |
1) Inlet temperature 180°C, Atomizing pressure 180 kPa, Blow power 0.50 m3/min, Feeding rate 500 mL/h.
2) Inlet temperature 180°C, Atomizing pressure 240 kPa, Blow power 0.50 m3/min, Feeding rate 500 mL/h.
3) Inlet temperature 200°C, Atomizing pressure 240 kPa, Blow power 0.50 m3/min, Feeding rate 500 mL/h.
각각의 수율은 기기에 주입한 10 kDa permeate 액상 시 료(375 mL)에 존재하는 고형분 함량(18.38 g/375 mL) 대비 건조된 파우더의 무게(g)를 백분율로 나타내었다. 분무조건 에 따른 시료의 수율은 조건에 따라 각각 34.01±1.05%, 22.31±1.12%, 25.61±0.95% 그리고 27.70±1.03%였으며, 수 분함량은 각각 9.11±1.05%, 9.33±1.22%, 9.66±2.52%, 9.44 ±1.30%로 나타났다. Inlet temperature에 따른 결과를 살펴 보면 atomizing pressure가 180 kPa로 고정된 condition 1과 condition 3의 수율을 비교한 결과 inlet temperature가 더 낮은 condition 1의 수율이 더 높게 나타났으나, atomizing pressure가 240 kPa로 고정된 condition 2와 3을 비교한 결 과 inlet temperature가 더 높은 condition 3의 수율이 더 높게 나타났다. Atomizing pressure에 따른 수율을 비교한 결과, inlet temperature가 180°C로 고정된 condition 1과 4 중에서 atomizing pressure가 더 낮은 condition 1의 수율이 더 높게 나타났으며, inlet temperature가 200°C인 condition 3과 4의 수율을 비교하였을 때에도 atomizing pressure가 더 낮은 condition 4의 수율이 더 높게 나타났다. 따라서 분무건조 수율은 inlet temperature보다 atomizing pressure 에 영향을 더 많이 받는 것으로 추측된다. 이러한 결과는 NaCl/maltodextrin 혼합물의 분무건조에 미치는 공정변수의 영향에 대한 Cho et al. (2015)의 보고와 유사한 경향을 나타내고 있다. Chindapan et al. (2010)은 어간장을 electrodialysis하여 염농도를 달리하여 시료를 분무건조한 경우, inlet temperature가 가장 중요한 변수라고 보고하였 지만 이 경우에는 atomizing pressure를 공정변수로 고려하 지 않았기 때문으로 사료된다.
요 약
중고압효소가수분해 공정의 산업화를 위하여 설정한 생 멸치고압효소가수분해 최적 조건(복합효소 1%, 압력 75 MPa, 온도 59°C 그리고 반응시간 12 시간)으로 pilot plant 규모의 중고압 처리장치를 이용하여 중고압멸치효소가수분 해물을 제조하고, 이를 pilot plant 규모의 연속식 원심분리 기와 막여과 장치(UF와 NF)로 APH 및 분자량 분포가 다 른 4가지 분획물을 제조하였다. 그리고 분획물을 분말 제 형으로 제조하여 그 유용성을 확대하고자 분무건조 조건을 탐색한 결과, 가수분해는 본 조건에서 거의 달성되었고, APH의 단백질 용해도 및 수율은 각각 63.50%와 55.61% 이었다. 분획물의 수율, 특성, 유리아미노산 조성 및 분자 량 분포 확인한 결과, 몇몇 분자량 대의 피크들이 여러 분 획물에서 발견되는 것을 확인할 수 있었다. 비록 여과막의 한계 분자량별로 peptides가 정확하게 분리되지는 않았지 만, 여과막의 한계 분자량이 작아질수록 분획물에서 큰 분자량의 peptides가 감소하거나 제거된다는 사실을 확인 할 수 있었다. 또한 짠맛증진물질로 알려진 arginine과 arginyl dipeptides는 10 kDa permeate에 다량 존재할 것으 로 추측되었으며 분획 수율이 손실이 27% 이상 발생되어 가수분해물의 산업화를 위해서는 장비 사용법의 훈련 또는 분획 공정의 재검토가 필요하다고 판단하였다. 이에 APH 또는 분획물의 분말 제형화를 위해서는 70% 이상의 수율 을 얻을 수 있는 최적화 연구와 좀 더 효율을 높힐 수 있 는 공정개선 연구가 필요하다고 판단되었다.








