서 론
감자(Solanum tuberosum L.)로부터 제조되는 건조식품소 재들은 감자가루, 감자전분, 감자과립(potato granule), 감자 다이스(potato dice), 감자후레이크(potato flake)가 있다 (Chun & Kim, 2014). 건조감자소재들이 다양한 가공식품 의 주원료 및 부원료로서 널리 활용되는 서구와는 달리 국 내에서는 감자전분이 요식업의 조리원료로 사용되는 이외 에 감자가루, 감자과립 및 감자전분이 스낵류 및 인스턴트 스프류의 가공식품에 제한적으로 사용되는 실정이다(Chun & Kim, 2014; Shin et al., 2015). 국내 식품산업에 있어 건조감자소재들의 제한된 사용은 이들의 가격적인 측면을 고려하지 않더라도 감자를 주식으로 여기지 않으며, 고 혈 당반응 식품으로 인식되고(Ek et al., 2012), 감자가루 및 감자전분의 빠른 침강속도, 급격한 점도발달 및 끈적거리 며 접착성이 강한 풀(paste)의 형성과 같은 통제가 용이하 지 않은 가공적성 때문이다(Shin et al., 2015). 그래서 건 조감자소재의 다양성을 확장시키고 산업적 활용도를 증대 하기 위해 기존의 건조감자소재들과 다른 형태학적 특성을 보유한 건조감자소재가 개발되었다.
개발된 건조감자소재는 감자전분들을 내포하는 유세포들 (parenchyma cells)의 집합체인 감자조직(Bordoloi al., 2012)으로부터 손상되지 않은 개별 유세포들로 분리하고 건조하여 제조된다. 감자유세포는 감자엽육(potato flesh)을 킬레이트제를 포함한 묽은 수산화나트륨용액(Anantachote, 2009) 또는 펙틴 가수분해효소(Anantachote, 2009; Kim & Kim, 2015a, 2015b; Shin et al., 2015) 처리를 통해 유세 포벽(parenchyma cell walls)의 중간층(middle lamella)에 존 재하는 펙틴성 물질들(pectic substances)을 제거함으로써 분 리된다. Anantachote (2009)는 킬레이트제를 포함한 묽은 수 산화나트륨용액보다 polygalacturonase의 처리가 감자유세포 의 분리시간을 단축하고 분리수율을 증가시키는 것으로 보 고하였다. Kim & Kim (2015a, 2015b)은 polygalacturonase 를 이용하여 스팀조리된 감자로부터 노화된 감자전분을 포 함하는 감자유세포를 분리하였다. Kim & Kim (2015b)과 Shin et al. (2015)는 생감자로부터 polygalacturonase를 이 용하여 호화되지 않은 상태의 감자전분을 포함한 감자유세 포를 분리하여 건조감자유세포를 제조하였다. 현재까지 선행 된 연구들(Anantachote, 2009; Kim & Kim, 2015a, 2015b; Shin et al., 2015)은 polygalacturonase를 이용하여 생 및 조리된 감자로부터 감자유세포를 성공적으로 분리하였지만 감자유세포의 분리를 위한 최적 효소반응조건을 보고하지 않았으며, 사용된 펙틴 가수분해효소도 건조감자유세포 소 재를 상업적으로 생산하기에 비용적인 측면에서 애로사항 이 있고, 감자유세포의 분리수율과 직접적인 연관이 있을 것으로 예상되는 감자전분 함량에 대한 저온저장기간의 영 향을 간과하고 있다. 게다가 감자유세포의 분리수율에 대 한 감자품종의 영향을 고려하지 않았으며, 건조감자유세포 소재의 제조를 위한 원료선정에 대한 기준을 제시하지 못 하고 있다.
따라서 본 연구의 목적은 감자로부터 감자유세포의 분리 를 위한 최적 효소반응조건을 조사하고, 최적 효소반응조 건하에서 감자유세포의 분리수율에 대한 국내산 감자품종 의 영향을 조사하였으며, 감자유세포의 분리수율과 감자의 성분학적 및 조직경도 사이의 상관분석을 통해 건조감자유 세포 소재의 제조에 적합한 감자원료의 선정기준을 탐색하 였다.
재료 및 방법
국내에 존재하는 가원(Gawon), 가황(Gahwang), 고운(Goun), 남서(Namseo), 남작(Irish Cobbler), 대서(Atlantic), 대 지(Dejima), 방울(Bangul), 수미(Superior), 신남작(Sinnamjak), 새봉(Sebong), 세풍(Shepody), 조원(Jowon), 조풍(Jopung), 추강(Chugang), 추동(Chudong), 추백(Chuback), 추 영(Chuyoung)의 18품종 일반감자들과 서홍(Seohong), 자서 (Jaseo), 자심(Jasim), 자영(Jayoung), 하령(Haryeong), 홍영 (Hongyoung)의 6품종 유색감자들을 농촌진흥청 국립식량과 학원 고령지농업연구소(Pyeongchang, Gangwon, Korea)로부 터 제공받았다. 공급받은 감자들(2013년 여름 수확하여 12 월까지 저장된 것)은 상대습도 90-95%의 저온저장고(4°C) 에 저장하였으며, 이중 일부는 세척·박피하여 1 cm 두께의 막대모양으로 세절하고 폴리프로필렌 지퍼백에 넣어 -45°C 에서 48시간 동안 급속동결한 후 -18°C의 냉동고에서 저장 하면서 본 연구의 재료로 사용하였다. 상업적인 펙틴 가수 분해효소 혼합물은 식품첨가물 등급으로 pectin lyase가 주 성분인 Novozym 33095 (1,150 U/mL)와 polygalacturonase 가 주성분인 pectinex Ultra SP-L (540 U/mL)을 아피스바 이오켐(Daegu, Korea)으로부터 구입하여 사용하였다. 여기 서 효소 1 unit (U)은 주어진 조건(40°C, pH 3.5) 하에서 단위시간(per minute) 당 1 μmole의 α-D-galacturonic acid 를 생성하는 효소의 양으로 규정하였다. 이외 감자분말의 분석 및 감자유세포의 분리에 사용된 시약과 용매들은 ACS 등급 이상의 것을 사용하였다.
감자조직으로부터 유세포 분리의 최적조건 탐색은 대지 품종의 국내산 감자를 이용하였으며, 감자조직의 상태, 펙 틴분해효소의 종류, 효소반응온도, 효소반응 pH, 효소반응 시간, 펙틴 가수분해효소용액의 희석배수 및 감자조직과 반응용액의 혼합비율을 감자유세포 분리조건들로 하였다. 세척·박피한 생감자는 정육면체 모양(1 cm × 1 cm × 1 cm) 으로 세절하여 흐르는 물로 감자의 표면으로 배출된 전분 을 세척하여 표면수분을 제거하였다. 동결된 감자는 0.1% (w/v) ascorbic acid 용액에 담가 4°C에서 18시간 동안 해 동하고 생감자의 처리와 동일하게 준비하였다. 준비된 감 자 시료들은 100 mM citrate 완충용액(350 mL)과 혼합하고 ascorbic acid (140 mg)을 가하여 효소반응온도에서 기계식 교반기(overhead stirrer MS-3060, Misung Scientific Co. Ltd., Yangju, Korea)를 이용하여 100 rpm으로 30분 동안 효소반응온도에서 교반하였다. 30분 후 펙틴 가수분해효소 희석액을 1 mL를 가하고 효소반응온도에서 효소반응시간 동안 교반하면서 효소반응시켰다. 효소반응시간 후에 반응 혼합물은 20 mesh와 140 mesh 표준체들(No. 20 & 140, Chunggye, Seoul, Korea)을 순차적으로 통과시키고 140 mesh 표준체 위의 감자유세포들은 흐르는 물로 5분간 세 척하고 과량의 탈이온수에 분산시켜 10분간 방치한 후 140 mesh 표준체를 이용하여 회수하였다. 감자유세포들은 무수에탄올(300 mL)에 분산시켜 10분간 탈수하여 감압여과 하고 45°C에서 48시간 동안 건조하여 건조감자유세포를 제조하였다. 감자유세포의 분리수율은 감자유세포의 건조 중량에 대한 감자유세포 분리를 위해 사용된 감자시료의 건조중량의 백분비율로 나타내었다.
감자유세포(0.1 g)는 증류수(2 mL)에 분산시키고 1.0% (w/v) Congo red 수용액을 2 mL 가한 후 상온에서 5분 동 안 염색하고 상등액이 투명해질 때까지 증류수로 세척하였 다. 염색된 감자유세포는 역상광학현미경(Axiovert 100, Carl Zeiss Microimaging Inc., Thornwood, NY, USA)을 이용하여 40배의 배율로 관찰하였다(Kim & Kim, 2015a).
세척·박피한 생감자의 중심부분을 취하여 적외선수분측 정기(LJ16, Mettler-Toledo AG, Greifensee, Switzerland)를 이용하여 105°C에서 수분함량을 결정하고, 고형분 함량은 100에서 수분함량을 차감하여 계산하였다.
생감자는 세척·박피한 후 1 cm 두께의 막대모양으로 세 절하고 -80°C에서 36시간 동안 동결한 후 진공동결건조기 를 이용하여 4일 동안 건조하였다. 건조된 감자는 가정용 믹 서기(HMF-3450S, Hanil Electric, Incheon, Korea)를 이용 하여 분쇄하여 50 mesh 표준체(No. 50, Chunggye, Seoul, Korea)를 통과시킨 후 PET 사각 샘플병(500 mL)에 넣어 상온에서 보관하면서 분석시료로 하였다.
수분함량은 적외선수분측정기(LJ16, Mettler-Toledo AG, Greifensee, Switzerland)를 이용하여 105°C에서 정량하였고, 조단백질 함량은 Kjeldahl법에 의해 총 질소 함량을 측정 한 후 단백질 환산계수 6.25를 곱하여 계산하였다(AOAC, 2000). 조회분과 조지방 함량은 각각 AOAC법 923.03과 960.39에 따라 분석하였다(AOAC, 2000). 총 탄수화물 함 량은 감자가루의 건조중량 100 g에서 조단백질, 조지방과 조회분의 건조중량의 합을 차감하여 계산하였다. 감자가루 의 총 전분 함량은 총 전분 분석 kit (total starch assay kit, Megazyme Int., Wicklow, Ireland)을 이용하여 AACC 법 76-13에 준하여 분석하였다(AACC, 2010). 비전분성 탄 수화물 함량은 총 탄수화물 함량에서 총 전분 함량을 차감 하여 나타내었다.
감자가루의 펙틴 함량을 결정하기 위하여 감자가루 1 g (d.b)과 추출용매(0.75% sodium hexametaphosphate를 함유 한 0.05 M NaOH) 25 mL을 50 mL 원심분리관 안에서 혼 합하여 25°C에서 2시간 동안 진탕하고 3,000 g에서 30분간 원심분리하였다. 상등액은 100 mL 정용플라스크로 옮기고 침전물은 추출용매 25 mL에 다시 분산시켰다(Nurdjanah et al., 2013). 이와 같은 펙틴 추출조작은 총 3회 반복하였다. 추출조작으로부터 회수하여 100 mL 정용플라스크에 취합 한 상등액은 탈이온수를 가하여 100mL로 정용하였다. 추출 된 펙틴은 carbazole-sulfuric acid법에 따라 D-galacturonic acid를 정량하여 나타내었다(Taylor & Buchanan-Smith, 1992). 펙틴용액 0.1mL를 유리시험관에 넣고 농축황산 3mL 와 0.1% (w/v) carbazole (2526-4425, Daejung Chemicals & Metals Co. Ltd., Siheung-si, Gyeonggi-do, Korea) 용액 0.1 mL를 가하여 혼합하였다. 반응혼합물은 60°C에서 1시
간 동안 반응시킨 후 530 nm에서 흡광도를 측정하고 Dgalacturonic acid (73960, Sigma-Aldrich Co., St. Louis, MO, USA) 표준용액을 사용하여 작성된 검량곡선에 의해 D-galacturonic acid 함량을 측정하고 아래 식에 따라 감자 가루의 펙틴함량을 계산하였다.
여기서 0.9는 anhydrogalacturonic acid의 몰질량(176.14 g/ mol)에 대한 galacturonic acid 의 몰질량(194.14 g/mole)의 비율이다.
세척·박피한 생감자의 중심부를 직경 2 cm, 높이 2 cm 의 원기둥으로 성형하여 압착경도를 위한 시료로 하였으며, 생감자 1개 당 분석시료 1개를 제조하였고, 총 10개의 시 료에 대해 압착경도를 반복하여 측정하였다. 압착경도는 원형 probe(지름 75 mm)가 장착된 물성분석기(TX-TA, Stable Micro Systems Ltd., London, UK)를 이용하여 측정 하였다. 원통형 생감자 시료는 변형율 30%로 압착하였으 며, 물성분석기 운전조건은 pre-test speed 2.0 mm/s, test speed 1.0 mm/s와 post-test speed 10 mm/s이었다.
감자유세포의 분리는 반응조건에 따라 3회 반복하여 수 행하였으며, 감자가루의 성분특성의 분석과 측정은 최소 3 회 이상 반복하였고, 감자조직의 압착경도는 감자품종 및 처리조건에 따라 10회 반복하여 측정하였다. 측정된 특성 치들과 감자유세포의 분리수율은 one-way ANOVA 분석을 수행하여 평균±표준편차로 나타내었으며, 평균값들 사이의 통계적 유의성은 95% 신뢰수준에서 Tukey법을 이용하여 분석하였다. 또한 감자유세포의 분리수율, 감자가루의 화학 적 성분 특성들과 감자조직의 압착강도 사이의 상관관계를 조사하기 위해 Pearson’s correlation을 수행하였다. 모든 통 계적 계산과 분석은 Minitab 16 (Minitab Inc., State College, PA, USA)에 의해 수행되었다.
결과 및 고찰
펙틴 가수분해효소를 이용하여 유세포의 집합체로 구성 되어 있는 감자조직으로부터 유세포를 개별적으로 분리하 기 위한 효소반응조건을 탐색하였다(Table 1). 감자유세포 분리수율에 대한 감자조직의 상태에 대한 영향을 조사하였 을 때, 생 감자조직을 원료로 사용하는 것(22.3%)보다 냉 동감자조직을 해동하여 사용하는 것(56.7%)이 유의적으로 높은 분리수율을 나타내었다(p<0.05; Table 1-Set I). Bordoloi et al. (2012)은 유세포들은 생 감자조직 내에 치 밀하게 압착되어 있어 그들의 크기와 모양이 다양하다고 보고하였다. 냉동채소들(연근, 양파)을 해동 시 수분 및 영 양성분의 손실로 유의적인 수준의 해동감량(drip loss)이 발 생한다고 보고하였다(Jang et al., 2014; Park & Song, 2015). 본 연구에서 생 감자조직보다 냉동감자조직이 높은 유세포 분리수율을 나타낸 것은 냉동감자조직의 해동에 따 른 유세포 내의 수분과 세포액의 드립(drip)으로 유세포가 수축되어 유세포들 사이에 존재하는 펙틴성 물질들에 대한 펙틴 가수분해효소들의 작용이 생 감자조직보다 용이하였 기 때문으로 생각된다. 따라서 건조감자유세포 소재의 생 산을 목적으로 할 때 감자를 냉동하여 저장하면서 사용하 는 것이 감자의 저온(4~8°C) 저장 시 저온당화현상에 의한 감자전분의 손실(Kaur et al., 2009)을 최소화하면서 높은 수율의 감자유세포를 얻을 수 있을 것으로 판단된다.
[Abbreviation] E: dilution times of enzyme solution, T: reaction temperature, t: reaction time, V: volume of the reaction medium, W: potato weight (w.b).
한편 냉동감자조직으로부터 감자유세포의 분리수율은 반 응온도가 30°C에서 50°C로 상승하면서 25.4%에서 58.1%로 상승하였고(Table 1-Set II), 이 결과는 pectin lyase와 polygalacturonase의 효소반응 최적온도가 50°C 부근에서 형성되 기 때문으로 생각된다(Tomlin et al., 2013). 반응시간은 1시 간에서 2시간으로 길어지면서 감자유세포 분리수율이 28.0%에서 60.7%까지 급격히 증가하였으나 3시간까지 연장 하였을 때는 58.4%로 2시간 반응하였을 때와 유의적인 차 이를 보이지 않았다(Table 1-Set III). 반응 pH는 2.5에서 5.5 로 증가하면서 감자유세포 분리수율이 61.6%에서 0.4%로 감소하였다(Table 1-Set IV). 펙틴 가수분해효소들의 생산자 자료에 의하면 본 연구에서 사용한 상업적 펙틴 가수분해효 소들(Novozym 33095, Pectinex Ulta SP-L)은 Aspergillus aculeatus로부터 생산되어 셀룰로오스 가수분해효소들을 함 유하고 있다. 따라서 감자조직에 대한 효소반응 시 셀룰로 오스 가수분해효소들의 과도한 활성화는 유세포막을 손상 시켜 유세포의 분리수율을 저하시킬 수 있다. A. aculeatus 유래 셀룰로오스 가수분해효소의 최적 pH는 5.0인 반면에 (Naika et al., 2007) 펙틴 가수분해효소들의 최적 pH는 3.5이다(Tomlin et al., 2013). 결과적으로 감자유세포 분리 수율이 pH 2.5에서 가장 높은 것은 높은 것은 셀룰로오스 가수분해효소들의 활성이 제한되었기 때문인 것 같다.
상업적 펙틴 가수분해효소들은 탈이온수를 이용하여 50- 400배로 희석하여 효소반응완충용액 350 mL당 1 mL를 가 하여 감자유세포 분리수율과 형태학적 특성에 대한 효소사 용량의 영향을 조사하였다(Table 1-Set V; Fig. 1). 펙틴 가 수분해효소의 희석배수가 50배에서 200배로 증가하면서(효 소량이 감소하면서) 감자유세포의 분리수율은 증가하였으 나 400배로 희석하여 사용한 경우 분리수율은 감소하였다. 각 조건에서 분리하여 제조된 건조감자유세포를 재수화하 여 광학현미경으로 관찰하였을 때 50배(Fig. 1A)와 100배 (Fig. 1B)로 희석한 펙틴 가수분해효소 처리군들은 자유로 운 감자전분들이 높은 빈도로 관찰되었으나 200배(Fig. 1C)와 400배(Fig. 1D)의 경우 극히 낮은 빈도로 존재하였 다. 이와 같은 결과는 펙틴 가수분해효소를 50배와 100배 로 희석한 경우 셀룰로오스 가수분해효소들의 활성을 제한 할 수 있는 낮은 pH 조건이라 하더라도 200배와 400배로 희석한 경우에 비해 상대적으로 높은 수준의 셀룰로오스 가수분해효소들이 희석된 효소액 내에 존재하게 되고 감자 조직의 효소반응 동안 유세포막을 손상시켜 감자전분이 유 세포 외부로 유출되어 손상된 유세포들과 함께 감자유세포 회수과정에서 손실되었기 때문으로 생각된다.
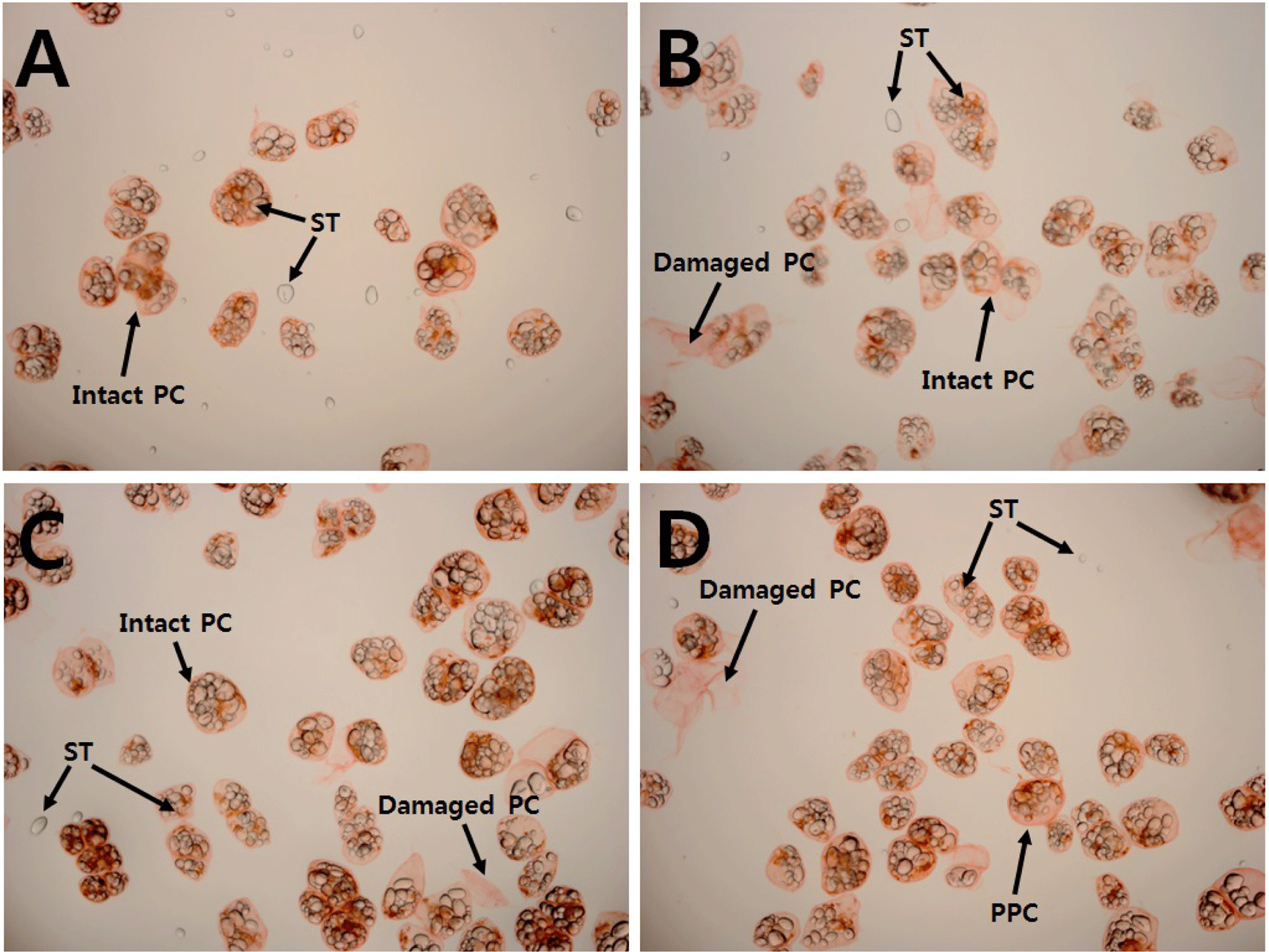
펙틴 가수분해효소 종류에 대한 영향은 pectin lyase와 polygalacturonase를 이용하여 조사되었다(Table 1-Set VI). Pectin lyase와 polygalacturonase 처리군들이 각각 61.4%와 54.6%의 높은 수준의 감자유세포 분리수율을 나타내었으 며 pecin lyase가 감자유세포의 분리에 좀더 효과적이었다. 효소반응 완충용액과 감자조직의 혼합비율의 영향을 조사 하였을 때 효소반응 완충용액 350 mL에 감자조직 75 g을 가하는 것이 가장 높은 감자유세포 분리수율을 얻었다 (Table 1-Set VII). 마지막으로 펙틴 가수분해효소를 이용하 여 감자조직으로부터 유세포의 분리가 펙틴 가수분해효소 의 영향인지 pH 2.5의 구연산 완충용액과 50°C의 반응온도 때문에 유세포들 사이의 펙틴성 물질들의 유동성 증가로 기계적인 교반에 의해 유세포들이 물리적으로 탈착하는 것 인지를 판단하기 위해 펙틴 가수분해효소를 제외한 최적반 응조건 하에서 감자조직을 처리하였고, 0.1%의 감자유세포 분리수율을 얻었다(Table 1-Set VIII). 따라서 본 연구에서 감자조직으로부터 유세포의 분리는 펙틴 가수분해효소들의 역할 때문인 것으로 확인되었다. 이상의 결과를 종합하면, 건조감자유세포 소재를 제조하기 위해 감자조직으로부터 유세포의 최적분리조건은 냉동감자조직을 원료로 하여 냉 동감자조직 75 g과 100 mM 구연산 완충용액(pH 2.5) 350 mL의 비율로 혼합하고 200배 희석된 펙틴 가수분해효소 (pectin lyase가 주요 구성효소) 용액을 1 mL 가하여 50°C 에서 2시간 동안 기계적으로 교반하는 것이었다.
감자유세포의 최적 분리조건 하에서 국내산 18품종의 일 반감자와 6품종의 유색감자로부터 유세포를 분리하여 건조 감자유세포 소재의 수율을 조사하였다(Table 2). 일반감자 로부터 분리하여 제조한 건조감자유세포의 수율은 26.0- 61.7%의 범위에 있었으며, 50% 이상의 수율을 기준으로 할 때, 고운, 수미, 남서, 방울, 대서, 남작, 추강, 추백, 조 원, 가원, 추동, 추영, 대지 품종의 감자들 순으로 수율이 증가하였다. 게다가 감자유세포의 분리 후 회수가 가능한 총 고형물(감자유세포와 감자조직 잔류물)의 건조중량을 기준으로 감자유세포의 회수율을 계산하였을 때, 회수율 75% 이상을 얻은 감자품종은 추백, 추동, 추영, 대지, 조원 이었다. 한편 유색감자의 경우 건조감자유세포의 수율이 50%이상인 품종은 발견되지 않았고, 하령감자가 47%로 가장 높았으며 자서감자가 4.3%로 가장 낮았다. 이상의 결 과를 종합할 때, 건조감자유세포 소재의 원료로는 대지, 추 백, 추동, 추영, 조원 품종의 일반감자가 적합한 것으로 판 단된다.
감자의 성분학적 특성과 조직경도를 조사하고 건조감자 유세포 수율과의 상관분석을 통해 감자로부터 펙틴 가수분 해효소 처리에 의해 제조된 건조감자유세포의 수율에 영향 을 미치는 감자의 특성 인자를 탐색하였다. 박피한 생감자 의 총 고형분 함량은 14.8-23.0%의 범위에 있었으며 세풍 감자가 23.0%로 가장 높았으며 조풍감자가 14.8%로 가장 낮았다(Table 3). 이와 같은 결과는 20품종의 국내산 감자 의 총 고형분 함량을 조사한 Lee et al. (2012)의 결과와 유사하였다. 생감자의 총 고형분 함량은 건조감자유세포의 수율 사이의 유의적인 상관성 나타내지 않았다(p>0.05; Table 5). 생감자의 조직경도는 278.2-427.7 kN/m2의 범위 에 있었으며 방울감자가 가장 낮았으며 자서감자가 가장 높은 수준을 나타내었다(Table 3). 생감자의 조직경도는 건 조감자유세포의 수율과 음의 상관관계(r=-0.888, p<0.01)를 나타내었다(Table 5). Borodoli et al. (2012)는 감자조직 내 의 유세포들이 치밀하게 압착된 형태로 배열되어 있는 감 자가 느슨하게 배열되어 있는 것보다 높은 부서짐성 (fracturability)와 경도(hardness)를 나타낸다고 하였다. 따라 서 감자조직의 조직경도가 높은 감자일수록 감자조직 내의 유세포들이 치밀하게 압착되어 있을 것으로 생각되며 이로 인해 유세포의 세포벽과 인접하는 유세포의 세포벽 사이에 존재하는 펙틴성 물질에 대한 펙틴 가수분해효소의 접근이 용이하지 않아 감자유세포의 분리수율이 낮아지는 것으로 판단된다.
24품종 감자들의 조단백질 함량은 7.5-11.9%, 조지방 함 량은 0.1-0.9%, 조회분 함량은 3.5-4.7%, 총 탄수화물 함량 은 83.6-88.5%의 범위에 있었다(Table 4). 본 연구에서 분 석된 감자들의 일반성분들의 함량은 국내산 감자들의 영양 성분을 보고한 Lee et al. (2012)와 Kim et al. (2013)의 결 과와 유사하였다. 그러나 감자의 일반성분들과 감자유세포 수율 사이에 유의적인 상관성은 관찰되지 않았다(Table 5). 이는 조단백질, 조지방, 조회분들이 감자전분과 함께 유세 포 내부에 존재하기 때문에(Borodoli et al., 2012) 유세포 의 세포막 외부의 펙틴성 물질의 제거를 통해 손상되지 않 은 유세포를 분리하는 본 연구에 있어 영향을 미치지 않는 것으로 생각된다.
24품종 감자들의 총 전분 함량은 64.3~73.8%의 범위에 있었으며, 서홍감자가 가장 적었고 가원감자가 가장 높았 다(Table 4). 감자의 총 전분 함량과 건조감자유세포의 수 율 사이에는 양의 상관성(r=0.317, p<0.05)이 존재하였다 (Table 5). Borodoli et al. (2012)는 감자의 경도와 감자전 분 함량 사이에 양의 상관성이 존재한다고 하였다. 그러나 본 연구에서 감자전분 함량과 조직경도 사이에는 상관성이 관찰되지 않았다(Table 5). 또한 Borodoli et al. (2012)는 유세포가 느슨하게 배열된 감자들 내에서 감자전분 함량의 증가는 감자조직의 경도를 증가시킨다고 보고하였다. 따라 서 감자전분 함량은 유세포들 사이의 긴밀한 밀착에 부분 적으로 공헌하여 펙틴 가수분해효소들의 유세포 세포벽 사 이의 펙틴성 물질에 대한 접근을 용이하지 않게 할 수는 있을 것으로 판단된다. 그러나 감자조직의 건조중량에 대 한 유세포의 건조중량의 비율에 의해 수율을 계산하는 본 연구에 있어 감자전분은 유세포 내에 존재하기 때문에 (Shin et al., 2015) 유세포의 건조중량을 증가시키는 증량 제로서 역할을 하는 것으로 생각된다.
감자들의 비전분성 탄수화물고분자 함량은 14.0-21.3%의 범위를 나타내었다(Table 4). 비전분성 탄수화물고분자 함량 과 건조감자유세포의 수율 사이에는 음의 상관성(r=-0.334, p<0.05)이 존재하였다(Table 5). 비전분성 탄수화물고분자 함량은 총 탄수화물 함량에서 총 전분 함량을 차감하여 계 산하기 때문에 비전분성 탄수화물고분자 함량과 총 전분 함량은 역의 관계를 가지고 있다. 따라서 본 연구에서 비 전분성 탄수화물고분자 함량과 건조감자유세포 수율의 상 관성은 총 전분 함량과 건조감자유세포 수율의 상관성이 존재하기 때문인 것으로 판단된다. 한편 감자의 비전분성 탄수화물고분자 중 펙틴 함량은 건조감자유세포의 수율과 높은 상관성이 있을 것으로 예상하였으나 본 연구에서는 펙틴 함량과 건조감자유세포의 수율 사이에 유의적인 상관 성이 관찰되지 않았다(Table 5). 결과적으로 감자의 펙틴 함량은 펙틴 가수분해효소를 이용하여 감자조직으로부터 유세포를 분리하는데 있어 큰 영향을 미치지 않는 것 같다.
요 약
새로운 형태의 건조감자소재를 개발하기 위해 감자조직 을 구성하고 있으며 감자전분들을 다양한 정도로 함유하고 있는 유세포를 펙틴 가수분해효소를 이용하여 개별적으로 분리할 수 있고, 최대 분리수율을 얻을 수 있는 최적의 유 세포 분리조건을 탐색하였다. 감자조직은 동결하여 -18°C에 서 저장하면서 해동하여 유세포 분리를 위한 원료로 사용 하는 것이 생 감자조직을 사용하는 것 보다 2배 이상의 감자유세포를 얻을 수 있었다. 펙틴 가수분해효소는 pectin lyase를 주요 구성효소로 하는 펙틴 가수분해효소 용액을 탈이온수로 200배 희석하여 pH 2.5의 효소반응용액 350 mL 당 1 mL를 가하여 50°C에서 2시간 동안 100 rpm 으로 기계적으로 교반할 때 가장 높은 수율의 건조감자유 세포 소재를 얻을 수 있었다. 유색감자보다는 일반감자들 중 추백, 추동, 추영, 조원, 대지 품종들이 건조감자유세포 소재의 제조를 위한 원료로 적합하였으며, 이 중 대지감자 를 사용할 때 가장 높은 수율의 건조감자유세포를 얻을 수 있었다. 감자의 총 전분 함량, 비전분성 탄수화물고분자 함 량과 생감자의 조직경도가 감자조직으로부터 유세포의 분 리수율에 유의적인 영향을 미쳤다. 따라서 품종을 알 수 없는 감자가 건조감자유세포 소재의 원료로 적합한지를 판 단할 때 이 감자의 조직경도와 총 전분 함량의 측정을 통 해 결정할 수 있을 것으로 기대된다.







