서 론
Starch 및 cellulose를 대표로 하는 다당류는 식품으로서 뿐만 아니라 인류 사회생활에 필수의 주요 소재로서 예로 부터 이용되고 있다. 특히 hemicellulose 및 목재는 재생산 이 가능한 생물자원으로서 최근 그 이용법이 중요시되고 있으며, 최근 들어 아토피 및 피부염에 효과적인 것으로 밝 혀져 이에 따른 기능성 식품, 기능성 화장품에도 첨가되는 등 그 응용분야가 여러 분야로 확대되고 있는 추세이다 (Moro et al., 2006; Shibata et al., 2009). 위장이 약해서 음 식에서의 항산화효소를 섭취하는 능력이 떨어지는 아토피 피부염 체질의 경우 올리고당을 이용하여 장내세균 생육을 촉진시키는 방법으로 위장개선 치료를 하고 있는 한방병원 이 있으며, 일본의 경우 아토피 피부염에 개선효과가 있는 konjac glucomannan 유래 올리고당 함유 화장품이 시판중 이다. 이처럼 hemicellulose는 기능성 식품산업, 화장품 산 업 등에서 가장 주목받고 있는 소재 중 하나이다.
Bifidobacterium 속은 우리 몸에 필요한 영양분, 비타민, 아미노산, 단백질 등의 합성, 면역강화, 소화촉진 등의 유 익한 작용을 하는 것을 알려져 있다(Mitsuoka et al., 1980; Colombel et al., 1987; Marteau et al., 1990; Ryu et al., 1998). 사람의 대장에는 대장 1 g당 3×1011 이상의 세균이 존 재하여 flora를 형성하고 있으며, 이중 Bifidobacterium의 점 유상태가 생체 건강의 중요한 인자로 작용하고 있다. 장내 microflora의 구성에는 물론 개인차가 존재하나 일반적으로 섭취하는 식품, 감염상태, 스트레스, 기후에 따라 민감하게 변화한다. Bifidobacterium의 증식과 함께 생산된 대사산물( 항균성인자, 유산, 유당분해효소 등)에 의해 직접, 간접적으 로 위에 언급한 것과 같은 효과를 발휘하게 된다(Lee, 1996).
생후 평균 41일 된 유아에게 galactooligosaccharide를 조제분유 100mL당 260mg에 해당하는 양을 첨가하여 10주간 포육한 후 분변을 회수하여 분석한 결과, galactooligosaccharide을 첨가하지 않은 조제분유로 포육된 유아보다 분변의 굳기, 색상, pH가 모유 영양아의 그것에 가까워졌으며, galactooligosaccharide를 건강한 성인에게 1일 10 g 섭취시켰을 경우, 장내의 Bacteroides의 유의적인 감소와 Bifidobacterium 및 LactoBacillus의 유의적인 증가가 보고되었으며(Heo, 1995), 총균 수에 차지하는 Bifidobacterium 의 비율은 섭취전의 23%에서 48%로 상승하였고, 대상자에 따라서는 77%까지 증가하는 경우도 있었다(Choi et al., 2004). 또한 사람의 장내균총을 정착시킨 rat에게 Bifidobacterium과 galactooligosaccharide를 연속적으로 혼합 투여하여 발암 관련 인자와 장내 부패 대사산물의 동태를 조사한 결과, 장관내용물 중의 nitroreductase, tryptophanase, urease 등의 미생물의 효소 활성과 부패산물인 인돌, 암모니 아 함량이 저하하여 Bacteroides와 대장균군에 의한 장내 부패가 억제되는 것으로 나타났다고 보고되었다(Kim et al., 2005).
본 연구팀에서는 Bifidobacterium의 생육촉진활성에 효과 를 보이는 gums 유래 galactosyl mannooligosaccharide와 konjac 유래 glucosyl mannooligosaccharide의 장내세균 생 육활성에 관하여 보고한 바 있으나(Lee & Park, 2008), galactosyl glucomannan 유래 가수분해 올리고당에 대한 연 구를 보고한 바가 극소수에 불과해 본 연구에서는 Bacillus sp. 유래 β-mannanase의 정제를 수행하여 Picea abies 유 래 galactosyl glucomannan 가수분해물을 분리, 조제 회수 하고, thin layer chromatography(TLC), fluorophore assisted carbohydrate electrophoresis(FACE) 및 Timell’s method에 의해 분리된 당가수분해물의 중합도를 결정하여, Bifidobacterium 속(B. longum, B. bifidum, B. animalis, B. breve, B. infantis, B. adolescentis, B. auglutum.)에 대한 장내세균의 생육활성을 기 존에 보고된 중합도별 올리고당의 활성과 비교하였다.
재료 및 방법
기질로는 경기도 파주시 종묘원에서 가문비나무(Picea abies) 무방부목을 구입하여 사용하였다. Galactosyl glucomannan 조제를 위해 Stålbrand 등(2002)의 방법에 따 라 가문비나무의 잔사를 증류수 100 mL에 포화시키고 0.05% NaOH, 0.05% H2SO4 를 첨가하여 1시간 반응시킨 후 건조하였다. 건조된 톱밥 9.1 g을 증류수 100 mL에 첨 가하고 1시간 물중탕을 가하여 galactosyl glucomannan을 조제하였다.
Bacillus sp.는 일본 Tsukuba 대학 응용생화학 연구실로 부터 분양받아 실험에 사용하였으며 Choi의 방법(2004)에 따라 locust bean gum 2.5%, peptone 1.2%, yeast extract 0.5%, KH2PO4 1.0%, MgSO4 7H2O 0.05%를 함유하는 액 체배지 2 L에 종모배양액을 접종하여 jar fermentor(KFC, KF-5L)에서 35°C, 170 rpm, 24시간 동안 배양하고, 4°C에 서 11,000 rpm으로 15분간 원심분리(Beckman, rotor 14)한 후 상층액을 효소액으로 사용하였다.
효소 활성 측정은 dinitrosalicylic acid(Sigma Chemical Co.)를 사용하였고 β-mannanase의 생산량은 DNS 환원당 정량법(Miller, 1959)에 의하여 수행하였다. 즉, 0.5 mL 1% locust bean gum, 0.4 mL의 McIlvaine buffer pH 4.5와 0.1 mL의 균체가 제거된 배양액을 섞어 55°C에서 30분간 반응시킨 후 생성된 mannose를 희석하여 570 nm에서 흡 광도를 측정하였다. 표준곡선은 D-mannose를 0.1-1.0 mg/ mL를 사용하였고, β-mannanase 효소 1 unit은 동일조건에 서 1분당 D-mannose에 해당하는 1 mg/mL의 환원당을 생 성하는 효소의 양으로 정의하였다.
DNS 환원당 정량법(Miller, 1959)에 의하여 수행하였다. 즉 mannose를 함유한 가수분해물 0.1 mL와 DNS시약 1.0 mL를 혼합하여 10분간 물중탕을 하여 냉각시킨 후 희 석하여 570 nm에서의 흡광도를 측정하였다. 표준곡선은 D-mannose를 0.1-1.0 mg/mL를 사용하였다.
DEAE sephadex는 0.2 M McIlvaine 완충용액(pH 6.0)으 로 세척한 다음 column(2.5×42 cm)에 충진시켜서 0.2M McIlvaine 완충용액(pH 6.0)으로 평형을 유지시켰다. 여기 에 투석한 조효소 30 mL를 0-1 M NaCl로 linear gradient 하여 용출시켰다. 이때 용출속도는 45 mL/h로 하였고, 용 출액은 5 mL씩 fraction collector를 사용하여 수집하였고, 각 용출액은 단백질과 효소의 활성을 측정하여 정제효소액 으로 사용하였다(Laemmli, 1970; Jackson, 1996).
정제효소를 열로 변성시킨 후 분자량은 10 kDa molecular weight marker(Life Technologies LTD., USA)를 이용하여 결정하였고, Laemmli의 방법(Laemmli, 1970)에 의해 SDS polyacrrylamide gel electrophoresis를 수행하였다. 전기영동 은 200V 정전압에서 수행하였으며, 전기영동 완료 후 coomassie blue 염색하여 관찰하였다.
당을 전기영동하여 분석하기 위해서 Jackson의 방법 (Timell et al., 1956; Laemmli, 1970; Stålbrand, 2002)에 따라 8-aminonaphthalene-1,3,6-trisulfonate(ANTS)에 의해 유도체화하였다. 당용액 50 μL를 동결건조한 후 15% acetic acid에 0.15M로 조제한 ANTS 용액 5μL와 dimethyl sufoxide(DMSO)에 1.0M로 조제한 sodium cyanoborohydride(NaCNBH3) 용액 5 μL를 첨가하여 혼합 하였다. 이 혼합액을 37°C에 15시간 반응시킨 후, 원심농 축을 해서 20% glycerol 50 μL에 용해하였다. 이를 전기영 동용 시료로 하여 10 μL를 전기영동하였다.
ANTS에 의해 유도화한 당의 전기영동은 Jackson의 방 법(Timell et al., 1956; Laemmli, 1970; Stålbrand, 2002)에 따라 40-30%의 polyacrylamide gel을 사용하였다. 즉, Acrylamide A(acrylamide 53.33%와 bisacrylamide를 1.41% 함유) 5.625 mL와 Buffer A(1.5M Tris-HCl, pH 8.8) 1.875 mL를 혼합하여 5분간 탈기하고, Acrylamide B(acrylamide 26.67%와 bisacrylamide를 0.89% 함유) 2.125 mL와 Buffer A 1.875 mL를 혼합한 후 탈기하여 각 각 10% ammonium persulfate 18 μL와 TEMED 6 μL를 첨 가한 후 Pasteur pipette을 사용하여 separating gel를 제조하 였다. Acrylamide A 0.75 mL와 Buffer B(0.25 M Tris-HCl buffer, pH 6.8) 3.75 mL와 증류수 3.0 mL를 혼합하여 5분간 탈기한 다음 10% ammonium persulfate 20 μL와 TEMED 7.5 μL를 첨가하여 stacking gel를 제조하였다. 전기영동용 완충액으로는 Buffer C(1 L 증류수에 30.3 g의 Tris와 144 g의 glycine을 함유)을 10배 희석한 액을 사용하였다. 전기영동은 stacking gel은 100 V, separating gel은 400 V 의 정전압에서 수행하였고, 전기영동 종료 후 365 nm의 자 외선하에서 사진 촬영하였다.
Oligosaccharides의 분리에는 activated carbon powder(Wako. Co., Tokyo, Japan)를 사용하였다. Bifidobacterium의 생육배지 로 MRS broth(Difco, Detroit, MI, USA)를 사용하였으며 기타시약은 분석용 특급시약을 사용하였다. Bacillus sp. 효 소액 90 mL(10 units)에 대해 기질용액 10 mL을 55°C, 24 시간 가수분해하여 TLC로 pattern을 검토한 후 activated carbon column chromatography를 이용해 당을 분리하였다. Activated carbon powder를 100°C에서 1시간동안 가열한 후 column(4×90 cm)에 충진시키고, 증류수를 이용하여 24 시간 동안 평형화시킨 후 당용액을 주입하고, 250 mL/h의 유속으로 tube당 50 mL씩 ethanol 0-30%의 linear gradient 로 당을 분리하였다.
TLC는 McCleary(1982)의 방법에 따라 다음과 같은 조 건하에서 전개한 후 UV 조사 및 분무시약으로 분무하여 140°C에서 5분간 가열하여 당을 분석하였다: TLC plate; 20×20 cm silicagel 60 F254(Merck, Germany), developing solvent; n-propanol:methanol:water=5:2:3(v/v), spray reagent; 30% sulfuric acid-ethanol.
가수분해된 galactosyl glucomannooligosaccharide 1 mL 에 8% H2SO4 1 mL를 100°C에서 2시간 동안 가수분해 후 9% NaOH, 페놀프탈레인 용액을 2 방울 가하여 DNS 환 원당 정량법으로 총환원당(total reducing sugar, TRS)의 양을 구하고 가수분해된 galactosyl glucomanno oligosaccharides를 DNS 환원당 정량법으로 직접환원당(direct reducing sugar, DRS)의 양을 구하였다. TRS값을 DRS값으로 나눈 값을 가수분해된 galactosyl glucomannooligosacchrides의 중합도 로 결정하였다(Timell et al., 1956).
Bifidobacterium속 균주(B. animalis ATCC 25527, B. bifidum ATCC 15696, B. breve ATCC 15701, B. longum ATCC 29521, B. infantis ATCC 15697, B. adolescentis KCCM 11206, B. auglutum KCTC 3353)에 대한 생육촉진활 성을 측정하기 위해 MRS배지에 탄소원으로 포도당 대신 에 분리조제된 중합도별 galactosyl glucomannooligosaccharidesdextrose를 포도당과 동일한 환원당량으로 첨가한 후 균주들을 적당하게 희석하여 도말한 다음 혐기적 조건하 에서 37°C에서 48시간 평판배양한 후 colony수를 비교하였고 (Deya et al., 1982), 동일한 조건으로 액체 배양하여 590 nm에 서 흡광도를 측정하여 총균수를 비교하였다(Toba, 1985).
결과 및 고찰
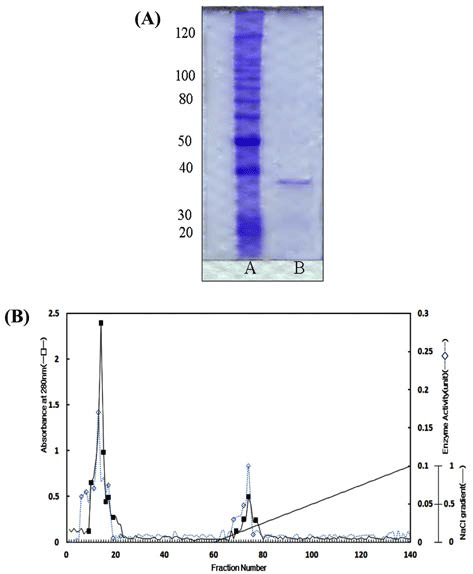
30% (NH4)2SO4를 냉장상에서 효소액에 처리하여 4°C에 서 12시간 동안 방치한 후 원심분리하여 얻은 상층액을 투석막(cellulose tubing, 16 mm×30 cm, Sigma Chemical Co.)에 처리하여 4°C에서 24시간 투석한 효소액을 DEAE sephadex chromatography(2.5×42 cm)에 30 mL/h의 유속으 로 통과시켜 tube당 5 mL씩 용출하였으며 정제를 진행한 결과 분획 No. 70-77에서 효소활성분획이 나타났다(Fig. 1A). 정제효소는 SDS-PAGE에 의해 단일밴드를 나타내었으 며(Fig. 1B), β-mannanase의 분자량은 38.9 kDa으로 추정 되었다. Penicillium purpurogenum No. 618 유래의 β- mannanase는 57 kDa, Aspergillus niger에서는 42 kDa, Tyromyces palustris에서는 61 kDa, Streptomycespalustris sp. No. 17에서는 43 kDa, Trichoderma harzianum에서는 52.5 kDa, Xylogone sphaerospora에서는 42 kDa의 분자량이 보고되고 있다(Park et al., 1991; Choi & Park, 2004b).
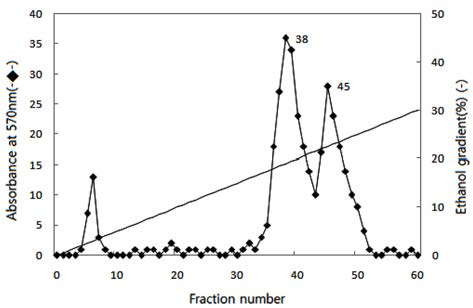
Bacillus sp. 유래 효소액 90 mL를 이용하여 10 mL의 Picea abies 유래 galactosyl glucomannan을 24시간 가수분 해해 TLC로 pattern을 검토한 후 activated carbon column chromatography을 이용해 250 mL/h 유속으로 tube당 50 mL씩 ethanol 0-30% linear gradient로 당을 분리하였다 (Fig. 2). Activated carbon column chromatography에 의한 당 용액 0.2 mL와 5% phenol 0.2 mL를 가하여 혼합 후 conc.-H2SO4 1 mL를 가하여 혼합한 후 20분간 방치하여 570 nm로 흡광도를 측정한 후 peak를 나타내는 각 fraction 을 FACE로 pattern을 검토한 후 중합도 8과 10의 2종류 galactosyl glucomannooligosaccharides을 분리 회수하였다 (Fig. 3A). TLC에 의한 가수분해 pattern을 검토한 결과 fraction No. 38에서 중합도 8, fraction No. 45에서 중합도 10의 galactosyl glucomannooligosaccharides를 회수하였다 (Fig. 3B).
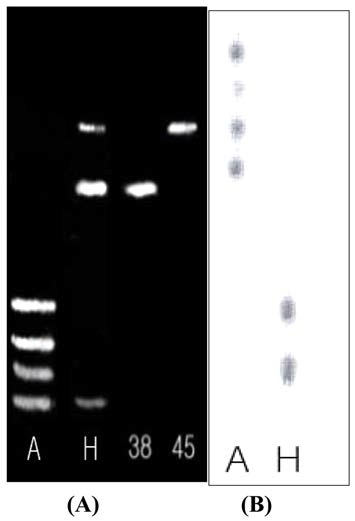
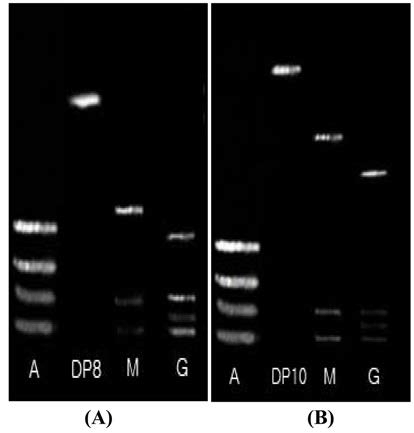
중합도 결정을 위해 TLC pattern과 함께 Timell 등 (1956)의 방법에 의해 분석한 결과 Fig. 2에서 각각 분리된 Fraction No. 38 가수분해 올리고당의 TRS는 16.48, DRS 는 1.99로서 TRS/DRS는 8.26로, Fraction No. 45 가수분 해 올리고당의 TRS는 25.09, DRS는 2.39로서 TRS/DRS 는 10.47로 나타났다(Table 1). 이에 Fraction No. 38 올리 고당은 중합도 8, Fraction No. 45 올리고당은 중합도 10 으로 규명하였다. 구조유추를 위해 본 연구실에서 확보하 고 있는 기질 특이성이 규명된 Penicillum purpurogenum 유 래 정제 β-mannanase와 α-galactosidase를 이용하여 enzymatic sequential action에 의해 중합도 8은 β-mannanase 처리후 mannose, mannobiose, hetero type의 중합도 5로 가수 분해 되었으며, 순차적으로 정제 α-galactosidase를 처리한 결 과 mannose, mannobiose, galactose, hetero type의 중합도 4 의 당이 나타나는 것으로 확인하였다(Fig. 4A). 중합도 10 은 β-mannanase 처리에 의해 mannose, mannobiose, hetero type 중합도 8로 가수분해 되었으며, 순차적으로 정제 α- galactosidase를 처리한 결과 mannose, mannobiose, galactose, hetero type 중합도 6의 올리고당으로 가수분해 되어 branching 하고있는 galactose의 위치 등은 유추가능하였으 나(Fig. 4B, mannose와 mannose사이에 swiching하고 있 는 glucose의 위치 유추는 불가능하여 현재 Penicillium purpurogenum 유래의 효소의 기질 특이성과 상이한 Aspergillus niger 5-16을 정제하여 enzymatic sequential action 에 의한 구조를 해석하고 있으며, 정확한 구조식 동정을 위 해 Methylation method(Ciucanu & Kerk, 1984)를 병행하여 수행할 예정으로 있다.
| D.P value | |
|---|---|
| GGM hydrolysates by Bacillus sp fraction No. 38 | 8 |
| GGM hydrolysates by Bacillus sp fraction No. 45 | 10 |
Bifidobacterium속 균주(B. longum, B. bifidum, B. infantis, B. animalis, B. breve, B. adolessentis, B. auglutum)에 대한 생육촉진활성을 측정하기 위해 표준 MRS medium에서 탄소 원 dextrose 대신에 분리 조제된 중합도 8, 10 galactosyl glucomannooligosaccharides을 첨가한 후 평판배양을 하여 측정한 결과 올리고당이 첨가되지 않은 표준 MRS broth 에 비해 높은 생육 촉진 활성을 보였다.
B. animalis에서는 중합도 8 galactosyl glucomannooligosaccharide 를 탄소원으로 대체한 경우 표준 MRS배지와 비교하여 19.5배, 중합도 10에서 18.7배의 가장 우수한 생육활성을 나 타내었으며, B. bifidum에 대해서는 중합도 8의 경우 15.3배 와 중합도 10에서 14.3배 그리고 B. longum에서는 중합도 8 galactosyl glucomannooligosaccharide를 탄소원으로 대체 한 경우 표준 MRS배지와 비교하여 중합도 8에서 15.2배, 중합도 10에서 13.9배의 상대활성을 우선적으로 나타내었 다(Table 2, 3).
본 연구실에서는 hemicellulose계열 올리고당 탐색 및 탄 소원 대체에 의한 저가의 신규 MRS배지의 제품화와 관련 하여 galatomannan 및 galactosyl glucomannan 가수분해 올리고당에 대하여도 연구를 수행하고 있는 바, Bacillus sp. 유래 정제효소에 의한 gums류 유래 galactomannan 가수 분해 올리고당의 경우 B. longum에서는 중합도 5 galactomannooligosaccharide를 탄소원으로 대체한 경우 표 준 MRS배지와 비교하여 10배의, 중합도 7을 처리한 경우 에도 7.5배 및 B. bifidum의 경우에서도 중합도 5에서 9.8배, 중합도 7에서 7.7배의 우수한 생육활성을 나타내었 으며 이외에도 B. breve, B. animalis, B. infantis에 있어서 도 중합도 5의 경우 2.9-5.7배의 상대활성을 나타내었으나, B. infantis에 대한 중합도 7의 경우에서는 표준 MRS배지 와 비교하여 0.62배로 감소하였다. 또한 중합도 5의 올리 고당이 중합도 7의 올리고당보다 생육활성에 크게 기여하는 것으로 나타났다(Choi & Park, 2004b). Guar galactomannan과 konjac glucomannan 가수분해 올리고당의 Bifidobacterium spp.에 대한 생육활성을 비교하기 위하여 guar galactomannan 과 konjac glucomannan으로부터 생성된 중합도 5와 7과 KG5, KG7(konjac glucomannooligosaccharides의 중합도 5 와 7)의 Bifidobacterium spp.에 대한 생육 활성을 평판한천 배지상의 colony의 수를 비교한 결과 Konjac glucomannan 유래 올리고당에 비해 guar galactomannan 유래 올리고당이 생육 활성이 높게나왔으며, 특히 중합도 5 galactomannooligosaccharide 의 생육활성이 가장 높게 나왔다(Park et al., 2007). 또한 Bacillus sp.는 천연유래 galactomannan 중 mannose와 galactose의 비율이 14:1로 존재하는 coconut 야자열매의 부 산물인 copra cake와 gum류 중에서 mannose와 galactose의 비율이 4:1 및 2:1로 존재하는 locust bean gum과 guar gum 및 konjac glucomannan에 대한 가수분해 최종산물은 중합도 5와 7의 올리고당으로 가수분해되는 공통된 특징을 나타내고 있으나 본 연구에서 수행된 Picea abies galactosyl glucomannan에서는 중합도 8과 10의 올리고당으로 가수분해 되어 기질의 구조에 따른 가수분해 올리고당의 pattern도 상이함을 확인할수 있었다. 또한 동일한 중합도를 갖는 hetero type 올리고당이 Bifidobacterium spp.에 대한 생육활성의 차이는 구조적인 측면에서 galactosyl mannooligosaccharides는 galactose가 mannose main chain에 분지하고 있는 구조로서, mannose와 mannose 사이에 glucose가 위치하는 konjac glucomannooligosaccharides보다 미생물 생육활성에 영향을 더 미치는 것으로 추정하고 있다.
상기의 결과를 바탕으로 추론하자면, Bifidobacterium spp.의 종마다 탄소원으로 사용하기에 선호하는 올리고당의 중합도가 존재하는 것으로 예상되며 이에 대한 심층적인 연구가 필요할 것으로 사료된다.
본 연구진의 선행연구와 비교하면 같은 효소와 기질을 이용한다 하더라도 효소가 유래된 미생물의 종류가 다르다 면 생산되는 올리고당의 중합도가 달라질 수 있으며, 이로 인하여 각기 다른 대체 탄소원을 생산할 수 있다는 것을 알 수 있다. 유산균 특화 배지인 MRS 배지를 키우고자 하는 유산균의 종에 따라 더욱 특이적으로 변형 시킬 수 있으며 이로 인한 효능 증대, 원가 절감 등 산업적으로 큰 도움이 될 수 있을 것이라 판단된다
요 약
DEAE Sephadex column chromatography에 의해 Bacillus sp. 유래 β-mannanase의 정제를 수행하여 비활성 21.57 units/ mL 정제배율 95.33배를 나타내었다. SDS-PAGE에 의한 단 일밴드를 확인하였고, 분자량은 38.9 kDa으로 결정되었다. 정제효소에 의해 Picea abies galactosyl glucomannan을 가 수분해하여 activated carbon column chromatography에 의 해 당가수분해물을 분리 회수하여 TLC, FACE 및 Timell’s method에 의해 중합도 8, 10으로 결정되었으며, Penicillum purpurogenum유래 정제 β-mannanase와 α- galactosidase를 이용한 enzymatic sequential action에 의해 2가지 가수분해산물 모두 hetero type galactosyl glucomannooligosaccharides로 확인되었다. B. longum, B. bifidum, B. infantis, B. animalis, B. breve, B. adolessentis, B. auglutum의 생육활성에 대한 중합도 8, 10의 영향을 검 토하기 위하여 modified-MRS 배지상에 탄소원으로 중합도 8, 10를 대체하여 생육활성을 비교한 결과 B. animalis에서 는 중합도 8 galactosyl glucomannooligosaccharide를 탄소원 으로 대체한 경우 표준 MRS 배지와 비교하여 19.5배, 중 합도 10에서 18.7배의 가장 우수한 생육활성을 나타내었으 며, B. bifidum에 대해서는 중합도 8의 경우 15.3배와 중합도 10에서 14.3배 그리고 B. longum에서는 중합도 8 galactosyl glucomannooligosaccharide를 탄소원으로 대체한 경우 표준 MRS배지와 비교하여 중합도 8에서 15.2배, 중합도 10에서 13.9배의 상대활성을 우선적으로 나타내었다.







