서 론
간장의 주재료는 콩이며, 콩에는 단백질이 38%나 함유 되어 있어 농작물 중에서도 높은 수치를 나타내고 있다. 또한 단백질뿐만 아니라 지방은 18%나 함유하고 있으며, 다양한 무기질과 비타민 B군, A와 D도 함께 포함하고 있 다. 특히 콩에는 곡류의 제한 아미노산인 필수아미노산 lysine이 풍부하며, 콜레스테롤이 없고 포화지방산이 적은 이점을 가지고 있다. 지방에는 불포화지방산인 linolic acid 와 linoleic acid가 풍부하며, 이 2개의 불포화지방산은 혈 액 속의 콜레스테롤의 양이 늘어나는 것을 막는 동시에 동 맥혈관의 벽에 달라붙은 콜레스테롤을 녹여내는 기능성 작 용을 나타낸다(Kim, 2001). 간장의 구성성분은 아미노산, 당류, 발효에 의해 생성된 알코올과 유기산, 소금 등이 주 성분이며 단 맛, 고유한 향미, 짠 맛을 띄고 있다. 간장은 비타민의 함량이 된장에 비해 미량이지만 methionine은 간 장의 해독작용을 도와 체내에 유독한 유해물질 제거에 관 여하며, 알코올 및 니코틴 해독작용으로 술, 담배의 해를 줄이고 미용에도 효과적이다. 레시틴이 함유되어 콜레스테 롤을 용해하여(Yoo, 1997) 동맥경화 예방과 고혈압 강하작 용을 한다(Lee et al., 1971; Okamato et al., 1995; Choi et al., 2004). 이외에도 정장작용을 돕고, 혈관을 부드럽게 하 여 혈액을 맑게 하며, 비타민의 체내 합성을 촉진한다는 연 구가 보고되고 있다(Kobayashi et al., 2004a; 2004b; Park, 2010). 이처럼 다양한 기능성이 확인됨에 소비자들의 편리 성을 위해 공장에서 생산되는 제품의 수요가 점점 증가하 고 있으며, 소비자의 기호에 맞게 전통식 방법을 혼용하여 변형시키려는 노력과 여러 가지 부재료를 첨가하여 그 기 능성을 향상시키는 연구가 활발히 진행되고 있다. 간장의 원료 중 미생물의 생육에 가장 큰 영향을 미치는 성분은 식염으로서, 약 12.0% 이상의 소금을 첨가하여 이상 발효 와 부패를 방지하고 제조 후 저장성을 부여한다(Mok et al., 2005). 우리나라는 김치, 장류, 젓갈 등의 고염도 발효식품 이 발달한 식문화 습관 때문에 하루 식사를 통해 세계적으 로 가장 높은 수준의 양인 평균 12.2 g, 나트륨 함량만으로 는 4.8 g을 섭취하고 있으며 이는 WHO (World Health Organization) 권장량(하루 5 g)의 약 2.4배에 이르고 있다 는 연구가 보고되어 있다(Lee et al., 2007). 소금의 과다 섭취는 심혈관 질환, 위암, 신장 결석 등과 관련 되어있기 때문에 이의 섭취량을 줄이려는 노력이 세계적으로 진행되 고 있다(He et al, 2010). 2011년 국민건강영양조사에 따르 면, 나트륨 섭취의 주요 공급원은 소금으로부터 17.7%, 김 치(배추김치, 총각김치 및 깍두기) 22.1%, 장류(된장, 고추 장, 간장 및 쌈장) 20.6%로서 김치와 장류의 섭취만으로도 하루 소금량의 40% 이상을 섭취하는 것으로 보고되었다. 또한 장류 내에 소금은 저장성외에 장류의 쓴맛에도 관여하 게 되는데, 과다한 사용은 과도한 짠맛과 함께 고혈압, 뇌 졸중, 위암, 신장병, 간경변증, 만성신부전증 등 성인병을 유발하므로, 기호성 향상과 성인병 예방을 위해 간장과 된 장의 식염 함량을 낮출 필요성이 대두되고 있다(Kim et al, 1995; Park et al, 2002). 따라서 본 연구에서는 전통 간장을 염 농도 별로 달리 제조하고, 각 발효기간 별 microflora 분석실험을 통해 다양한 발효 정보를 비교 분석 하였다. 또한, 저염으로 제조되었다 하더라도 식품으로서 장류의 기호성을 충족시키기 위해서는 양호한 풍미와 품질 이 전제되기 때문에, 염도를 낮추어 제조한 간장의 발효기 간에 따른 향미 변화를 같이 조사하였다.
재료 및 방법
연구에 사용된 메주(메주는 개당 약 700 g)는 순창발효미 생물센터에서 제조된 메주를 사용하였으며, 메주는 물로 2회 세척한 뒤 햇볕에 2-3일 동안 메주표면에 습기가 없 어질 때까지 자연 건조하였다. 간장의 식염농도는 각각 4.8, 8.4, 12.0, 15.6, 19.2%으로 달리하여 제조하였으며, 각 시료에는 메주 7개씩을 사용하였다. 입구가 넓은 20 L 항 아리를 짚불을 이용하여 내부를 소독한 후, 메주를 안에 넣고 식염수를 이용해 침수시켰다. 사용된 식염수는 2011년 생산된 신안군천일염을 이용하여 제조했으며, 각 시료별 식염수 비율은 다음과 같다. 4.8%: 720 g salt/15 L, 8.4%: 1,260 g salt/15 L, 12.0%: 1,800 g salt/15 L, 19.2%: 2,880 g salt/15 L. 메주가 침강된 후 2-3일이 지나고 나면 숯 2개와 말린 홍고추 6개를 첨가하였다. 각 시료를 30일 동 안 발효시킨 뒤에 상등액을 분리하여 간장으로 담갔으며, 20 L 항아리에 담아 발효하였다.
간장의 생균수 측정은 호기성균과 호염성균, 효모, 유산 균, 곰팡이총 5종류의 균수를 측정하여 진행하였다. 생균수 측정에 사용된 희석액의 조건은 다음과 같다. 시료 10mL를 멸균 생리식염수 90 mL에 용해한 뒤 2시간 동안 균질화하 여 시료액을 제조하였다. 시료액은 상온에 5분간 방치한 뒤 상등액 1 mL를 취해 9 mL 멸균수에 109배까지 연속적 으로 희석한 다음의 희석액을 사용하여 생균수를 측정하였 다. 호기성균의 생균수 측정에는 nutrient agar(Difco Becton Dickinson, Cowley, Oxford, UK)를 사용하였으며, 30°C에서 2일간 배양한 후 형성된 colony 수를 계수하였다. 호염성균 생균수 측정에는 HM agar(KCl 2.0 g, MgSO47H2O 1.0 g, CaCl27H2O 0.36 g, NaBr 0.23 g, NaHCO3 0.06 g, FeCl3 0.06 g, peptone 5.0 g, yeast extract 10.0 g, dextrose 1 g, agar 24.0 g, NaCl 100 g, distilled water 1.0 L)를 사용하여 30°C에서 4일간 배양한 후 형성된 colony 수를 계수하였다. 효모 생균수 측정에는 yeast mold agar(Difco Becton Dickinson)에 20μg/mL chloramphenicol(Sigma-Aldrich, St. Louis, MO, USA)을 첨가하여 사용하였으며, 25°C에서 4일간 배양한 후 형성된 colony 수를 계수하였다. 유산균 생균수 측정에는 MRS agar(Difco Becton Dickinson)에 anaerobic system gas pak(Difco Becton Dickinson)을 이용하여 혐기 조건을 만든 후 37°C에서 3일간 배양하여 형성된 colony 수를 계수하였다. 곰팡이 생균수 측정에는 potato dextrose agar(Difco Becton Dickinson)에 20 μg/mL chloramphenico을 첨가하여 사용하였으며, 25°C에서 4일간 배양한 후 형성된 colony 수를 계수하였다. 평판배지 상에 나타난 colony를 각각의 종류에 따라 계수한 후 선별배지를 통해 배양 분리 된 미생물은 호기성균, 호염성균의 경우 colony의 색과 형 상을 관찰하여 각각 분리하였고, 효모, 유산균의 경우 colony의 형상과 light microscope(Olympus BH-2, Olympus Co., Tokyo, Japan)를 이용하여 1,000배로 검경하여 분리하 였다. 1차 분류를 통하여 3번의 계대배양 후 순수 분리 된 균주는 동결건조 보관하였다.
간장에서 발효초기와 2개월, 4개월, 6개월, 9개월, 12개월에 각각 호기성 세균, 호염성 세균, 효모, 유산균과 곰팡이를 분리 배양한 후 임의로 5종을 선정한 뒤 각 균 을 순수 분리 하였다. 순수 분리 된 균들은 지방산 분석 (cellular fatty acid composition)을 통하여 동정하였다 (Sasser, 1990). 약 40 mg의 세포를 teflon-lined screw cap tube에 옮긴 후, 50% methanol에 15.6% NaOH를 첨가한 용액 1 mL을 넣고 100°C에서 30분간 가열하여 실온에서 냉각하여 가수분해하였다. 여기에 methanolic-HCl 2 mL (6.0 N HCl 325 mL: methanol 275 mL)을 첨가하여 80°C에 서 10분간 가열하여 메틸화시킨 다음, 이를 급냉 한 후 1.25 mL의 hexane/methyl-tert-butylether(1:1, v/v)을 넣어준 뒤 10분간 교반시켜 cellular fatty acid를 추출해냈다. 실온 에서 정치하여 2개의 층으로 분리시킨 뒤 하층액만을 제 거하고 3 mL의 dilute NaOH(약 1.2% NaOH)를 첨가하여 다시 10분간 교반하였다. 그 후 세척단계를 거쳐 실온에 정치하여 상등액의 2/3을 screw-capped tube에 보관하였다. 시료의 분석에는 Agilent technologies 6890 gas chromatography(Agilent Technologies model 6890N, Agilent, Palo Alto, CA, USA)를 이용하였다. Separation column은 A30 m×0.320 mm×0.25 μm Crosslinked Methyl siloxane column(HP-1)(Agilent)을 사용하였으며, 분석된 profile은 Sherlock MIS Software(Sherlock MIS ver. 6.2, Microbial ID, Inc. (MIDI), Newark, DE, USA)를 이용하였 다. Standard calibration 용액과의 비교에 의해 peak의 동정, retention time, peak의 면적, 비율을 구하였다.
향기성분 분석은 Head-space SPME(solid phase micro extraction) 방법을 사용해 GC-MS(Agilent 6890N, Agilent 5973 network mass selective detector, MSD., Agilent Co, Palo Alto, CA, USA)로 분석하였다. SPME Fiber는 50/ 30 μm DVB / Carbpxen™/ PDMS Stable Flex™ for manual holder gray(Agilent)를 사용하였다. Column은 DB-5ms (60 m length×0.25 mm I.D×0.25 μm film thickness, J&W Scientific, Folsom, CA, USA)을 이용하였다. 20 mL SPME vial에 시료 3 g을 각각 넣어준 뒤 water bath를 이용해 40°C에서 30분 동안 평형화하였다. 그 다음으로 equilibrium state의 vial에 SPME를 주입하여 30분 동안 흡착시켰다. 흡착된 SPME를 GC-MS injector에 주입하여 10분 동안 탈착시켰다. Oven temperature setting은 40°C에 서 5분 동안 유지하며 200°C까지 5°C/min의 속도로 온도 를 올렸으며, 200°C에서 20분 동안 유지하였다.
결과 및 고찰
간장의 표면은 시료별 및 숙성기간에 따라 산막으로 추 정되는 하얀 물질이 덮여있는 것이 관찰되었다. 1개월 차 에는 12.0%, 15.6%에서 가장 많이 덮였고, 2개월과 4개 월 차에서는 4.8%, 19.2%가 가장 많이 표면이 덮였다. 발 효 1개월 차에 산막으로 추정되는 하얀 물질이 표면에 가 장 적게 덮였지만, 발효가 진행됨에 따라 6개월 이후부터 는 더 이상 관찰되지 않았다. 염도별로 보았을 때, 저염으 로 갈수록 발효경과에 따라 점도가 더 높아졌으며. 반대로 고염으로 갈수록 점도가 묽어졌다(data not shown). 4.8% 저염 간장의 경우 많이 걸쭉하였고, 8.4% 간장의 경우 일 반적인 간장보다 걸쭉하였기 때문에 일반적인 액상형태의 간장으로 사용하기에는 선호되지는 않을 것으로 생각된다. 발효초기 전체적으로 산막이 형성되었는데, 산막은 상품성 을 떨어트리고, 산소를 차단함으로써 여러 부패균들의 증 식을 유발시킬 수 있다(Jeonl et al., 2013). 부패균 증식 억 제를 위해 알코올(Lee et al., 1985)이나 항균활성을 가진 천연 향신료 등을 첨가 할 수도 있지만 장류의 고유한 풍 미가 사라지는 단점이 연구보고 되어 있다(Oh et al., 2002; Oh et al,. 2005; Lim et al., 2010). 본 연구에서는 모든 시료 내에서 산막이 형성되어졌지만, 숙성이 진행됨 에 따라 발효 6개월부터는 전체적으로 사라졌으며, 이는 4.8%의 저염성 장류 내에서도 알코올이나 다른 첨가물이 없이도 산막의 형성이 억제되며 어느 정도 상업적인 이용 가능성을 확인할 수 있었다.
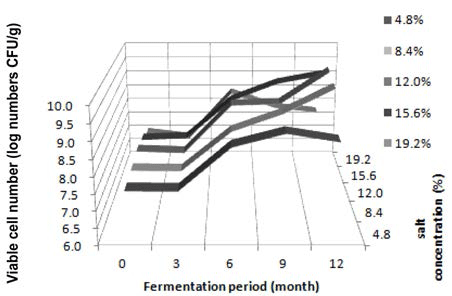
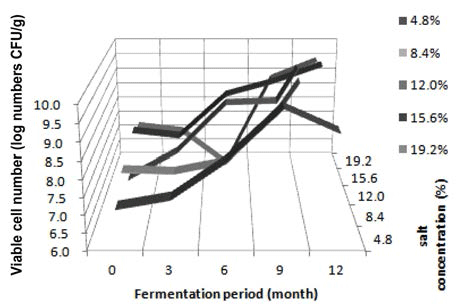
간장에서 발효기간 동안 호기성균, 호염성균, 효모균, 유 산균과 곰팡이의 생균수를 측정하였다. 도말한 각각의 시 료에서 형태적으로 다른 균주를 임의로 선정하여 분리하였 으며, 호기성균 102종, 호염성균 120종, 효모 5종, 유산 균 25종과 곰팡이 27종으로 총 279종을 지방산분석을 통하여 동정하였다. 호기성균의 생균수 변화를 Fig. 1에 나 타냈다. 전체적으로 간장시료는 전 숙성기간에 걸쳐 큰 변 화 없이 꾸준히 증가하고 있으며, 이 중 4.8% 저염성 간 장과 19.2% 고염성 간장만 발효가 지속됨에 따라 증가하 다가 감소하는 경향을 나타내었다. 4.8% 염도의 간장 시료 의 경우에는 발효 9개월에 9.08 log CFU/g에서 발효 12개월에 8.84 log CFU/g으로 감소하였고, 19.2% 간장 시 료는 발효 6개월에 8.49 log CFU/g으로 최고 수치를 보였 다가 발효 9개월, 12개월에 약간씩 감소하여 7.81 log CFU/g로 감소하였다. 그러나 그 수준이 전 숙성기간 동안 크게 증감되지 않고 많은 균수를 유지하는 것으로 보아, 간장발효에는 호기성 세균이 많은 역할을 하고 있는 것으 로 판단된다. 분리한 호기성 세균의 우점종에 대한 표를 Table 1에 나타내었다. 4.8%와 8.4% 저염 시료에서 발효초 기에 B. amyloliquefaciens가 높은 분리 빈도수를 보였으며, 발효 3개월에는 4.8%와 8.4% 모두에서 B. licheniformis, B. subtilis가 나타났고 4.8%에서만 B. amyloliquefaciens, 8.4% 에서만 B. methylotrophicus가 동정되었다. 발효 6개월에는 4.8% 시료에서는 다양한 B. amyloliquefaciens와 B. subtilis, B. atrophaeus, Paenibacillus polymyxa, P. macerans 등 다양 한 균이 확인되었으며, 8.4% 시료에서는 P. macerans가 우 점종으로 나타났다. 4.8% 저염 간장에서는 발효 9개월과 12개월에서는 B. subtilis가 동정되었고, 8.4% 저염 간장에서 는 9개월에 B. atrophaeus와 B. subtilis가, 12개월에는 P. macerans와 B. subtilis가 동정되었다. 12.0% 시료에서 분리한 호기성균의 우점종은 발효초기부터 3개월까지 B. subtilis 가 높은 비율을 차지하였고, 발효 6개월에는 B. atrophaeus가 우점종을 차지하였다. 발효 9개월에는 8.4% 저염 된장과 동일하게 B. subtilis와 B. atrophaeus가 동정되 었다. 발효 12개월에는 P. macerans가 높은 비율로 나타났 다. 15.6% 시료에서 분리된 호기성균의 우점종은 발효초기 에는 B. amyloliquefaciens가 높은 비율을 차지하였고, 발효 6개월에도 B. atrophaeus가 우점종을 차지하였다. 발효 9개 월에는 B. licheniformis, B. subtilis, Staphylococcus cohnii, B. atrophaeus, P. macerans의 다양한 종이 분리되었고, 마지막 발효 12개월에는 P. larvae가 동정되었다. 19.2% 고염간장의 호기성균 우점종은 발효초기에서는 B. licheniformis가 가장 높은 비율을 차지하였고, 발효 3개월에는 S. nepalensis가 높은 분리 빈도수를 차지했다. 발효 6개월에는 12.0%. 15.6%와 마찬가지로 B. atrophaeus가 높은 비율로 동정됐다. 발효 9개월에는 B. licheniformis가 동정되었으며, 발효 12개월에는 V. pantothenticeus와 P. macerans가 높은 비율로 동정되었다. 간장의 호염성균의 생균수 변화를 Fig. 2에 나 타냈다. 4.8%와 8.4%, 12.0%, 15.6% 시료의 호염성균에 대한 생균수 분포도는 호기성균과 거의 유사한 경향으로 나타났다. 4.8% 저염 간장을 제외한 3가지 시료에서 발효 가 지속됨에 따라 생균수가 증가하였고, 4.8% 시료의 경우 발효 9개월부터 점차 감소하였다. 반면 19.2% 고염 간장 의 시료는 호기성균과는 다른 경향을 보여 주었는데, 발효 3개월부터 생균수가 큰 수준으로 감소하여 발효초기에서 의 생균수 수준보다 더 낮은 5.93 log CFU/g의 수준을 나 타내었다. 그리고 그 후 발효 9개월에 8.88 log CFU/g까 지 생균수 분포가 큰 폭으로 증가하였다. 발효 12개월 차 에도 그 수준을 유지하며 증가하였다. 전체적으로 모든 시 료가 높은 생균수 값을 띄었으며, 호기성균과 마찬가지로 간장발효에 있어 높은 비중을 차지하는 것으로 판단된다. 호염성 세균의 우점종은 Table 2에 나타내었다. 4.8% 저염 간장에서 분리한 호염성균의 우점종은 발효초기에서는 S. nepalensis와 B. amyloliquefaciens가 높은 비율을 차지하였 으며, 발효 3개월에는 호기성균과 마찬가지로 B. amyloliquefaciens와 B. licheniformis, B. subtilis가 높게 나 타났다. 발효 6개월에는 V. pantothenticus가 많이 동정되었으 며, 발효 9개월과 12개월에는 B. subtilis가 우점종으로 나타 났다. 전체적인 호염성균의 우점종은 호기성균과 거의 유사하 게 나타났다. 8.4% 저염 간장에서 분리한 호염성균의 동정결 과를 확인한 결과, 발효초기에는 B. atrophaeus가 가장 높은 비율을 차지하였고, 3개월에는 B. amyloliquefaciens와 B. licheniformis가 동정되었다. 발효 6개월에는 4.8% 간장과 같 이 V. pantothenticus가 높은 수준으로 분리되었고, 12개월 에는 B. amyloliquefaciens가 높은 빈도수를 보여주었다. 12.0% 시료의 경우 발효 초기 B. amyloliquefaciens가 높은 비율로 동정되었고, 발효 3개월에는 B. licheniformis와 B. subtilis, B. amyloliquefaciens, S. nepalensis가 다양하게 동 정되었다. 발효 6개월에는 V. pantothenticus와 S. cohnii가 나타났다. 발효 9개월에는 B. subtilis가 우점종을 차지하 였고, 12개월에는 P. larvae와 B. subtilis, B. alcalophilus, B. amyloliquefaciens, P. validus등 다양한 균들이 동정되었 다. 15.6% 시료의 경우 발효초기에는 S. nepalensis가 높게 동정되었고, 발효 3개월에는 B. subtilis와 B. licheniformis, B. amyloliquefaciens가 높은 비율을 나타내었다. 발효 6개 월에는 S. cohnii가 우점종을 나타냈으며, 발효 9개월에는 P. macerans, 발효 12개월에는 B. licheniformis, B. subtilis, B. amyloliquefaciens, P. macerans, V. pantothenticus 등 다 양한 종이 분리되었다. 19.2% 고염 간장의 경우 발효 3개 월에는 S. nepalensis가 높은 분리 빈도수를 차지하였고, 6개월에는 S. cohnii와 V. pantothenticeus가 우점종을 차지 하고 있었다. 발효 9개월에는 12.0%, 15.6% 간장과 같이 P. macerans가 발효후기에 영향을 미쳤으며, 12개월에는 B. subtilis, B. amyloliquefaciens, P. macerans, S. cohnii, P. larvae 등 다양한 종이 분리되었다. 효모는 전체적으로 4.8% 인 저염 간장의 발효초기에서만 2.26 log CFU/g의 낮은 수 준의 분포를 보였고, 그 외의 다른 시료에서는 전혀 분리 되지 않았다. 이로써, 간장의 발효에는 큰 영향을 미치지 않는 것으로 사료된다. 4.8% 간장 발효초기에 분리된 효모 는 동정결과 모두 Pichia guilliermondiidu였다(data not shown). 유산균의 생균수 분포를 보게 되면 전체적으로 발효 초기에서만 유산균이 발견되었으며, 효모와 마찬가지로 3 log CFU/g 이하로 나타났다. 4.8%와 8.4% 저염 간장의 발효초기에서는 P. pentosaceus가 동정되었고, 12.0% 간장 에서는 Weissella paramesenteroides, 15.6%와 19.2% 고염 간장에서는 발효초기에 Enterococcus faecium가 높은 비율 로 우점종을 차지하였다(data not shown). 곰팡이 생균수 분포는 고염 간장인 19.2%를 제외한 모든 염도의 간장에 서 발효 3개월까지 2.3-4.0 log CFU/g의 낮은 수준으로 확 인할 수 있었으며, 발효 6개월이 지난 후에는 곰팡이가 분리되지 않았다. 4.8% 저염 간장에서 3.6-3.5 log CFU/g의 비교적 높은 생균수분포를 보였으며, 분리된 모든 균주는 Aspergillus oryzae로 동정되었다. 8.4% 저염 간장에서는 4.8% 시료와 같이 발효 3개월까지 2.8-4.0 log CFU/g 생 균수를 확인할 수 있었으며, 분리한 균주는 동일한 A. oryzae로 동정되었다. 12.0%와 15.6% 간장에서는 곰팡이의 생균수 분포가 약 2 log CFU/g 정도의 전반적으로 낮은 수준에서 발효초기와 발효 3개월에서 분리되었다. 두 시료 모두 발효초기에는 A. oryzae가 우점종을 나타냈고, 발효 3개월에는 A. versicolor가 높게 동정되었다. 19.2% 고염 간장의 곰팡이 생균수 분포는 다른 시료들과는 다르게 오직 발효초기에서만 분리되었으며, A. oryzae가 동정되었다(data not shown). 전체적으로 발효초기에는 B. amyloliquefaciens, B. licheniformis, B. subtilis가 주를 이루었고 발효 후기에는 P. macerans와 B. subtilis, S. cohnii, B. atrophaeus, B. amyloliquefaciens 등 다양한 균종이 주를 이루었다. 간장 내 에서 다양한 균총이 간장발효에 기여하고 있는 것을 볼 수 있었으며, 특히 그 중에서도 P. macerans, B. licheniformis, B. subtilis가 간장의 숙성이 진행됨에 있어 영향력 있는 균 으로 판단할 수 있었다. 간장에서는 호기성균과 호염성균 의 균총이 염도별로 매우 다양하게 나타났으며, 시료별 특 징적 차이점은 보이지 않았다. 유산균이나 곰팡이의 미생 물 총균수 패턴은 모든 염도 별로 거의 유사하게 나타났으 며, 이러한 결과로 보았을 때 저염 간장인 4.8%와 고염간 장인 19.2%를 제외한 나머지 시료에서는 전체적으로 미생 물학적 특징이 크게 다르지 않게 나타났다. 또한 지금까지 연구된 다른 연구결과와도 크게 다르지 않았다(Yoo et al., 2000; Cho & Seo, 2007; Nam et al., 2012). 이는 최저 8.4% 염도의 조건에서도 발효기간이 장기간으로 이루어졌 을 때 발효과정 동안 미생물분포에 관한 문제는 없을 것으 로 생각되어진다.
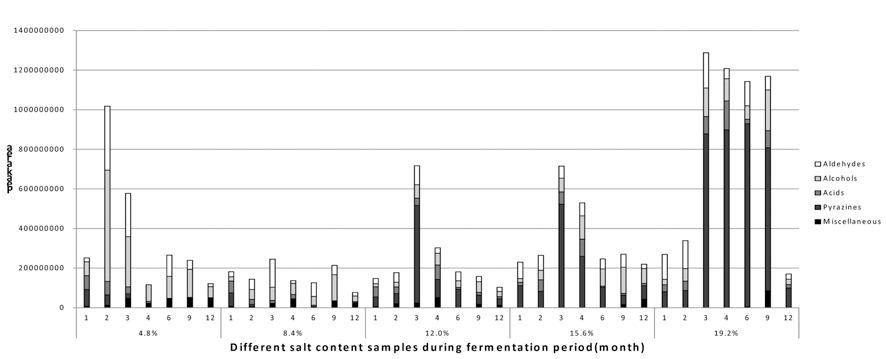
간장의 주요 향기화합물들은 기존에 연구되어진 문헌들을 참고하여 aldehydes, alcohols, acids, pyrazines, miscellaneous으 로 나누었으며(Arctander, 1982; Sugawara, 1991; Kim et al., 1992; Park et al., 1997), 본 실험은 이를 중심으로 각각의 시 료들의 발효기간 중에 따른 향미성분의 변화 값을 SPME를 이용한 GC-MS를 통해 비교분석하였다(Fig. 3). Aldehydes 는 대부분의 모든 시료에서 발효초기에 거의 생성되지 않았 으며, 발효가 진행됨에 따라 다른 향미성분에 상대적으로 적은 양이 생성되는 것을 확인할 수 있었다. 그 중 benzaldehyde가 발효초기 염의 농도가 낮을수록 더 높은 값을 나타냈으며, 발효 2개월에 4.8% 저염 시료에서 가장 높은 값을 보였다. Benzaldehyde는 crush bitter almond 향을 띄며, 장류의 기호도에 있어 긍정적인 측면을 보이는 생산물 이다(Kim et al., 1992). 반대로 3-methyl butanal의 경우는 고 염의 시료 일수록 높은 값을 나타냈으며, 3-methyl butanal 은 malt 향의 긍정적인 면을 띄는 주요 향성분이다. Alcohols은 각 시료별의 차이가 가장 크게 나타났는데, 2,3-butanediol은 처음 발효초기에만 생성되었으며 발효 4개월 이후에는 분석되지 않았다. 1-Octen-3-ol은 버섯 향 을 띄는 향미성분으로서 모든 시료 내에서 염 농도와 상관 없이 비슷한 경향성을 띄었으며, 고염의 시료에서 가장 높 은 수치를 나타냈다. 하지만 3-octanol은 4.8% 저염 간장 시료에서만 생성되었으며, phenethyl alcohol은 고염의 시 료일수록 높은 양을 생산하였다. 특히 phenethyl alcohol의 경우에는 hydrocarbon 냄새가 나는 화합물로서 장미유 등 에 함유되어 있는 향료성분 중 하나이다(Kim et al., 1992). 하지만 phenethyl alcohol 또한 발효가 진행됨에 따라 고염 시료에서의 값은 감소하였고, 반대로 저염 시료에서의 값 은 증가하였다. 3-Octanol은 대두 특유의 냄새를 내는 화합 물로서 대두의 발효과정이 늦어질 경우에 많이 발생하게 되는데 발효가 진행됨에 따라, 8.4% 시료에서는 발효 9개 월에 적은 양이 분석되었으며, 4.8% 시료에서는 발효초기 부터 마지막 발효 12개월까지도 지속적으로 분석되었다 (Park et al., 1997). Acids는 크게 acetic acid와 2-hydroxybenzoic acid를 측정하였는데, 발효기간 중 변화량을 살펴 보게 되면 처음 발효기간 3개월 동안에는 저염성의 시료 일수록 더 많은 acetic acid를 생산하였지만, 발효가 진행됨 에 따라 저염 간장의 값은 감소하였다. 고염성 시료들 간 의 acetic acid의 경향성은 보이지 않았다. 하지만 발효가 9개월 이상 지속됨에 따라 acetic acid양의 값들이 점차 감소되었으며 전체적으로 일정량의 낮은 수치를 나타냈다. 향미성분 내 acetic acid는 소량으로 있을 때에 단과일향과 배향을 내는 화합물로서, 많은 양을 생산 시에는 오히려 역 한 쉰내를 내며 풍미 저하를 가져올 수 있다(Sugawara, 1991; Kim et al., 1992). 2-Hydroxy-benzoic acid는 고염의 시료일수록 많은 양을 생산하였으며 발효가 4개월 이상 진 행됨에 따라 급격히 감소되었으며, 발효 12개월이 되었을 때 전체 시료가 낮은 수치의 일정량을 유지하였다. Pyrazines 의 경우, 발효초기 과정에서 고염의 시료가 증감하는 폭이 컸으며, 발효가 진행됨에 따라 전체적으로 그 값 또한 감 소하여 전체적인 시료들과 안정화를 이루었다. Pyrazines의 경우에는 고염의 시료일수록 높은 값을 나타냈다. Dimethyl pyrazine과 trimethylpyrazine은 된장 내에서 특유의 향에 크 게 기여하는 화합물로 알려져 있다(Sugawara, 1991; Kim et al., 1992). 전체적인 발효과정이 지속됨에 따라 그 값은 크게 감소하였고, 발효 12개월이 되었을 때에는 dimethyl pyrazine이 주를 이루었다. 전체적으로 pyrzines을 제외한 고염 간장과 저염 간장의 향기성분이 비슷한 경향성을 보 였지만, 4.8% 저염 간장에서는 대두의 발효과정이 늦어질 경우에 많이 발생하게 되는 3-octanol이 지속적으로 생성되 어 산업적으로 이용하기에는 지장이 있을 것이라 사료된다. 또한, 8.4% 염도 간장의 경우, 12%와 15.6% 염도 간장과 비슷한 경향의 향미성분을 가지지만, 전체적인 향기성분의 수치가 낮아 관능적으로 다를 것으로 예상된다. 그러므로 일 반적으로 제조되는 12% 염도의 간장은 그 이하로 염도를 낮출 경우, 관능적으로 다른 간장이 제조될 가능성이 높은 것으로 사료된다.
요 약
본 연구에서는 염 농도에 따른 간장의 발효과정 중에 microflora와 향미의 변화를 분석하였다. 전체적으로 4.8% 와 8.4%, 12.0%, 15.6% 시료의 호기성균과 호염성균 생균 수에 대해서는 큰 증감 없이 유사한 경향으로 나타났다. 발효초기에는 Bacillus amyloliquefaciens, B. licheniformis, B. subtilis가 주를 이루었다. 유산균이나 곰팡이의 미생물 총균수 패턴은 모든 염도 별로 거의 유사하게 낮게 나타났 으며, 발효 초기에만 발견되었다. 효모 또한 4.8% 간장에 서만 2 log CFU/g 이하의 낮은 수치를 보였다. Aldehydes, alcohols, acids의 경우 발효초기부터 발효 3개월까지 저염 화 시료에서 많이 생성되었다







