서 론
2050년까지 세계 인구는 약 72억 명에서 약 95억 명으 로 약 23억명이 증가할 것으로 예상되며, 이에 따라 식량 생산량은 약 70%가 증가해야 한다(Godfray et al., 2010). 그러나 이전에 활용된 농업 생산 방법은 자연 서식지 파괴, 생물 다양성 위협, 토지 개간으로 인한 온실가스 발생, 비 료 및 가축 생산 등 환경에 미치는 영향이 크기 때문에 식량 생산 요구를 충족하기 위한 새로운 친환경적인 식량 공급원이 필요하다(Tilman et al., 2011). 단백질은 사람이 생명을 유지하기 위해 필수적으로 필요한 3대 영양소 중 하나로 단백질 수요는 인구 증가와 함께 계속 증가할 것으 로 보인다. 그러나 지구 온난화로 인한 자원 고갈과 식품 생산량의 한계로 전통적인 축산업에 의존한 육류 생산으로 는 단백질 확보가 어려울 것으로 예상된다(Park, 2021;Cho & Ryu, 2022). 이에 따라 동물성 기반 단백질을 대체 하기 위한 연구 개발 필요성이 점차 높아지고 있다. 현재 가장 대표적인 대체 단백질 주원료는 대두, 완두, 녹두와 같은 식물성 단백질이 있으며, 미세조류, 곤충 역시 활용 가능한 소재로 알려져 있다(Asgar et al., 2010). 이러한 연구 흐름에 따라 다양한 대체 단백질 소재가 등장하고 있는데 이 중 미세조류는 자원 활용성과 지속가능성의 장점이 있 어 대체 단백질 식량원으로서 미래 가치가 높다. Chlorella 종과 Spirulina 종 등 대부분의 미세조류 종은 고기, 계란, 콩, 우유와 같은 전통적인 단백질 공급원과 유사한 수준의 단백질을 함유하고 있는 것으로 알려져 있다(Fleurence, 1999;Sousa et al., 2008).
미세조류는 광합성 대사를 통해 성장하는 단세포 미생물 로 이산화탄소를 탄소원으로 이용하여 탄수화물, 단백질, 지질을 합성할 수 있는 식물 바이오매스 자원이다(Jeon et al., 2008;Joo et al., 2015). 기존의 곡물 자원보다 광합성 효율이 높고 빠른 성장 속도와 짧은 세대시간을 가진다는 특징이 있으며 특히 단백질 함량과 지질 함량이 높다 (Miao & Wu, 2006;Choi et al., 2012). 미세조류의 구성 성분 중 지질을 제외하면 많은 부분을 차지하는 것은 단백 질로서, 단백질 함량이 높을 뿐 아니라 아미노산 조성 또 한 우수하여 미래지향적 소재 자원으로 주목할 만 하다 (Lee et al., 1999). 그러나 현재 미세조류를 이용한 상업적 응용 분야는 폐수 처리, 바이오 연료, 고부가가치 산물 생 산 등 환경, 에너지, 화학 분야에 국한되어 있다(Chew et al., 2017). 지금까지 미세조류에 대한 선행 연구는 색소물 질 생산(Kang et al., 2023), 축산 폐수처리(Park et al., 2019), 수질 개선(Kim et al., 2018), 바이오 디젤 생산 (Shin et al., 2016) 등으로 주로 하수 및 폐수 처리에서의 영양 염류 제거, 미세조류를 이용한 바이오 오일 생산에 초점을 두고 있다. 미세조류 바이오매스와 부가가치 화합 물은 경제적으로 가치가 있어 매년 매출액이 증가하고 있 으며 미세조류는 단백질 자원으로서도 연구가 지속 되어야 한다(Pulz & Gross, 2004). Chlorella 종과 Spirulina 종은 건강기능성 식품으로, Dunaliella 종은 기능성 지질 식품으 로 연구, 산업화되고 있으나 식품 단백질 소재로서 미세조 류의 사용은 현재까지 제한적이다. 단백질 소재로 확대하 기 위해서는 생산성 향상이 매우 중요하며 가장 기초가 되 는 미세조류의 다양한 배양 조건에 대한 비교 연구가 필요 하다.
미세조류는 광원 뿐만 아니라 산소, 이산화탄소, pH, 온 도, 배지 성분, 교반 속도 등 여러가지 요인들에 의해서 세포 성장과 이차대사산물 생산량이 결정된다. 대체 단백 질 소재로서 미세조류의 생산성을 고려한다면 배양 환경 인자들의 최적화가 필수적이다(Schenk et al., 2008;Jo & Cha, 2010). 미세조류 배양에 대한 선행 연구를 보면, Choi et al. (2013)은 LED 파장, 광도, 공기주입에 따른 배 양 최적화, Park et al. (2020)은 접종 농도에 따른 배양 최 적화, Jeong et al. (2016)은 배양 방법에 따른 배양 최적화, Joo et al. (2015)은 광도, 광파장에 따른 배양 최적화 등을 진행하였으나 복수의 환경 인자를 함께 고려한 연구는 미 흡한 실정이다.
본 연구에서는 단백질 함량이 높다고 잘 알려진 Chlorella vulgaris, Dunaliella salina, Scenedesmus obliquus의 생산량 증대를 목적으로 배양 방법, 배양 온도, 배양 초기 pH, 교 반 여부, 광도, 광주기, 파장, 초기 접종량, 배양 규모가 미 세조류 성장에 미치는 영향을 비교하고, 최적화하여 미세 조류를 대체 단백질 자원 소재로 활용하기 위한 기초 연구 로 활용하고자 하였다.
재료 및 방법
본 실험에 사용한 3종의 미세조류 Chlorella vulgaris (AG10032), Dunaliella salina (AG60854), Scenedesmus obliquus (AG10047)는 생물자원센터(Korean Collection for Type Cultures, KCTC)에서 분양 받았다. 일반적으로 Chlorella vulgaris는 단백질 함량 51-58%, Dunaliella salina 는 57%, Scenedesmus obliquus는 50-55%라고 알려져 있 다(Abakoura & Christophe, 2016;Kumar et al., 2022). 배양 배지는 C. vulgaris와 S. obliquus는 BG11 (Allen, 1968), D. salina는 f/2 (Ryther & Guillard, 1962)를 제조하여 고 압 멸균기(AC-100, Hanyang Science Lab Co., Ltd, Korea)를 이용해 121°C에서 15분간 멸균하여 실험에 사용 하였다. 종균은 250mL 삼각 플라스크에 100mL 배지와 분양 받은 균주 10mL를 넣고 온도 25°C, 3000 Lux 광도 로 24시간 빛 공급, 교반 속도 120 rpm, 공기 주입은 하지 않는 조건, 초기 접종 농도 1.0 × 106 cells/mL으로 수행되 었으며, 계대 배양은 일주일 간격으로 수행하였다.
배양 방법은 자가영양배양(Autotrophic culture), 타가영양 배양(Heterotrophic culture), 혼합영양배양(Mixotrophic culture) 으로 하였다. 자가영양배양은 탄소원을 제공하지 않고 광 원으로 배양하는 방법이고, 타가영양배양은 광원을 제공하 지 않고 탄소원만을 제공하여 배양하는 방법이며, 혼합영 양배양은 광원과 탄소원을 모두 제공하는 조건에서 배양하 는 방법이다(Jeong et al., 2016). 본 연구에서는 최적 배양 방법을 확립하기 위해 자가영양배양, 타가영양배양, 혼합영 양배양 조건을 설정하여 7일 동안 배양하였다. 배양 방법 에 따른 성장 양상을 알아보기 위하여 온도 25°C, 3000 Lux 광도로 24시간 빛 공급, 교반 속도 120 rpm, 공기 주 입은 하지 않는 조건을 기본 조건으로 설정하여 실험을 진 행하였다.
본 연구에서는 최적 배양 온도를 확립하기 위해 15°C, 20°C, 25°C, 30°C, 35°C으로 온도 조건을 설정하여 7일 동 안 배양하였다. 온도에 따른 성장 양상을 알아보기 위하여 온도를 제외한 나머지 조건은 동일하게 고정하였다.
본 연구에서는 배지의 최적 초기 pH 조건을 확립하기 위해 pH 3.0, 4.0, 5.0, 6.0, 6.5, 7.0, 9.0으로 설정하여 7일 동안 배양하였다. 배양액 초기 pH에 따른 성장 양상을 알 아보기 위하여 pH를 제외한 나머지 조건은 동일하게 고정 하였다.
본 연구에서는 교반 여부에 따른 성장 영향을 알아보기 위해 진탕 배양기(Daihan scientific, WIS-010, Korea)를 이 용하여 교반 속도 120 rpm 조건과 정지 배양 조건으로 나 누어 10일 동안 배양하였다. 교반 여부에 따른 성장 양상 을 알아보기 위하여 교반을 제외한 나머지 조건은 동일하 게 고정하였다.
본 연구에서는 배양기(LTE-510, EYELA, Tokyo, Japan) 내부 환경에서 광원 미제공, 1500, 3000, 4500, 6000 Lux 조건으로 변화하여 20일 동안 성장 양상을 실험하였다.
광주기는 빛 공급에 있어서 명반응(L):암반응(D)으로 본 연구에서는 24L:0D, 16L:8D, 14L:10D, 12L:12D, 10L:14D, 0L:24D 조건으로 10일 동안 성장 양상을 실험하였다.
본 연구에서는 파장에 따른 성장 속도를 비교하기 위해 광원으로 Red LED (660 nm), Blue LED (450 nm), White LED, Mixed LED (Red:Blue:White = 1:1:1), Fluorescent light을 사용하였다. 투입 전력은 60W로 모두 일정하지만 White LED는 6200 Lux, Red LED는 2600 Lux, Mixed LED는 2300 Lux으로 다른 조도 값을 가졌다.
결과 및 고찰
배양 방법에 따른 미세조류의 성장 정도를 알아보기 위 하여 자가영양배양, 타가영양배양, 혼합영양배양 배양 방법 을 사용하여 배양하였다. 탄소원과 광원을 모두 제공한 혼 합영양배양 방법에서는 C. vulgaris, D. salina, S. obliquus 3종의 미세조류 모두 9.483×106 cells/mL, 5.529 × 106 cells/ mL, 4.123 × 106 cells/mL 결과를 보여 배양 방법 중 가장 높 은 세포 밀도를 보였다(Table 1). 또한 C. vulgaris, D. salina, S. obliquus 3종의 미세조류 모두 자가영양배양 방 법으로 7일 동안 배양 결과 각각 5.173×106 cells/mL, 3.874 × 106 cells/mL, 2.694 × 106 cells/mL이 측정되어 탄소 원이 없는 환경에서 광합성만으로 성장하는 자가영양배양 이 가능함을 보였다. 특히 D. salina, S. obliquus는 자가영 양배양이 타가영양배양 보다 높은 세포 밀도를 확인할 수 있었다. 그러나 자가영양배양 방법에서는 배양기간 7일 동 안 높은 세포 밀도까지 도달하지 못하였고, 배양 시간과 광원에 대한 효율을 고려하였을 때 적합한 방법이 아니라 고 판단되었다. 배양 방법에 따른 성장 비교 결과, 높은 수 율의 미세조류 생산을 위해 가장 적합한 배양방법은 혼합 영양배양인 것으로 나타났다. 본 실험 이후에는 혼합영양 배양 방법을 선택하여 실험을 진행하였다.
미세조류의 성장은 종에 따라 조건이 상이한데 일반적 으로 광합성에 의한 성장에서 온도는 매우 중요한 조건 요소이다. 적절한 온도 설정은 미세조류의 증식을 최대로 증대 시킬 수 있는 방법이다(Choi & Lee, 2011). 온도에 따른 C. vulgaris, D. salina, S. obliquus의 세포 성장 정 도 결과를 나타내었다(Fig. 1). C. vulgaris의 경우 25°C에 서 7.279 × 106 cells/mL으로 가장 높은 세포 밀도를 보였 으며 다음으로 30°C 6.638×106 cells/mL, 35°C 5.919×106 cells/mL, 20°C 5.932×106 cells/mL, 15°C 2.911×106 cells/ mL 순으로 나타났다. D. salina의 경우 20°C에서 6.313 × 106 cells/mL으로 가장 높은 세포 밀도를 보였으며 25°C 5.924 × 106 cells/mL, 30°C 5.332×106 cells/mL, 35°C 3.299× 106 cells/mL, 15°C 2.811 × 106 cells/mL 순으로 나타났다. S. obliquus의 경우 30°C에서 4.425 × 106 cells/mL으로 가장 높은 세포 밀도를 보였으며, 25°C 4.123 × 106 cells/mL, 35°C 2.865 × 106 cells/mL, 20°C 2.291×106 cells/mL, 15°C 1.887 × 106 cells/mL 순으로 나타났다. C. vulgaris, D. salina, S. obliquus 모두 15°C 저온 환경에서는 성장이 느린 것을 확인하였다.

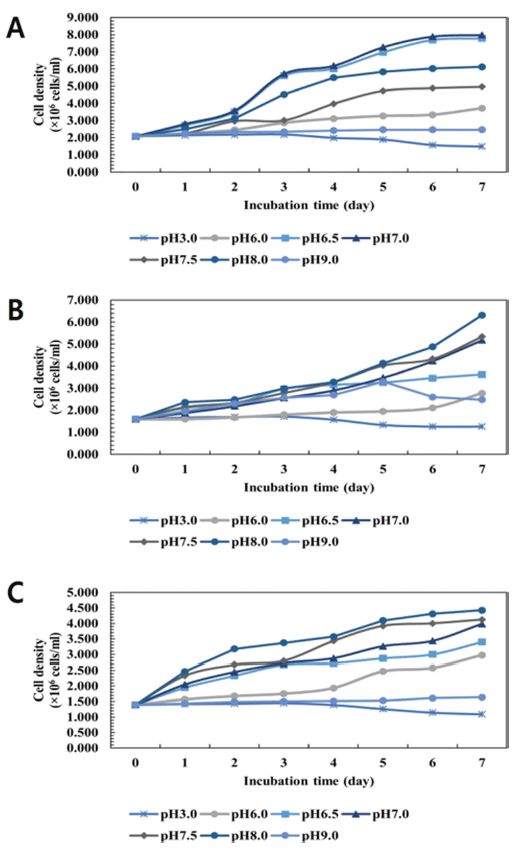
미세조류 배양에서 배지 안의 pH는 미세조류의 조절, 광 합성 등 모든 요인에 영향을 미친다. pH에 따른 C. vulgaris, D. salina, S. obliquus의 증식을 나타내었다(Fig. 2). C. vulgaris의 경우 pH 3.0과 9.0에서는 성장이 현저하게 저조 했으며, pH가 너무 낮거나 높은 경우는 미세조류 성장에 필요한 포도당을 축적하기 어려워 폐사할 가능성이 있다고 알려져 있다. 결과적으로 pH 7.0에서 7.979× 106 cells/mL 으로 세포 밀도가 가장 높았다. pH 6.5는 7.779 × 106 cells/ mL으로 pH 7.0 보다 약간 낮은 성장을 보였지만 거의 차 이 없이 비슷한 증식을 나타내었다. 실험 결과 C. vulgaris 의 증식에서는 pH 6.5와 pH 7.0가 미세조류 성장에 최적 pH임을 알 수 있었다. D. salina의 경우 앞서 C. vulgaris 와 유사하게 pH 3.0과 9.0에서는 성장이 현저하게 저조했 고, pH 8.0에서 6.313 × 106 cells/mL으로 가장 높은 성장 을 보였다. S. obliquus의 경우 앞서 C. vulgaris와 유사하 게 pH 3.0과 9.0에서는 성장이 현저하게 저조했고, pH 8.0 에서 4.425 × 106 cells/mL으로 가장 높은 성장을 보였다.
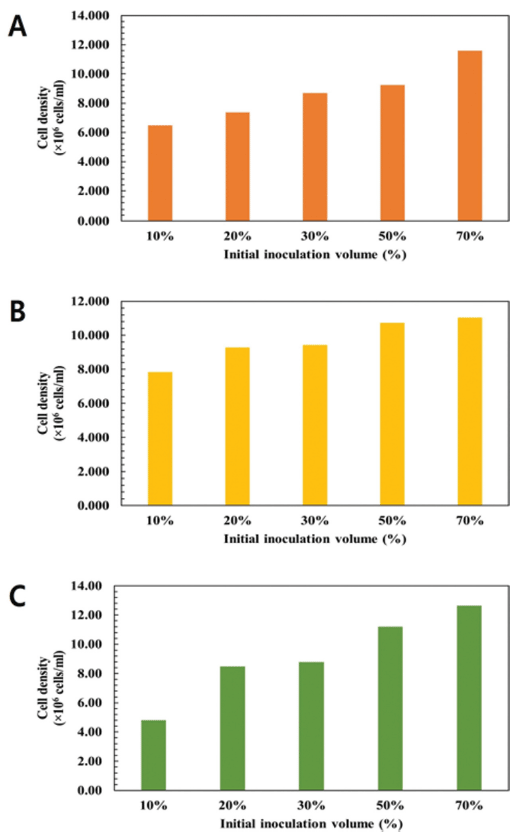
초기 접종량에 따른 C. vulgaris, D. salina, S. obliquus 의 성장 결과를 나타내었다(Fig. 3). C. vulgaris의 경우 배 양 결과 접종량이 증가함에 따라 성장 또한 증가하는 것으 로 나타났다. 10% 접종 시 6.484 × 106 cells/mL, 20% 접종 시 7.381 × 106 cells/mL, 30% 접종 시 8.684×106 cells/mL, 50% 접종 시 9.246 × 106 cells/mL, 70% 접종 시 11.584 × 106 cells/mL으로 나타났다. 그러나 10%를 접종한 경우와 70% 를 접종한 경우를 비교하였을 때 접종량은 7배 차이 나는 것에 비해 성장률은 각각 6.484 × 106 cells/mL와 11.584 × 106 cells/mL으로 효율은 낮음을 보였다. 이는 미세조류 배 양 초기 접종량이 미세조류의 성장에 영향을 미치지만 일 정 농도 이상의 접종량은 오히려 세포 밀도에 방해가 되는 것으로 보인다. 특히 30%를 접종한 경우와 50%를 접종한 경우는 성장에 차이가 거의 나타나지 않았다. D. salina의 경우 C. vulgaris와 마찬가지로 접종량이 증가함에 따라 성장 또한 증가하는 것으로 나타났다. 10% 접종 시 7.841 × 106 cells/mL, 20% 접종 시 9.282 × 106 cells/mL, 30% 접종 시 9.434 × 106 cells/mL, 50% 접종 시 10.732 × 106 cells/mL, 70% 접종 시 11.041 × 106 cells/mL으로 나타났다. S. obliquus의 경우 C. vulgaris와 마찬가지로 접종량이 증가함에 따라 성 장 또한 증가하는 것으로 나타났다. 10% 접종 시 4.80 × 106 cells/mL, 20% 접종 시 8.48×106 cells/mL, 30% 접종 시 8.80 × 106 cells/mL, 50% 접종 시 11.20×106 cells/mL, 70% 접종 시 12.64 × 106 cells/mL으로 나타났다.
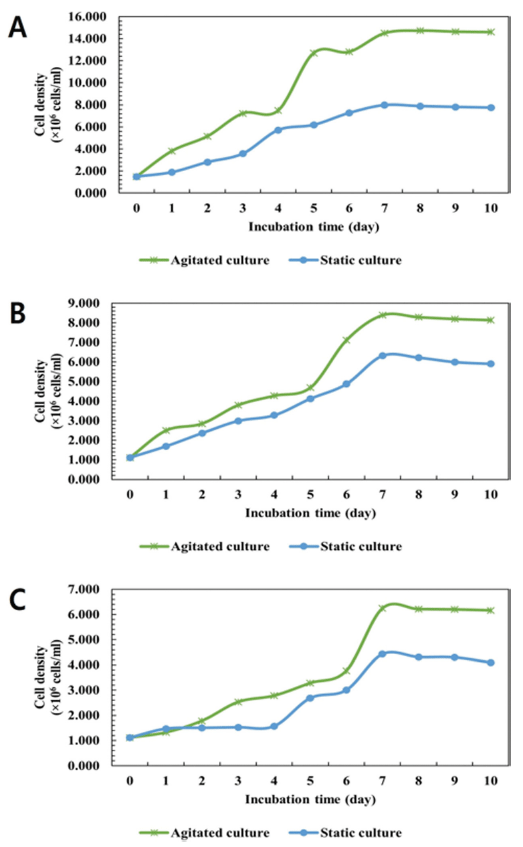
미세조류의 성장에 있어 적당한 혼합은 세포를 부유 상 태로 유지시켜줘 성장에 좋은 영향을 미친다. 또한 용기의 교반으로 인해 광원 저해를 최소화할 수 있어 교반은 중요 하다. 적당한 교반은 미세조류의 성장에 도움이 되지만 과 도한 교반 속도는 세포에 스트레스를 주어 오히려 성장에 악영향을 미친다(Choi & Lee, 2012). 교반에 따른 C. vulgaris, D. salina, S. obliquus의 성장 결과를 나타내었다 (Fig. 4). C. vulgaris의 경우 예상대로 적당한 교반은 미세 조류의 성장에 도움을 주어 정치 배양에 비해 교반 배양이 높은 세포 밀도를 보였다. D. salina의 경우 교반 배양 시 14.593 × 106 cells/mL, 정지 배양 시 7.750 × 106 cells/mL으로 2배 가까운 차이를 보였다. S. obliquus의 경우 교반 배양 시 8.134×106 cells/mL, 정지 배양 시 5.899×106 cells/mL 으로 나타났다. 교반에 따른 S. obliquus의 성장 결과를 나 타내었다. 교반 배양 시 6.162×106 cells/mL, 정지 배양 시 4.091 × 106 cells/mL으로 나타났다.
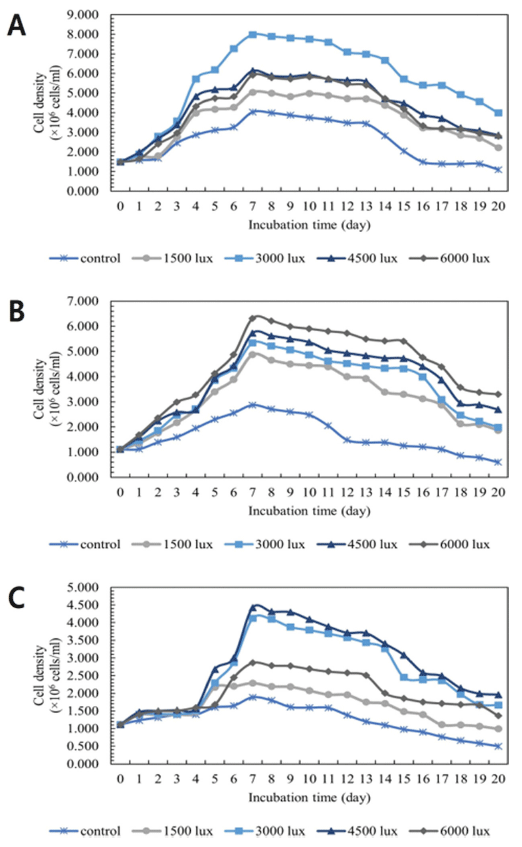
본 연구에서는 광원 미제공, 1500, 3000, 4500, 6000 Lux 조건으로 변화하여 20일 동안 성장 양상을 실험하였다. 광 도에 따른 C. vulgaris, D. salina, S. obliquus의 성장 결과 를 나타내었다(Fig. 5). 광도에 따른 C. vulgaris의 성장 결 과, 3000 Lux, 4500 Lux, 6000 Lux, 1500 Lux, 광원 미제공 순으로 나타났다. 3000 Lux에서 3.987 ×106 cells/mL으로 가장 우수한 세포 밀도를 보였으며, 광원을 주지 않은 무 처리 조건에서는 빛이 제한되어 1.093 × 106 cells/mL으로 낮은 세포 밀도를 보였다. 광도에 따른 D. salina의 성장 결과, 6000 Lux, 4500 Lux, 3000 Lux, 1500 Lux, 광원 미제 공 순으로 나타났다. 6000 Lux에서 3.299 × 106 cells/mL으로 가장 우수한 세포 밀도를 보였다. 광도에 따른 S. obliquus 의 성장 결과, 4500 Lux, 3000 Lux, 6000 Lux, 1500 Lux, 광원 미제공 순으로 4500Lux에서 1.961 × 106 cells/mL으 로 가장 우수한 세포 밀도를 보였다. C. vulgaris, D. salina, S. obliquus 모두 광원을 제공하지 않은 경우 성장 이 가장 저조함을 보였다.
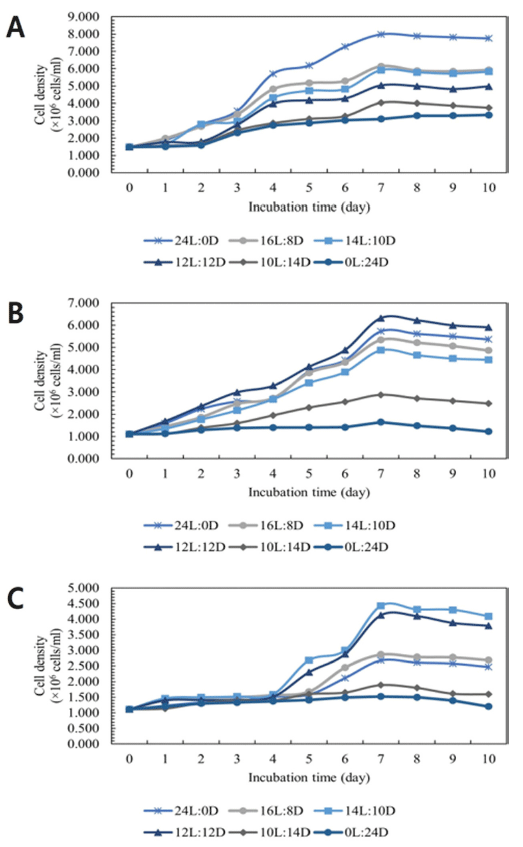
Yoshimoto et al. (2005)에 따르면 미세조류 배양에서 광 조사 간격이 광합성 효율을 더 증가시킨다. 광주기가 미세 조류의 배양에 미치는 영향을 확인하기 위해 24L:0D, 16L:8D, 14L:10D, 12L:12D, 10L:14D, 0L:24D 조건으로 10일 동안 성장 양상을 비교하였다. 광주기에 따른 C. vulgaris, D. salina, S. obliquus의 성장 결과를 나타내었다 (Fig. 6). C. vulgaris의 경우 24L:0D, 16L:8D, 14L:10D, 12L:12D, 10L:14D, 0L:24D 순으로 C. vulgaris의 성장에 는 빛 제공이 중요함을 알 수 있다. 24L:0D에서 7.750 × 106 cells/mL으로 가장 우수한 세포 밀도를 보였다. D. salina의 성장 결과, 12L:12D, 24L:0D, 16L:8D, 14L:10D, 10L:14D, 0L:24D 순으로 나타났으며 12L:12D에서 5.899 × 106 cells/mL으로 가장 우수한 세포 밀도를 보였다. S. obliquus의 성장 결과, 14L:10D, 12L:12D, 16L:8D, 24L:0D, 10L:14D, 0L:24D 순으로 나타났다. 14L:10D에서 4.091 × 106 cells/mL으로 가장 우수한 세포 밀도를 보였다.
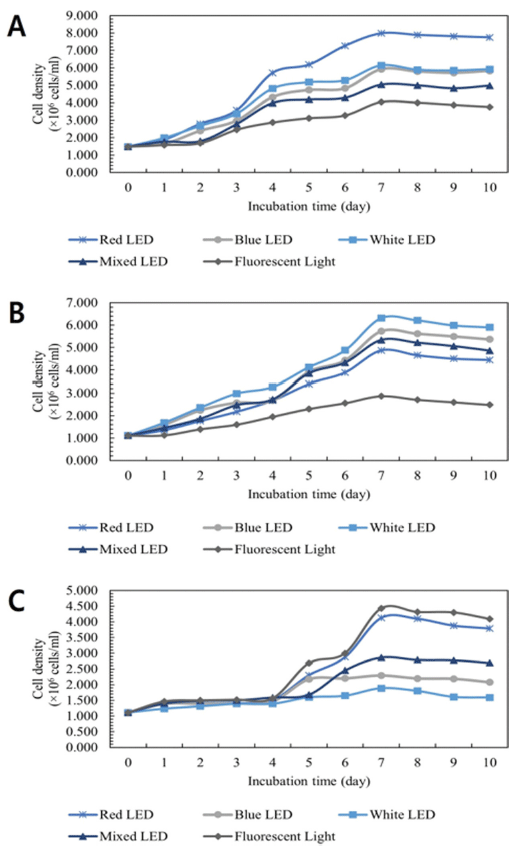
본 연구에서는 파장에 따른 성장 속도를 비교하기 위해 광원으로 red LED (660 nm), blue LED (450 nm), white LED, mixed LED (Red:Blue:White = 1:1:1), fluorescent light을 사용하였다. 파장에 따른 C. vulgaris, D. salina, S. obliquus의 성장 결과를 나타내었다(Fig. 7). C. vulgaris의 경우 Red LED에서 7.750 × 106 cells/mL으로 가장 높은 세 포 밀도를 보였으며, white LED 5.923 × 106 cells/mL, blue LED 5.825 × 106 cells/mL, mixed LED 4.975 × 106 cells/mL, fluorescent light 3.755 × 106 cells/mL 순으로 성장이 감소 하였다. C. vulgaris와 보색 관계인 red 색상의 빛이 C. vulgaris의 성장에 매우 중요하게 작용했을 것으로 판단된 다. D. salina의 경우 White LED에서 5.899 × 106 cells/mL 으로 가장 높은 세포 밀도를 보였으며, blue LED 5.359 × 106 cells/mL, mixed LED 4.858 × 106 cells/mL, red LED 4.444 × 106 cells/mL, fluorescent light 2.481 × 106 cells/mL 순으로 성장이 감소하였다. 따라서 white LED가 D. salina 의 배양에 가장 효과가 좋은 것으로 확인되었다. 이는 D. salina의 Chlorophyll-a (광합성을 할 때 필요한 빛을 흡수 하는 색소)의 흡음 특성이 440 nm에서 높게 나타났다는 연구 결과와 일치한다(Barbieri et al., 2006). 파장에 따른 S. obliquus의 성장 비교 결과 fluorescent light에서 4.091 × 106 cells/mL으로 가장 우수한 세포 밀도를 보였고, red LED 3.789 × 106 cells/mL, mixed LED 2.689 × 106 cells/mL, blue LED 2.076 × 106 cells/mL, white LED 1.593 × 106 cells/ mL 순으로 나타났다.
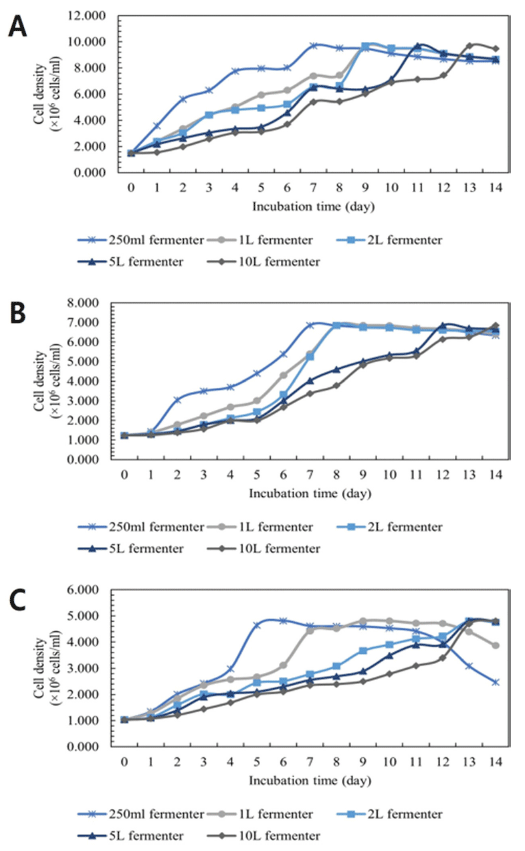
배양 규모에 따른 C. vulgaris, D. salina, S. obliquus의 성장 결과를 나타내었다(Fig. 8). C. vulgaris의 경우 배양 용기의 규모가 작을수록 빠른 성장률을 보였으며 최대 세 포 밀도를 보인 후 세포 밀도가 점차 낮아짐을 확인하였 다. 250 ml 배양관은 배양 7일차에, 1 L와 2 L 배양관은 배양 9일차에, 5 L 배양관은 배양 11일차에, 10 L 배양관 은 배양 13일차에 9.684 × 106 cells/mL으로 최대 세포 밀 도를 보였다. D. salina의 경우 250mL 배양관은 배양 7 일차에, 1 L와 2 L 배양관은 배양 8일차에, 5 L 배양관은 배양 12일차에, 10 L 배양관은 배양 14일차에 6.849 × 106 cells/mL으로 최대 세포 밀도를 보였다. S. obliquus의 성 장 결과 250 mL 배양관은 배양 6일차에, 1 L 배양관은 배양 10일차에, 2 L, 5 L 배양관은 배양 13일차에, 10 L 배양관은 배양 14일차에 4.812 × 106 cells/mL으로 최대 세포 밀도를 보였다. 배양 규모에 따른 성장 속도의 차이 는 배양 용기가 작을수록 고른 광량 확보가 가능했기 때 문인 것으로 판단된다.
요 약
단백질은 사람이 생명을 유지하기 위해 필수적으로 필 요한 3대 영양소 중 하나로 단백질 수요는 인구 증가와 함께 계속 증가할 것으로 보인다. 이에 따라 동물성 단백 질을 대체하며 식량 생산 요구를 충족하기 위한 새로운 친환경적인 식량 공급원이 필요하다. 미세조류는 기존의 곡물 자원보다 광합성 효율이 높고 빠른 성장 속도와 짧 은 세대시간을 가진다는 특징이 있으며 특히 단백질 함량 이 높다. 식품 단백질 소재로서 미세조류의 사용이 확대 되기 위해서는 생산성이 증대되어야 하며, 단백질 함량이 높은 미세조류를 대량으로 생산하기 위한 미세조류 배양 조건이 종합적으로 비교된 기초 연구가 필요하다. 본 연 구에서는 미세조류 종에 따라 생산량 증대를 목적으로 배 양 방법, 배양 온도, 배양 초기 pH, 교반 여부, 광도, 광 주기, 파장, 초기 접종량, 배양 규모에 따른 조건을 다양 화하여 배양 조건을 최적화하였다. 실험 결과, C. vulgaris (AG10032)는 혼합영양배양, 배양 온도 25°C, 배양 초기 pH 7.0, 초기 접종량 10%, 교반 배양, 광도 3000 Lux, 광 주기 24L:0D, red LED가 최적 배양 조건으로 판단된다. D. salina (AG60854)는 혼합영양배양, 배양 온도 20°C, 배양 초기 pH 8.0, 초기 접종량 10%, 교반 배양, 광도 6000 Lux, 광주기 12L:12D, White LED였으며 S. obliquus (AG10047)는 혼합영양배양, 배양 온도 30°C, 배양 초기 pH 8.0, 초기 접종량 10%, 교반 배양, 광도 4500 Lux, 광 주기 14L:10D, Fluorescent light, 배양규모 250 mL가 최 적 배양 조건으로 조사되었다. 단백질 함량이 높은 것으 로 잘 알려진 대표 미세조류 3종의 배양 조건을 종합적 으로 비교하였다. 이러한 연구 결과는 미세조류의 단백질 대체 소재 활용을 위한 기초 정보로 활용될 수 있을 것 이다.







