서 론
전세계적으로 경제 성장과 기술 발전으로 인해 사람들의 삶의 질이 향상되면서 식생활문화가 변화되고 인간 수명이 연장됨에 따라 사람들은 건강한 삶을 유지하는데 많은 관 심을 기울이고 있다. 그러나 이와 동시에 인구 고령화로 인한 만성 질환 증가 및 코로나19(COVID-19)와 급성 호 흡기 증후군(SARS, MERS)과 같은 바이러스로 인한 각종 질병들이 자주 발생하면서 이들을 예방하고자 면역기능을 개선할 수 있는 천연물 유래 소재를 활용한 건강기능식품 에 대한 사회적 요구와 관심이 지속적으로 높아지고 있다 (Kim et al., 2022).
인체의 면역시스템은 외부 병원성 물질이 침입했을 때 단핵구(monocyte), 호중구(neutrophile), 포식세포(phagocyte) 및 대식세포(macrophage)와 같은 다양한 면역세포들이 상 호작용함으로써 외부로부터 유입된 병원성 항원으로부터 우리 몸을 보호하려고 한다. 이중 대식세포는 인체 내 거 의 모든 조직에 분포해 있으며, 이물질 또는 생체 내 불필 요한 세포 등을 포식하고 제거하여 선천 면역에 관여하고 (Kwon et al., 2016), 면역조절인자인 nitric oxide (NO), reactive oxygen species (ROS), IL-1β, IL-6, IL-12 및 tumor necrosis factor (TNF)-α와 같은 다양한 cytokine 및 chemokine을 분비하여 면역반응을 극대화 시킬수 있는 중 요한 매개체 역할을 한다(Adams & Hamilton, 1984;Nathan, 1987;Sung et al., 2016). 특히, 외부 병원체가 인체에 침 입하면 대식세포 표면에는 Toll-like receptors (TLRs), CD14, scavenge receptor (SR), dectin-1 및 mannose receptor (MR)와 같은 패턴 인식 수용체(pattern recognition receptors, PRRs)가 존재하는데 이 막 수용체를 통해 미생물(병원체) 을 인식할 수 있다(Schepetkin & Quinn, 2006). 대식세포 의 PRRs를 통해 발생하는 신호는 대식세포를 활성화하여 다양한 cytokine 및 chemokine을 분비하여 외부 병원체를 제거할 뿐만 아니라 외부 항원을 인식하여 T 세포를 활성 화하고 조절함으로써 후천 면역의 활성화를 유도한다고 알 려져 있다(MacMicking et al., 1997;Forman & Torres, 2002;Jiang et al., 2010).
새싹보리(Hordeum vulgare L.)는 외떡잎식물 벼목 화본 과에 속하는 두해살이풀로 보리를 파종하고 자란 15-20 cm 정도의 어린잎을 말한다(Chae et al., 2019). 새싹보리는 보 리순, 보리잎 또는 보리싹이라고도 불리며, 보리알의 어린 잎으로 녹색가루 성분으로 잘 알려져 있으며 독일에서는 ‘Gersten-gras’, 일본에서는 ‘Aojiru’라는 상품명으로 유통되 고 있다. 새싹보리는 보통 파종 후 2주 이내에 수확한 어 린 잎으로 외부의 공격으로부터 자기자신을 보호하고 싹을 틔워기 위해 다양한 생리활성물질들을 다량 함유하고 있는 것으로 알려져 있어 보리의 씨앗, 줄기와 같은 다른 부위 들보다 새싹부위에 더 큰 관심을 두고 연구를 진행하고 있 다(Sattar & Badshah, 1995). 새싹보리에는 비타민 C, 비타 민 E, β-carotene, lutonarin, saponarin, polysaccharide 등의 기능성 물질이 다량 함유되어 있어 이들이 각종 항산화 활 성, 지질 및 당의 대사작용, 혈중 콜레스테롤 감소 및 장 관면역활성에 효과가 있다는 연구가 보고되어 있다 (McIntosh et al., 1991;Yu et al., 2002;Markham & Mitchell, 2003;Kim, 2006;Ferreres et al., 2009;Yamaura et al., 2012;Ikeguchi et al., 2014;Kim et al., 2017).
따라서, 본 연구에서는 대식세포주 RAW264.7 cell을 이 용하여 새싹보리로부터 추출한 조다당의 세포 생존율, cytokine 분비능, 대식세포 활성화를 통해 세포내 신호전달 경로를 확인함으로써 새싹보리 유래 다당의 면역증강 효과 및 작용 기전을 규명하고, 면역증진 효과를 가진 천연물로 서의 개발 가능성을 확인하고자 하였다.
재료 및 방법
본 연구에서 사용된 새싹보리는 2021년에 수확하여 열 풍건조 및 분쇄 후 보관하였다. 새싹보리로부터 다당을 분 리하기 위해 건조된 새싹보리 500 g에 20배의 증류수를 가 하고, 6시간 동안 열수추출하였다. 이후 원심분리(6,000 rpm, 15분)하여 불용성 물질들을 제거하고 상등액에 4배의 에탄올을 첨가하여 2시간 교반 후 12시간 방치하여 침전 물을 얻었다. 다시 원심분리기를 이용하여 상등액은 제거 하였으며, 회수된 침전물은 소량의 물에 재용해하여 투석 을 3일간 냉장에서 진행하였으며, 이후 농축 및 동결건조 를 거쳐 새싹보리 유래 열수추출 조다당 YBP를 얻었다.
다당의 구성성분을 분석하고자 Honda et al. (1989)의 방 법을 일부 변형하여 실험에 적용하였다. 시료 1mg에 2M TFA (trifluoroacetic acid) (Sigma-Aldrich, St. Louis, MO, USA) 1 mL을 첨가하여 실링 후 121°C에서 1.5시간 가수분 해하여 N2 flushing으로 건조한 뒤, 0.3M sodium hydroxide (NaOH) 100 μL와 메탄올에 용해된 0.5 M 1-Phenyl-3- methyl-5-pyrazolone (PMP) (Sigma-Aldrich)을 120 μL씩 분 주하여 실링 후 70°C에서 1시간 동안 유도체화하였다. 반 응이 종결되고 0.3M hydrogen chloride (HCl) 100 μL로 중화한 후, 이를 완전히 건조한 뒤, chloroform과 distilled water을 이용하여 2상 용매계로 분리하고 물층만을 회수하 는 과정을 4회 반복하였다. 그 다음, 0.22 μm filter를 이용 하여 여과한 후 C18 column이 장착된 high performance liquid chromatography (HPLC)-UVD로 분석하였다. HPLC 로 분석하기 위해 사용된 용매는 0.1 M phosphate buffer (pH 6.7)와 acetonitrile (ACN)을 각각 82:18로 혼합하여 사 용하였으며, 흡광도 254 nm에서 60분간 측정하였다. 각 구 성당의 mole%는 유도체화된 internal standard (glucosamine 사용) 대비 시료의 peak 면적과 각 단당의 분자량으로부터 환산하여 계산하였다.
실험에 사용한 대식세포주인 RAW 264.7 (KCLB 40071) 세포는 한국세포주은행(Seoul, Korea)에서 분양 받아 사용 하였다. 대식세포에 대한 시료의 cytotoxicity, nitric oxide (NO)와 IL-6 및 TNF-α를 측정하기 위해 96 well plate에 RAW 264.7 세포를 2.0 × 105 cells/well로 조정하여 100 μL 씩 가하고, 37°C, 5% CO2 배양기에서 2시간 동안 세포를 부착시켰다. 이후 여러 농도로 희석하여 시료를 100 μL씩 첨가하였고 37°C, 5% CO2 배양기에서 24시간 배양하였다 (Janaeway, 1968). 시료 농도에 따른 세포 독성을 확인하기 위해 상등액을 제거한 뒤 각 well에 5배 희석한 E Z-cy tox (Daeil Lab Service, Seoul, Korea)를 50 μL씩 well에 첨가 하고 37°C, 5% CO2 배양기에서 30분 반응시켜 450 nm에 서 흡광도를 측정하였다.
반면, NO, IL-6 및 TNF-α를 측정하기 위해 위와 같이 동일한 방법으로 RAW264.7 cell을 24시간 배양한 후, 원 심분리(900 rpm, 5 min, 4°C)하여 세포배양액을 50 μL 회수 하여 상등액에 유도된 NO를 Griess reagent system kit (Promega, Madison, WI, USA)를 이용하여 측정하였다. IL-6의 경우에는 상등액을 2배, TNF-α의 경우에는 상등액을 5배 희석한 후, enzyme-linked immunosorbent assay (ELISA) kit (Mouse IL-6 ELISA, BD Biosciences, San Jose, USA; Mouse TNF-α kit, Invitrogen, Carlsbad, CA, USA)를 이용 하여 cytokine의 생성량을 측정하였다.
mRNA expression을 확인하기 위해 먼저 RAW 264.7 세 포를 60 π dish에 1.5×106 cells/dish로 조정한 후 37o C, CO2 배양기에서 12시간 배양하였다. 이후, 시료를 DMEM 에 용해하여 1-100 μg/mL 사이에 다양한 농도로 처리하고, 37°C, CO2 배양기에서 3시간 배양하였다. 이후, RNeasy Mini Kit (QIAGEN, Valencia, CA, USA)를 사용하여 제조 사에 지침에 따라 RNA를 추출하고 nanodrop으로 정량한 후, ReverseAid First Strand cDNA Synthesis kit (Fermentas, MA, USA)로 제조사의 protocol에 따라 cDNA를 합성하였 다. Power SYBR Green Master Mix (Applied Biosystems, Foster City, CA, USA) 형광 염색 시약을 이용하고, quantitative real-time PCR (qPCR)을 통해 iNOS, IL-6 및 TNF-α의 DNA 발현량을 측정하고자 하였다. 이때 사용된 각 primer sequence는 Table 1과 같다. 이후 상대적인 유전 자 발현량(relative mRNA expression)은 Step One Plus System (Applied Biosystems)을 이용하여 확인하였다. qPCR 조건은 IL-6와 TNF-α의 경우, 95°C에서 15초 → 60°C에서 1분으로 40 cycles (melting curve), iNOS의 경우 95°C에서 15초 →58°C에서 20초 →72°C에서 30초로 40 cycles (melting curve)까지 증폭시켜 시료의 comparative CT 값을 구한 후, housekeeping gene인 β-actin 유전자 cDNA를 같은 방법으로 증폭하여 2-ΔΔCT 방법으로 정량하 였다.
대식세포 내 대표적인 신호전달 경로인 mitogen-activated protein kinase (MAPK)와 nuclear factor kappa-light-chainenhancer of activated B cells (NF-κB) 경로를 확인하고자 RAW 264.7 세포를 60 π dish에 1.0 × 106 cells/dish로 조정 한 후 37°C, CO2 배양기에서 12시간 배양하였다. 이후, 시 료를 DMEM에 용해하여 최종농도가 0.05-5 μg/mL이 되도 록 처리한 후, 37°C, CO2 배양기에서 30분간 배양하였다. 배양 후 잔존 배지를 완전히 제거하기 위해 TBS로 세척하 고 Ripa buffer 400 μL를 첨가하여 세포를 용해시키기 위 해 dish를 ice 상에 30분 방치하고 난 후 세포 용출액을 회수하였다. 용출된 단백질은 원심분리(13,000 rpm, 15 min, 4°C)하여 상등액과 Laemmli sample buffer (Bio-Rad, Hercules, CA, USA)를 3:1 비율로 혼합한 후 100°C에서 5 분간 중탕한 후, 상온에 보관하면서 사용하였다.
Western blot을 진행하기 위해 10% polyacrylamide gel에 제조된 시료를 20 μL loading하여 120V에서 90분간 전기 영동하였다. 전기영동이 완료된 gel은 PVDF membrane (Millipore, Billerica, MA, USA)에 0.45A에서 80분간 transfer하고, PVDF membrane을 5% skim milk (Sigma- Aldrich) 또는 5% BSA (bovine serum albumin) (Sigma- Aldrich)에 2시간 blocking 하였다. 그 후, 1% TBS-T (Tris 247 mM, NaCl 1,370 mM, KCl 27 mM, Tween 20 0.5%, pH 7.6)를 이용하여 10분간 2회 washing하였다. 이후 1차 항체를 각각의 적정비율로 희석하여 처리한 후, 4°C에서 12시간 반응시킨 후, 1% TBS-T를 이용하여 10분간 3회 washing하였다. 이후 2차 항체를 각각의 적정비율로 희석 하여 처리하고 2시간 반응시킨 후, 1% TBS-T를 이용하여 10분간 3회 washing하였다. 항체반응이 완료된 membrane 은 ECL (Enhanced chemiluminescence, GE Healthcare, Buckinghamshire, UK)과 반응시켜 X -ray film (Agfa, Mortsel, Belgium)에 현상한 후 확인하고자 하는 단백질의 발현량을 비교하였다.
대식세포 내 신호전달 경로인 NF-κB (p65)의 핵 내로 신호전달 이행 여부를 확인하고자 confocal laser scanning microscopy (Carl Zeiss Microscopy, NY, USA)을 이용하여 실험을 진행하였다. 24 well plate에 12 mm cover slip (Paul Marienfeld GmbH & Co. KG, Germany)을 넣고 0.1% gelatin (Sigma-Aldrich) 500 μL씩 첨가하여 37°C, 5% CO2 배양기에서 30분간 방치한 뒤, 상등액을 모두 제 거하였다. 여기에 2.0 × 105 cells/mL로 조정한 RAW 264.7 세포를 37°C, CO2 배양기에서 5시간 동안 세포를 부착시 킨 후, 시료를 최종농도가 5 μg/mL이 되도록 처리한 후, 37°C, 5% CO2 배양기에서 2시간 동안 시료를 처리하였다. 시료처리 종료 후 PBS로 1회 washing하고 4% formaline (pH 7.2) 500 μL씩 가하여 15분간 실온 방치하여 반응을 중지시켰다. 다시 PBS로 1회 5분 동안 shaking하면서 3회 washing하고 5% BSA (in 0.1% Trion X-100/1× PBS)를 300 μL씩 처리하여 25°C의 암실에서 1시간 반응시켰다. 반응 종료 후 PBS로 1회 5분 동안 shaking하면서 2회 washing하고 1차 항체(p65) (Santa cruz)를 1% BSA (in 0.3% Triton X-100/1× PBS)에 1:200으로 희석한 뒤 250 μL씩 처리하여 4°C에서 12시간 반응시켰다. 이후 PBS를 이용하 여 1회 5분 동안 shaking하면서 3회 washing하고 2차 항 체(Alexa Flour 488 goat anti-rabbit IgG) (Thermo Fisher Scientific, Seoul, Korea)를 1% BSA (in 0.3% Triton X- 100/1× PBS)에 1:2000으로 희석한 뒤 250 μL씩 처리하여 25°C의 암실에서 70분간 반응하였다. 이후 PBS로 1회 5분 동안 shaking하면서 3회 washing하고 24 well로부터 cover slip을 분리하여 mounting medium with DAPI (Vectashield, Burlingame, USA)와 함께 slide glass에 처리한 뒤 confocal laser scanning microscopy (Carl Zeiss Microscopy, NY, USA)를 이용하여 cell morphology를 관찰하였다.
대식세포를 표면에 존재하는 수용체의 발현 유무를 확인 하기 위해 2.0 × 106 cells/mL로 조정된 RAW 264.7 세포를 96 well plate에 100 μL씩 분주하고 37°C, 5% CO2 배양기 에서 5시간 배양한 뒤, TLR-2, TLR-4, SR, CD14, MR, CR3, Dectin-1 수용체 (pattern recognition receptor antibodies, anti-PRRs)를 최종농도가 각각 10 μg/mL이 되게 처리하여 37°C, 5% CO2 배양기에서 1시간 방치하였다. 이후 DMEM 에 시료를 용해 및 희석하여 최종농도가 5 μg/mL이 되도 록 처리하고 37°C, 5% CO2 배양기에서 24시간 시료를 처 리하였다. 시료처리 종료 후, NO는 Griess reagent system kit (Promega)를 이용하였고, IL-6는 Mouse IL-6 ELISA kit (BD Biosciences)를, TNF-α는 Mouse TNF-α kit (Invitrogen)를 이용하여 제조사의 지침에 따라 함량을 측정 하였다.
결과 및 고찰
새싹보리로부터 열수추출하여 얻은 조다당 YBP의 구성 당 분석을 진행한 결과(Table 2), xylose 25.8%, arabinose 24.1%, galactose 23.4% 그리고 galacturonic acid 11.7%로 구성되어 있었다. 이 결과로부터 본 연구진은 식물세포에 주 로 존재하는 arabinoxylan과 펙틴 유래 rhamnogalacguronan-I 및 arabinogalactan이 혼재하여 존재할 것이라 추정하였다 (Kim et al., 2017).
| YBP (Mole%) | |
|---|---|
| Mannose | 2.2±0.0 |
| Rhamnose | 7.2±0.1 |
| Glucuronic acid | 2.6±0.1 |
| Galacturonic acid | 11.7±0.0 |
| Glucose | 2.0±0.1 |
| Galactose | 23.4±0.0 |
| Xylose | 25.8±0.4 |
| Arabinose | 24.1±0.5 |
| Fucose | - |
대식세포는 선천면역을 담당하는 대표적인 세포로 외부 로부터 침입한 세균, 바이러스 및 이물질을 흡수하고 소화 하는 식세포 작용을 하고, 다양한 chemokine이나 cytokine 을 분비하면서 자기 방어를 하게 된다(MacMicking et al., 1997;Forman & Torres, 2002).
대식세포의 활성화 지표 중 하나인 nitric oxide (NO)는 면역반응에서 중요한 세포신호전달 분자로써 세포 내 감염 을 일으키는 미생물과 암세포를 제거하는 능력을 가지고 있다(Kwon et al., 2016). NO는 세포 내에 존재하는 Larginine으로부터 nitric oxide synthase (NOS)라는 합성효소에 의해 생성되며, 크게 endothelial NOS (eNOS), neuronal NOS (nNOS) 및 inducible NOS (iNOS)가 있다고 알려져 있는데(Stuehr, 1999), 특히 iNOS에 의해 생성되는 NO는 외부에서 침입한 병원체로부터 인체를 보호하고, 방어하며, 순환계 질환, 염증 질환 및 암 예방에 효과적이라고 보고 되어 있다(Kröncke et al., 1998). 반면, 대식세포 활성화에 의해 분비되는 다양한 cytokine 중, IL-6는 대표적인 multifunctional cytokine으로써 감염 초기 반응에 관여하며 면역 및 조혈 활동을 유도하는 능력으로 인해 숙주 방어에 중요한 역할을 한다(Simpson et al., 1997;Izadpanah et al., 2014;Tanaka et al., 2014). 더불어 TNF-α는 면역세포 조절에 중요한 인자로써, 암세포에 자살 신호를 유도하거 나 바이러스의 세포 내 복제를 저해하여 선천면역 반응에 폭넓게 관여하는 신호분자의 일종이다(Kwon et al., 2016;Sung et al., 2016).
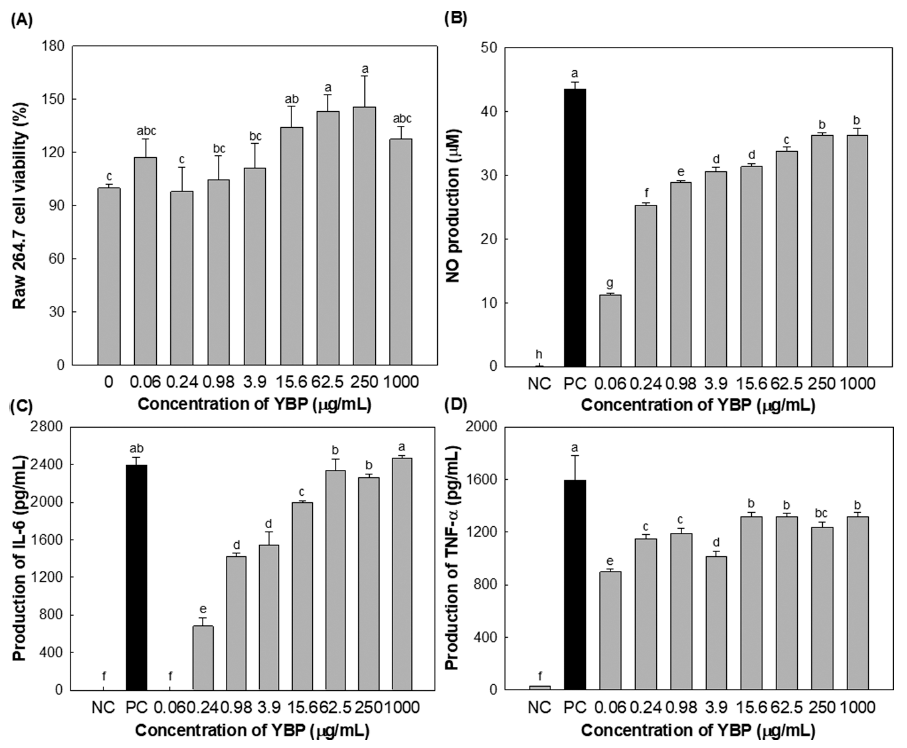
따라서, 본 연구진은 새싹보리 유래 조다당 YBP의 RAW264.7에 대한 직접적인 세포독성을 확인하고자 YBP 시료 0.06-1000 μg/mL의 다양한 농도를 대식세포 세포주인 RAW264.7 세포에 처리하여 세포독성을 확인한 결과, 세포 독성은 확인되지 않았으며, 오히려 3.9 μg/mL 이상의 농도 에서는 우수한 세포 증식능을 보여주었다(Fig. 1A). 또한, RAW 264.7 세포의 NO 및 면역과 관련된 cytokine IL-6 및 TNF-α의 분비능을 확인한 결과(Fig. 1B, C), NO의 경 우 0.24 mg/mL 농도부터 양성대조군 대비 50% 이상의 우 수한 NO 분비능을 보여주었으며, IL-6는 0.98μg/mL, TNF-α는 15.6 μg/mL 이상에서 우수한 cytokine 분비능을 보여주었다. 위 결과로부터 새싹보리 유래 조다당 YBP는 NO, IL-6 및 TNF-α의 분비능을 증가시켜 선천면역계의 대표적 면역세포인 대식세포를 활성화하여 면역증강 효과 에 관여할 것으로 확인되었다.
우수한 NO 및 cytokine 생산능을 나타낸 YBP의 면역조 절 관련 유전자 IL-6, TNF-α 및 iNOS의 발현 정도를 조 사하고자 quantitative real-time PCR (qPCR)로 분석하였다. 그 결과(Fig. 2), 새싹보리 유래 조다당 YBP는 IL-6의 mRNA 발현량이 10μg/mL 농도부터 양성대조군 대비 50%에 준하는 발현량을 나타내었으며, TNF-α의 mRNA 경우 농도의존적인 발현량을 보여주었다. iNOS의 mRNA 경우 50 μg/mL 농도에서는 양성대조군 대비 약 90% 이상 의 발현량을 보여 주었다.
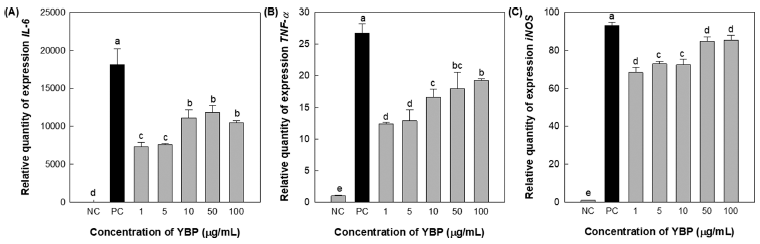
이를 통해 새싹보리 유래 조다당 YBP는 IL-6, TNF-α 및 iNOS 유전자를 발현시켜 최종적으로 NO, IL-6 및 TNF-α와 같은 chemokine 및 cytokine 분비를 유의적으로 생산함으로써 생체방어에 작용하는 선천면역계의 활성화 및 조절에 관여하여 면역증강효과를 나타낸다는 것을 재차 확인하였다.
대식세포 표면에는 TLR-2, TLR-4, MR, CR3, SR, CD14 및 Dectin-1 등의 다양한 패턴인식수용체(PRRs)가 존재하는데, 이때 lipopolysaccharide (LPS) 혹은 β-glucan 과 같은 천연물 유래 다당 분자를 인식하게 되면 연속적인 인산화로 인해 세포내 신호전달을 유도하게 된다. 이후 이 들은 핵 내로 들어가 transcription factor를 활성화시켜 최 종적으로 다양한 cytokine 및 chemokine의 생산을 유도한 다고 알려져 있다(Lewis et al., 1998;Rice et al., 2002;Taylor et al., 2002;Yang et al., 2003).
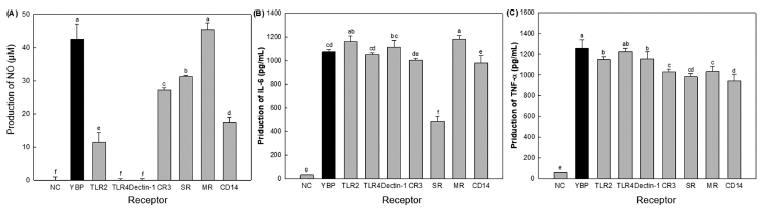
본 연구진은 새싹보리 유래 조다당 YBP가 대식세포 표 면에 존재하는 수용체 중 어떤 수용체와 결합하여 신호전 달을 유도한 후, NO 및 IL-6, TNF-α를 분비하는지 확인 하고자 하였다. RAW 264.7 세포에 TLR-2, TLR-4, MR, CR3, SR, CD14 및 Dectin-1 receptors-blocking antibodies 를 처리하여 NO 및 IL-6, TNF-α 분비량을 측정하였다. 그 결과(Fig. 3), NO의 경우, TLR4 및 Dectin-1 중화항체 를 처리한 군에서 생성능이 거의 나타나지 않았다(Fig. 3A). 반면, IL-6의 경우(Fig. 3B) SR 중화항체를 처리한 군에서만 생성능이 감소한 것을 확인하였으며, TNF-α의 경우(Fig. 3C) CD14 중화항체를 처리한 군에서 생성능이 가장 크게 감소한 것을 확인하였다. 따라서 새싹보리 유래 조다당 YBP는 대식세포 표면에 존재하는 TLR4 및 Dectin-1과 결합하여 세포 내로 들어가 NO를 분비하며, SR과 결합하여 IL-6, CD14과 결합하여 TNF-α를 분비하는 것으로 최종 확인하였다.
활성물질에 의해 대식세포 표면에 존재하는 수용체를 인 식하여 활성화되면 세포 내 MAPK 및 NF-κB 경로와 같 은 신호전달을 통해 연속적으로 유도한 후(Rice et al., 2002;Taylor et al., 2002), 핵 내로 들어가 AP-1 (c-Jun) 및 NF-κB (p65 및 p50)와 같은 transcription factor를 활성 화시켜 최종적으로 cytokine 및 NO 등의 생산을 유도한다 고 보고되어 있다(Lewis et al., 1998;Yang et al., 2003). 대식세포의 대표적인 신호전달 경로인 MAPKs는 다양한 세포의 증식, 분화 및 사멸 등의 중요 조절자 역할을 하며 이밖에 cytokine 생성, 항원제시세포(antigen-presenting cell, APC)의 기능을 조절함으로써 선천면역 반응에 중요한 역 할을 하는 것으로 알려져 있다(Liu et al., 2007). MAPKs 는 ERK1/2, JNK, p38 등을 포함하는 신호전달경로로 알 려져 있으며 이들이 핵 내로 이전되어 다양한 전사인자를 포함한 AP-1 family를 활성화함으로써 NO 및 cytokine 등 의 분비를 유도하는 것으로 밝혀져 있다(Corre et al., 2017). 반면, NF-κB의 하위분자 중 하나인 p65는 세포질 내에 존재하는 IκBα가 비인산화된 형태로 존재하다가 ligand 자극에 의해 IκBα를 인산화시켜 분해(degradation) 되면, p65는 핵 내로 들어가 transcription factor를 개시함 으로써 다양한 cytokine의 생산을 유도한다고 알려져 있다 (Liacini et al., 2002).
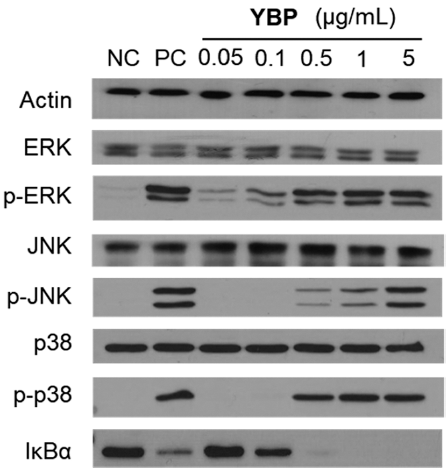
새싹보리 유래 조다당 YBP의 대식세포 내 신호전달 경 로를 확인하기 위해 RAW 264.7 세포에 YBP 시료를 0.05-5 μg/mL의 농도로 처리하여 MAPK 및 NF-κB 경로의 단백질 수준을 관찰한 결과(Fig. 4), MAPK (p38, JNK 및 ERK) 단백질이 농도의존적으로 인산화된 것을 확인하였으 며, 특히, p38과 ERK의 경우 농도의존적으로 인산화되는 것을 확인하였으며 0.5-5 μg/mL의 농도에서 큰 차이를 보 이지 않았다. JNK 경우, 0.5 μg/mL 농도부터 농도의존적인 결과를 나타내었으며, p38, JNK 및 ERK 단백질의 전체량 에는 큰 변화가 없었다. 한편 NF-κB 신호전달 경로에서 p65가 활성화되면 IκBα가 인산화 되어 분해되면서 p65가 핵 내로 직접 들어간다고 알려져 있다. 따라서 새싹보리 유래 조다당 YBP를 0.05-5 μg/mL의 농도로 RAW 264.7 세포에 처리하여 Western blot으로 확인한 결과, 0.5 μg/mL 부터 농도 의존적으로 IκBα의 degradation을 유도하는 것 으로 확인되었다.
추가적으로, p65가 인산화되어 핵 내로 이행되어 transcription factor로 작용하는지를 현미경으로 관찰하기 위해 confocal microscopy로 관찰한 결과(Fig. 5), 시료를 처리하지 않은 군에서는 세포질에서만 FITC 형광(초록색) 이 발색된 반면, 양성대조군 LPS의 경우 FITC 형광이 핵 안에서도 나타나는 것으로 보아 p65가 활성화되어 핵 내로 이행되었음을 확인하였다. 이와 마찬가지로 YBP 5 μg/mL의 농도로 처리한 결과에서도 양성대조군에 준하 는 만큼 p65가 활성화되어 핵 내로 이행되었음을 확인하 였다.
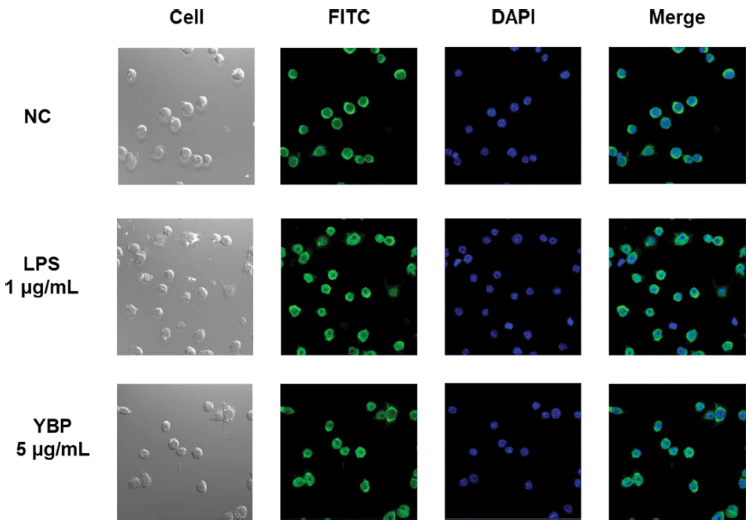
위의 결과를 종합해 볼 때 새싹보리 유래 조다당 YBP 는 대표적인 면역세포인 대식세포를 활성화시키기 위해 MAPKs (p38, JNK 및 ERK)와 NF-κB 경로를 거쳐 핵 내 로 들어가 전사인자 p65를 활성화시켜 iNOS, IL-6 및 TNF-α의 유전자 발현을 촉진시킨 후, cytokine 및 NO의 생산을 유도하여 나아가 면역증진 효과에 기여한다는 것을 확인하였다. 따라서 대식세포의 수용체 경로 및 신호전달 경로 결과를 모두 종합해 보면 새싹보리 유래 조다당 YBP는 대식세포를 활성화시켜 NO, IL-6 및 TNF-α와 같 은 다양한 면역활성 물질을 분비하는데, 특히 chemokine인 NO는 대식세포 막 표면에 존재하는 TLR4 및 Dectin-1 수 용체와 결합하여, cytokine IL-6는 SR, TNF-α는 CD14 수 용체와 결합하여 MAPKs (p38, JNK, ERK) 및 NF-κB 경 로를 일련의 연속과정을 통해 신호전달 후, 핵 내로 들어 가 transcription factor p65를 활성화시켜 NO, IL-6 및 TNF-α를 생산한다고 최종 결론지었다.
요약 및 결론
본 연구에서는 새싹보리로부터 분리한 다당의 대식세포 에 대한 면역증진 효과를 관찰하기 위하여 RAW264.7 세 포주를 이용하여 실험을 진행하였다. 건조된 새싹보리로부 터 열수추출 및 에탄올 침전 과정을 거쳐 조다당 YBP를 얻었다. 대식세포주 RAW264.7 cell을 이용하여 면역증진 효과를 확인하고자, 세포독성을 측정한 결과 직접적인 독 성은 나타내지 않았으며 오히려 증식능을 보여주었다. NO, IL-6 및 TNF-α를 측정한 결과 농도 의존적으로 우수한 cytokine 분비능을 보여주었으며, mRNA expression 결과에 서도 우수한 iNOS, IL-6 및 TNF-α 발현량을 나타내었다. 이후 대식세포 막 표면에 존재하는 수용체와 세포내 신호 전달 경로를 확인하고자, western blot과 confocal을 이용하 여 관찰한 결과, NO는 TLR4 및 Dectin-1 수용체, IL-6는 SR 수용체, TNF-α는 CD14 수용체와 결합하여 MAPKs (p38, JNK 및 ERK) 및 NF-κB 경로를 인산화시킴으로써 연속적인 신호전달을 거쳐 핵 내로 이행되어 p65를 활성 화시키고나아가 NO, IL-6 및 TNF-α를 생산한다고 최종 결론지었다. 이 결과는 건강기능식품 소재 개발을 위한 기 초자료로 제공하고자 하였다.







