서 론
오늘날 커피는 그 자체가 지니는 독특한 향과 맛으로 인 하여 전 세계에서 가장 많이 소비되는 음료 중의 하나 (Perez-Martínez et al., 2010;Caporaso et al., 2014)이며 한국에서도 가장 많이 소비되는 기호식품 중 하나(Choi et al., 2015)로 자리 잡았다.
커피에는 대표적으로 카페인과 폴리페놀 등 생리활성 물 질들이 있으며, 탄수화물, 지방, 단백질 등의 영양성분들이 있다(File, 1988). 이러한 생리활성 물질들과 그 고유한 풍 미로 스트레스와 피로로 지친 일상에서 커피는 매일 아침 혹은 업무 중에 기호적으로 섭취되는 음료이다.
식품산업통계정보시스템(Food information statistics system, aT FIS)에 따르면, 2018년부터 2021년까지 연평균 6.6%씩 지속 성장하는 추세로 2021년 국내 커피류 매출 규모는 3조1168억 원이다. 또한, 우리나라에서 현재 영업 중인 커피 전문점은 12만5600개에 달하는데 2014년 기준 으로 133% 증가한 수치이다(Lee et al., 2022.). 이처럼 커 피 시장은 무척 빠르면서도 가파르게 성장하고 있으며 시 장 내 경쟁이 치열해지고 있다. 개인 카페, 프랜차이즈 카 페, 원두 공급자 등 시장 내 여러 업체들은 차별화된 제품 개발에 힘을 쏟고 있으며 이러한 노력의 결과로 다양한 재 료가 활용, 첨가된 특색있는 커피들이 출시되고 있다. 그 중에서도 과일과 곡물 등을 혼합한 커피는 여러 프랜차이 즈 카페에서 정식 출시되어 소비자들에게 큰 인기를 얻고 있으며 새로운 커피 메뉴의 개발은 꾸준히 시도되고 있다 (Shin, 2019;Shin et al., 2023).
과일은 항산화 물질 등 풍부한 생리활성 성분을 함유 (Kim et al., 2009)하고 있어 여러 식물성 자원 중 가장 항 산화능이 뛰어난 천연 자원으로 특히 유리기를 소거하는 능력이 탁월한 것으로 보고 되어 왔으며 이들 성분의 종류 에는 플라보노이드, 탄닌 등의 폴리페놀 성분뿐만 아니라 비타민 C, 토코페롤, 카로티노이드 등의 항산화 비타민 성 분 등이 관련된다(Lee et al., 2012). 이러한 과일 중에서도 페놀성 성분을 다량 함유하고 있는 포도 및 포도 가공제품 의 (+)-cathechin, (-)-epicathechin, phrocyanidin, viniferin 및 reveratol 등이 가진 심장질환 예방(Ghiselli et al., 1998), 인지질 산화 및 혈소판 응집 저해작용(Landrault et al., 2001), 항암작용(Kim et al., 1999) 등의 주요 생리 활 성이 알려지면서 포도주를 비롯한 포도 가공제품에 대한 연구가 많이 보고 되고 있는데, 포도주와 포도주스는 기능 성 물질인 페놀성분이 풍부할 뿐만 아니라 색, 향, 맛 등 의 관능적 요소까지 함유하고 있어 세계적으로 널리 음용 되고 있다(Nam & Joo, 2004).
최근에는 포도 중에서 스위트 사파이어 포도(Vitis vinifera) 가 관심을 받고 있는데, 국내에서는 열매가 가지 모양과 비슷하게 생겨 가지 포도라고 불리우며, 씨가 없고 과피가 얇아 껍질채로 섭취가 가능하며 과즙의 평균 당도가 18~20°Brix로 당도가 높고 풍미와 저장성이 높아 소비자의 관심이 높아지고 있다.
이러한 과일의 항산화 물질 등의 생리활성 성분이 커피 에 첨가됨으로써 커피 자체의 항산화능과 건강 기능성 물 질이 더해지며 맛과 향미가 증가된 건강 음료 개발이 요구 되고 있다(Kim et al., 2016). 또한, 과일을 첨가한 커피는 낮은 등급의 원두로 만든 커피일지라도 맛과 향을 높은 등 급의 원두로 만든 커피처럼 상승시켜줄 수 있으며, 평소 접하던 커피와 다른 새로운 풍미를 느낄 수 있어 소비자들 의 호감을 얻기 쉬울 것으로 생각된다.
그러나 지금까지 대다수의 커피 연구는 원두의 산지(Ji et al., 2009), 품종(Lee et al., 2019), 로스팅 조건(Baggenstoss et al., 2008), 분쇄도(Shin et al., 2011), 추출방법(Eun et al., 2014), 추출환경(Banti & Abraham, 2021) 등 커피콩과 이를 다루는 방식에 집중되어왔다. 과일을 활용한 커피에 대한 연 구는 오디 추출물(Lim et al., 2015), 한라봉 추출액(Shin et al., 2021), 건조 사과분말(Kim & Ahn, 2022) 등 연구가 아직 미비한 실정이며 스위트 사파이어 포도에 대한 연구는 국내 산 스위트 사파이어와 다른 품종 포도의 이화학적 특성 및 영양성분(Park et al., 2021) 연구 외에는 거의 없는 상황이다.
이에 본 연구에서는 스위트 사파이어 포도를 첨가하고 추출 조건을 달리하여 제조한 커피의 pH, 수분, 가용성 고 형분, 색도, 총 폴리페놀, DPPH 라디컬 소거능, 유기산, 유리당, 트리고넬린, 클로로겐산, 카페인 함량을 측정하여 커피의 품질 특성은 높이면서 새로운 건강 기능성 커피의 소재 개발과 식음료 시장의 건강 음료 개발 연구에 필요한 기초 자료를 제시하고자 한다.
재료 및 방법
본 연구에 사용된 커피 원두는 시판되고 있는 블랜딩 원 두(Duldamiro, Wooricoffee, Seoul, Korea)로 아라비카 품종 이며 건식법으로 가공된 브라질 모지아나(Mogiana), 습식 법으로 가공된 코스타리카 따라주(Tarrzu)와 로부스타 품종 이며 습식법으로 가공된 인디아 카피로얄(Kappi Royale)을 블랜딩한 후 중강배전으로 로스팅하였다. 스위트 사파이어 포도(Grapeco Australia, Merbein South, Australia)는 서울 농산(Buk-gu, Daegu-si, Korea)에서 수입한 것을 구입하여 사용하였다.
스위트 사파이어는 열추 추출물 제조방법은 Kim et al. (2013)의 방법을 변형하여 사용하였다. 수돗물과 증류수로 각 1회씩 총 2회에 걸쳐 세척하여 사용하였다. 세척 후 줄 기에서 송이를 분리한 뒤, 물기를 제거한 송이 1,000 g에 생수 1,000 mL의 생수를 가하여 90 °C에서 60분간 열수 추출을 진행한 후 20 mesh 체(Changsun, Gimpo, Korea) 에 걸러 냉장보관 후 사용하였다.
블랜딩 원두를 사용한 커피는 에스프레소(Moon, 2013), 핸드드립, 모카포트(Koh et al., 2020), 이브리크, 프렌치 프 레스(Eun et al., 2014)의 다섯 가지 추출 조건으로 제조하 였다. 에스프레소는 상업용 에스프레소 머신(Classe 5, Rancilio, Milan, Italy)을 사용하여 15g의 분쇄원두를 90±5 °C 추출수로 26초간 30mL를 추출하였다. 핸드드립은 15 g의 분쇄원두를 핸드 드립퍼(V60, Hario, Tokyo, Japan) 와 필터(V60, Hario, Tokyo, Japan)를 사용하여 90±5 °C 추 출수 150 mL를 3회에 나누어 푸어링 하였고 불림시간을 포 함하여 2분 50초간 130mL를 추출하였다. 모카포트(Comac E5, Woodoh, Seongnam, Korea)는 분쇄원두 20 g과 생수 280 mL를 채워 넣은 뒤 중불에서 가열 하여 205mL를 추 출하였다. 이브리크는 스테인리스 이브리크(Coving 350 mL, Jjint, Kimpo, Korea)를 사용하여 15 g의 분쇄원두와 150 mL 의 생수로 중불에서 가열 후 저어줌, 식힘 과정을 3회 반복, 원두를 침전시킨 뒤 상단부 75mL를 사용하였다. 프렌치 프레스(ComacP3, Woodoh, Seongnam, Korea)는 비커에 원 두 20 g과 90±2 °C 추출수 200mL를 붓고 3분간 대기 후 추출하였고 하단부 50mL를 제외한 150mL를 사용하였다.
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피는 각 추출 조건별로 제조된 커피와 스위트 사파이어 열수 추출물 100:30의 비율로 Table 1과 같이 제조하였다.

|
커피의 pH는 pH meter (GmbH-8603, Mettler-Toledo, Greifensee, Switzerland)를 사용하여 각 시료 25mL를 3회 반복 측정하였다. 수분 함량은 각 시료 2mL를 트레이에 넣고 적외선 수분 측정기(mL-50, A&D Company, Tokyo, Japan)로 3회 반복 측정하였으며 가용성 고형분은 각 시료 1mL를 굴절계(Refractometer, Atago Co., Tokyo, Japan)로 3회 반복 측정하였다.
각 시료의 색도는 colormeter (CR-0, Minolta Co., Osaka, Japan)를 사용하여 Hunter’s vaule L 값(명도, lightness), a 값(적색도, redness), b 값(황색도, yellowness)을 3회 반복 측정 후 평균값으로 나타내었고 표준 백색판(L = 96.68, a = 0.26, b = 1.89)을 사용하였다.
각 시료의 유기산 측정은 HPLC (Dionex ultimate 3000, Thermo Dionex, USA/pump, auto-sampler, oven)로 측정하 였으며 UV-Detector (ERC, Refracto MAX 520, Tokyo, Japan)로 column은 Aminex 87H (300 × 10 mm, Bio-Rad, Hercules, CA, USA)를 이용하였으며, Column 온도 40 °C, 이동상은 0.01M H2SO4 (Honeywell Fluka, Charlotte, NC, USA)로 사용하였고, 유속은 0.5 mL/min, 시료 주입량은 20 μL로 사용하여 210 nm에서 측정하였다.
각 시료의 유리당 측정은 HPLC (Dionex ultimate 3000, Thermo Dionex, USA/pump, auto-sampler, oven)로 측정하 였다. Column은 Sugar-pak (300 × 6.5 mm, Waters Co., Milford, MA, USA)를 이용하였으며, 온도는 70 °C, 이동상 은 증류수(Waters Co., Milford, MA, USA)를 사용하였고, 유속은 0.5 mL/min, 시료는 10 μL를 주입하였고 Shodex RI-101 refractive index detector (Resonac, Tokyo, Japan)를 사용하여 검출하였다.
각 시료의 트리고넬린, 클로로겐산, 카페인 함량의 측정 은 각 시료 10mL와 증류수 100mL씩 첨가한 용액을 각 20 mL씩 취해 50mL의 measuring flask에 넣고 아세트산납 1mL를 첨가하여 10분간 방치한 후, 10% (w/v) Na2CO3 1mL를 넣어 혼합한 시료 1mL를 0.45 μm membrane filter 로 여과하여 HPLC로 분석하였다. 분석기기는 HITACHI model (655A-11, Hitachi, Ltd., Tokyo, Japan)을 사용하였고, column은 Inertsil ODS-3 (5 μm, 250 × 5.0 mm)로, column 온도는 35°C, 이동상은 acetonitrile: 10mM KH2PO4 (10:90, v/v)을 이용하였고, 유속은 0.9mL/min로 분석하였다. 280 nm에서 UV-detector (Shimadzu SPD-10 AVP, Shimadzu Co., Kyoto, Japan)로 검출하였다.
총 폴리페놀 함량 분석은 Folin-Denis 방법(Singleton et al., 1999)을 변형하여 측정하였다. 시료 50μL에 10% Na2CO3 용액(w/v) 100 mL 첨가하여 실온에 방치한 뒤, 50% Folin-Ciocalteu’s reagent 50 mL 첨가하여 암실에서 60분 동안 반응 시킨 후 725nm에서 흡광도(Multiskan SkyHigh, Thermo Fisher Scientific, Inc., Spain)를 측정하였 다. 시료에 함유된 총 폴리페놀 함량은 gallic acid (Sigma Aldrich Co., MO, USA)를 표준물질로 사용하여 표준곡선 을 사용하여 산출하였다.
DPPH 자유 라디칼 소거 활성능 측정은 Blois (1958)의 방법으로 각 시료의 환원력을 측정하였다. 제조한 각 시료 100 μL와 0.1mM DPPH 용액 100 μL을 혼합하여 암실에서 30분 동안 반응시킨 후, 분광광도계(Multiskan SkyHigh, Thermo Fisher Scientific, Inc., Spain)를 사용하여 517 nm 에서 흡광도를 측정하였다. 각 시료의 DPPH free radical scavenging 활성은 [1 - (시료첨가구의 흡광도/무첨가구의 흡광도)] × (%)으로 나타내었다.
결과 및 고찰
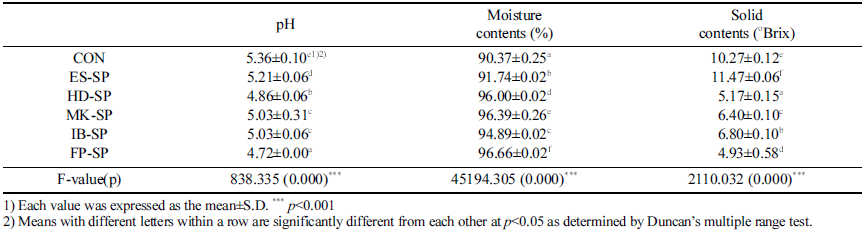
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피의 pH, 수분, 고형분 함량 측정 결과는 Table 2와 같다.
|
pH는 대조군이 5.36±0.10으로 가장 높았으며 FP-SP가 4.72±0.00으로 가장 낮은 값을 나타내었다. 대조군에 열수 추출물만 첨가한 ES-SP의 경우, 5.21±0.06으로 대조군보다 pH가 0.15 낮아졌는데, 착즙한 스위트 사파이어의 pH가 3.56±0.15로 보고된 연구(Park et al., 2021)의 결과로 보아 낮은 pH를 가진 스위트 사파이어 열수 추출물이 혼합된 영향으로 사료된다. 또한 FP-SP가 4 .72, H D-SP 4.8 6, MK-SP와 IB-SP가 5.03으로 나타났는데, 이는 커피의 pH 에 있어서 분쇄입도가 가장 미세한 very fine이 높은 pH 값을 나타내었으며, 분쇄입도가 커질수록 pH 값이 감소하 였다는 선행 연구(Shin et al., 2011)와 미세하게 분쇄된 원 두를 사용하는 이브리크 제조 커피의 pH가 다른 기구들을 이용하여 추출한 커피의 pH 보다 높게 나왔다는 연구 보 고(Eun et al., 2014)와 같은 경향을 나타냈다.
수분함량은 대조군보다 시료군들의 수분 함량이 더 높은 것으로 나타났고 시료군 중 ES-SP의 수분 함량이 91.74% 로 다른 시료군보다 낮았다. 이러한 결과는 에스프레소의 고온, 고압 추출방식이 다른 추출 방식 대비 원두의 성분 을 더 많이 추출하는 것이 낮은 수분 함량의 원인으로 사 료된다.
가용성 고형분 함량은 ES-SP가 11.47±0.060°Brix로 가장 높았으며 FP-SP가 4.93±0.58°Brix로 가장 낮았다. 추출에 사용된 원두의 분쇄도가 가장 작은 에스프레소로 추출한 대조군과 ES-SP가 10.27±0.12, 11.47±0.06로 다른 시료군 보다 높은 값을 보였으며 이러한 결과는 에스프레소 방식 이 고온, 고압 추출법으로 인해 고형분 함량이 더 많아지 고(Seo et al., 2003), 분쇄입자의 크기 차이(Bell et al., 1996)와 분쇄입도가 가늘수록 더욱 많은 가용성 성분과 휘 발성 화합물이 추출되기 때문인 것으로 사료된다(Eun et al., 2014;Clarke, 1987).
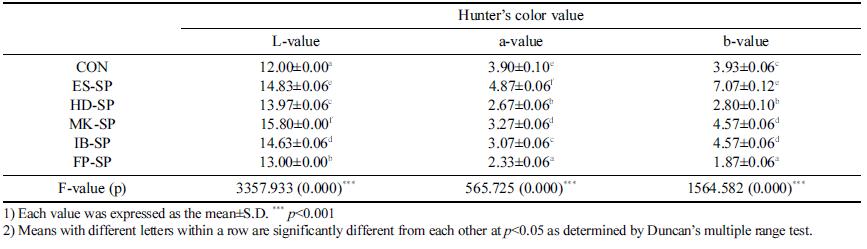
색도 측정 결과는 Table 3과 같다. 명도 L 값은 대조군 이 12.00으로 가장 낮았고 이러한 결과는 고온, 고압 추출 방식의 차이와 용출된 가용성 고형분 함량이 원인으로 사 료되며 대조군보다 열수 추출물이 포함된 다른 시료군이 높은 L 값을 나타나는 결과는 Eun et al. (2014)의 연구 결과와 같은 경향을 보였다. 적색도 a 값은 대조군과 ESSP가 3 .90, 4 .8 7로 다른 시료군 보다 높았고 다른 시료군 끼리의 차이는 크지 않았다. 황색도 b 값은 ES-SP가 7.07 로 가장 높았으며 FP-SP의 1.87로 가장 낮았다.
|
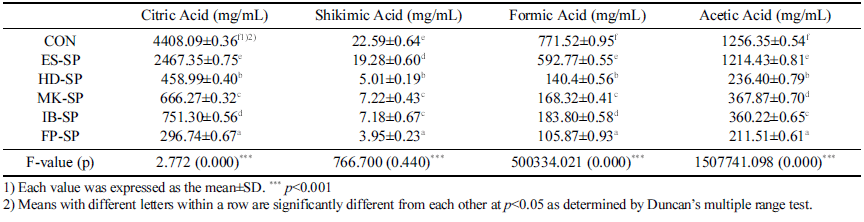
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피의 유기산 측정 결과는 Table 4와 같다. 시트르산은 대조군이 4408.09±0.36 mg/mL로 가장 높았으며 FP-SP가 296.74±0.67 mg/mL로 가장 낮았다. 시킴산은 대조군이 22.59±0.64 mg/mL로 가장 높은 함량을 나타냈으며 FP-SP 가 3.95±0.23 mg/mL으로 가장 낮은 함량을 보였다. 포름 산과 아세트산 역시 대조군이 가장 높고 FP-SP가 가장 낮은 함량을 보였다. 시료군 중에서는 ES-SP가 가장 높은 함량을 나타내었다. 이러한 결과는, 높은 압력을 이용하여 고온에서 커피를 추출하는 에스프레소의 유기산 함량이 가장 높았다는 Hwang et al. (2013)의 연구 결과와 일치 하는 경향을 보였으며, 유기산의 종류와 함량은 제조 조 건과 추출 방법에 영향을 받은 것으로 사료된다(Kim & Kim, 2017).
|
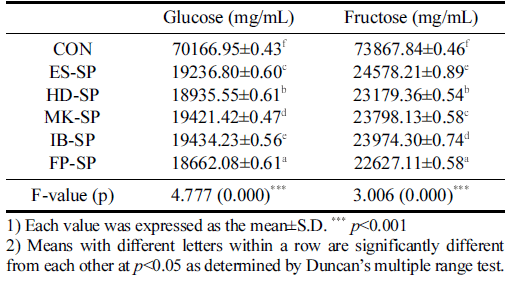
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피의 유리당 측정 결과는 Table 5와 같다. Glucose는 대 조군이 70166.95±0.43 mg/mL로 가장 높았으며 FP-SP가 18662.08±0.61 mg/mL로 가장 낮은 함량을 보였다. Fructose 에서도 대조군이 73867.84±0.46 mg/mL로 가장 높았고 FPSP가 22627.11±0.58m g/mL로 가장 낮았다. 시료군 중에서 는 ES-SP가 가장 높은 값을 나타내었다. 대조군보다 열수 추출물 첨가군이 낮은 함량을 보인 이유는 열수추출액 제 조시 사파이어 포도의 유리당의 분해가 적게 추출된 것으 로 사료되며(Kim et al., 2013), 이러한 결과는 추출 방법 에 따른 유리당 함량의 차이와 그 중 에스프레소의 유리당 함량이 가장 높다고 보고한 Kim & Ahn (2022)의 연구와 일치하는 경향을 보였다.
|
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피의 트리고넬린, 글로로겐산, 카페인 함량 측정 결과는 Table 6과 같다. 트리고넬린은 ES-SP가 1349.44±0.50 mg/ mL로 가장 높았으며 대조군은 1338.29±0.52 mg/mL이며 FP-SP는 191.76±0.68m g/mL을 가장 낮았다. 클로로겐산에 서도 ES-SP가 1132.58±0.51 mg/mL로 가장 높은 값을 나 타내었고 대조군이 1127.58±0.61 mg/mL이며, FP-SP가 141.67±0.98m g/mL로 가장 낮은 것으로 나타났다. 카페인 에서는 대조군이 4588.43±0.49 mg/mL로 가장 높았으며, ES-SP가 4478.16±0.50 mg/mL으로 두 번째로 높은 함량을 나타내었고 FP-SP가 가장 낮은 함량인 589.71±0.19 mg/ mL를 나타내었다.

|
시료군에서 트리고넬린과 클로로겐산, 카페인 함량은 에 스프레소 > 이브리크 > 모카포트 > 핸드드립 > 프렌치 프 레스 추출 방법 순으로 나타났으며, 추출 조건 간 유의한 차이가 있는 것으로 나타났다(p<0.001). 고온, 고압으로 추 출하는 에스프레소와 이브리크, 모카포트가 저온, 저압으로 추출하는 핸드드립, 프렌치 프레스보다 높은 성분 함량을 보였다는 Eun et al. (2014)과 Kim & Ahn (2022)의 연구 결과와 일치하는 것으로 나타났다. 커피의 항산화 작용 등 다양한 기능성을 갖는 것으로 보고된 트리고넬린과 클로로 겐산에서 ES-SP가 가장 높았으며 이러한 결과는 추출 조 건의 차이와 스위트 사파이어 포도 열수 추출물 첨가에 의 한 영향으로 판단되며 카페인에서 같은 추출 방법을 사용 한 대조군보다 낮은 함량을 보여 ES-SP가 가장 효과 있는 추출 조건으로 판단되며 음료 제품 개발의 활용성이 있을 것으로 사료된다.
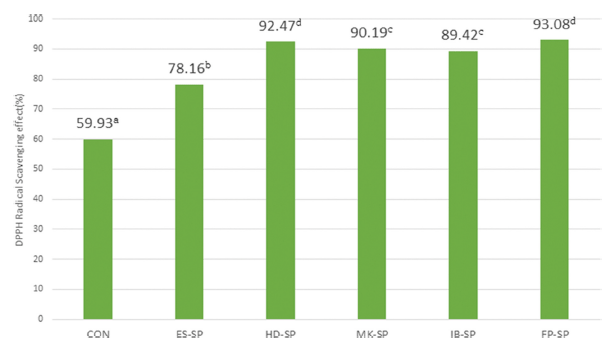
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피의 DPPH 자유 라디칼 소거 활성능 측정값은 Fig. 1과 같다. 대조군이 59.93%으로 가장 낮았고 첨가 시료군 모 두가 대조군보다 더 높은 값을 보였다. 시료군 중에서는 ES-SP가 78.16%로 가장 낮았고 FP-SP가 9 3.08 %로 가장 높은 값을 나타내었다. 이러한 결과는 과일주스의 DPPH 소거 활성은 과일의 품종과 제조공정에 따라 차이가 있으 며 포도는 사과, 석류 등과 함께 라디칼 소거활성이 높은 과일이며 DPPH 자유 라디칼 소거 활성능이 있는 안토시 아닌의 함량이 높은 스위트 사파이어 열수 추출물의 첨가 로 DPPH 라디칼 소거능에 영향을 주는 것으로 판단된다 (Kim et al., 2013).
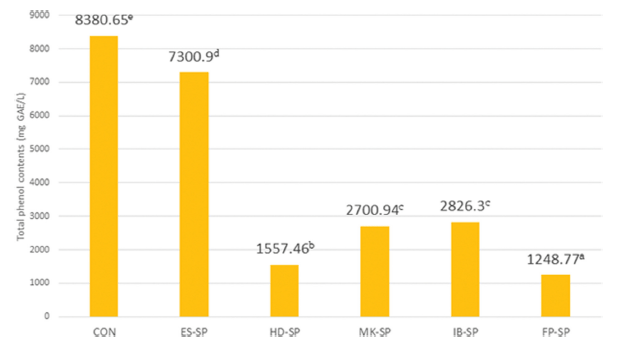
추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피의 총 폴리페놀 함량은 Fig. 2와 같다. 대조군이 8380.65 mg gallic acid equivalents (GAE)/L로 가장 높았으 며 ES-SP가 7300.90 mg GAE/L이며 FP-SP는 1248.77 mg GAE/L로 가장 낮았다. 커피의 총 페놀 함량은 사용된 원 두 양 대비 추출에 사용된 물의 양에 따라 차이가 있으며 (Koh et al., 2020), 포도 주스에는 다양한 종류의 페놀성 물질이 존재할 뿐만 아니라 추출 방법에 따른 포도 추출액 의 폴리페놀의 함량이 다르며 열수추출액이 효소분해 추출 액보다 함량이 낮았다(Kim et al., 2013). 이러한 선행연구 결과로 보아 본 연구의 총페놀 함량은 열수추출액 첨가에 의한 영향보다는 커피 추출방법에 의한 영향이 더 큰 것으 로 사료되며 고온, 고압추출로 인해 페놀 및 페놀 분해 산물 이 많이 용출되어 에스프레소 추출을 이용하여 추출한 커피 의 총 페놀 함량이 높은 것으로 사료된다(Seo et al., 2003).
요약 및 결론
본 연구에서는 새로운 건강 기능성 커피 메뉴의 소재 개 발에 필요한 기초 자료를 제시하기 위해, 추출 조건을 달 리하여 스위트 사파이어의 열수 추출물을 첨가하여 제조한 커피의 pH, 수분함량, 가용성 고형분, 색도, 유기산, 유리 당, 트리고넬린, 클로로겐산, 카페인, DPPH, 총 폴리페놀 함량을 측정하였고 결과는 다음과 같다.
pH는 대조군이 5.36±0.10으로 가장 높게 나타났으며 추 출 방법에 따른 유의적인 차이가 있었다. 가용성 고형분 함량은 ES-SP가 11.47±0.06°Brix로 가장 높았으며 FP-SP 가 4.93±0.58°Brix로 가장 낮았다. 색상에 있어서는 a와 b 값은 ES-SP가 4.87±0.06과 7.07±0.12로 가장 높은 값을 보였으며 L 값은 대조군이 첨가 시료군보다 낮았으며 이 러한 결과는 고온, 고압 추출방식의 차이와 용출된 가용성 고형분 함량이 원인으로 사료된다. 유기산 함량은 고온, 고 압으로 추출한 대조군이 시료군보다 높았으며 시료군 중에 서는 ES-SP가 시킴산, 포름산, 아세트산에서 가장 높아 유 기산의 함량은 제조 조건과 추출 방법에 영향을 받는 것으 로 나타났다. 유리당 함량은 glucose와 fructose에서는 대조 군이 70166.95±0.43, 73867.84±0.46으로 가장 높은 함량을 보였고 시료군 중에서는 ES-SP가 가장 높은 함량을 보여 에스프레소 추출 방법이 유리당 함량이 높은 것으로 나타 났다.
트리고넬린과 클로로겐산함량은 ES-SP가 1349.44±0.50 mg/mL와 1132.58±0.51 mg/mL로 가장 높은 것으로 나타났 다. 카페인 함량은 대조군과 ES-SP가 각각 4588.43±0.49 mg/mL와 4478.16±0.50 mg/mL로 높은 함량을 나타내었다. 추출 방법 간 유의한 차이가 있는 것으로 나타났으며 (p<0.001) ES-SP가 효과 있는 추출 조건으로 나타나 음료 제품 개발의 활용성이 있을 것으로 사료된다.
DPPH 자유 라디칼 소거 활성능 측정값은 대조군이 59.93%으로 가장 낮았고 첨가 시료군 모두가 대조군보다 더 높은 값을 보였다. 시료군 중에서는 ES-SP가 78.16%로 가장 낮았고 FP-SP가 93.08%로 가장 높은 값을 나타내었 으며 이러한 결과는 스위트 사파이어 열수추출물을 첨가에 영향을 받은 것으로 사료된다. 총페놀 함량은 대조군이 8380.65 mg GAE/L로 ES-SP가 7300.90 mg GAE/L로 높았 으며 FP-SP가 1248.77 mg GAE/L로 가장 낮아 에스프레 소 추출조건을 이용하여 추출한 커피의 총 페놀 함량이 높 은 경향을 보여 열수추출액 첨가에 의한 영향보다는 커피 추출방법에 의한 영향이 더 큰 것으로 사료된다.
위의 결과로 추출 조건을 달리한 스위트 사파이어 열수 추출물 첨가 커피에서, 에스프레소로 추출한 커피가 유기 산, 유리당, 트리고넬린, 클로로겐산, 항산화성, 총 폴리페 놀 함량 등이 높은 것으로 나타나 다양한 생리활성 물질과 높은 기능성을 가진 스위트 사파이어 포도를 활용한 커피 메뉴 개발에 가장 적합한 제조 조건으로 생각된다. 추후 스위트 사파이어포도의 생리활성 물질과 기능성 성분을 가 장 효과적으로 용출할 수 있는 열수 추출물 제조 조건에 대한 심화 연구가 필요하다 사료되며 건강기능성 음료 개 발 소재로 다양한 과일들을 활용하고 품질이 개선된 새로 운 커피 메뉴 개발에 활용될 수 있다고 사료된다.







