서 론
유산균(Lactic acid bacteria, LAB)은 대표적인 프로바이 오틱스(Probiotics)로 포도당 등의 당류를 이용해 유기산, 저급지방산, 박테리오신과 같은 항균물질 등 다양한 대사 물질을 생산하여 식품의 부패를 억제하고 장내 균총 안정 화 및 정장 작용, 면역활성화, 고혈압 및 고지혈증 개선, 항암효과 등 다양한 기능성으로 인하여 건강과 웰빙에 도 움을 주는 것으로 알려져 있다(Fijan, 2014;Reid et al., 2003). 유산균은 전통적인 식품산업(유제품, 육류 및 야채, 음료)에서 광범위하게 응용되고 있으며 프로바이오틱스 기 능을 지닌 유산균에 대한 연구도 지속적으로 진행되어왔다. 하지만 일부 유산균인 L. perolens는 16S rRNA 염기서열 분석방법을 이용하여 청량음료나 맥아즙에서 부패 미생물 로 확인되기도 하였다(Back et al., 1999).
L. harbinensis는 중국 동북부 하얼빈의 전통 채소발효식품 인 “Suan cai”에서 2005년에 처음 보고된 이후(Miyamoto et al., 2005) 우리나라 탁주인 막걸리(Jin et al., 2008), 발 효식품에서 변화하는 미생물 군락(Lacerda et al., 2011;Sagdic et al., 2014;Sekwati-Monang et al., 2012), 항곰팡이 기능을 부여하는 발효유(Delavenne et al., 2013;Delavenne et al., 2015), 토마토 사일리지(Wu et al., 2014a, 2014b), Kefir 발효식품(Angelescu et al., 2019;Laureys & Vuyst, 2014;Talib et al., 2019), 발효유 제품(Colombo et al., 2018), 두유를 이용한 발효식품(Zheng et al., 2020) 등에서 제한적으로 보고되어 왔다.
일반적으로 유산균은 장내의 낮은 pH 및 담즙산에 대한 내성을 지니며 안정성이 확보된 GRAS (generally regarded as safe)로 분류되어 프로바이오틱스로서 이용가치가 매우 높은 것으로 알려져 있다(Hill et al., 2014). 그러나 특정 유산균을 프로바이오틱스로 이용하기 위해서는 섭취에 대 한 안전성, 소화기관 내에서의 안정성, 세포 정착능력과 항 균활성에 대한 기능성과 배양에 대한 기술적인 부분에 대 한 검증이 이루어져야 된다(Fijan, 2014). 대부분 산업적으 로 이용되고 있는 프로바이오틱스는 인체 유래 또는 유제 품 등에서 분리한 동물 유래 유산균이 대부분이었으나 최 근에는 김치를 포함하여 전통 발효식품(Kim et al., 2019;Kim et al., 2016;Seo et al., 2020)에서 분리된 식물 유래 유산균에서도 프로바이오틱스 기능이 있다고 밝혀지고 있 지만 아직까지 상업적인 활용은 미흡한 실정이다.
본 연구에서는 전통 발효식품인 식초로부터 순수 분리한 유산균인 L. harbinensis에 대하여 1 6 S rRNA 염기서열 분 석과 생화학적 특성을 규명하고, 용혈성, 내산성 및 내담즙 성, 항생제에 대한 내성, 항균 활성, 장내 상피세포 부착능 등 안정성과 기능성을 지닌 프로바이오틱스 소재로서 적용 가능성을 확인하고자 하였다.
재료 및 방법
전북 김제에 소재한 자람농원에서 청일뽕(Morus alba L.)을 이용하여 제조한 전통 발효식초에서 산 생성력이 높 은 균주를 분리하였다. 전통 발효식초를 멸균 생리식염수 를 이용한 희석액을 3% CaCO3과 2% (v/v) 에탄올을 함 유한 초산균 분리용 GY (glucose-yeast extract) 평판배지 (5% Glucose; 1% Yeast extract)에 도말하여 25°C에서 5일 간 배양한 후 colony 주변에 투명환이 확인된 균주를 1차 선발하였다. 선발한 균주를 GY 평판배지에서 획선평판법 으로 계대 배양하여 단일 균주를 확보하였다. 확보한 균주 를 MRS (De Man, Rogosa and Sharpe agar) (BD DifcoTM, NJ, USA) 평판배지에 획선평판법으로 접종한 이후 37°C에 서 24시간 배양하여 유산균을 확보하였다. 확보한 유산균 은 MRS 액체배지를 이용하여 37°C에서 16시간 배양한 이 후 원심분리(Combi-514R, Hanil Scientific Inc., Gyeonggido, Korea)하여 농축시킨 균액을 20% glycerol과 1:1 비율 로 혼합한 후 -80°C에서 보관하였다. 분리한 유산균주와 비교를 위하여 대표적인 식물 유래 유산균으로 알려진 L. plantarum (KCTC 3108) (LP)은 생물자원센터로부터 분양 받아 사용하였다.
분리한 유산균은 Gram 염색 후 광학현미경(BX60, Olympus, Japan)을 이용하여 형태학적 특성을 확인하였으 며 49종의 탄수화물(당) 이용능은 제조사 방법에 따라 API® 50 CH test kit (bioMérirux, France)를 이용하여 조 사하였다.
분리한 유산균의 1 6 S rRNA 염기서열을 솔젠트(주) (Daejeon, Korea)에 의뢰하여 분석하였다. Genomic DNA extraction kit (iNtRON Biotech., Korea)를 이용하여 DNA 를 추출하고 universal primer인 27F (5'-AGA GTT TGA TCC TGG CTC AG-3', forward), 1492R (5'-GGC TAC CTT GTT ACG ACT T-3', reverse)를 사용하여 SolgTM EF-Taq DNA Polymerase (Solgent Co., Ltd. Deajeon, Korea) 를 이용하여 PCR (polymerase chain reaction)을 수행하였다. PCR 조건은 95°C에서 1분간 열 변성 후, 45°C에서 1분간 primer 결합, 72°C에서 1분 30초간 DNA 신장으로 30회 반복 반응을 실시하였다. 증폭된 DNA는 전기영동 후 확인 된 DNA를 QIAquick Gel Extraction kit (QIAGEN GmbH, Hilden, Germany)를 이용하여 정제하였다. 16S rRNA 염기 서열은 BigDye® Terminator v3.1 Cycle Sequencing Kits와 ABI Prism 3730XL DNA Analyzer (Applied Biosystems, CA, USA)를 사용하여 결정하였고 GenBank (http://www. ncbi.nlm.nih.gov/)자료와 비교하여 동정하였다.
장내환경과 유사한 산성 및 담즙산에 대한 생존율을 확 인하기 위해 분리된 유산균을 MRS 액체배지를 이용하여 37°C에서 24시간 배양한 후 15분간 4,000 rpm으로 원심분 리하여 phosphate-buffered saline (PBS, pH 7.0) 용액에 현 탁하여 109 CFU/mL이 되도록 준비하였다. 내산성과 내담 즙성은 각각 pH를 2 .0, 2.5, 3 .0, 5.0, 6 .0으로 조정한 PBS buffer와 bile salt (Sigma, MO, USA)를 0%, 0.3%, 0.5% 첨가한 MRS 액체배지에 유산균을 1% (v/v) 접종하여 배 양한 이후 각각 0-3시간 및 0-6시간 생균수를 측정하여 생 존율을 산출하였다. 식물 유래 유산균으로 알려진 LP을 대 조군으로 이용하였으며 동일한 조건에서 3반복 실험을 진 행하였으며 생존율은 다음의 식에 의하여 산출하였다.
분리한 유산균의 용혈성은 5% sheep blood (MBcell, Seoul, Korea)를 첨가한 MRS 평판배지를 사용하여 확인하였다. 분리한 유산균을 획선평판법으로 도말하여 37°C에서 48-72 시간 동안 배양하면서 용혈현상으로 인해 균주 주변에 형 성되는 환의 형태를 관찰하여 용혈성 여부를 판단하였다.
항생제에 대한 감수성은 agar-disc diffusion 방법으로 13 종에 해당하는 항생제를 함유한 antibiotic-disc (Liofilchem, Antibiotic disc, Italy): amikacin (AK, 30 μg), ampicillin (AMP, 10 μg), cephalothin (KF, 30 μg), penicillin (P, 10 IU), chloramphenicol (CI, 30 μg), ciprofloxacin (CIP, 5 μg), erythromycin (E, 15 μg), gentamicin (CN, 10 μg), kanamycin (K, 30 μg), streptomycin (S, 10 μg), tetracycline (TE, 30 μg), sulfamethoxazole with trimethoprim (SXT, 25 μg), vancomycin (VA, 30 μg)을 사용하였다. 분리한 유산균을 MRS 액체배지를 이용하여 37°C에서 24시간 배양한 후 106 CFU/mL가 되도록 희석하여 MRS 평판배지에 도말한 다음, 그 위에 antibiotic-disc를 올려놓고 37°C에서 24시간 배양 후 각 항생제에 대한 저해환의 크기를 vernier caliper (CD-15APX, Mitutoyo Co., Kanazawa, Japan)로 측정하여 항생제에 대한 감수성을 판단하였다. 식물 유래 유산균으 로서 대조군 LP을 이용하여 동일한 방법으로 3반복 실험 을 진행하였다.
식중독을 유발하는 위해미생물로 알려진 B. cereus (KCTC 1013), E. coli O157:H7 (ATCC 43895), S. typhimurium (KCTC 2515), S. aureus (KCTC 1621), L. monocytogenes (KCTC 3569), 5종에 대한 항균활성은 paper-disc method 를 이용하였다. 분리한 유산균을 MRS 액체배지를 이용하 여 37°C에서 24 및 48시간 배양한 후 원심분리하여 제균 한 상등액을 순수한 상등액(Pure-supernatant: PS) 시료로 사용하였으며 PS를 95°C에서 5분간 중탕처리한 상등액 (Heat-treated supernatant: HS), PS의 pH를 7.0±0.3으로 중 화처리한 상등액(Neutralized-supernatant: NS), NS를 95°C 에서 5분간 중탕처리한 상등액(Neutralized & heat-treated supernatant: TS)을 제조하여 항균활성을 조사하였다. 5종의 위해미생물은 nutrient (BD DifcoTM) 액체배지를 이용하여 30°C에서 24시간 배양한 후 B. cereus (103 CFU/mL), E. coli O157:H7 (105 CFU/mL), 그리고 S. typhimurium, S. aureus, L. monocytogenes (106 CFU/mL)를 준비하여 nutrient 평판배지에 도말한 후 8 mm 직경의 paper-disc (Advantec, Tokyo, Japan)를 위치하고 각각의 시료를 6 0 μL씩 분주하 여 30°C에서 12 및 24시간 배양 후, 위해미생물의 생육 저해환의 크기를 vernier caliper로 측정하였다. 식물 유래 유산균으로서 대조군인 LP를 이용하여 동일한 방법으로 3 반복 실험을 진행하였다.
탄화수소에 대한 세포 표면 소수성(BATH, bacterial adhesion to hydrocarbon)과 aggregation 실험은 기존 방법 (Collado et al., 2008)을 약간 변형하여 적용하였다. 분리한 유산균과 대조구인 LP은 MRS 액체배지를 이용하여 37°C 에서 24시간 배양한 후 원심분리하여 회수한 균체를 PBS 용액으로 세척하고 UV-Visible spectrophotometer (Optizen POP, Mecasys Co., Daejeon, Korea)를 이용하여 6 00 nm에 서 OD (Optical density)를 0.6으로 조정한 현탁액을 준비 하였다. 준비한 현탁액(A0)을 chloroform 및 xylene (Sigma, MO, USA)과 각각 1:1 비율로 혼합한 다음 vortex mixer 를 이용하여 약 30초간 균질화시키고 상온에서 3 0, 6 0, 120분 동안 정치배양한 이후 수용액층(A)을 분리하였다. 초기 현탁액(A0)과 분리한 수용액층(A)을 6 00 nm에서 OD 를 측정하여 다음의 계산식에 따라 용매에 대한 세포 표면 에 대한 소수성을 산출하였다. 대조군인 LP를 이용하여 동 일한 방법으로 3반복 실험을 진행하였다.
장내 부착능력을 간접적으로 확인하기 위한 auto-aggregation 과 co-aggregation 실험은 기존 방법(Collado et al., 2008) 을 약간 변형하여 진행하였다. 분리한 유산균과 대조구인 LP는 MRS 액체배지를 이용하여 37°C에서 24시간 배양한 후 원심분리하여 회수한 균체를 PBS 용액으로 세척하고 spectrophotometer를 이용하여 600 nm에서 OD가 1.0이 되 도록 조정한 현탁액을 준비하였다. 준비한 현탁액(B0)을 4mL 취하여 10초간 진탕한 뒤 1.5-24시간 상온에 방치한 후 상등액(B)의 OD를 측정하여 다음 계산식에 따라 autoaggregation을 산출하였다. 대조군인 LP를 이용하여 동일한 방법으로 3반복 실험을 진행하였다.
또한 식중독을 유발하는 5종의 위해미생물은 nutrient 액체 배지를 이용하여 37°C에서 24시간 배양한 후 원심분리하여 회수한 균체를 PBS 용액으로 세척하고 spectrophotometer 를 이용하여 6 00 nm에서 OD가 1.0이 되도록 조정한 현탁 액을 준비하였다. auto-aggregation 실험과 동일한 방법으로 준비한 유산균과 위해미생물의 현탁액을 총 4mL이 되도록 1:1로 혼합하고 30초간 진탕한 뒤 실험 시작 직후의 상등액 (C0)과 진탕 후 1.5-24시간 동안 상온에서 방치한 상등액 (C)의 OD를 측정하여 다음 계산식에 따라 co-aggregation 을 계산하였다.
결과 및 고찰
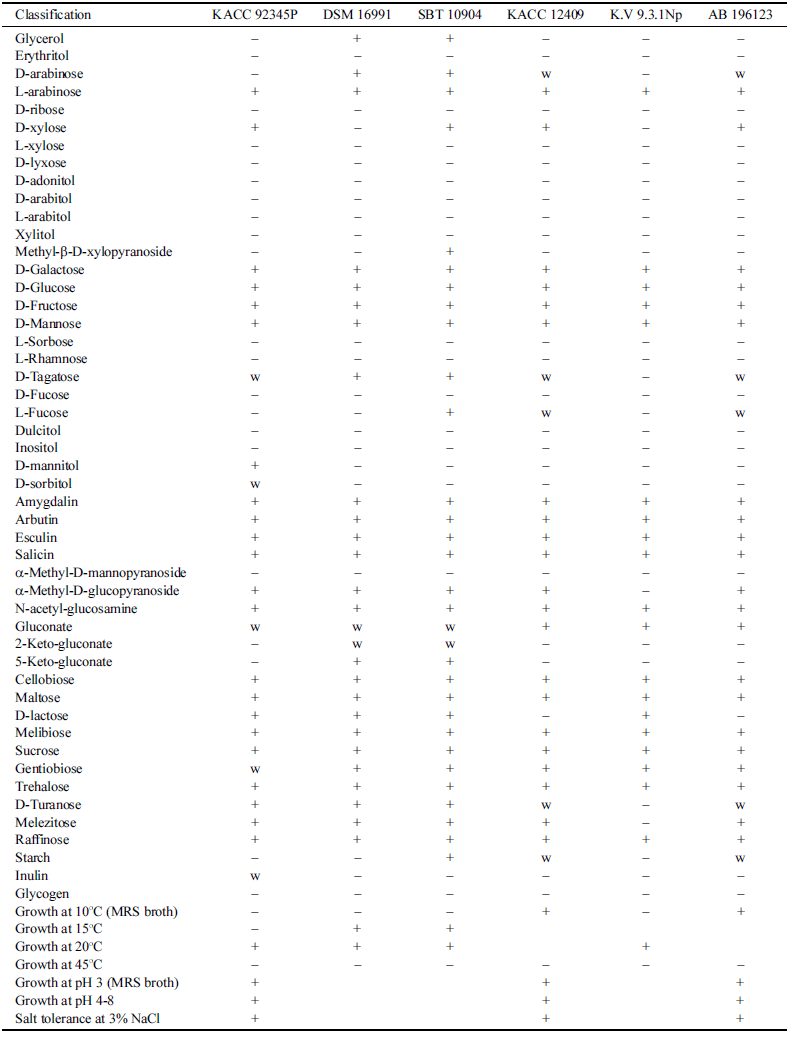
전통 발효식초에서 분리한 유산균은 Gram 양성인 간균 의 형태를 지니고 있으며 API Kit를 이용하여 확인된 균 종은 Lactobacillus brevis이지만 유의성은 90.7% 수준으로 낮았다. 분리한 유산균은 16S rRNA 염기서열 분석에 따 라 L. harbinensis DSM 16991와 99.9% 일치하는 것으로 확인되어 L. harbinensis로 최종 확인되었다. 기존에 보고 된 L. harbinensis의 생리적 특성과 생화학적 특성을 비교 한 결과(Table 1), 16S rRNA 염기서열에서 99.9% 일치한 DSM 16991 (Miyamoto et al., 2005)과는 glycerol, Darabinose, D-xylose, D-mannitol, D-sorbitol, 5-keto-gluconate, inulin에 대한 이용능이 다른 것으로 확인되었다. 또한 L. harbinensis로 보고된 DSM 16991 이외에 4종, SBT 10904 (Miyamoto et al., 2005), KACC12409 (Wu et al., 2014b), K.V9.3.1Np (Delavenne et al., 2013), AB 196123 (Wu et al., 2014a)의 생화학적 특성을 비교한 결과, 본 연구에서 분리한 L. harbinensis는 D-mannitol과 D-sorbitol에 대한 이용능이 다른 것으로 확인되어 Lactobacillus harbinensis VF (LH)로 명명하고 국립농업과학원 씨앗은행에 기탁하였 다(KACC 92345P).
|
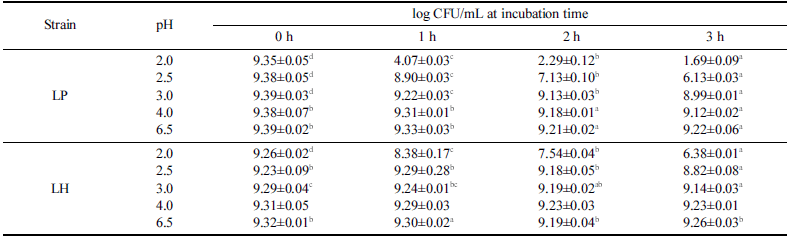
유산균이 프로바이오틱스로서의 효과를 나타내기 위해서 는 소화액과 유사한 낮은 pH와 담즙산에서 생존할 수 있 는 조건을 충족하여야 한다고 알려져 있다. 분리한 유산균 인 LH와 대조군인 LP를 대상으로 pH에 대한 내성을 조 사한 결과를 Table 2에 정리하였다. 대조구인 LP는 pH 2.5 이하에서 노출되는 시간이 증가함에 따라 생존율이 낮 아졌으며 pH 2.0과 2.5에서 3시간 노출에 의하여 각각 18.1% 및 65.4%로 낮은 생존율이 확인되었다. 그러나 pH 3.0 이상에서는 3시간 노출되어도 95% 이상이 생존하는 것으로 확인되었다. 유제품에서 분리한 L. plantarum MLE5 는 pH 2.0에 노출된 경우에 한하여 생존율이 감소하는 것 으로 보고되었으며(Colombo et al., 2018) 이러한 현상은 전통 피클에서 분리한 L. plantarum 균주들의 경우에도 pH 2.5에서 4시간 노출된 이후 생존률이 0-85%로 개별 균 주의 특성에 기인하다고 판단되었다(Tokatlı et al., 2015). 말레이시아의 Kefir 샘플에서 분리한 L. plantarum (D/J)은 pH 2에서는 생존하지 못하였지만 pH 3과 4에서는 각각 85% 및 92% 이상의 생존율이 보이고 있는 반면(Talib et al., 2019) 루마니아의 Braga (BR9)와 water Kefir (CR1)에 서 분리된 L. plantarum의 경우에는 pH 2.5에서 1시간 노 출되었어도 생존율이 91-100%로 보고되었다(Angelescu et al., 2019). 본 연구에서 분리한 LH는 전통 발효식초에서 분리하여 기본적으로 낮은 pH에 대한 내성이 높을 것으로 예측되었으며 pH 2.0에서 3시간 노출되었을 때 생존율이 68.9%이었으며 pH 2.5 이상에서는 95.6% 이상의 높은 생 존율이 확인되었다. 루마니아의 water Kefir grain (CR12) 에서 분리된 L. harbinensis는 pH 2.5에서 1시간 노출된 경우 생존율이 40% 내외로 보고되었고(Angelescu et al., 2019) 말레이시아의 Kefir 샘플에서 분리된 L. harbinensis (A)는 pH 2에서는 생존하지 못하였지만 pH 3과 4에서 각 각 6 4% 및 92% 내외의 생존율이 보고되었다(Talib et al., 2019). 중국의 전통 두부에서 분리한 L. harbinensis M1은 pH 3에서 3시간 노출된 이후 생존율이 30% 수준으로 감 소한 것으로 보고되었다(Zheng et al., 2020). 이처럼 유산 균의 내산성은 개별 균주의 특성으로 판단되지만 본 연구 에서 분리한 LH는 기존에 알려진 L. harbinensis에 비하여 내산성이 우수한 것으로 확인되었다.
|
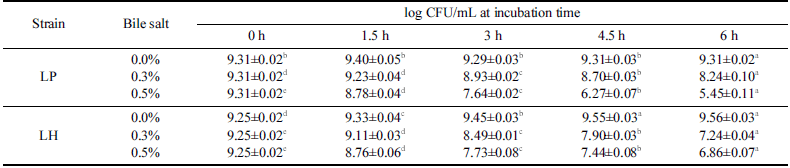
분리한 유산균인 LH와 대조군인 LP는 담즙산의 농도와 노출시간이 증가함에 따라 생존율이 감소하는 경향이 확인 되었으며 LH와 LP는 0.5% 담즙산에서 6시간 노출된 이후 생존율이 각각 58.8%와 74.2%로 확인되었다(Table 3). LH 의 담즙산에 대한 내성은 0.3% 담즙산에서 노출시간이 증 가함에 따라 대조구로 사용된 LP보다 생존율이 낮아지는 반면 0.5% 담즙산에서는 LP보다 높은 생존율을 보이고 있 었다. 이러한 현상은 전통적인 피클시료에서 분리한 L. plantarum는 0.3% Bile salt에서 4시간 노출된 이후 생존율 이 45-99%로 보고된 반면(Tokatlı et al., 2015) 말레이시아 의 Kefir 샘플에서 분리된 L. plantarum (D/J)는 0.3% 및 0.5% 담즙산에서 3시간 노출된 이후 각각 73% 및 85% 내외의 유사한 생존율이 보고되었다(Talib et al., 2019). 또한 루마니아의 Braga (BR9)와 water Kefir (CR1)에서 분리된 L. plantarum은 0.8% 및 2.0% 담즙산에 3시간 노출된 이후 생존율이 61-66%로 보고되었다(Angelescu et al., 2019). 루마니아의 water Kefir grain에서 분리된 L. harbinensis (CR12)는 0.8% 및 2.0% 담즙산에 3시간 노출된 이후 생 존율이 각각 49% 및 45%로 보고되었다(Angelescu et al., 2019). 말레이시아의 Kefir 샘플에서 분리된 L. harbinensis (A)는 0.3% 및 0.5% 담즙산에서 3시간 노출된 이후 70% 수준의 생존율을 보이고 있었다(Talib et al., 2019). 한편 유제품에서 분리한 L. harbinensis MSI3과 MSIV2는 0.5% 담즙산에서 4시간 노출된 경우에 생존율이 다소 감소하는 반면 3.0% 담즙산에서는 별다른 차이가 없는 것으로 보고 되었다(Colombo et al., 2018). 본 연구에서 분리한 LH는 0.3% 및 0.5% 담즙산에서 3시간 노출된 이후 생존율이 91.8% 및 8 3.6 % 수준이었으며 6시간 노출된 경우에도 78.2% 및 74.2% 수준의 생존율이 확인되어 기존에 알려진 L. harbinensis에 비하여 담즙산에 대한 내성도 우수한 것 으로 확인되었다.
|
용혈성은 5% sheep blood를 첨가한 MRS 평판배지를 이용하여 분리한 LH와 대조구인 LP에 대하여 최대 72시 간까지 관찰한 결과, 모두 γ-hemolysis로 확인되어 용혈성 에 대한 안전성이 확보되었다.
일반적으로 Lactobacillus는 다양한 항생제에 대한 내성 을 지니고 있는 것으로 알려져 있기 때문에(Danielsen & Wind, 2003) 분리한 LH와 대조구인 LP에 대하여 13종의 항생물질에 대한 감수성을 조사하였다(Table 4). LP는 ciprofloxacin, kanamycin, streptomycin, vancomycin에 대 한 내성이 없었으며 amikacin과 gentamycin에 대한 감수 성은 높은 것으로 확인되었다. 반면 LH는 유일하게 sulfamethoxazole과 trimethoprim이 혼합된 항생물질에 대한 내성이 없는 것으로 확인되었으며 amikacin, gentamicin, kanamycin, vancomycin에 대한 감수성이 높은 것으로 확 인되었다. 이러한 결과는 말레이시아 Kefir 시료에서 분리된 L. harbinensis와 L. plantarum이 ampicillin, tetracycline, penicillin에 대한 내성이 높은 것으로 보고된 결과와 일치 하였다(Talib et al., 2019). 그러나 발효두유에서 분리된 L. harbinensis M1는 vancomycin에 대한 내성이 없었으 며 kanamycin과 streptomycin에 대한 감수성이 낮은 반 면 gentamycin, tetracycline, chloramphenicol, ampicillin, erythromycin에 대한 높은 감수성과는 다른 경향을 보이 고 있다(Zheng et al., 2020). 발효 요거트에서 보고된 L. harbinensis는 vancomycin, streptomycin, kanamycin, trimethoprim/sulfamethoxazole에 대한 감수성이 낮은 반면 erythromycin, tetracycline, ampicillin, chloramphenicol에 대 한 감수성이 예민한 것으로 보고되어 본 연구결과와 반대 되는 경향을 보이고 있다(Delavenne et al., 2013). 김치에서 분리한 L. plantarum과 L. sake는 gentamycin과 streptomycin 에 대한 감수성이 낮은 반면 erythromycin과 penicillin에 대한 감수성은 예민한 것으로 보고되기도 하였다(Lee et al., 2011). Lactobacillus species가 지닌 항생제에 대한 내 성이나 감수성은 개별 균주의 특성으로 이해되며 본 연구 에서 분리한 LH는 기존에 알려진 L. harbinensis에 비하여 항생물질에 대한 광범위한 내성을 지니고 있는 것으로 확 인되었다.

|
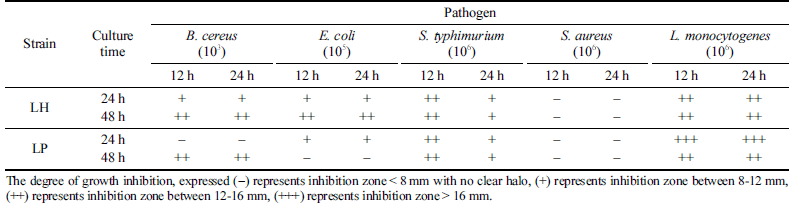
분리한 유산균(LH)과 대조군(LP)을 MRS 액체배지에서 24 및 48시간 배양한 후 원심분리하여 균체를 제거한 상 등액(PS), pH를 중성처리(NS)하거나 가열처리(HS), 그리고 중화 및 가열처리(TS)한 시료를 이용하여 식중독을 야기하 는 위해미생물 5종에 대한 항균활성을 측정한 결과, PS에 서만 S. aureus를 제외한 4종의 위해미생물에 대한 항균활 성이 확인되었다(Table 5). 항균활성 측정에 사용된 PS 용 액의 pH는 3 .6 -3.8으로 유산균의 생육에 따라 생성되는 유 기산에 의한 항균활성으로 판단되었다. 이러한 결과는 우유 를 이용한 요거트 발효에서 스타터와 함께 L. harbinensis K.V9.3.1Np를 이용하여 젖산과 더불어 생성되는 유기산에 의하여 항곰팡이 활성을 높이는 방법을 제시한 연구결과와 유사하였다(Delavenne et al., 2013). 또한 L. harbinensis M1 의 PS에서 S. typhimurium, E. coli O-157, L. monocytogenes 에 대한 항균활성이 확인되었으나 S. aureus에서는 항균활 성이 확인되지 않는다는 결과와 일치하였다(Zheng et al., 2020). 한편 발효음료에서 분리한 L. harbinensis CR12는 B. cereus, L. monocytogenes, E. coli에 대한 항균활성이 본 연구결과와 일치하였지만 S. aureus에 대한 항균활성은 다 른 결과를 보이고 있었다(Angelescu et al., 2019). 김치에서 분리한 L. plantarum과 L. sake는 E. coli와 S. typhimurium에 대한 항균활성이 없는 반면 L. monocytogenes와 B. cereus 에서는 항균활성이 있는 것으로 보고되기도 하였다(Lee et al., 2011). 본 연구에서 선발한 L. harbinensis VF의 항균 활성은 생육에 따라 생성되는 다양한 유기산(낮은 pH)에 기인하는 것으로 확인되었다.
|
세포의 장내 부착성은 세포 표면의 조성과 구조에 의한 영향을 받고 있으며 세포표면의 소수성과 밀접한 관련이 있다고 알려져 있다(Tulumoglu et al., 2013). 프로바이오틱 스로 사용되는 유산균은 장내 부착성이 요구되기 때문에 상대적으로 높은 cell surface hydrophobicity와 aggregation 능력이 좋은 것으로 알려져 있다(Li & So, 2021). 또한 탄 화수소(용매)에 대한 세포 표면 소수성은 세포막과 표면에 서의 다양한 반응에 의한 결과이며 이러한 현상은 동일 균 주 또는 유전적으로 다른 균주와의 aggregation에 영향을 미친다고 알려져 있다(Collado et al., 2008). Cell surface hydrophobicity를 xylene과 chloroform을 이용하여 측정한 결과, 분리한 LH는 대조구인 LP에 비하여 hydrophilic한 것으로 확인되었다(Table 6). 프로바이오틱스로 알려진 Lactobacillus 7종에 대하여 xylene을 이용하여 측정된 hydrophobicity는 13.5-67.1%이었으며 이 중 L. plantarum Lp-115는 44.2%로 보고되어 이번 결과와 유사하였다 (Collado et al., 2008). Lactobacillus 20종에 대하여 xylene 을 이용하여 보고된 hydrophobicity는 L. casei 94 (16.9%), L. plantarum 130 (26.7%), L. casei 196 (35.8%), L. plantarum f12 (45.5%)를 제외하면 대부분 6 2.6 % 이상으로 보고되었으며(Tuo et al., 2013), L. plantarum 4종(KLB213, KLB234, KLB270, KLB296)에 대하여 chloroform을 이용 하여 측정한 hydrophobicity는 각각 90.4%, 95.6%, 5.41%, 84.4%로 보고되었다(Li & So, 2021). 또한 L. plantarum (MLE5/MSI2)과 L. harbinensis (MSI3/MSIV2)에 대하여 xylene을 이용하여 확인된 hydrophobicity는 각각 97.2-99.5 와 98.8-96.6%이었으며(Collado et al., 2008) 김치에서 분 리한 12종의 L. plantarum과 L. sake 중에서 10종이 nhexadecane을 이용한 hydrophobicity는 100%로 로 보고되 었다(Lee et al., 2011). 탄화수소(유기용매)를 이용하여 측 정되는 hydrophobicity는 동일한 Lactobacillus species라 하 더라도 생육환경이나 유전적인 특성에 따른 개별 균주의 특성이며 세포표면의 이온반응 등 다른 영향도 있는 것으 로 판단되었다.

|
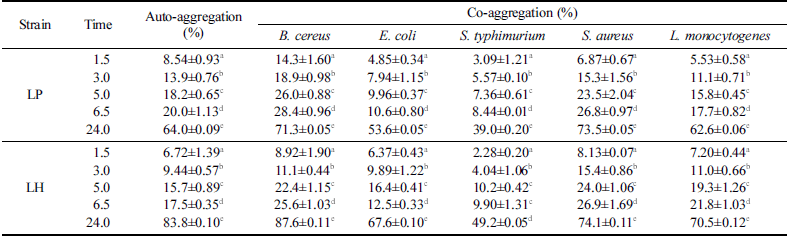
분리한 LH와 대조구인 LP에 대한 auto-aggregation은 시 간 경과에 따라 지속적으로 증가하여 24시간 이후에 각각 83.8%와 64.0%로 증가하였으며 5종의 식중독 유발 위해미 생물과 co-aggregation 역시 각각 39.0-73.5% 및 49.2- 87.6% 수준으로 확인되었다(Table 7). 위해미생물과 LH의 co-aggregation은 24시간 이후에 B. cereus (87.6%), S. aureus (74.1%), L. monocytogenes (70.5%), E. coli (67.6%), S. typhimurium (49.2%) 순이었으며 대조구인 LP보다 높은 경향이 확인되었다. 이러한 결과는 L. plantarum Lp-115의 auto-aggregation이 상온(20°C)에서 5.7%(2시간)에서 44.5% (24시간)로 시간결과에 따라 증가한다는 결과와 S. aureus 에 대한 co-aggregation이 24시간 이후에 74.7%로 증가한 다는 보고와 유사하였다(Collado et al., 2008). 그러나 Lactobacillus 20종에 대한 auto-aggregation은 37°C에서 5 시간 이후에 24.2-41.4% 수준으로 보고된 결과보다는 높은 수준으로 확인되었다(Tuo et al., 2013). 또한 L harbinensis (MSI3/MSIV2) (71.1-78.7%)가 L. plantarum (MLE5/MSI2) (86.9-91.7%) 보다 auto-aggregation이 다소 낮은 결과와는 차이가 있지만 L. monocytogenes와의 co-aggregation에서는 L. harbinensis (64.0-64.3%)가 L. plantarum (57.8-62.8%) 보다 다소 높은 결과와는 일치하였다(Colombo et al., 2018). 분리한 LH의 낮은 hydrophobicity로 인하여 autoaggregation에서 낮은 결과가 예측되었지만 24시간 이후에는 LP와 유사한 수준이었으며 위해미생물과의 co-aggregation 에서도 높은 수준을 확인하였다.
|
요 약
전통적인 발효식초로부터 산 생성능이 높은 유산균을 분 리하여 생화학적 특성과 16S rRNA 염기서열 분석을 거쳐 신규의 L. harbinensis VF (KACC 92345P)를 분리·동정하 였다. 본 연구에서는 분리된 L. harbinensis VF에 대하여 내산성, 내담즙성, 용혈성, 항생물질에 대한 내성, 항균활성, 소수성과 aggregation에 해당하는 프로바이오틱스 특성을 평가하였다. 분리된 L. harbinensis VF는 pH 2.0과 2.5에 3시간 노출되어도 생존율이 각각 68.9%와 95.6%이었으며 0.3% 및 0.5% 담즙산에서 3시간 노출되어도 생존율이 각 각 91.8% 및 83.6%로 기존에 보고된 L. harbinensis에 비 하여 높은 내산성과 내담즙성을 지니고 있었다. 또한 γ- hemolysis로 확인되어 용혈성에 대한 안전성도 확보되었다. 분리된 L. harbinensis VF는 trimethoprim/sulfamethoxazole 를 제외한 12종의 항생물질에 대한 내성을 지니고 있으며 대조구로 사용한 L. plantarum (KCTC 3108)과 기존에 보 고된 L. harbinensis보다 항생물질에 대하여 광범위한 내성 을 지니고 있었다. 분리된 L. harbinensis VF는 S. aureus 를 제외한 B. cereus, E. coli O157:H7, L. monocytogenes, S. typhimurium, 4종의 식중독 유발 위해미생물에 대한 항 균활성이 확인되었으며 이러한 항균활성은 배양액에 존재 하는 유기산에 기인하는 것으로 확인되었다. 분리된 L. harbinensis VF에 대하여 xylene과 chloroform을 이용하여 측정한 hydrophobicity는 1시간 반응한 이후 각각 11.7% 및 14.4%로 대조구인 L. plantarum (44.8% & 57.7%)에 비하여 낮은 소수성을 지니고 있었다. 분리된 L. harbinensis VF의 auto-aggregation 능력은 24시간 이후에 83.8%로 대 조구인 L. plantarum (64.0%)보다 높았으며 위해미생물과 의 co-aggregation은 B. cereus ( 87.6 %), S. aureus (74.1%), L. monocytogenes (70.5%), E. coli (67.6%), S. typhimurium (49.2%) 순이었으며 대조구인 L. plantarum보다 높은 경향 이 확인되었다. 본 연구결과로부터 발효식초로부터 분리한 L. harbinensis VF는 프로바이오틱스 균주로서 활용 가능 성이 높을 것으로 판단된다.







