서 론
현대사회는 도시화, 공업화로 인한 환경오염과 식생활의 변화 그리고 과다한 스트레스로 인하여 각종 신체 내 문제 점이 발생할 위험이 증가하고 있다. 이러한 환경에서는 신 체 내 대사의 균형이 깨지면서 활성산소가 과잉 발생하게 되고, 이는 세포막 단백질의 변성, DNA 손상과 같은 비가 역적인 변화 및 면역 조절 이상으로 이어져 만성 염증성 질 환 등의 질병을 유발할 수 있다(Alessio, 1993;Heinzemann et al., 2002).
아로니아(Aronia melanocarpa)는 장미과의 낙엽 관목으 로 주로 폴란드, 유럽, 북아메리카에서 주로 재배되고 있고 (Wu et al., 2004), 최근에는 한국에서도 수요 에 따라 재 배가 확대되고 있다. 아로니아는 안토시아닌과 같은 폴리 페놀류, 플라보노이드 및 탄닌 등의 생리활성 물질을 다량 함유하고 있어, 항산화(Bermúdez-Soto et al., 2004), 항암 (Brinckerhoff et al., 2000), 항염증(Charous et al., 1997), 항당뇨(Chen et al., 2001), 면역조절(Curran et al., 1999) 등에 효과가 있는 것으로 알려져 있다.
아로니아의 국내 재배는 2007년 일부 농가에서 소규모 로 재배되기 시작하였으며 2010년 이후 전국적으로 재배 가 확대되어 2014년부터 생산량이 크게 증가하였다(Choi et al., 2015a). 주로 7-8월에 수확하는 아로니아는 냉동 저 장하거나 건조하여 분말화 또는 착즙하여 판매되고 있다. 생산량이 증가함에 따라 농가에서는 가공시설 및 판매처를 확보하는데 애쓰고 있다. 이와 같이 일시적으로 수확되고, 수분함량이 높은 아로니아는 건조하여 분말화하면 저장 및 유통 용이성을 높일 수 있다. 식품의 건조에는 건조방법, 온도, 시간, 태양 광선의 존재 여부 등 다양한 조건이 관 여되고 있으며 이들 조건은 식품의 색, 질감, 영양성분을 변화시킬 뿐 아니라 식품에 함유된 생리활성 물질이나 기 능에도 영향을 미칠 수 있다(Kurozawa et al., 2014). 건조 방법에는 열풍건조, 진공건조, 동결건조 등이 식품건조과정 에서 활용되고 있는데, 열풍건조는 건조효과가 뛰어나고 비용이 비교적 저렴하기 때문에 주로 이용된다(Hong et al., 2004). 동결건조는 건조 방법 가운데 열에 민감한 물질 의 손상을 최소화시키는 장점이 있어 과실류의 건조에 효 과적인 것으로 알려져 있다(Ezhilarasi et al., 2013).
본 연구에서는 열풍건조와 동결건조의 2가지 방법으로 건조시킨 후 분말화된 아로니아를 이용하여 항산화 기능과 함께 항염증 활성을 비교함으로써 아로니아 가공을 위한 우수한 건조방법을 제시하고, 동시에 기능성 소재로의 이 용 가능성을 높이고자 하였다.
재료 및 방법
본 실험에 사용한 아로니아(Aronia melanocarpa)는 전북 고창산을 구매하여 사용하였다. 2,2-diphenyl-1-picryl-hydrazyl (DPPH), 2,2'-azino-bis-3-ethylbenzthiazoline-6-sulphonic acid (ABTS), dimethyl sulfoxide (DMSO), L-ascorbic acid, 3- (4,5-dimethylthiazol-2-yl)-2,5-dimethyl tetrazolium (MTT), Folin-Ciocalteu's phenol reagent, gallic acid, quercetin, potassium hydroxide, sodium chloride, potassium chloride 는 Sigma Chemical Co. (St. Louis, MO, USA)에서 구입 하였다. 대식세포인 RAW 264.7은 한국세포주은행(Korea cell line bank, Seoul, Korea)에서 분양 받아 사용하였다. 세포 배양에 사용한 fetal bovine serum (FBS), penicillinstreptomycin solution, trypsin 0.25% EDTA solution, roswell park memorial institute medium (RPMI-1640 with L-glutamine)은 Hyclone Co. (St. Louis, MO, USA)에서 구입하였다.
동결건조는 -18°C의 냉동고에서 8시간 냉동시킨 후, 동 결건조기(JF200, Jeonjin E&C, Busan, Korea)를 이용하여 -55°C에서 48시간 동안 실시하였다. 열풍건조는 열풍건조 기(CF-21WF, Jeiotech, Daejeon, Korea)를 이용하여 50°C 에서 48시간 동안 수행하였다. 아로니아 추출물은 동결건 조 및 열풍건조 된 아로니아를 분쇄기(HMF-3450S, Hanil Inc., Seoul, Korea)로 분쇄한 후, 분말화된 아로니아에 70% 에탄올을 10배수로 가하여 2시간 동안 70°C로 연속3 회 환류추출하였다. 이후 30분동안 상온에서 자연 냉각시 킨 다음, 여과지(5 μm paper filter, Hyundai Micro No. 100, Korea)를 통해 여과한 후, 감압 농축한 다음 급속냉동 기(Deep Freezer, DF 9010, Ilshin Lab Co. Ltd., Yangju, Korea)를 이용하여 -80°C에서 급속냉동 한 후, 동결건조기 (Freeze dryer, FD5508, Ilshin Lab Co. Ltd., Yangju, Korea)로 -45°C에서 건조하였다. 시료의 수분함량은 동결건 조 아로니아 6.01±0.08%, 열풍건조 아로니아 5.4±0.21%로 동결건조물이 약 11% 높았다.
총 폴리페놀 함량 측정은 Folin-Denis법을 이용하였다 (Folin et al., 1912). 희석된 시료 1 mL에 증류수 5 mL를 혼합한 후 Folin-Ciocalteu's phenol reagent 0.5 mL를 가하 고 혼합하여 실온에서 8분간 반응시켰다. 그 후 7% sodium carbonate 10 mL를 첨가하였다. 증류수를 이용하여 최종 부피를 25 mL로 맞춘 후 실온의 암소에서 2시간 동 안 방치한 다음 분광 광도계(CM-25000D, Konica Minolta Holdings Inc., Tokyo, Japan)를 이용하여 750 nm에서 흡광 도를 측정하였다. 총 페놀함량은 gallic acid를 표준물질로 이용하여 표준곡선으로부터 함량을 구했으며, 결과값은 3 회 반복 측정한 후 평균값으로 나타내었다.
총 플라보노이드 함량은 Moreno et al. (2000)의 방법을 이용하여 측정하였다. 희석된 시료 500 μL에 10% aluminum nitrate 1 mL와 1M potassium acetate 100 μL, 80% 에탄올 4.3 mL를 순서대로 첨가한 후 실온의 암소에서 40분 동안 반응시켰다. 그 다음 510 nm에서 반응액의 흡광도를 측정 하였다. 표준물질로 quercetin을 사용하여 표준곡선으로부 터 함량을 구했으며, 3회 반복 측정한 후 평균값으로 나타 내었다.
DPPH radical에 대한 소거 활성은 Blois (1958)의 방법 을 이용하여 측정하였다. 즉, 0.1M sodium acetate buffer (pH 5.5)를 이용하여 희석된 시료 1 mL에 7.5×10-5M DPPH 용액 2 mL를 첨가하여 혼합한 후 37°C 암소에서 30분간 반응시킨 후 517 nm에서 흡광도를 측정하였다.
ABTS radical 소거 활성은 Re et al. (1999)의 방법을 이용하여 측정하였다. ABTS radical cation을 제조하기 위 해 7 mM ABTS 용액과 2.45 mM potassium persulfate 용 액을 1:1로 혼합하여 30°C 암소에서 12시간 방치하였다. 그 후 5 mM potassium phosphate buffer (pH 7.4)로 희석 하여 413 nm에서 흡광도가 0.7이 되도록 하였다. 희석된 ABTS 용액 4 mL에 0.1M sodium acetate buffer (pH 5.5) 로 희석된 시료 40 μL를 가하여 1분간 반응시킨 후 413 nm에서 흡광도를 측정하였다.
항염증활성 측정에 이용한 RAW264.7는 RPMI-1640배 지를 사용하였다. 10% (w/v) FBS와 1% (w/v) penicillin streptomycin을 첨가한 복합배지를 조제하여 배양에 사용하 였으며 37°C, 5% CO2 incubator에서 4일 간격으로 계대 배양하면서 실험에 사용하였다.
RAW 264.7에 대한 아로니아 추출물의 세포독성은 Carmichael et al. (1987)의 방법을 이용한 MTT assay를 통해 측정되었다. 미리 배양한 암세포를 1×105 cells/mL의 농도로 96 well plate에 180 μL씩 seeding하고 5% CO2 incubator에서 37°C, 24시간 조건으로 배양하였다. 기존 배 지 80 μL를 제거하고 각 well에 시료를 농도별로 100 μL 씩 첨가하여 위와 같은 조건에서 48시간 동안 배양한 후 각 well에 5 mg/mL의 MTT용액을 20 μL씩 첨가하여 4시 간 동안 배양하였다. 배양액 제거 후 DMSO와 ethanol을 1:1 비율로 혼합한 용액을 150 μL씩 각 well에 첨가하여 30분간 흔들어 반응시킨 뒤 ELISA reader (Versamax, Molecular Device, Sunnyvale, CA, USA)를 이용하여 550 nm에서 흡광도를 측정하였다.
아로니아 동결건조 및 열풍건조 추출물의 nitric oxide (NO) 생성량 측정은 Lee et al. (2012)의 방법을 이용하였 다. 즉, 선 배양한 RAW 264.7를 1×105 cells/mL의 농도로 희석한 뒤 96 well plate에 180 μL씩 분주하여 24시간 동 안 배양하고, 시료를 20 μL씩 처리한다. 여기에 1 μg/mL lipopolysaccharide (LPS)를 20 μL 처리하여 24시간 배양하 였다. 세포 배양액 100 μL와 동량의 Griess Reagent를 혼 합하여 상온에서 10분간 반응시킨 후 ELISA reader를 이 용하여 540 nm에서 흡광도를 측정하였다. sodium nitrite의 검정곡선을 이용하여 배양액의 NO함량을 산출하였다.
결과 및 고찰
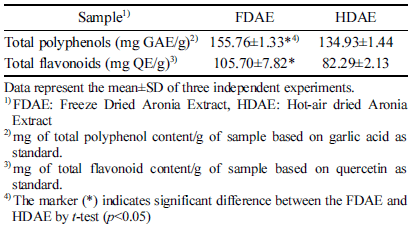
본 연구에서 아로니아 동결건조 추출물(FDAE)과 열풍 건조 추출물(HDAE)의 총 폴리페놀 함량은 각각 155.76 mg GAE/g, 134.93 mg GAE/g으로, 동결건조 추출물의 총 폴리페놀 함량이 유의적으로 높았다. FDAE와 HDAE의 총 플라보노이드 함량은 각각 105.70 mg QE/g, 82.29 mg QE/g으로 분석되어 총 폴리페놀과 같이 동결건조 추출물 이 열풍건조 추출물 추출물에 비해 총 플라보노이드 함량 이 높게 나타났다(Table 1). 아로니아의 생리 활성을 연구 한 Chung (2014)는 국내산 아로니아의 70% 에탄올 추출 물의 총 폴리페놀 함량과 총 플라보노이드 함량을 Chung은 117.20 mg/g과 32.50 mg/g으로 보고하였고, Hwang et al. (2014)은 총 폴리페놀의 함량을 192 mg/g으로 보고하여 본 연구결과와 유사한 것을 볼 수 있다. Kim et al. (2016)은 건조방법에 따른 삼백초의 총 폴리페놀의 함량을 측정한 결과, 일광건조, 열풍건조, 동결건조 순으로 함량이 증가한 다고 보고 하였고, Yook et al. (2010)은 포도가공부산물의 총 폴리페놀 및 안토시아닌 함량을 분석한 결과, 동결건조 시료가 열풍건조시료보다 더 높은 수치를 보인다고 보고하 였다. 일반적으로 고온에서 열처리를 하는 경우 세포벽을 파괴하여 유효성분의 분리가 쉽게 일어나 시료의 페놀 및 플라보노이드 함량이 증가하는 것으로 보고되었지만(Peleq et al., 1991), 열풍건조 시 장시간의 열처리를 통해 이들 성분의 변화가 발생하여 동결건조에 비해 총 폴리페놀과 플라보노이드 함량이 낮게 측정된 것으로 보인다.
|
FDAE와 HDAE의 DPPH radical 소거능과 ABTS radical 소거능은 두 시료 모두 농도가 증가함에 따라 유의적으로 증가하였으며, FDAE가 HDAE에 비해 전 농도에 걸쳐 DPPH 및 ABTS radical 소거능이 유의적으로 높은 것으로 나타났다(Fig. 1). FDAE의 DPPH radical 소거활성은 20, 40, 60, 80, 100, 150, 200 ug/mL 농도에서 각각 13.01, 33.80, 45.41, 58.82, 79.86, 85.32, 86.93%로 나타났다. HDAE의 DPPH radical 소거활성은 같은 농도에서 10.93, 20.69, 32.46, 48.13, 64.57, 74.45, 80.14%였다. ABTS radical 소거 활성은 가장 높은 농도인 200 μg/mL의 농도에서 FDAE는 90.44%의 ABTS radical 소거 활성을 나타내었 으며, HDAE은 87.72%의 높은 소거 활성을 나타내었다. 베리류의 ABTS radical 소거능을 조사한 연구에 의하면 250 μg/mL의 농도에서 아사이베리, 블루베리, 산수유, 오디 가 56.2, 28.8, 90.5, 40.1%의 ABTS radical 소거능을 보여 (Lim et al., 2015), 다른 베리류에 비해 아로니아의 활성이 높을 것을 알 수 있다. 건조방법에 따른 아로니아 열수추 출물의 DPPH radical 소거 활성과 ABTS radical 소거 활 성을 조사한 연구에서는 동결건조한 아로니아의 항산화활 성이 200 ug/mL에서 각각 65%와 61.7%의 소거활성을 보 여 오븐건조나 일광건조(52.0-59.7%, 45.0-52.9%)에 비해 유의적으로 높은 결과를 보였고(Hwang et al., 2014), 이는 포도 가공부산물이나 삼백초를 이용한 실험에서도 유사한 결과를 보여주었다(Kim et al., 2006;Yook et al., 2010).

건조방법에 따른 오미자의 마이크로웨이브 추출의 총 폴 리페놀 함량 및 항산화 특성(DPPH 및 ABTS radical 소거 능)간의 상관성을 분석한 Park et al. (2013)의 연구에 따르 면 동결 건조 오미자는 총 폴리페놀 함량과 항산화 활성간 에 높은 상관성을 보였다. 따라서, 본 실험결과에서도 건조 방법에 따른 총 폴리페놀과 총 플라보노이드 함량 변화에 의해 항산화활성에서의 차이가 발생한 것으로 사료된다.
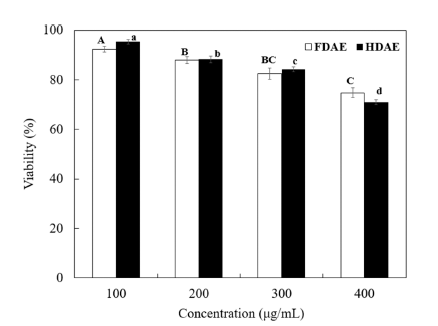
아로니아 추출물을 100, 200, 300, 400 ug/mL 농도로 RAW 264.7 cell에 처리했을 때의 세포생존율 실험결과, FDAE와 HDAE에서 모두 300 ug/mL의 농도에서 각각 82.6%, 84.3%의 생존율을 보여, 300 ug/mL까지 80% 이상 의 세포 생존율을 나타내었다. 본 시험결과를 토대로 NO 생성 억제 시험시 시험물질의 농도는 300 mg/mL 이하로 설정하였다(Fig. 2). 본 결과는 아로니아와 같은 베리류인 아사히베리 및 블루베리의 세포독성측정에서 20, 100, 250, 1,000 ug/mL 농도로 처리했을 때 RAW 264.7 cell에 대하 여 세포독성이 나타나지 않은 연구결과와 유사하다(Choi et al., 2015b;Kim et al., 2017).
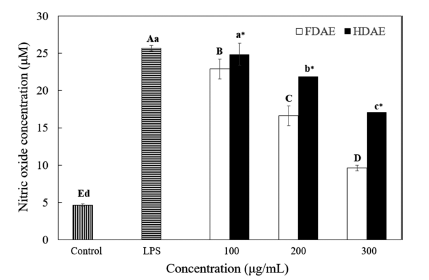
건조법에 따른 아로니아 추출물의 항염증활성을 비교하 기 위해 RAW 264.7 cell에서의 NO 생성량을 측정한 결 과, FDAE와 HDAE 모두 농도가 증가함에 따라 유의적으 로 NO 생성이 저하되었으나, FDAE의 저해율이 전 농도 에 걸쳐 HDAE에 비해 유의적으로 낮았다(Fig. 3). HDAE 는 100 ug/mL 농도에서 LPS 처리군과 비교했을 때 NO 생성이 거의 감소하지 않았지만, FDAE는 유의적인 감소를 보였고, 300 ug/mL 농도에서는 FDAE가 LPS 처리군에 비 해 NO 생성을 62.7% 감소시킨 데 비해 HDAE는 33.5% 감소에 그쳤다. 아사히베리, 아로니아, 블루베리, 블랙커런 트 등의 베리류의 항염증 활성을 연구한 실험결과에서는 LPS 1 ug/mL 처리시 200 ug/mL 농도에서 생성이 억제되 는 결과를 보였는데(Matchett et al., 2006), 본 실험과 비 교했을 때 아로니아 동결건조 추출물의 NO 생성 억제효과 가 더 큰 것을 볼 수 있다.
요 약
본 연구에서는 열풍건조와 동결건조 2가지 방법으로 건 조된 아로니아의 항산화 기능과 항염증 활성을 비교함으로 써 아로니아의 최적 가공법과 기능성 소재로의 이용가능성 을 살펴보고자 하였다. 동결건조는 -18°C의 냉동고에서 8 시간 냉동시킨 후, 동결건조기를 이용하여 -55°C에서 48시 간 동안 실시하였고, 열풍건조는 열풍건조기를 이용하여 50°C에서 48시간 동안 수행하였다. 아로니아 추출은 분말 화된 원료에 70% 에탄올을 10배수로 가하여 2시간 동안 70°C로 연속 3회 환류추출하였다. 총 폴리페놀 함량은 동 결건조 추출물이 155.76 mg GAE/g, 열풍건조 추출물이 134.93 mg GAE/g으로, 총 플라보노이드 함량은 동결건조 추출물이 105.7 mg QE/g, 열풍건조 추출물이 82.29 mg QE/g으로 분석되어 동결건조 추출물에서 더 높은 함량을 보였다(p<0.05). DPPH radical 소거 활성과 ABTS radical 소거 활성은 전 농도에 걸쳐 동결건조 추출물이 열풍건조 추출물에 비해 유의적으로 높은 것으로 나타나 동결건조 추출물이 열풍건조 추출물에 비해 우수한 항산화력을 가짐 을 알 수 있었다. RAW 267.4를 이용한 MTT assay를 통 해 세포독성을 조사한 결과 동결건조 및 열풍건조 아로니 아 추출물 모두 100-300 ug/mL의 농도에서 세포독성은 나 타나지 않았으며, 항염활성 평가에서는 동결건조 추출물이 300 ug/mL 농도에서 LPS 처리군에 비해 NO 생성을 62.7% 감소시킨 데 비해 열풍건조 추출물이 33.5%를 감소시켜 동결건조 추출물이 열풍건조 추출물에 비해 더 높은 항염 증 활성을 보여주었다. 본 연구결과를 통해 열풍건조보다 는 동결건조 방법이 아로니아의 유효성분 함량 증대를 통 한 항산화 및 항염증 활성을 높이는 더 나은 방법임을 알 수 있었다. 단, 동결건조 방법이 산업적인 측면에서 장비 및 운용비용 등의 문제를 가진 만큼, 향후 열풍건조 대비 기능성분 및 기능성 개선과 함께 원가적인 측면을 고려하 여 가공법을 결정할 필요가 있다.







