서 론
2015년 청소년 건강행태 온라인 조사에서 청소년의 음주 율은 16.7%로서 증가하는 현상이 나타나지 않았지만 현재 음주자의 위험음주율은 50.2%로서 증가하였다고 발표하여 음주로 인한 사회적 문제점이 증가할 수 있음을 시사하였 다. 청소년의 만성 알코올 섭취의 문제는 뇌 발달, 뇌 기 능 그리고 신경, 정신적 건강에 해로우며, 심각한 인지기능 손실, 주의력, 집중력 그리고 시각장애 등과 관련이 있다 (McQueeny et al., 2009). 알코올중독 청소년 12명을 대상 으로 한 연구 결과에서 해마 부피가 약 16% 감소하였으며 (De Bellis et al., 2000), 알코올 중독 청소년 33명을 대상 으로 한 neuropsychological (NP)검사와 심리검사 결과 만 성 알코올 섭취는 학습능력 및 언어 구술 능력을 떨어뜨린 다고 보고되었다(Brown et al., 2000).
한편, 알코올섭취와 관련한 병태생리학적 연구들도 다수 보고되고 있다. 6 g/kg BW의 농도로 급성 알코올을 섭취 한 6주령 마우스에서 간장의 triglyceride (TG) 농도가 섭 취 8시간 동안 급격히 증가하는 것으로 보고되었고(Kaiser et al., 2009), 3-9개월령 마우스에서 알코올 섭취 농도가 증가할수록 간장의 TG 농도가 더 높게 증가한 것으로 보 고되었다(Donohue et al., 2012). 또한 6-8주령을 대상으로 한 마우스 실험에서 20% 농도의 알코올 섭취는 폐포의 미 토콘드리아에 Reactive oxygen species (ROS)를 생성을 촉 진하여 미토콘드리아의 장애를 촉진시키며 alveolar macrophage를 악화시킨다고 보고하였다(Liang et al., 2014).
또한 8-9주령 흰쥐에서 3.5 g/kg BW 농도의 알코올 섭 취는 뇌 조직의 p-Akt 발현을 감소시키는 것으로 나타났으 며(Laguesse et al., 2017) 4.5 g/kg BW의 농도로 급성 알코 올 중독을 유발한 마우스의 간에서 Forkhead box protein O (FoxO) 발현의 증가로 인한 autophagy가 유발되었다고 보고되었다(Ni et al., 2013). 그리고 흰쥐의 골격근에 알코 올 투여 농도가 증가할수록 muscle RING-finger protein-1 (MuRF1), MAFbx와 같은 atrogene들의 발현이 증가하는 것으로 보고되고 있다(Vary et al., 2008). 한편, 알코올 섭 취와 관련된 인체실험에서, 성인 20대에서 70대까지의 알 코올 섭취로 인해 외측광근의 type II 근섬유만 위축된 그 룹에서는 근 횡단 면적의 감소가 나타났고, MuRF1과 MAFbx mRNA 발현이 증가하였으나, type I과 type II 모 두 위축된 군에서는 MuRF1과 MAFbx mRNA 발현이 감 소되었다고 보고되었다(Shenkman et al., 2013).
12주간 총 열량의 36%를 알코올로 섭취한 체중 400 g 전후의 성인 흰쥐 골격근의 P38의 인산화가 증가하며, 족 저근의 근횡단면적과 근육 중량이 감소하였다고 보고되고 있다(Clary et al., 2011). 알코올 섭취에 따른 골격근의 형 태적 생화학적 변화에 대한 연구는 많이 보고되고 있으나 알코올 섭취에 따른 성장기 골격근의 변화에 대한 생화학 적 분자생물학적 연구는 거의 보고되고 있지 않은 실정이 다. 이에 본 연구에서는 4주간의 만성 알코올 섭취가 6주 령의 성장기 흰쥐의 골격근 위축 관련 신호전달 단백질 발 현에 미치는 영향에 대해 연구하였다.
재료 및 방법
본 연구에서는 6주령 수컷 SD계 흰쥐(Samtaco Bio Korea, Hwaseong, Korea) 18마리를 1주간 환경 적응 후에 CG군 (Control group, n=9), AG군(Alcohol supplemented group, n=9)으로 분류하여 4주간 사육하였다. 사육 환경은 실내 온도 23±1°C, 습도 50±5%로 유지하였으며 12시간의 명암 주기를 설정하였다. 또한 사육 기간 동안 물과 AIN-76 표 준식이는 자유로운 섭취가 가능하도록 하였다. 사육기간중 의 식이효율은 (실험기간중의 체중 증가분/실험기간중의 식이 섭취량)으로 계산하여 나타내었다. AG군은 매일 일 정한 시간대에 존대를 이용하여 3 g/kg BW의 99% 에탄올 (Sigma-Aldrich, St. Louis, MO, USA)을 경구 투여하였으 며, CG군은 동일한 방법으로 수돗물을 경구 투여하였다. 4 주간의 사육 종료 후, 12시간의 공복 상태에서 에테르 마 취 상태에서 좌심실에서 1회용 주사기를 이용하여 8 mL씩 채혈한 후에 700 × g로 15분 간 원심 분리하여 혈청을 분 리하였다. 혈청 및 골격근 등 조직들은 분석 시까지 -80°C 에 보관하였다. 본 연구는 선문대학교 동물실험윤리위원회 의 승인을 득한 후에 수행하였다(SM-2016-01-01).
혈청 내 glucose 농도는 glucose oxidase 및 peroxidase의 작용에 의해 phenol과 4-aminoantipyrine을 산화적으로 축 합시켜 키논형 적색 색소를 생성할 때 이 적색 색소를 500 nm에서 비색 측정하였다(Morin & Prox, 1973). 혈청 내 TG 농도는 lipoprotein lipase의 작용에 의해 가수분해 되어 글리세롤이 형성된 후 glycerol kinase와 ATP의 작용 에 의해 과산화수소가 생성되면 peroxidase의 존재 하에 N-ethyl-N-sulfopropyl-m-toluisine과 4-aminoantipyrine을 산 화 축합하여 적색 색소를 생성할 때 이 적색 색소를 550 nm에서 비색 측정하였다(Ekindjian & Duchassaing, 1979). 혈청 내 Total cholesterol (TC)농도는 혈청 중의 에스테르형 콜레스테롤이 cholesterol esterase 및 cholesterol oxidase 의 해 생성된 과산화수소가 peroxidase의 존재 하에 4-aminoantipyrine과 phenol을 산화 축합시켜 키논형 적색 색소를 생성할 때 이 적색 색소를 500 nm에서 비색 측정하였다 (Steele et al., 1980). 혈청 내 High density lipoprotein cholesterol (HDLC) 농도는 Phosphotungstic acid와 Mg2+의 작용으로 low density blipoprotein을 침전 시킨 후에 상층 액(supernatant)을 TC와 동일한 원리를 이용하여 500 nm에 서 비색 측정하였다(Steele et al., 1980). 모든 혈중 성분은 상업용 kit (Asan pharm, Seoul, Korea)을 이용하여 분광 광도계(Biochrom WPA, Hollston, MA, USA)를 이용하여 분석하였다.
Soleus 근육의 전 처리는 건 조직을 모두 제거한 후, 근 육 샘플에 cytoplasmic extract buffer (10 mM HEPES, pH 7.9, 10mM KCl, 0.1mM EDTA, 0.3% NP-40, 1% protease inhibitor cocktail, 1% phosphatase inhibitor cocktail (Sigma- Aldrich, St. Louis, MO, USA))를 첨가한 후 polytron homogenizer (Biospec Products, Bartlesville, OK, USA)를 이용 하여 조직을 균질화 한 후에 10,000 × g에서 5분간 원심 분리하여 상층액을 추출하였다. 또한 pellet에 nuclear extract buffer (20 mM HEPES, pH 7.9, 0.4M NaCl, 1 mM EDTA, 25% glycerol, 1% protease inhibitor cocktail, 1% phosphatase inhibitor cocktail (Sigma-Aldrich, St. Louis, MO, USA))를 첨가한 후 10,000 × g에서 5분간 원심 분리하여 상층액을 추출하였다. 단백질 농도는 Bio-rad Bradford Protein Assay kit (Bio-rad, Hercules, CA, USA)을 이용하 여 정량하였다.
단백질은 전기 영동 후에 polyvinylidenediflouride membranes (PVDF, Millipore, Bedford, MA, USA)에 트랜스퍼 하였으며, 상온에서 Tris-buffered saline in Tween-20 (TBST)로 희석한 5% BSA로 1시간 블록킹 하였다. 1차 항체는 Akt, phospho-Akts473, FoxO1, phospho-FoxO1Thr24/ 3aThr32 (Cell Signaling, Beverly, MA, USA), MuRF1, P38 그리고 phospho-P38T180+Y182 (Abcam, Cambridge, MA, USA)를 사용하여 상온에서 TBST로 희석한 5% BSA에 희석하여 각각 2시간동안 반응시켰으며, 2차 항체는 HRPconjugated anti-goat IgG (Santa Cruz, CA, USA) 또는 anti-rabbit IgG (Santa Cruz, CA, USA)을 사용하여 각각 1시간동안 반응시켰다. 그 후 ECL kit (GE Healthcare, Buckinghamshire, UK)을 사용하여 각 단백질의 밴드를 동 정하였으며 현상 필름은 ImageJ program (ImageJ, NIH, Bethesda, MD, USA)을 통해 각각의 단백질 발현 농도를 분석하였다.
결과 및 고찰
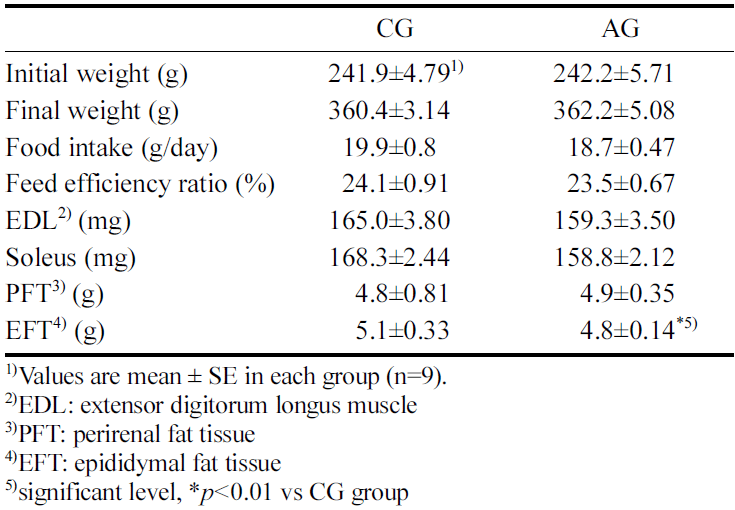
4주간 알코올 섭취에 따른 체중, 식이섭취량, 식이 효율 및 조직 중량 변화는 Table 1에 나타내었다.
|
CG군의 초기 체중은 241.9±4.79 g으로 나타났으며, 최종 체중은 360.4±3.14 g이었으며 AG군의 체중은 242.2±5.71 g 으로 나타났고, 최종 체중은 362.2±5.08 g으로 CG군과 AG 군 간에 체중에서 유의한 차이가 없었다. 임상실험에서 만 성 알코올 환자인 성인 남성을 대상으로 한 연구에서 알코 올 섭취에 의한 BMI변화는 적었으며, 만성적인 알코올 섭 취가 체중 변화의 주된 원인이 아니라고 한 선행연구 (French et al., 2010)와 유사한 결과를 나타내었다. 또한, 신장 주위부 지방과 고환 부 지방 중량도 알코올섭취에 의 한 차이는 없는 것으로 나타났다. 선행 연구에서 8주령 흰 쥐를 이용하여 22주간 2.5 g/kg BW로 알코올을 섭취한 결 과에서 신장 주위부 지방과 고환 부 지방 중량이 차이가 없는 것으로 보고(Ren et al., 2012) 하여 본 연구결과와 유사한 결과를 나타냈다. 또한 식이섭취량에서 CG군은 19.9±0.8 g/day, AG군은 18.7±0.47 g/day 로 유의한 차이가 나타나지 않았으며, 식이효율에서도 CG군은 24.1±0.91%, AG군은 23.5±0.67%로 두 군 간에 유의한 차이가 나타나 지 않았다. 따라서 만성 알코올 섭취는 체중 변화에 영향을 미치지 않은 것으로 추측된다. 그러나, 주로 속근으로 구성 된 extensor digitorum longus (EDL) 근육중량에서 CG군 165.0±3.80 mg, AG군 159.3±3.50 mg으로 유의하지 않았으 며, 주로 지근으로 구성된 soleus 근육중량에서도 CG군 168.3±2.44 mg, AG군 158.8±2.12 mg으로 나타나 알코올 섭취에 의해 감소하였으나 유의한 차이는 나타나지 않았 다. 선행연구에서 하루 최소 80 g 수준으로 1년 이상 만성 알코올을 섭취한 성인에게서 Type II 근섬유의 횡단 면적 이 약 10-20% 감소하였다고 보고되고 있으며(Preedy et al., 2003), 3년간 매일 100% 알코올을 100 mL 섭취한 성 인에서도 근섬유의 횡단면적이 10-40% 수준으로 감소 (Shenkman et al., 2013)됨을 보고하였다. 따라서, 본 연구 에서 4주간의 알코올섭취가 근육의 횡단면적 및 골격근의 중량을 유의하게 감소시킬 정도의 충분한 알코올 농도 및 섭취 기간이 부족했던 것으로 판단된다.
4주간 알코올 섭취에 따른 혈액 성분 변화는 Table 2에 나타내었다
혈중 glucose농도는 CG군에서 148.3±3.47 mg/dl, AG군 은 155.6±2.87 mg/dl으로 AG군의 혈당이 증가하였으나, 유 의한 차이는 없었다. 성인을 대상으로 한 선행 연구에 따 르면 100 g/wk 이하의 알코올 섭취 집단에서 인슐린 저항 성 감소를 통해 혈중 glucose농도가 감소했으며, 130 g/wk 이상의 알코올 섭취 집단에서는 인슐린 저항성이 증가하여 혈중 glucose 농도가 증가했다고 보고되고 있다(Dixon et al., 2002). 본 연구에서 혈중 glucose농도가 유의하게 증가 하지 않은 것은 성장기 흰쥐에게서 4주간 3 g/day의 알코 올 섭취가 인슐린 저항성을 초래할 정도의 충분한 알코올 농도 및 섭취기간에는 부족한 것으로 판단된다. 한편, 혈청 TG농도는 CG군이 58.7±6.29 mg/dl, AG군이 71.3±13.45 mg/dl로 AG군의 TG농도가 유의하게 증가(p<0.01) 한 것 으로 나타났다. 이는 36% 농도로 4개월간 만성적으로 알 코올을 섭취한 흰쥐는 간장의 지방산 대사 기능 악화로 인 해 혈청 TG농도가 유의하게 증가한 선행연구와 일치하며 (Romero et al., 2014), 성인을 대상으로 한 선행 연구에서 혈중 TG 농도가 16% 이상일 때 관상동맥질환 발병 위험 이 증가하는 것으로 나타났다(Consortium & Collaboration, 2010). 이러한 결과는 만성 알코올 섭취로 인한 혈청 TG 농도의 증가가 심혈관 질환 발병 확률을 증가시키는 것을 의미한다. 한편 본 연구의 TC농도에서 CG군은 43.1±1.09 mg/dl, AG군은 44.5±1.40 mg/dl로 나타나 양군 사이에 유 의차가 없었다. 또한 HDLC 농도에서 CG군은 29.9±1.13 mg/dl, AG군은 33.5±0.80 mg/dl로 양 군 간에 유의한 차이 가 나타나지 않았다. 이러한 결과는 10-12주령의 마우스에 10일간 31.5%의 알코올 섭취 그룹에서 혈청 TC 및 HDLC 농도가 유의하게 증가하지 않은 결과(Gu et al., 2015)와 4 개월간 36%의 농도로 만성 알코올 섭취 그룹에서 혈청 TC농도에는 차이가 없었다(Romero et al., 2014)는 선행연 구와 일치하는 결과로서, 흰쥐에서 만성적인 알코올 섭취 가 혈청의 TC 및 HDLC와 같은 지단백질농도 변화에는 크게 영향을 미치지 않았음을 시사하였다. 본 연구의 혈액 성분 결과를 종합하여 볼 때, 성장기 흰쥐에서 3g/day의 농도로 4주간 섭취한 알코올은 혈청 TG 농도를 증가시켜 간장의 기능 이상 및 심혈관 질환의 위험에 노출될 가능성 이 있을 것으로 판단된다.
본 연구 결과 Akt (Fig. 1A)는 AG군에서 CG군에 비해 90.5±3.72% 수준으로 유의하게 감소(p<0.01)하였으며, p- Akt 단백질(Fig. 1B)은 AG군에서 72.3±4.32% 수준으로 유 의하게 감소(p<0.01)하였다. 그리고 p-Akt/Akt (Fig. 1C)은 AG군에서 73.0±3.00% 수준으로 유의하게 감소(p<0.01)하 였다. 조직 성장 관련 신호 인자로 알려진 Akt는 phosphatidylinositol 3-kinase (PI3K)의 downstream이며, Akt의 인산 화를 통해 조직 성장이 이루어 진다. Akt는 마우스의 배아 를 이용한 연구에서 골격근, 뼈 등 조직 성장에 중요한 역 할을 하며(Peng et al., 2003), Akt유전자변형마우스를 이용 한 골격근 비대 유도 연구에서 Akt의 인산화는 골격근 비 대에 중요한 인자로 밝혀졌다(Blaauw et al., 2010). 또한 Myocyte와 8-10주령 마우스 비복근에 IGF-1을 투여한 연 구에서 p-IGFR와 p-Akt 발현을 통해 근섬유 비대가 일어 나는 것으로 보고되어(Stitt et al., 2004) Akt가 골격근 성 장에 직접적인 연관성이 있음을 뒷받침하고 있다. 성체 흰 쥐를 대상으로 8주간 35.5%의 만성 알코올 섭취한 연구에 서 IGF-1과 IGF-1 receptor (IGF-1R)의 감소에 의해 Akt 및 p-Akt 발현이 억제되어 골격근 위축을 유발한다고 알려 진 선행연구(Nguyen et al., 2012)와 본 연구가 일치하는 결과를 나타냈다. 따라서, 본 연구의 성장기 흰쥐의 만성 알코올 섭취가 골격근의 Akt와 p-Akt 발현 감소를 통해 골 격근 성장 억제와 골격근 위축을 촉진한 것으로 판단된다.

본 연구 결과, FoxO 발현(Fig. 2A)은 AG군에서 CG군 에 비해 126.4±9.75% 수준으로 유의하게 증가(p<0.01)하 였으며, p-FoxO 발현(Fig. 2B)은 AG군에서 73.3±3.89% 수준으로 유의하게 감소(p<0.01)하였다. 그리고 AG군의 p- FoxO/FoxO (Fig. 2C)가 51.0±4.00% 수준으로 유의하게 감소(p<0.01)하였다.
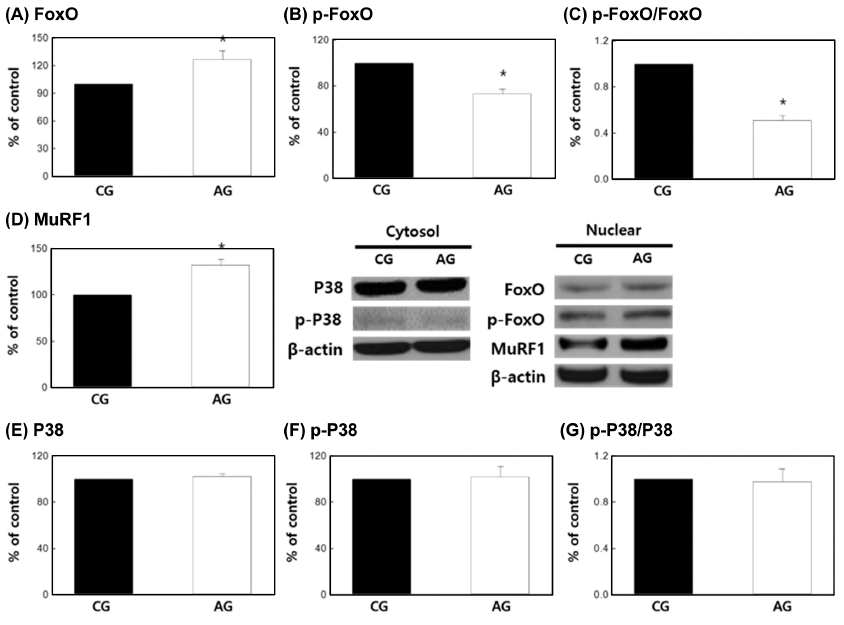
선행연구에서 myocyte인 C2C21 세포에 dexamethasone 으로 근육 위축을 유도하였을 때 FoxO와 atrogin-1 발현이 증가하며 myotube의 횡단면적이 감소된 결과를 나타내었 다(Sandri et al., 2004). 또한 myocyte와 8-10주령 마우스 비복근에 IGF-1을 투여한 연구에서 FoxO는 p-Akt 발현을 통해 억제되어 골격근 분해가 억제되는 것으로 보고(Stitt et al., 2004)되어 p-Akt와 FoxO의 연관성을 입증하였다. 따라서, 본 연구에서도 AG군에서 근육위축경향이 나타난 것은 AG군의 FoxO 발현 증가(Fig. 2A)와 p-FoxO 발현의 감소(Fig. 2B)에 의해 골격근 위축 현상이 나타났다고 판 단되었다.
한편, 본 연구 결과 MuRF1 (Fig. 2D)은 AG군에서 132.39 ±6.02% 수준으로 유의하게 증가(p<0.01)하였다. 선행연구 에서 C2C21 myotube와 마우스 골격근에 immobilization, denervation, hindlimb suspension 그리고 dexamethasone 처 리로 골격근 위축을 유발하였을 때, MuRF1과 MAFbx 발 현이 증가하여 골격근 분해를 유도한다고 알려졌으며 (Bodine et al., 2001), 흰쥐의 골격근에 75 mmol/kg의 알코 올을 24시간 투여하여 골격근 위축을 유도한 선행연구에서 MuRF1 발현이 증가(Vary et al., 2008)하여 본 연구와 일 치하는 결과를 나타내었다.
C2C21 myocyte와 8-10주령 마우스 골격근에 dexamethasone을 처리하여 골격근 위축을 유도한 연구에서 FoxO와 MuRF1 발현이 증가하여 유비퀴틴화를 통해 골격근 위축 이 유발된다고 알려졌다(Stitt et al., 2004). 따라서 본 연구 의 FoxO 발현 증가(Fig. 2A)는 MuRF1 발현 증가(Fig. 2D)를 뒷받침하며, 성장기 흰쥐의 만성 알코올 섭취는 골 격근의 FoxO와 MuRF1 발현이 증가되어 골격근 위축을 유발할 수 있음을 의미한다.
그리고 본 연구 결과 P38 발현(Fig. 2E)은 CG군에 비해 AG에서 102.4±1.80%, p-P38 발현(Fig. 2F)은 AG군에서 102.0±8.98% 그리고 p-P38/P38 (Fig. 2G)은 양 군 간에 유 의한 차이가 없었다. 선행연구에 의하면 P38 인산화는 B세 포에서 ROS의 스트레스 상황에서 발생하고, 세포사멸을 유도한다고 보고되고 있다(Park et al., 2014). 이러한 이화 작용은 8주령 마우스를 이용한 H2O2 투여로 ROS를 유발 한 연구에서 P38의 인산화의 증가와 P38의 downstream인 atrogin-1 발현에 의해 단백질 분해 신호전달 기전이 촉진 되는 것으로 알려졌다(Li et al., 2005). 그러나 본 연구 결 과, 알코올 섭취에 의한 P38의 활성화는 영향이 없는 것으 로 나타났다. 따라서 성장기 흰쥐의 만성 알코올 섭취에 의해 나타나는 골격근 위축 현상은 P38의 활성화보다는 p- Akt와 p-FoxO의 발현을 감소에 의한 골격근 성장이 억제 되고, FoxO 및 MuRF1 발현을 통해 근단백질 분해가 촉 진되어 골격근 위축이 유도되었음을 시사하였다.








