Article
서브마이크론 입자 형태 커큐민의 생체 흡수율 및 제품 조성에 따른 흡수율 동등성 연구
박희정*, TsukasaTakahashi1, HitomiOzawa1
Oral Bioavailability for Sub-micron Particle Curcumin (TheracurminCR-033P) and Absorption Rate by Product Composition in Healthy Human Volunteers
Hee Jung Park*, Takahashi Tsukasa1, Ozawa Hitomi1
Author Information & Copyright ▼
Department of Foods & Nutrition, Kookmin University
*Corresponding author: HeeJung Park, Food & Nutrition Dept. Kookmin University, 77 Jeongneung-ro, Seongbuk-gu, Seoul 02707, Korea +82-2-910-5490; +82-2-910-5249
heejp@kookmin.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Jun 28, 2017; Revised: Aug 17, 2017; Accepted: Aug 18, 2017
Abstract
Curcumin have various health-beneficial properties in numerous studies. However, its bioavailability is low due to its limited intestinal uptake and rapid metabolism. This study aimed to evaluate the pharmacokinetics of newly developed sub-micron particle curcumin with increased water dispersibility (Theracurmin® CR-033P). Plasma curcumin levels were measured at 0, 1, 2, 4, 8 h after Theracurmin® CR-033P intake using high-performance liquid chromatography. For analyzing pharmacokinetics of Theracurmin® CR-033P, eighteen healthy subjects were recruited and received Theracurmin® CR-033P at a single oral dose containing curcumin 30 mg. Cmax was 28.14 ng/ml, and the area under the curve for 8 h was estimated to be 104.36 ng/ml. Based on the area under the plasma concentration (AUC), the bioavailability of sub-micron particle curcumin was higher 22-, 35-, 28-fold than native curcumin in men, women, and all subjects, respectively. For comparing by formulation, seven healthy subjects were recruited and received two type of treatment: (1) existing dosage form 300 mg (contained curcumin 30 mg) × 3 capsule, (2) high dosage form 300 mg (contained curcumin 90 mg) × 1 capsule + placebo 300 mg × 2 capsule. In the cross-over study, there was no significant differences in Cmax and AUC of plasma curcumin. In conclusion, submicron particle curcumin with increased water dispersibility significantly improved its oral bioavailability and women absorbed curcumin more effectively than men. Different formulation of Theracurmin® CR-033P has shown equivalent to the reference in terms of pharmacokinetics.
Keywords: curcumin; absorption; bioavailability; sex differences
서 론
커큐민은 생강과에 속하는 curcuma longa (Zingiberaceae) 의 뿌리에서 추출되는 노란색 천연 폴리페놀 화합물이다 (Jemal et al., 2005). 주로 인도와 동남아시아에 분포되어 있으며, 전통적으로 식품, 색소물질 및 전통의약품으로 이 용되고 있다. 최근에는 커큐민의 유용성에 대한 연구가 많 이 진행되었으며, 혈액암(Golombick et al., 2012), 전립선 암(Ide et al., 2010), 당뇨(Chuengsamarn et al., 2012; Na et al., 2014), 심혈관계질환(Akazawa et al., 2012; Sukardi et al., 2016), 신경계질환, 퇴행성 류마티스염(Chandran & Goel, 2012), 알츠하이머(Baum et al., 2008; Masoumi et al., 2009) 등에 대한 생리활성기능이 보고되고 있다. 특히, mTOR 신호전달에 영향을 미치는 항암기전에 대한 연구 (Beevers et al., 2013)와 nuclear respiratory factor 2 (Nrf2) 발현을 증진시켜 당뇨환자들의 체외 알부민 배출을 억제 시킨다는 기전 연구(Soetikno et al., 2013; Yang et al., 2015)들이 보고되면서, 잠재적 의약품으로 활용가능성이 있 음을 시사하고 있다.
그러나, 커큐민 섭취 후, 혈액이나 소변 중 커큐민 혹은 curcumin glucuronide, curcumin sulfate, hexahydrocurcumin 등의 커큐민 대사체 등이 거의 나타나지 않았으며(Sharma et al., 2001), Ravindranath & Chandrasekhara (1980)의 연 구에서는 400 mg의 커큐민을 쥐에게 투여한 후에도 심장 혈관에서 커큐민이 검출되지 않은 것을 보고하였다. 더불 어, 세포 실험을 통한 흡수율 시험에서 커큐민의 흡수율이 0-20% 미만일 것으로 예측되었으며(Artursson & Karlsson, 1991), 3H 방사선 동위원소를 이용한 동물 실험에서도 체외로 90% 이상 배출되는 것으로 나타났다(Holder et al., 1978). Tritium-labeled 커큐민을 이용한 또 다른 연구 에서는 10 mg부터 400 mg의 다양한 투여량에도 동일한 혈중 농도를 보이는 것으로 보고하였다(Ravindranath & Chandrasekhara, 1981-1982). Kurita & Makino (2013)는 세 포 외 실험 및 동물실험 결과들을 리뷰한 논문에서 일반 커큐민의 흡수율이 매우 낮은 것으로 판단되며, 생체 이용 률을 증진시키기 위한 다양한 방법이 모색되어야 한다고 언 급하였다.
현재, 커큐민의 생체 흡수율을 높이기 위한 다양한 방법 이 시행되고 있다. 인지질, 사이클로덱스트린 및 크리스탈 을 이용하여 고체형으로써 흡수율을 높인 형태가 있으며 (Gupta & Dixit, 2011; Wan et al., 2012), 커큐민을 서브 입자화(200-600 nm) 한 후 고압 균질화시킨 형태도 보고되 었다(Shaikh et al., 2009). 액상형태의 리포좀을 이용하여 커큐민의 흡수율을 증진시킨 연구도 보고되었으며, 동물모 델에서 일반형의 커큐민보다 리포좀 형태의 커큐민이 5배 이상 흡수율이 증가되는 것으로 나타났다(Takahashi et al., 2009). Yan et al. (2011)은 제약에 있어 소수성의 약물을 용해시켜 경구 복용에 적합하도록 고안된 약물 전달 도구 인 self-emulsifying drug delivery systems (SEDDS)를 사 용할 경우 커큐민의 흡수율이 7.6배 이상 증가됨을 보고하 였다. 또 다른 커큐민의 형태인 마이셀 형태의 커큐민은 일반 형태의 커큐민에 혈중 커큐민 농도가 30배 이상 증 가하는 것으로 보고되었다(Pawar et al., 2012). 이상의 연 구에서와 같이, 커큐민의 흡수율을 증진시키기 위한 여러 형태들이 다양하게 보고되고 있으며, 커큐민 형태에 따른 흡수율은 다양한 범위로 나타나고 있다.
THERACURMIN (Theravalues, Tokyo, Japan)은 커큐민의 서브마이크론 입자 형태로 일반 커큐민 형태보다 장내 흡수 율을 약 27배 정도 개선시킨 소재이다. Sasaki et al. (2011) 에 의해 동물시험과 인체시험을 통해 장내 흡수율을 개선시 키는 것으로 보고되었으며, 액상 형태의 THERACURMIN 을 임상시험을 통해 7일 동안 보충시켰을 때, 커큐민 추출물 의 형태 보다 흡수율이 유의적으로 높게 나타났다(Morimoto et al., 2013). 이중맹검법으로 교차시험을 진행한 임상시험 에서도 3주간 서로 다른 형태(THERACURMIN 형태, 오 일결합형태, 인지질결합형태)의 커큐민을 보충하였을 때, THERACURMIN 형태의 혈중 커큐민 농도(AUC) 및 Cmax 값이 다른 2가지 형태에 비해 유의적으로 높은 것으로 보 고되었다.
흡수율이 증진된 THERACURMIN 제형의 경우, 생리 기 능성에 대한 연구도 일부 진행되었다. 알코올 섭취 시 혈 중 아세트알데히드를 감소시켜 숙취 해소에 도움이 되는 것으로 보고되었으며(Sasaki et al., 2011), THERACURMIN 의 형태로 항산화 효과를 살펴본 연구(Nazari et al., 2013) 에서는 일반 커큐민의 형태보다 세포내 항산화효소인 글 루타치온의 수준이 높고, DPPH 라디컬 소거능이 더 높으 며, 철분 흡착력이 높은 것으로 보고되었다. 하루 커큐민 300 mg에 해당하는 THERACURMIN 섭취 시 과도한 운 동으로 인한 근육 손상을 일부 약화시키는 임상 결과가 보 고되었으며(Tanabe et al., 2015), 하루 커큐민으로 180 mg 에 해당하는 THERACURMIN을 섭취시 관절염에도 효과 가 있는 것으로 나타났다(Nakagawa et al., 2014).
본 연구에서는 상업적인 효율성이 높이기 위해 THERACURMIN을 분말화시킨 Theracurmin® CR-033P (커큐민 30%) 함유 원료 형태에 대한 체내 흡수율을 살펴보고, 성 별에 따른 흡수율의 차이를 살펴보고자 하였다. 또한 섭취 편의성을 증진시키고자 개발한 고함량 제형의 흡수율과 동 등성 비교 연구를 진행하고자 하였다.
재료 및 방법
시험 원료
시험 원료인 Theracurmin® CR-033P는 Theravalues사 (Tokyo, Japan)에서 제공받았다. Theracurmin CR-033P는 커 큐민 함유량이 30 mg/100 mg이며, gum Ghatii, 말토오즈, 구연산, 덱스트린을 혼합하여 제조하였다. 즉, 커큐민의 원 재료를 그라인더로 갈고, 헥산과 아세톤으로 추출한 후, 필 터링 및 농축과정을 거치고, 건조과정 후 turmeric oleoresin curcumin을 획득하였다. Gum ghatti, 말토오즈, 구연산, 덱 스트린을 물에 용해시키고, 1차적으로 획득한 Turmeric oleoresin curcumin을 첨가하여 혼합하고, 고압 균질기로 균질화하였다. 혼합물을 필터링을 거친 후 분무 건조기를 통해 건조시키고, 최종 분말 제품화하였다. 분말 제품은 10% 커큐민이 함유된 캡슐 형태로 제작하였다. 대조군 원 료인 일반 커큐민 분말은식품첨가물 형태로 사용하였다 (Curcumin No.3705, San-Ei Gen F.F.I., Inc., Osaka, Japan). Theracurmin® CR-031P(커큐민 10% 함유 원료) 제형과 고함 량 제형 (30% 커큐민 함유 원료, Theracurmin® CR-033P) 의 동등성 비교를 위한 시료는 Theracurmin® CR-031P 3 캡슐과 동일한 커큐민 양의 Theracurmin® CR-033P(커큐 민으로 90 mg) 1 캡슐을 이용하여 비교 분석하였다.
대상자 선정 및 시험 절차
대상자는 본 연구의 목적을 이해하고 자발적으로 참여의 사를 나타내는 피험자를 대상으로 하였다. 연구에 참여하기 로 동의한 대상자 중 약제 알레르기, 식품 알레르기의 전 력이 있거나, 약물 치료 중인 자, 간 기능 검사수치에 이상 이 있는 자, 알코올 다량 음주자, 임신, 수유 중인 대상자 는 제외하였다. 사전검진 후부터 본 시험 종료까지 울금 함유식품, 카레 섭취를 중단할 수 있는 자로 선정하였다.
사전 검사 시, 기본 문진, 신체계측, 수축기혈압, 이완기 혈압, 맥박수 등을 측정하고, 혈액학적 검사로 총 단백, 혈 중 알부민, 빌리루빈, AST, ALT, LDH, γ-GTP, CK, 총 콜 레스테롤, 중성지질, HDL-콜레스테롤, LDL-콜레스테롤, UA, BUN, 크레아틴, 공복 시 혈당, HbA1c, 백혈구 수, 적혈구 수, 혈소판 수, 헤모글로빈 농도를 측정한 후 이상 소견이 있을 시 대상자에서 제외하였다.
서브마이크론 입자 커큐민 분말의 혈중 동태시험을 위한 연구는 무작위 이중맹검법 연구 디자인으로 수행하였으며, 인체시험 프로토콜은 Akihabara Medical Clinic (Tokyo, Japan)의 IRB 승인(1502903)을 득하였다. 연구대상자는 일 본에 거주하는 25세 이상 49세 미만의 건강한 남녀를 대 상 18명(위약군 9명, 시험군 9명)으로 하였다. 시험물질은 일반 커큐민 분말 30 mg과 Theracurmin® CR-033P 로 하 였다. 제공 제형은 캡슐 형태였으며, 시험 전날은 21시 이 후부터 시험 당일 시행하는 사전 검사 종료 시까지 기관에 서 지급하는 음식물 이외에는 단식하고, 물 이외의 음료수 를 금지하였다. 시험은 2015년 2월-2015년 3월 중 실시하 였다. 시험당일 시험식품 섭취 전, 식사 섭취 60분 후에 시험식품을 물 150 mL과 함께 섭취한다. 시험 식품 섭취 1시간 후, 2시간 후, 4시간 후, 8시간 후 헤파린 튜브를 사 용하여 5 mL씩 채혈하였다. 채혈 후 원심분리하며, 분리 된 혈장은 -80°C에서 동결하였다.
동등성 비교를 위한 임상실험은 이중 맹검 교차 연구 디 자인으로 수행하였다. 연구대상자는 일본에 거주하는 18세 이상 60세 미만의 건강한 남녀(n=7)를 대상으로 하였으며, 인체시험 프로토콜은 Akihabara Medical Clinic (Tokyo, Japan)의 IRB 승인(倫 10-05-09)을 득하였다. 제형에 따른 비교 실험을 위해 두 가지 복용 방법을 제공하였으며, 한 가지는 일본 내 시판 중인 제품 300 mg (Theracurmin® CR-031P) 제형을 3개의 캡슐로 제공하였으며, 다른 한 가 지는 고함유 제형 300 mg (Theracurmin® CR-033P) 1 캡 슐과 위약 제제 2 캡슐로 제공하였다. 대상식품의 섭취 휴 지기간은 3일로 두었으며, 시험은 2013년 6월 중 실시하였 다. 시험 전날은 21시 이후부터 시험 당일 시행하는 사전 검사 종료 시까지 기관에서 지급하는 음식물 이외에는 단 식하고, 물 이외의 음료수를 금지하였다. 시험당일 시험식 품 전, 식사 섭취 60분 후에 시험식품을 물 150 mL과 함 께 섭취한다. 채혈은 시험 식품 섭취 1시간 후, 2시간 후, 4시간 후, 실시하고, 분리 된 혈장은 -80°C에서 동결하였다.
커큐민 농도 분석
혈장은 1000U-glucuronidase (Wako Pure Chemical Industries Ltd., Osaka, Japan)가 함유된 0.1M sodium acetate buffer (pH 5.0)를 이용하여 37℃에서 1시간 동안 인큐베이 션하였다. 클로로포름 추출 후 추출물을 건조시키고, 50% 메탄올을 첨가하였다. 혈중 커큐민 농도는 HPLC-MS/MS 를 이용하여 분석하였으며 HPLC는 Prominence micro-LC system (Prominence HPLC system, Shimadze Corp., Kyoto, Japan)과 ESI-MS/MS system (API 3200 tandem mass spectrometer configured with ESI, AB SCIEX, Foster, CA, USA)을 이용하였다.
약동학 분석
약동학 분석을 위해서 시험 섭취시각을 기준으로 검체를 채취한 시점까지 경과한 시각과 해당 시점의 커큐민 농도 를 이용하였다. 최고농도도달시간과 최고농도는 관찰값을 그대로 제시하였고, 농도시간 곡선아래면적(AUC)을 산출 하기 위하여 사다리꼴계산법(linear trapezoid rule)으로 계 산하였다.
통계분석
모든 실험결과는 Statistical Analysis Systems package version 9.2 (SAS Institute, Cary, NY, USA)를 이용하여 분석하였다. 군간 분석 항목별 차이는 Student t-test 또는 mann-whitney test를 이용하여 분석하였고, 동등성 비교를 위한 교차분석은 paired t-test를 이용하여 분석하였다. 유의 성은 p<0.05 수준에서 검증하였다.
결과 및 고찰
대상자 일반 사항
서브마이크론 입자 형태의 커큐민에 대한 혈중 동태 시 험 참여 대상자는 본 연구에 최종 18명이 등록되었으며, 남 여 각각 9명이었다. 평균 연령은 41세였고, 체중 및 신 장은 각각 60.5 kg과 165.0 cm 이었다. BMI 평균 22.1 kg/ m2이었다(Table 1). 일반사항 및 기본 혈액학적 지표에 있 어서는 대조군과 실험군에서의 유의적인 차이는 없었다. 시험기간 동안 부작용 사례는 나타나지 않았다.
Table 1.
General characteristics of the subjects
|
|
Control (n=9) |
Theracurmin CR-033P (n=9) |
Total (n=18) |
p-value*2) |
| Age (yr) |
41.0±2.51) |
40.9±2.1 |
40.94±1.61 |
0.9736 |
| Height (cm) |
164.4±2.0 |
165.7±3.5 |
165.03±1.95 |
0.7391 |
| Weight (kg) |
60.1±3.1 |
60.9±2.8 |
60.54±2.04 |
0.8513 |
| BMI (kg/m2) |
22.2±1.0 |
22.1±0.6 |
22.17±0.54 |
0.9441 |
| SPB (mmHg) |
118.0±5.1 |
119.4±3.8 |
118.72±3.11 |
0.8242 |
| DPB (mmHg) |
76.3±4.8 |
75.3±3.7 |
75.83±2.94 |
0.8709 |
| Bpm |
72.9±1.2 |
75.8±4.8 |
74.33±2.40 |
0.5697 |
| Total cholesterol (mg/dL) |
193.6±13.6 |
223.3±12.6 |
208.44±9.70 |
0.1283 |
| LDL-cholesterol (mg/dL) |
113.2±10.7 |
140.7±11.4 |
126.94±8.27 |
0.0976 |
| HDL-cholesterol (mg/dL) |
67.2±4.7 |
59.7±3.5 |
63.44±2.97 |
0.2121 |
| Triglycride (mg/dL) |
72.9±8.7 |
117.3±24.1 |
95.11±13.54 |
0.1019 |
Download Excel Table
동등성 평가 시험에 참여한 대상자는 총 7명이며, 남녀 각각 4명, 3명이다. 평균 연령은 25.0세 이었고, 체중 및 신 장은 각각 61.3 kg, 170.0 cm 이었다. BMI 평균은 21.1 kg/ m2 이었다. 시험 기간 동안 부작용 사례는 나타나지 않았다.
혈중 동태 시험
혈중 커큐민에 대한 대표적 분석 크로마토그램은 Fig 1. 에 제시하였다.
Fig. 1.
Representative examples of HPLC chromatograms.
(A) Curcumin was identified in plasma after oral intake of Theracurmin® CR- 033P, (B) Mepronil: internal standard.
Download Original Figure
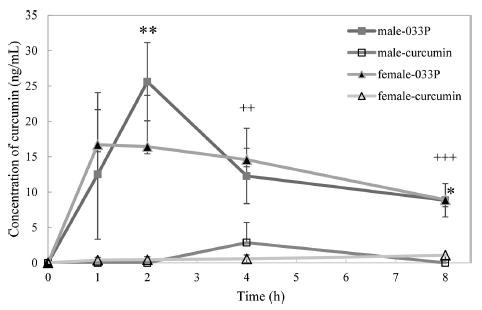
시험 식품 섭취 후 혈중 커큐민 농도를 측정한 결과는 Fig. 2에 제시하였다. Theracurmin® CR-033P 섭취군에서는 시료섭취 섭취 후 1시간 후, 2시간 후, 4시간 후 및 8시간 후 남자 대상자에서는 각각 12.5, 25.6, 12.3, 8.8 ng/mL로 측정되었으며, 일반 커큐민 분말 섭취시는 섭취 후 혈중 커큐민 농도가 0-3.5 ng/mL로 나타났다. 섭취 2시간 후 (p<0.01), 4시간 후(p<0.05) 측정값이 Theracurmin® CR 033P 섭취군에서 유의적으로 높았다. 여성대상자에서는 Theracurmin® CR-033P 섭취군에서 각 측정 시간별로 각 각 16.7, 16.4, 14.6, 8.9 ng/mL로 측정되었다. 일반 커큐민 분말 섭취시는 섭취 후 혈중 커큐민 농도가 0-2.8 ng/mL로 나타나, 섭취 4시간 후(p<0.01) 및 8시간 후(p<0.001) 측정 값이 Theracurmin® CR-033P 섭취군에서 유의적으로 높았 다(p<0.05, p<0.001).
Fig. 2.
Change in the plasma concentration of curcumin in healthy subjects.
Each point and bar represents the mean±SE (male: *p<0.05, **p<0.01; female: ++p<0.01, +++p<0.001).
Download Original Figure
커큐민 단회 투여 후 혈중 동태 시험 인자들은 Table 2 에 제시하였다. Theracurmin® CR-033P 섭취군에서는 Cmax 값이 남녀 각 31.39 및 24.07 ng/mL이었으며, AUC 값으 로 비교할 경우 AUC0-1h, AUC0-4h, AUC0-8h에서 Theracurmin® CR-033P 섭취군이 대조군에 비해 유의적인 높은 흡수율을 나타내었다(*p<0.05, **p<0.01, ***p<0.001). 특히, Theracurmin® CR-033P 섭취군에서는 섭취 4시간 후 AUC 값이 남녀 각각 63.20와 55.95 ng/mL이었으며, 일반 커큐민 분말 섭취군에서는 각각 2.86과 1.59 ng/mL로 측정되어, 섭취 4시간 후 AUC 값 비교 시 일반 커큐민 분말보다 Theracurmin® CR-033P 섭취군에서 남자는 22배, 여자는 35배 더 높은 것으로 나타났다. 중재 시험 중 부작 용 사례는 보고되지 않았다.
Table 2.
Pharmacokinetic parameters of curcumin in the plasma
|
|
Cmax (ng/mL) |
AUC0-1h (ng/mL) |
AUC0-4h (ng/mL) |
AUC0-8h (ng/mL) |
R.A.2) |
| Curcumin |
| Male |
2.86±5.711) |
0.00±0.00 |
2.86±5.71 |
8.58±17.15 |
|
| Female |
1.06±1.48 |
0.19±0.42 |
1.59±3.56 |
4.84±8.61 |
|
| Total |
1.86±3.77 |
0.11±0.31 |
2.16±4.36 |
6.50±12.30 |
|
| Theracurmin® CR-033P |
| Male |
31.39±13.21** |
6.25±10.24 |
63.20±28.09** |
105.47±35.59** |
22.1 |
| Female |
24.07±9.32*** |
8.35±7.36* |
55.95±32.15** |
102.97±25.94*** |
35.2 |
| Total |
28.14±11.60*** |
7.18±8.60* |
59.98±28.23*** |
104.36±29.79*** |
27.8 |
Download Excel Table
장내는 수용성이기 때문에 지용성인 커큐민의 흡수율은 매우 저조하고, 커큐민 분말 자체의 흡수율 저해는 바이오 식의약 소재로의 활용에 장애물로 작용하고 있다. 실제로 건강한 대상자에게 하루 2 g의 커큐민을 섭취하였을 때 혈 중 커큐민 농도가 6 ng/mL 정도로 측정되었으며(Shoba et al., 1998), 3.6 g의 커큐민을 보충한 또 다른 연구에서도 혈중 커큐민 농도가 미량으로 검출되었다(Garcea et al., 2005). 커큐민의 장내 흡수율을 증가시키기 위해서 리포좀 형태로 변형시키거나, 입자를 분산기술을 이용한 방법이 주 로 이용되고 있다(Anand et al., 2007). 동물 모델을 이용한 커큐민의 흡수율에 대한 연구에서는 self-nanoemulsifying drug delivery system (SNEDDS)을 이용한 커큐민의 Cmax 값이 3.95배 증가하고, 커큐민의 흡수율은 물에 녹인 커큐 민의 형태에 비교해 194.2%의 흡수가 증가되었음을 보고 하였다(Nazari-Vanani et al., 2017). 임상연구에서는 콜로이 드 미세입자로 변형시킨 커큐민의 경우 5배 이상 흡수율이 높아진다는 보고가 있으며(Sunagawa et al., 2015), Li et al. (2012) 등은 리포좀 형태의 커큐민을 건강한 남녀를 대 상으로 보충했을 경우 2.35배 정도 흡수율이 증진됨을 보 고하였다.
성별에 따른 커큐민 체내 흡수율에 대해서는 Schiborr et al. (2014)에 의해 보고되었다. Schiborr et al. (2014)은 커 큐민의 미세 입자 가루 제형과 마이셀 형태의 액상 제형이 성별로 흡수율이 다르게 나타남을 보고하였으며, 여성에서 흡수율에 대한 효과가 더 높은 것으로 보고하였다. 성별의 차이는 남성의 경우 커큐민 biotransformation에 영향을 미 치게 되는 효소인 glucuronosyltrasferases와 sulfotrasferase 의 활성이 여성보다 높고, 간 내 drug efflux transporter Pglycoprotein (MDR1) 의 유전자 발현이 높기 때문인 것으 로 예측되고 있다(Meibohm et al., 2002).
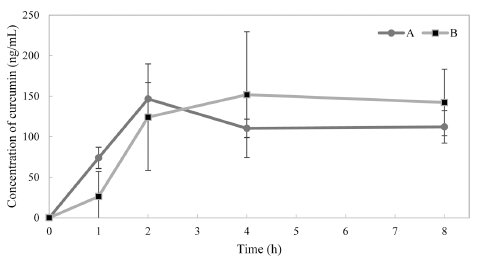
제형의 효율성을 높인 커큐민 고함량 제형인 Theracurmin® CR-033P 300 mg (커큐민 90mg 함유 제품)과 Theracurmin® CR-031P 제제 300 mg (커큐민 30 mg 함유 제품) × 3 캡 슐의 동등성 비교 결과는 Fig. 3에 제시하였다. 혈중 커큐 민 농도는 고함량 제형 섭취 후 1시간 후, 2시간 후, 4시 간 후 및 8시간 후가 각각 73.9, 146.5, 110.2, 112.0 ng/ mL로 측정되었으며, 기존 제형 섭취 후에는 각각 26.1, 124.1, 151.7, 142.1 ng/mL로 측정되어 두 군간의 유의적인 차이는 나타나지 않았다.
Fig. 3.
Change in the plasma concentration of curcumin in healthy subjects.
Each point and bar represents the mean±SE. A: Theracurmin® CR-031P (curcumin 30 mg × 3), B: Theracurmin® CR-033P (curcumin 90 mg).
Download Original Figure
커큐민 제형에 따른 동등성 비교 실험의 혈중 동태 시험 인자들은 Table 3에 제시하였다. 고함량 제형 Theracurmin® CR-033P와 기존 제형 (Theracurmin® CR-031P) × 3 capsule 의 동등성 비교 연구 결과, 고함량 제형과 기존 제형 흡수 율은 Cmax 값이 각각 166.0과 177.7로 통계적 유의성이 나 타나지 않았다. 단회 투여 후 8시간 동안의 AUC 값 역시 약 952와 약 849로 나타나 제제의 동등성에서 유의적인 차이는 없었다. 혈중 커큐민 농도, AUC 및 Cmax의 값에 유의적인 차이가 없으므로 두 가지의 흡수율이 거의 동등 하다고 할 수 있다.
Table 3.
Pharmacokinetic parameters of curcumin in the plasma
|
|
Theracurmin® CR-031P (curcumin 30 mg × 3) |
Theracurmin® CR-033P (curcumin 90 mg) |
| AUC0-1h (ng/mL) |
36.96±17.35 |
13.09±15.43 |
| AUC1-2h (ng/mL) |
110.22±30.70 |
75.13±36.51 |
| AUC2-4h (ng/mL) |
256.78±80.41 |
275.81±129.68 |
| AUC4-8h (ng/mL) |
444.57±126.70 |
587.78±196.68 |
| AUC0-8h (ng/mL) |
848.52±206.02 |
951.81±321.81 |
| Cmax (ng/mL) |
166.00±44.15 |
177.72±62.28 |
Download Excel Table
결론적으로, 본 연구에서는 일반 커큐민 보다 서브마이 크론 입자 형태의 커큐민의 체내 흡수율이 남녀 평균 약 28배 증진되는 것으로 확인되었으며, 편의성을 증진시킨 농축제제와 일반 제제의 흡수율이 거의 동일하게 나타났 다. 커큐민 10%를 함유한 THERACURMIN의 액상형에서 의 생리 기능은 항산화 및 숙취해소 등에서 연구가 보고된 바 있으나, Theracurmin® CR-033P 분말의 생리적 기능성 에 대한 연구는 추가적으로 필요할 것으로 사료된다.
요 약
커큐민 분말은 항산화 및 항염증 등의 생리활성을 내세 우며, 건강기능식품 및 일반식품의 마케팅 포인트로 광범 위하게 사용되고 있다. 커큐민의 낮은 체내 흡수율은 생리 적 기능성에도 영향을 미칠것으로 사료되어 리포좀 형태나 인지질 결합 형태로 커큐민의 제형 개발이 활발이 진행되 고 있다. 본 연구에서는 커큐민의 체내 흡수율을 높이고, 실제 산업에의 활용도를 높이기 위해 커큐민을 서브마이크 론 입자 형태의 제형으로 개발하여, 일반 커큐민 형태와의 흡수율을 비교해보고자 하였다. 본 연구 결과, 일반 커큐 민 보다 서브마이크론 입자 형태 커큐민의 체내 흡수율이 남녀 평균 28배 더 높게 나타났다.
서브마이크론 입자 형태 커큐민의 체내 흡수율은 성별에 따라 다르게 나타났으며, 남성의 경우는 22배, 여성의 경 우는 35배 흡수율이 높게 나타났다.
편의성을 증진시킨 농축제제와 기존 제제의 흡수율은 Cmax 값이 각각 166.0과 177.7로 통계적 유의성이 나타나 지 않았다.
단회 투여 후 8시간 동안의 AUC 값 역시 약 952와 약 849로 나타나 제제의 동등성에서 유의적인 차이는 없었다.
결론적으로, 본 연구를 통해 일반 커큐민 보다 서브마이 크론 입자 형태 커큐민의 체내 흡수율이 남녀 평균 약 28 배 증진되는 것으로 확인되었으며, 편의성을 증진시킨 농 축제제와 일반 제제의 흡수율이 거의 동일하게 나타났다.
감사의 글
본 연구는 (주)한독의 지원을 받아 수행된 연구사업에 의해 이루어진 것임.
References
Akazawa N, Choi Y, Miyaki A, Tanabe Y, Sugawara J, Ajisaka R, Maeda S. Curcumin ingestion and exercise training improve vascular endothelial function in postmenopausal women. Nutr. Res. 2012; 32:795-799.

Anand P, Kunnumakkara AB, Newman RA, Aggarwal BB. Bioavailability of curcumin problems and promises. Mol. Pharm. 2007; 4:807-818.

Artursson P, Karlsson J. Correlation between oral drug absorption in humans and apparent drug permeability coefficientsin human intestinal epithelial (Caco-2):cells. Biochem. Biophys. Res. Commun. 1991; 175:880-885.

Baum L, Lam CW, Cheung SK, Kwok T, Lui V, Tsoh J, Lam L, Leung V, Hui E, Ng C, Woo J, Chiu HF, Goggins WB, Zee BC, Cheng KF, Fong CY, Wong A, Mok H, Chow MS, Ho PC, Ip SP, Ho CS, Yu XW, Lai CY, Chan MH, Szeto S, Chan IH, Mok V. Six-month randomized, placebo-controlled, double- blind, pilot clinical trial of curcumin in patients with Alzheimer disease. J. Clin. Psychopharmacol. 2008; 28:110-113.

Beevers CS, Zhou H, Huang S. Hitting the golden TORget curcumin's effects on mTOR signaling. Anti-cancer Agent Me. 2013; 13:988-994.

Chandran B, Goel A. A randomized, pilot study to assess the efficacy and safety of curcumin in patients with active rheumatoid arthritis. Phytother. Res. 2012; 26:1719-1725.

Chuengsamarn S, Rattanamongkolgul S, Luechapudiporn R, Phisalaphong C, Jirawatnotai S. Curcumin extract for prevention of type 2 diabetes. Diabetes Care. 2012; 35:2121-2127.

Garcea G, Berry DP, Jones DJ, Singh R, Dennison AR, Farmer PB, Sharma RA, Steward WP, Gescher AJ. Consumption of the putative chemopreventive agent curcumin by cancer patients assessment of curcumin levels in the colorectum and their pharmacodynamicconsequences. Cancer Epidem. Biomar. Prev. 2005; 14:120-125.

Golombick T, Diamond TH, Manoharan A, Ramakrishna R. Monoclonal gammopathy of undetermined significance, smoldering multiple myeloma, and curcumin a randomized, doubleblind placebo-controlled cross-over 4g study and an open-label 8g extension study. Am. J. Hematol. 2012; 87:455-460.

Gupta NK, Dixit VK. Bioavailability enhancement of curcumin by complexation with phosphatidyl choline. J. Pharm.Sci. 2011; 100:1987-1995.

Holder GM, Plummer JL, Ryan AJ. The metabolism and excretion of curcumin (1,7-bis-(4-hydroxy-3-methoxyphenyl)- 1,6-heptadiene-3,5-dione) in the rat. Xenobiotica. 1978; 8:761-768.

Ide H, Tokiwa S, Sakamaki K, Nishio K, Isotani S, Muto S, Hama T, Masuda H, Horie S. Combined inhibitory effects of soy isoflavones and curcumin on the production of prostatespecific antigen. Prostate. 2010; 70:1127-1133.

Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer. J. Clin. 2005; 55:10-30.

Kurita T, Makino Y. Novel curcumin oral delivery systems. Anticancer Res. 2013; 33:2807-2821.

Li C, Zhang Y, Su T, Feng L, Long Y, Chen Z. Silicacoated flexible liposomes as a nanohybrid delivery system for enhanced oral bioavailability of curcumin. Int. J. Nanomedi. 2012; 7:5995-6002.

Masoumi A, Goldenson B, Ghirmai S, Avagyan H, Zaghi J, Abel K, Zheng X, Espinosa-Jeffrey A, Mahanian M, Liu PT, Hewison M, Mizwickie M, Cashman J, Fiala M. 1 alpha, 25-dihydroxyvitamin D3 interacts with curcuminoids to stimulate amyloid- beta clearance by macrophages of Alzheimer's disease patients. J. Alzheimers Dis. 2009; 17:703-717.

Meibohm B, Beierle I, Derendorf H. How important are gender differences in pharmacokinetics?. Clin. Pharmacokinet. 2002; 41:329-342.

Morimoto T, Sunagawa Y, Katanasaka Y, Hirano S, Namiki M, Watanabe Y, Suzuki H, Doi O, Suzuki K, Yamauchi M, Yokoji T, Miyoshi-Morimoto E, Otsuka Y, Hamada T, Imaizumi A, Nonaka Y, Fuwa T, Teramoto T, Kakeya H, Wada H, Hasegawa K. Drinkable preparation of Theracurmin exhibits high absorption efficiency-a single-dose, double-blind, 4-way crossover study. Biol. Pharm. Bull. 2013; 36:1708-1714.

Na LX, Yan BL, Jiang S, Cui HL, Li Y, Sun CH. Curcuminoids target decresing serum adipocyte-fatty acid binding protein levels in their glucose-lowering effect in patients with type 2 diabetes. Biomed. Environ. Sci. 2014; 27:902-906.

Nakagawa Y, Mukai S, Yamada S, Matsuoka M, Tarumi E, Hashimoto T, Tamura C, Imaizumi A, Nishihira J, Nakamura T. Short-term effects of highly-bioavailable curcumin for treating knee osteoarthritis a randomized, double-blind, placebocontrolledprospective study. J. Orthop. Sci. 2014; 19:933-939.

Nazari QA, Kume T, Izuo N, Takada-Takatori Y, Imaizumi A, Hashimoto T, Izumi Y, Akaike A. Neuroprotective effects of curcumin and highly bioavailable curcumin on oxidative stress induced by sodium nitroprusside in rat striatal cell culture. Biol. Pharm. Bull. 2013; 36:1356-1362.

Nazari-Vanani R, Moezi L, Heli H. In vivo evaluation of a self-nanoemulsifying drug delivery system for curcumin. Biomed.Pharmacother. 2017; 88:715-720.

Pawar YB, Purohit H, Valicherla GR, Munjal B, Lale SV, Patel SB, Bansal AK. Novel lipid based oral formulation ofcurcumin development and optimization by design of experiments approach. Int. J. Pharm. 2012; 436:617-623.

Ravindranath V, Chandrasekhara N. Absorption and tissue distribution of curcumin in rats. Toxicology. 1980; 16:259-265.

Ravindranath V, Chandrasekhara N. Metabolism of curcumin--studies with (3H) curcumin. Toxicology 1981-. 1982; 22:337-344.

Sasaki H, Sunagawa Y, Takahashi K, Imaizumi A, Fukuda H, Hashimoto T, Wada H, Katanasaka Y, Kakeya H, Fujita M, Hasegawa K, Morimoto T. Innovative preparation of curcuminfor improved oral bioavailability. Biol. Pharm. Bull. 2011; 34:660-665.

Schiborr C, Kocher A, Behnam D, Jandasek J, Toelstede S, Frank J. The oral bioavailability of curcumin from micronizedpowder and liquid micelles is significantly increased in healthy humans and differs between sexes. Mol. Nutr. Food Res. 2014; 58:516-527.

Shaikh J, Ankola DD, Beniwal V, Singh D, Kumar MN. Nanoparticle encapsulation improves oral bioavailability of curcuminby at least 9-fold when compared to curcumin administered with piperine as absorption enhancer. Eur. J. Pharm. Sci. 2009; 37:223-230.

Sharma RA, McLelland HR, Hill KA, Ireson CR, Euden SA, Manson MM, Pirmohamed M, Marnett LJ, Gescher AJ, Steward WP. Pharmacodynamic and pharmacokinetic study of oral Curcuma extract in patients with colorectal cancer. Clin. Cancer Res. 2001; 7:1894-1900,.

Shoba G, Joy D, Joseph T, Majeed M, Rajendran R, Srinivas PS. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta Med. 1998; 64:353-356.

Soetikno V, Suzuki K, Veeraveedu PT, Arumugam S, Lakshmanan AP, Sone H, Watanabe K. Molecular understanding of curcumin in diabetic nephropathy. Drug Discov. Today. 2013; 18:756-763.

Sukardi R, Sastroasmoro S, Siregar NC, Djer MM, Suyatna FD, Sadikin M, Ibrahim N, Rahayuningsih SE, Witarto AB. The role of curcumin as an inhibitor of oxidative stress caused by ischaemia re-perfusion injury in tetralogy of Fallot patients undergoing corrective surgery. Cardiol. Young. 2016; 26:431-418.

Sunagawa Y, Hirano S, Katanasaka Y, Miyazaki Y, Funamoto M, Okamura N, Hojo Y, Suzuki H, Doi O, Yokoji T, Morimoto E, akashi T, Ozawa H, Imaizumi A, Ueno M, Kakeya H, Shimatsu A, Wada H, Hasegawa K, Morimoto T. Colloidal submicron-particle curcumin exhibits high absorption efficiency double-blind, 3-way crossover study. J. Nutr. Sci. Vitaminol(Tokyo). 2015; 1:37-44.

Takahashi M, Uechi S, Takara K, Asikin Y, Wada K. Evaluation of an oral carrier system in rats bioavailability and antioxidant properties of liposome-encapsulated curcumin. J. Agric.Food Chem. 2009; 57:9141-9146.

Tanabe Y, Maeda S, Akazawa N, Zempo-Miyaki A, Choi Y, Ra SG, Imaizumi A, Otsuka Y, Nosaka K. Attenuation of indirect markers of eccentric exercise-induced muscle damageby curcumin. Eur. J. Appl. Physiol. 2015; 115:1949-1957.

Wan S, Sun Y, Qi X, Tan F. Improved bioavailability of poorly water-soluble drug curcumin in cellulose acetate solid dispersion. AAPS PharmSciTech. 2012; 13:159-166.

Yan YD, Kim JA, Kwak MK, Yoo BK, Yong CS, Choi HG. Enhanced oral bioavailability of curcumin via a solid lipid-based self-emulsifying drug delivery system using a spraydrying technique. Biol. Pharm. Bull. 2011; 34:1179-1186.

Yang H, Xu W, Zhou Z, Liu J, Li X, Chen L, Weng J, Yu Z. Curcumin attenuates urinary excretion of albumin in type II diabetic patients with enhancing nuclear factor erythroidderived 2-like 2 (Nrf2):system and repressing inflammatory signalingefficacies. Exp. Clin. Endocrinol. Diabetes. 2015; 123:360-367.