서 론
인체의 건강을 지키기 위한 가장 기본적인 3대 영양소는 탄수화물, 단백질, 지방이다. 그 중 주요 에너지원으로 사 용되고 있는 탄수화물은 식물의 광합성을 통해 생산되며 주로 곡류, 과실, 채소 등의 농산물로부터 얻게 된다. 신선 한 과일, 채소류 등에 함유된 당류는 농산물의 맛과 향에 영향을 끼치며 식물의 생육과 성숙과정에 따라 그 함량과 당의 종류가 달라지게 되는데 Elmstrom and Davids (1981)는 수박과 멜론에서 sucrose의 양이 수확시기를 결정 할 뿐만 아니라 과실의 품질과 등급을 결정한다고 하였고, Eisenberg (1955)는 fructose가 여러 가지 당 중에 가장 달 며 sucrose를 100으로 정하고 비교했을 때 glucose가 53으 로 가장 낮다고 보고하기도 하였다. 이와 같이 당류는 신 선농산물의 맛과 품질을 결정하는 중요한 요소가 되어 있 음을 알 수 있으며 최근에는 와인과 같은 가공식품에서도 유리당 조성이 시음평가에 미치는 영향에 관한 연구가 이 루어지고 있다(Kim, 2009).
최근 급속한 식품산업의 발전과 더불어 식품 소비패턴이 변화됨에 따라 가공식품이 차지하는 비중이 증가하게 되었 고 나트륨과 당류 섭취 과잉에 대한 우려가 높아지고 있는 실정이다(Lee et al., 2014). 전 세계가 ‘설탕과의 전쟁’을 선포하면서 우리나라도 식품의약품안전처에서 ‘제1차 당류 저감 종합계획’을 발표하기에 이르렀다(MFDS, 2016). 식 약처는 우리나라 어린이, 청소년, 청년층의 가공식품을 통 한 당류 섭취량이 2013년에 이미 섭취기준을 초과하였으 며 증가하는 당류 섭취 추세를 감안할 때 적정섭취 유도를 위한 선제적, 체계적 관리가 필요하다고 하였다. 따라서 음 료, 과자 등 가공·조리과정에서 첨가되는 당을 관리대상 으로 하여 2020년까지 당의 섭취량을 1일 열량의 10% 이 내로 관리하는 것으로 목표로 한다고 하였다. 당류 관리대 상은 쌀, 과일, 우유 등 천연물에서 유래되는 당은 제외되 기는 하지만 국민들이 당류가 적은 식품을 선택할 수 있도 록 당류 기준치 표시의무 품목을 확대 추진한다고 하였다 (MFDS, 2016). 이와 같이 농식품에 함유된 당류는 그 조 성에 따라 식품의 맛과 품질을 좌우할 뿐만 아니라 건강에 도 영향을 미치게 되므로 국민 식량자원 개발연구, 식생활 개선 정책, 단체급식의 합리적 식단 조성 등을 위하여 농 식품의 당류 함량과 그 조성에 대한 정확한 정보가 요구되 며, 국가적 Data Base의 확보가 더욱 필요한 실정이다.
일반적으로 섭취하는 가공식품과 조리된 음식에서는 단 당류로는 포도당(glucose), 과당(fructose), 이당류로는 자당 (sucrose), 맥아당(maltose), 유당(lactose)이 주로 검출된다 (Kum et. al., 2014). 식품영양학적으로는 단당류인 glucose, fructose, galactose와 이당류인 sucrose, maltose, lactose 등 이 식품 중 당류분석의 주요대상이 된다(KFN, 2000). 당류 의 정량분석을 위한 방법으로는 HPLC (high performance liquid chromatography)와 GC (gas chromatography)를 이용 한 방법이 가장 널리 이용되고 있는데 HPLC방법은 GC방 법에 비하여 감도 및 분리도가 상대적으로 낮으나 휘발성 유도체 처리 등의 전처리 과정 없이 신속하게 여러 가지 당을 동시에 분리 정량 할 수 있는 장점이 있어 현재 농 산물과 식품에 함유된 단당류 혼합물이나 이당류의 분석 및 식품공정 관리용으로 이용되고 있다(Sohn et al., 1996; Hur et al., 2000; KFN, 2000).
따라서, 본 연구에서는 농산물과 식품에 함유된 당류의 추출법을 비교하고 HPLC를 이용한 동시 정량분석 조건을 확립하여 식물영양성분 분석자료에 대한 신뢰도를 확보하 고 소비자들에게 신속하고 정확한 농산물의 당류함량 정보 의 제공과 국가 식품영양성분 DB 구축자료로 활용할 수 있는 기반을 마련하고자 하였다.
재료 및 방법
당류 HPLC 분석데이터의 정도 검증을 위한 표준인증물 질은 CRM BCR644 (Sigma-Aldrich Co., St. Louis, MO, USA)와 SRM 917C (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였고, 분석품질의 변화를 monitoring하기 위 한 내부 품질관리물질(In-house quality control material)은 분 유를 국립농업과학원 기능성식품과로부터 분양 받아 -60°C 의 초저온 냉동고(Thermo ULT Freezer, Thermo Fisher Scientific Inc., Marietta, OH, USA)에 보관하면서 분석할 때마다 상온으로 해동한 후 분석시료로 사용하였다.
분석에 사용할 유리당 표준품은 glucose, fructose, maltose, lactose, sucrose 등 5종을 선정하여 Sigma-Aldrich Co. (St. Louis, MO, USA)로부터 구입하여 사용하였고, 시료의 추출 에 사용한 정제수는 Samchun Pure Chemical Co. (Pyeongtaek, Korea)에서 ethanol과 이동상으로 사용한 acetonitrile 은 Honeywell B&J (Muskegon, MI, USA) 로부터 HPLC grade로 구입하여 실험에 사용하였다.
유리당 5종의 표준품을 각각 1 mg을 정량하여 증류수 50 mL를 가하여 완전히 용해시킨 후 100 mL 메스플라스 크에 정용한 후 0.10, 0.25, 0.5, 0.75, 1.0%가 되도록 단계 별로 희석하여 혼합표준용액을 조제하고 검량선을 작성하 였다.
시험용액은 균질화한 시료 0.5 g을 정밀히 칭량하여 추출 용매 10 mL를 첨가하고 85°C의 항온수조에서 30분간 교반 하여 추출하였다. 증류수 추출 후 3,000 rpm으로 10분간 원심분리한 후 상층액을 취하여 0.45 μm membrane filter (Millex, Merck Millipore Ltd., Darmstadt, Germany)로 여 과하여 시험용액으로 하였다.
HPLC 분석기기는 Agilent 1260 Infinities Series (Agilent Technologies, Waldbronn, Germany)로 구성하였다. 검출기 는 RI (Refractive Index) detector를 사용하였으며 column 은 ZORBAX Carbohydrate (4.6 mm ID×250 mm, 5 μm)를 이동상은 acetonitrile과 정제수를 75:25(v:v)의 비율로 조제 하여 용매조성은 변경하지 않았고, 칼럼온도 35°C, 시료 주입량은 10 μL, 유속은 1 mL/min으로 30분간 분석하였다 (Table 1).
참값을 알고 있는 표준인증물질 CRM BCR644와 SRM 917C를 이용하여 4가지 추출방법에 대한 정확도를 비교하 였다. 추출방법은 95% ethanol 추출, 70% ethanol 추출, 100% 증류수 추출과 100% 증류수 추출 후 Sep-Pak Plus C 18 cartridge (Waters Co., Milford, MA, USA) 처리 등 의 4가지 방법으로 전 처리한 후 분석 결과를 검토하였다.
표준품 glucose, fructose, maltose, lactose, sucrose, galactose 5종의 농도별 크로마토그램을 이용하여 검량선을 작성 한 후 직선성(linearity)을 검증하였고 Blank 용액의 크로마토 그램에서 계산된 nose peak area값의 평균과 표준편차를 이 용하여 본 실험의 검출한계(limit of detection)와 정량한계 (Limit of Quantification)를 산출하였다(aoac, 2002; michael et. al., 2002). 내부 품질 관리물질인 분유를 이용하여 동일 분석자가 동일한 장비와 시약으로 1일 3반복으로 분석하여 일내 정밀성(반복성, repeatability)을 측정하였고, 5일에 걸쳐 동일한 방법으로 분석하여 일간정밀성(재현성, reproducibility) 을 측정하여 실험의 정밀성(precision)을 검증하였다 (AOAC, 2002; Jeon & Lee, 2009; Kim et al., 2014).
결과 및 고찰
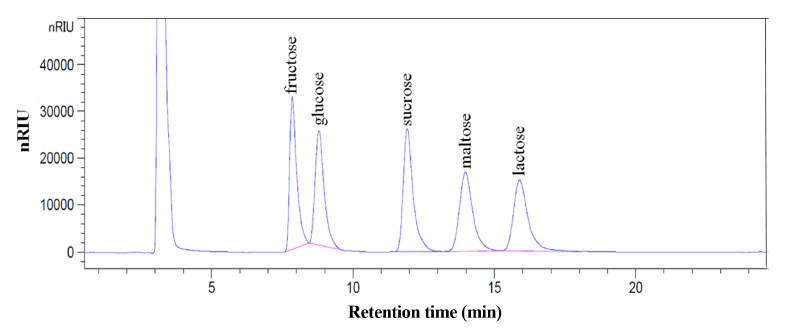
RI 검출기를 이용한 HPLC 시스템으로 5종의 유리당 0.75% 표준용액을 분석한 크로마토그램은 Fig. 1과 같으며 fructose, glucose, sucrose, maltose, lactose의 순으로 모두 방해 peak 없이 분리되었으며 RT값은 각각 fructose는 7.85분, glucose는 8.79분, sucrose는 11.92분, maltose는 13.97분, lactose 15.89분대에 분리되어 5종 모두 30분 이 내에 분리되었다.
유리당 5종의 표준용액 농도를 0.10, 0.25, 0.50, 0.75, 1.00%로 제조하여 표준 검량선을 작성하였다(Table 2). 검 량선의 상관계수는 fructose는 R2=0.9998, glucose는 R2= 0.9998, sucrose, maltose, lactose는 R2=0.9999로 확인되어 유리당 5종 모두 1.0%까지 매우 우수한 직선성을 나타내 었다. 분석정확도 검증을 위하여 fructose, sucrose, lactose, glucose의 검출 가능한 최소농도와 분석시료의 최소량을 측정하기 위한 LOD (limit of detection)와 LOq (limit of quantification)를 산출하였다. Michael et al. (2002)의 방법 을 적용하여 각각의 표준물질 크로마토그램에서 blank의 nose peak area값 10개에 대한 표준편차에 3배를 곱한 값 과 평균을 더한 것을 LOD로, 10를 곱한 값에 평균을 더 한 것을 LOQ로 하였다. Fructose는 LOD=0.0009 g/100 g, LOQ=0.0011 g/100 g, glucose는 LOD=0.0070 g/100 g, LOQ= 0.0099 g/100 g, sucrose는 LOD=0.0013 g/100 g, LOQ=0.0015 g/100 g, maltose는 LOD=0.0007 g/100 g, LOQ=0.0010 g/ 100 g, lactose는 LOD=0.0161 g/100 g, LOQ=0.0165 g/100 g으로 나타나 미량의 성분도 검출할 수 있음을 확인하였 다(Table 2).
당류의 HPLC 분석시 액체가 아닌 시료는 용매로 우선 추출하여야 하는데 이때 사용되는 용매는 시료내의 모든 당을 추출할 수 있어야 하고 방해물질의 추출은 최소화하 여야 한다. 일반적인 시료의 경우는 시료 일정량을 80% 에탄올 용액으로 추출하여 일정농도로 정용하여 0.45 μm membrane filter로 정밀 여과한 후 HPLC로 분석한다. 그 러나 시료에 따라서 유기용매, 이온교환수지 또는 Sep-Pak cartridge 처리를 하여 방해물질을 제거하여야 한다(KFN, 2000). 본 실험에서는 균질화된 신선 농산물에 함유된 당 류 정량분석을 위한 시료의 표준 추출방법을 구명하고자 추출방법을 달리하여 표준인증물질 BCR 644와 정확도를 비교하였다. 추출방법에 따른 BCR644의 fructose, sucrose, lactose함량은 Table 3에서와 같이 95% ethanol 추출처리는 각각 89.4, 104.7, 84.4%의 정확도를, 70% ethanol 추출처 리는 91.7, 91.3, 91.8%의 정확도를, 증류수 추출 후 Sep- Pak cartridge 처리에서는 92.5, 91.7, 97.7%의 정확도를, 증류수 추출처리에서는 95.7, 98.7, 102.7%의 정확도를 나 타내어 100% 증류수 추출방법이 가장 정확도가 높은 것으 로 나타나 이후 모든 분석에 증류수 추출방법을 적용하여 분석하였다.
참값을 알고 있는 표준인증물질을 사용하여 당류 분석데 이터의 정확성 검증을 실시하였다(Table 4). 본 실험에서는 fructose, sucrose, lactose의 표준인증물질로 BCR 644를, glucose의 표준인증물질로 SRM 917C를 사용하여 본 실험 의 분석값과 비교하였는데 각각의 당의 측정값과 참값에 대한 회수율은 fructose는 15.48±0.04 g/100 g으로 95.56%, sucrose는 10.64±0.11 g/100 g으로 98.43%, lactose는 16.22± 0.28 g/100 g으로 102.33%, glucose는 99.00±1.47 g/10 0g으 로 99.30%의 높은 회수율을 보여 정확성을 확보하였다.
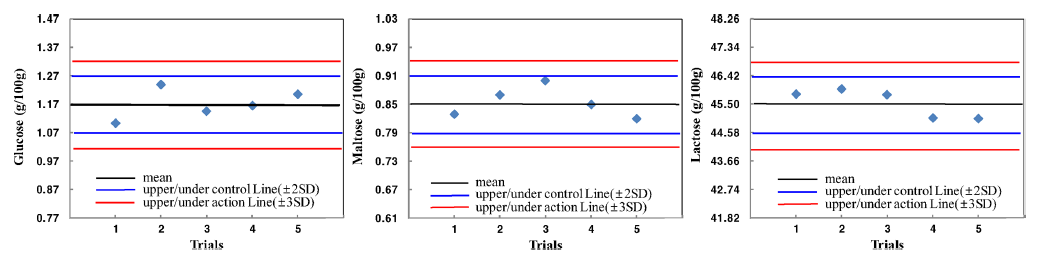
분석의 정밀성을 확인하기 위해 내부표준물질인 분유를 같은 실험실에서 하루 3반복으로 5일에 걸처 AOAC guideline (2002)에 따라 일내 정밀성(반복성, repeatability) 과 일간 정밀성(재현성, reproducibility)을 산출하였다(Table 5). 분석값을 표준편차로 나누어 상대표준편차(RSD)를 구 하였는데, 일내 정밀성 실험의 상대표준편차는 glucose 4.55%, maltose 3.66%, lactose 2.19%로 모두 5% 이내의 RSD 값을 나타내어 실험의 반복에 따른 분석값이 안정적 임을 확인하였고, 일간정밀성 실험의 상대표준편차는 glucose 3.42%, maltose 4.88%, lactose 1.01%로 재현성 또 한 5% 이내로 나타나 안정적임을 알 수 있었다. 이와 같 은 결과로 내부표준물질의 reference value는 glucose는 1.17 g/100 g, maltose는 0.85 g/100 g, lactose는 45.54 g/100 g으로 설정하고 농산물 분석시에 참고값으로 활용하였다.
내부표준물질의 reference value의 평균, 표준편차로부터 얻어진 허용한계 95% 수준(2*SD)값을 경고한계로, 허용한 계 99.7%(3*SD)를 거절한계로 설정하여 품질관리차트를 작성한 결과(Fig. 2), glucose, maltose, lactose의 5회에 걸 친 분석값 모두 경고한계 이내에 속하여 분석데이터의 재 현성이 안정적임을 확인하였으며 지역농산물 분석시 주기 적 정도 관리에 활용하였다.
요 약
HPLC를 이용하여 농식품에 함유된 fructose, glucose, sucrose, maltose, lactose 등 5종의 당류에 대한 신속하고 정확한 동시분석법을 확립하기 위하여 시험을 실시하였다. 수용성 당류의 HPLC 분석조건은 RI 검출기를 이용하여 column은 ZORBAX Carbohydrate (4.6 mm ID×250 mm, 5 μm)를 이동상은 75% ACN을 사용하였고 칼럼온도 35°C, 시료 주입량은 10 μL, 유속은 1 mL/min의 조건으로 30분 간 분석하여 방해 peak없이 5종의 표준용액을 분리하였다. 표준용액 검량선의 R2=0.999 이상으로 5종 모두 직선성이 우수하였고, 표준용액의 크로마토그램을 이용하여 분석의 정량한계와 검출한계를 산출하였다. 농식품의 당류 추출방 법을 구명하기 위하여 표준인증물질 BCR644을 이용 추출 방법별 정확도를 비교한 결과, 증류수 100% 추출처리에서 fructose 95.7%, sucrose 98.7%, lactose 102.7%로 가장 우 수하여 농산물 당류 추출시 적용하였다. 내부표준물질인 분유를 이용하여 반복성과 재현성을 확인하여 본 분석법에 대한 정밀도를 검증하였고 reference value 값으로 glucose 는 1.17 g/100 g, maltose는 0.85 g/100 g, lactose는 45.54 g/100 g으로 설정하였고, 허용한계 95% 수준(2*SD)을 경 고한계로, 허용한계 99.7% 수준(3*SD)을 거절한계로 산 출하여 품질관리차트를 작성하고 농식품 당류 분석에 활 용하였다.