서 론
국내에서 가장 많이 수확되어 유통되고 있는 단감은 주 로 만생종인 ‘부유’ 품종으로 국내 재배면적은 2012년에 1 만 4천 ha이고, 주요 재배지는 경남 지역이다(Heo et al., 2008). ‘부유’는 특유의 아삭아삭한 조직감과 단맛으로 인 해 신맛의 과일을 기피하는 사람들이 선호하며, 구성성분 으로는 탄수화물 13-15%, 포도당 6%, 과당 2-3%, 자당 5%가 함유되어 있고(Bae et al., 2001), 비타민A와 비타민 C, 가용성 타닌, 그리고 Ca, K, Mg 등의 무기질이 풍부하 여, 영양적으로 우수한 과일이며, 또한 최근에는 단감이 다 양한 질병에 효과가 있다는 연구결과가 보고 되고 있다 (Bae et al., 2002).
단감은 수확 후 빠르게 연화되어 상품성이 떨어지기 때 문에, 저장성을 향상시키기 위하여 1-methylcyclopropene (1-MCP) (George & Redapath, 2008), modified atmosphere packaging (MAP) (Gu et al., 2008), controlled atmosphere (CA) 저장 (Fukai et al., 2009), 그리고 예건 및 curing (Qrtiz et al., 2005) 등의 수확 후 관리기술들이 사용되고 있으나, 이러한 처리기술이 적용된 단감도 장기 저장을 위 해서는 0°C 저온 저장이 반드시 필요한 상황이다(Bae et al., 2001). 현재 국내에서 가장 많이 상용화되고 있는 저장 방법은 0°C에서 polyethylene (PE) 포장재로 밀봉하는 저 장방식이 사용되고 있다(Chung et al., 2013). 하지만, 0°C 저온 저장고에서 오랫동안 저장된 단감이 상온유통 과정에 서 발생하는 생리적인 변화와 장기간 저장 중 발생하는 부 산물들의 활용에 대한 연구가 매우 부족한 실정이다.
감 부산물은 예로부터 민간요법으로 사용되어온 기능성 소재로서 다양한 항산화 성분이 함유되어 있다(Hong et al., 1996; Bae et al., 2001; Bae et al., 2002). 많은 농가 에서 단감의 저장 중 발생한 장해과 또는 상품성이 떨어지 는 단감의 경우 대부분이 폐기되거나 식초 등으로 발효시 키는 연구가 일부 있다. 하지만 상품성이 떨어진 단감의 이용은 대부분이 과육(flesh)에만 집중되어 있어(Chung et al., 2002; Cho et al., 2003; Jo et al., 2010), 감꼭지 또는 꽃받침과 같은 단감의 부산물에 대한 연구가 부족하다.
본 연구에서는 단감을 수확 후 전통적인 방식인 상온에 서 7일간 예건 처리 하고, 0°C 저온 저장고에서 40일간 저 장 후 상온유통을 위해 실온에 방치시켰을 때 색도, 경도, 유리당 함량의 변화를 조사하여, 저온 저장된 단감의 특성 변화를 파악하고, 연화되어 상품성이 떨어진 단감의 부산 물인 과육, 씨, 및 꽃받침의 항산화 활성을 평가하여 폐기 되고 있는 부산물을 기능성 식품원료로서의 사용가능성을 밝히고자 한다.
재료 및 방법
2015년 10월 하순부터 11월 초순에 수확 된 ‘부유’ 단감 을 경남 진영농협에서 구매하여 외관상 이상이 없고, 크기 가 균일한 단감 만을 선별하여 실험에 사용하였다. 선별된 단감은 7일 동안 예건 처리 하고, 폴리에틸렌(PE) 필름으 로 포장하여, 0°C 저온 창고에서 40일간 저장 후 상온에서 의 노출 시간에 따른 단감의 품질 변화를 조사하였다.
저온저장 중 단감의 색도 변화는 색차계(CR-300, Minolta Co., Osaka, Japan)를 이용하여 Hunter’s L, a, b 값을 측정 하여 단감 표면의 색 변화를 관찰 하였다. 과육의 경도는 Texture analyzer (TA-XT2, Stable Micro Systems Ltd., Godalming, England)를 이용하여 5 mm 직경의 plunger를 1.0 mm/sec의 속도로 과실의 표면을 눌러 저항하는 힘을 N (newton)으로 표시하였다.
단감 착즙액 2 mL을 취하여 증류수 18mL에 혼합하여 희 석하고, 0.45 μm membrane filter로 여과 후 HPLC (Waters Alliance 2790, Waters Co., Milford, MA, USA)를 이용하여 유리당 함량을 측정하였다. Detector는 RI detector, column 은 carbohydrate column (Carbohydrate Cartridge column, 4.6 ×250 mm, Waters Co.)을 사용하였다. Mobile phase는 acetonitrile: water를 80:20의 비율로 혼합한 용액을 사용하였고, flow rate은 1.5 mL/min으로 하였다.
수확 후 예건, 포장 및 저온저장 40일 후 상온유통 조건 에서 7일 이상 보관하면서 상품성이 떨어져 폐기 처분해야 하는 단감을 과육, 씨, 꽃받침으로 분리하고, 건조하였다. 건조된 각 시료 200 g을 70% 에탄올 2 L에 넣고, 24 hr 정 치하여 총 3회 반복 추출하였다. 추출액은 여과지(Whatman No. 3, Whatman International Ltd., Maidstone, England)를 이용하여 여과한 후 rotary vacuum evaporator (UT-1000, Eyela World, Tokyo, Japan)로 55°C에서 농축한 후 동결 건조하여 사용하였다. 과육, 씨, 꽃받침 추출물의 수율 (yield)은 추출 전 시료의 건조중량 200 g에 대한 추출물의 건조무게를 백분율로 나타내었다.
총 폴리페놀 함량은 Folin-Denis법(Folin & Denis, et al., 1912)을 수정하여 측정하였다. 각 추출물 60 μL에 Folin- Denis reagent (Fluka Chemie GmbH, Buchs, Switzerland) 60 μL를 넣고, 3분간 실온에 반응시키고, 10% sodium carbonate solution 60 μL을 가하여 1시간 반응시킨 후 UVVIS spectrophotometer (UV-2600, Shimadzu Co., Kyoto, Japan)로 700 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량(mg/g)은 tannic acid의 표준곡선을 이용하여 환산하 였다.
DPPH (2,2-diphenyl-1-picrylhydrazyl)를 이용한 단감 부 산물 추출물의 자유라디칼 (free radical) 소거 활성은 Blois (Blois, 1958)의 방법을 변형하여 측정하였다. 즉, 99% 메 탄올에 각 시료를 녹여 농도별로 희석한 희석액 160 μL와 메탄올에 녹인 0.15 mM DPPH 용액 40 μL를 잘 혼합하여 실온에서 30분 동안 방치한 후 UV-VIS spectrophotometer 를 이용하여 517 nm에서 흡광도를 측정하였다. 대조구는 BHA (butylated hydroxyanisole)를 사용하였다. 전자공여능 력은 시료와 대조구의 흡광도를 이용하여 아래의 식에 따 라 계산하였다.
여기서, As는 시료의 흡광도를 나타내며, Ac는 대조구의 흡광도를 나타낸다. DPPH 자유라디칼 소거능을 1/2로 환 원시키는데 필요한 시료의 농도를 RC50으로 나타내었다.
ABTS radical 소거활성은 Roberta 등의 방법(Roberta et al., 1999)에 의해 측정하였다. 7mM ABTS (2,2'-azino-bis(3- ethylbenzothiazoline-6-sulfonic acid))와 2.4 mM potassium persulfate (K2S2O8)를 24시간 동안 어두운 곳에서 방치하여 ABTS 양이온을 형성시킨 후 이용액을 734 nm에서 흡광도 값이 0.70±0.02이 나오도록 증류수로 희석하였다. 희석된 용액 180 μL에 sample 20 μL를 혼합하여 1분 동안 방치한 후 734 nm에서 흡광도를 측정하였다. 각 시료 추출물의 ABTS 라디칼 소거활성(%)은 시료와 대조구(BHA)의 흡광 도를 이용하여 아래의 식에 따라 계산하였다.
여기서, As는 시료의 흡광도를 나타내며, Ac는 대조구의 흡광도를 나타낸다. ABTS 자유라디칼 소거능을 1/2로 환 원시키는데 필요한 시료의 농도를 RC50으로 나타내었다.
결과 및 고찰
과실의 색은 품질을 평가하는 중요한 지표로서, 과실 고 유의 색이 변하게 되면 상품적으로 가치가 하락하게 된다. 따라서 색상을 유지하는 것은 단감의 저장에 매우 중요한 인자이다. 일반적으로 수확 후 단감은 후숙 작용에 의해 Hunter’s a값은 증가하고, b값과 L값은 감소하는 경향을 보인다(Kim et al., 2003; Jeon et al., 2014). 하지만, 장기 간 저온저장된 단감을 상온에 노출 시켰을 경우에는 Fig. 1에서 보는 것과 같이 시간이 지남에 따라 Hunter’s a, b, L값 모두 감소하는 경향을 보였다. 이는 저온저장에서는 단감의 후숙 작용이 지연되면서 색의 변화를 지연 시킬 수 있었지만, 유통을 위해 상온에서 저장하면서 빠르게 색변 화가 발생하고, 특히 상온에서 4일 이후에는 a, b, L 값 모두 유의적인(p<0.05) 차이를 보이면서 감소하였고, 전체 적으로 검붉은 색을 나타내면서 상품성이 떨어지게 된다.
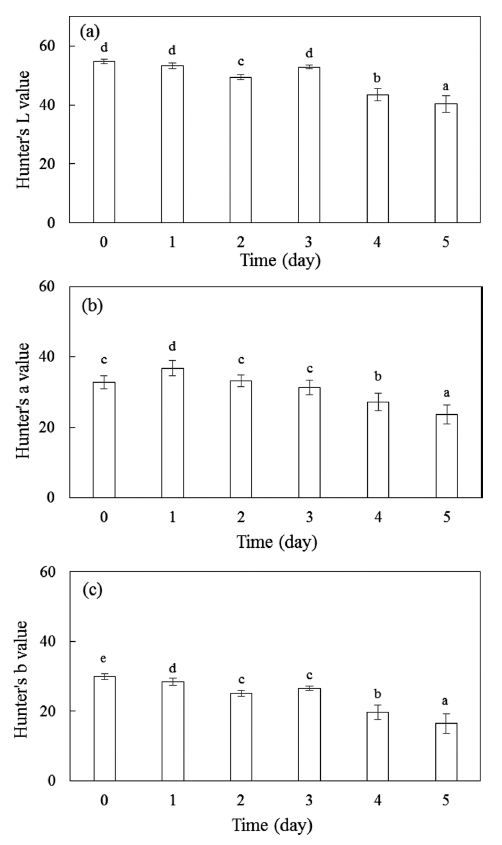
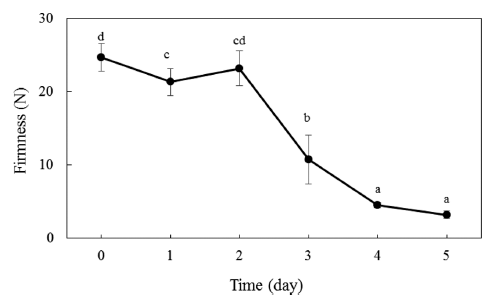
Fig. 2는 저온저장고에서 40일간 저장 후 상온유통을 위 해 상온저장 기간에 따른 경도의 변화를 나타낸 것이다. 수확 후 단감의 경도는 대략 25 N 정도를 보이는데, 저온 저장고에서 40일간 저장 직후에도 비슷한 수준의 경도를 나타내었다. 저장 단감을 상온에 보관 하였을 경우 2일 까 지는 통계적으로 유의적인(p<0.05) 감소는 보였으나 감소 율이 10% 미만을 유지하였다. 하지만 상온 보관 3일째에 는 단감의 연화가 빠르게 진행되면서 10.7 N의 경도를 보 이면서 0일째에 비해 약 60%의 감소율을 보였고, 4일 이 후에는 5 N 미만의 경도를 나타내었다. 단감은 온도에 따 라 경도 변화가 심하게 발생하는데, 이는 고온에 노출 되었 을 경우 단감의 호흡이 빨라지면서 ethylene 발생을 증가시 키기 때문으로 보고 있다. Ethylene의 생합성은 methionine → S-adenosylmethionine (SAM) → 1-aminocyclopropane-1- carboxylic acid (ACC) → ethylene의 단계를 거치게 되며, ethylene의 전구물질인 ACC에서 ethylene으로 전환되기 위 해서는 ACC oxidase의 활성이 필요하다(Kawaguchi et al., 1997). 수확 후 저온저장에서는 단감 내 ACC oxidase의 활성이 저하되기 때문에 ethylene 합성이 감소하고, 이는 경도의 감소를 억제하는 효과가 있다. 하지만 저온저장 기 간이 증가함에 따라 ACC의 축적되는 함량은 증가하게 되 며, 축적된 ACC가 상온에 노출 되는 경우 ACC oxidase 가 활성화 되면서 많은 양의 ACC가 ethylene으로 전환되 면서 급격한 경도의 감소를 발생하게 된다(García-Salinas et al., 2016). 따라서 저온저장된 단감은 상온유통 할 경우 3일 이후에는 경도의 변화가 급격하게 감소하면서 상품성 이 없게 된다.
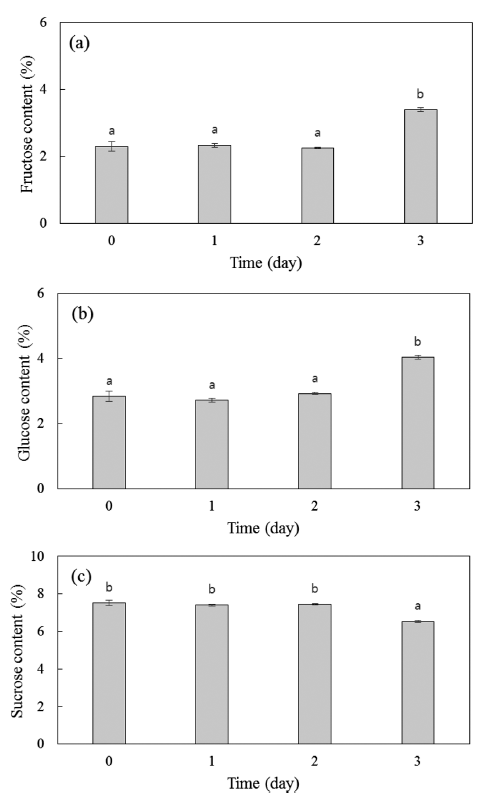
단감의 주요 구성 당은 glucose, fructose, sucrose이며, 단감의 성숙기에 sucrose의 함량이 증가하다가 과숙기에 sucrose가 분해되면서 glucose와 fructose의 함량은 증가하 고 sucrose의 함량은 감소한다고 보고되고 있다(Senter et al., 1991). 저온저장 후 상온에서 유통되는 단감을 착즙이 가능한 경도가 유지되는 3일까지의 유리당 함량변화를 조 사한 결과는 Fig. 3과 같다. 경도가 급격히 감소한 상온보 관 3일째에 glucose와 fructose의 함량이 유의적(p<0.05)으 로 증가하였고, sucrose의 경우는 통계적으로 유의적인 (p<0.05) 감소를 보였다. 이러한 결과는 상온 노출 시 활성 화된 ACC oxidase에 의한 ethylene의 빠른 생성과 ethylene 생성에 과육 내의 구성성분의 변화 및 증산작용에 의한 결 과로 보인다. Kim et al. (2003)의 연구에서는 저온에서 고 온으로의 온도상승은 단감의 증산작용을 촉진하며, 지속적 인 증산작용에 의해 단감 내부의 수분을 방출시킨다고 하 였다. 따라서 저온저장 후 상온에서 유통되는 단감은 3일 부터 내부 수분의 감소로 glucose와 fructose의 함량이 증 가할 수 있고, sucrose 함량은 감소하는 경향을 보이게 된 다. 저온저장된 단감은 상온보관 3일 이후에는 감식초 또 는 와인 등의 가공식품으로의 이용에 적합하다.
장기간 저온저장 후 상품성이 떨어진 단감 부산물인 과 육(flesh), 꽃받침(flower bud), 및 씨(seed)를 70% ethanol 로 추출한 수율은 Table 1에 나타낸 것과 같다. 수율의 양 은 과육(15.53%)>꽃받침(13.83%)>씨(10.53%)의 순으로 나 타났다. 이것은 각 부위에 함유된 수분함량의 순으로 씨와 꽃받침은 상대적으로 과육에 비하여 낮은 수분 함량을 가 지고 있기 때문이다. Jo et al. (2010)의 연구에서도 추출 수율이 과육>껍질>꽃받침>씨의 순서로 나타났다. 본 연구 에서는 단감을 40일 동안 저온저장 후 상온에서 일주일 이상 저장 하면서 단감의 탈습효과에 의한 수분 손실로 인 하여 수율이 감소한 것으로 보인다(Kim et al., 2003).
| Parts of ‘Fuyu’ | Extraction yield (%) |
|---|---|
|
|
|
| Flesh | 15.53 |
| Seed | 10.53 |
| Flower bud | 13.83 |
부산물 부위별 추출물의 총 폴리페놀 함량은 Table 2와 같다. 총 폴리페놀 함량은 과육(4.81±2.27 μg/mg)>씨(175.53 ±7.42 μg/mg)>꽃받침(178.17±14.72 μg/mg) 순으로 나타났다. 페놀성 화합물은 식물계에 분포된 2차 대사산물로서 구조 적으로 활성산소의 활성을 저해하여 항돌연변이, 콜레스테 롤 저하, 항균, 항바이러스, 면역증강 등의 다양한 작용이 보도되고 있다(Tomás-Barberán et al., 2001; Kawakami et al., 2010). 단감은 일반적으로 당류, 비타민, 무기질 등의 다양한 유효성분들이 함유되어 각종 질병에 대한 억제효과 가 있는 것으로 보고(Cho et al., 2001; Kang et al., 2002) 되고 있지만, 실제적으로 폴리페놀 물질은 식용되지 않는 꽃받침과 씨에 더 많이 분포 되어 있었다. 이러한 결과는 Tomás-Barberán (Tomás-Barberán et al., 2001) 등의 연구 에서 다양한 과일에서의 페놀 함량이 과육보다 껍질과 같 은 다른 부위에 페놀 화합물이 많이 존재한다는 연구결과 와 일치하였다.
| Parts of ‘Fuyu’ | Total polyphenols (μg/mg) |
|---|---|
|
|
|
| Flesh | 4.8± 2.7a1) |
| Seed | 175.5±7.4b |
| Flower bud | 178.2±14.7b |
총 폴리페놀 함량이 풍부하게 함유된 단감 부산물인 꽃 받침과 씨의 DPPH 자유라디칼 소거능에 대한 결과는 Fig. 4에 나타내었다. 꽃받침과 씨의 DPPH 자유라디칼 소거능 은 농도가 0.8 μg/mL에서 8 μg/mL로 증가함에 따라 유의 적인(p<0.05) 증가를 보였다. 하지만 꽃받침과 씨의 결과는 통계적으로 유의성(p>0.05)이 없었다. 꽃받침과 씨 추출물의 농도가 1.6 μg/mL 이하의 저농도에 서는 대조군인 BHA의 DPPH 자유라디칼 소거능의 약 50% 이하의 낮은 값을 보 였으나 8 μg/mL의 고농도에서는 DPPH 자유라디칼 소거능 이 90% 이상으로 대조군의 같은 결과를 보였다. RC50 값 의 경우 꽃받침 3.98 μg/mL과 씨 4.25 μg/mL으로 꽃받침 과 씨 사이에는 유의적이 차이가 없었고, 대조군인 BHA의 1.30 μg/mL에 비해서는 3배 이상의 높은 RC50 값을 보였다. 꽃받침과 씨의 RC50 값은 한약재로 쓰이는 오미자 145.1 μg/mL, 백부자 696.77 μg/mL, 결명자 306.18 μg/mL 그리고 오매 342.45 μg/mL와 비교하였을 때 보다 훨씬 높은 DPPH 라티칼 소거능이 있음을 확인할 수 있었다(Lee et al., 2002; Jeon et al., 2008).
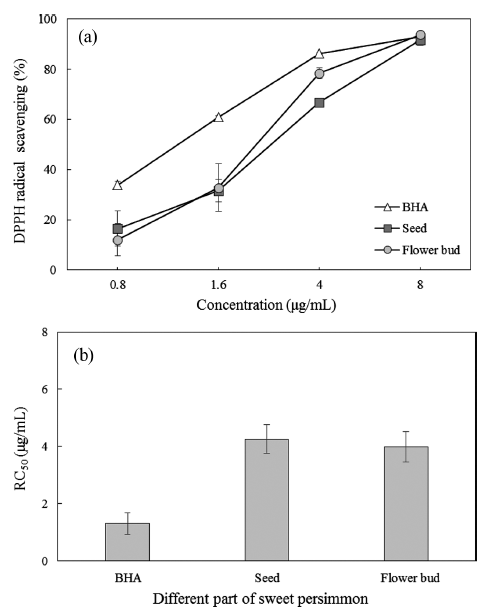
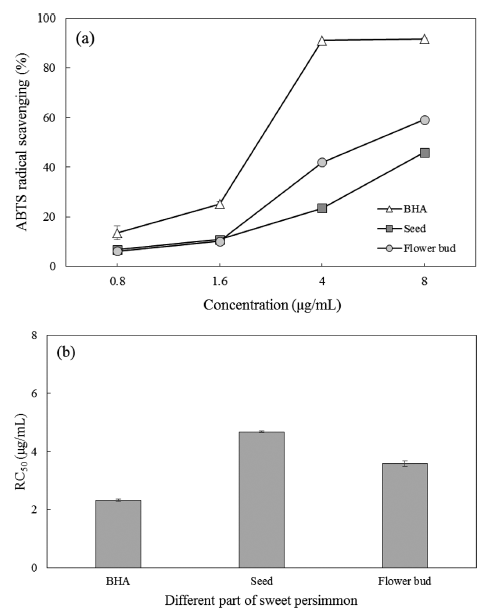
Fig. 5는 ABTS 자유라디칼 소거능에 대한 결과를 나타 내었다. DPPH 자유라디칼 소거능 결과와 달리 ABTS 자 유라디칼 소거능의 경우 모든 농도 조건에서 대조군인 BHA의 소거능에 비해 꽃받침과 씨의 소거능이 유의적으 로(p<0.05) 크게 낮은 결과를 보였다. 꽃받침과 씨 추출물 이 1.6 μg/mL 이하의 저농도에서는 ABTS 자유라디칼 소 거능이 유의적인 차이가 없었지만 4 μg/mL 이상의 고농도 조건에서는 꽃받침의 ABTS 자유라디칼 소거능이 씨의 소 거능에 비해 유의적으로(p<0.05) 높은 소거능을 보여준다. RC50 값의 경우 BHA 2.32 μg/mL, 씨 4.68 μg/mL, 꽃받침 3.58 μg/mL으로 DPPH 결과와 같이 대조군에 비해 씨와 꽃받침에서 다소 높은 RC50 값을 보인다. 하지만 DPPH 결과와 달리 꽃받침의 RC50 값이 씨의 RC50 값에 비해 유 의적(p<0.05)으로 작은 수치를 보이고 있다. ABTS radical 소거능 역시 기존의 항산화능이 우수한 것으로 알려진 머 루 추출물(RC50=220 μg/mL)과 약재로 이용되는 대추 (RC50 =125 μg/mL) 보다도 높은 활성을 가지고 있다(Jeong et al., 2007).
이전의 연구들에서 장성 대봉감 부산물의 항산화능(Jo et al., 2010), 감 씨의 항산화능(Ahn et al., 2002) 등이 보고 되었지만 부유 단감 부산물 항산화 활성에 대한 연구는 발 표되지 않았다. 본 연구 결과에서 비상품과에서 채취한 단 감 부산물인 꽃받침과 씨는 높은 폴리페놀 함유량과 함께 우수한 항산화 활성을 보이고 있어, 향후 가공식품으로 적 용 가능성을 보여 주었다.
요 약
본 연구에서는 수확 시기가 집중되어 한 번에 많은 물량 이 재배되고, 저장환경에 따라 저장성이 떨어지는 ‘부유’종 단감을 관행적으로 사용되는 예건 처리 후 40일 동안 저 온저장을 실시하여 상온에 유통시켜 시간에 따른 단감의 변화를 관찰 하였다. 그 결과 저온 3일째 상품성의 지표가 되는 경도가 크게 감소하였고, 색도는 모든 Hunter’s 값이 감소하여 어두운 색의 단감으로 변색되었다. 따라서 장기 간 저온저장한 단감의 경우 3일 이내까지 상품성이 유지 되었다. 또한 단감의 유리당 함량은 상온 노출 후 glucose 와 fructose 함량이 증가하고, sucrose 함량은 감소하는 경 향을 보였다. 상품성이 떨어진 단감은 식초와 같은 가공식 품의 원료로 활용되고 있는데, 이러한 상품성이 떨어진 단 감의 과육과 가식성 부분이 아닌 꽃받침, 씨를 활용하여 폴리페놀 함량과 함께 DPPH, ABTS 자유라디칼 소거능을 측정한 결과 과육 부분은 폴리페놀 함량이 매우 적었고, 꽃받침과 씨에 총 폴리페놀 함량이 높았으며, DPPH 및 ABTS 자유라디칼 소거능에서도 우수한 성능을 보였다.







