서 론
단풍취(Ainsliaea acerifolia)는 국화과의 다년생 식물로 동북아시아 지역에 널리 분포하며, 국내에서는 취나물류로 분류하고 있다(Xiao et al., 2014). 단풍취는 칼슘과 인산염 이 높은 알칼리성 식품으로 다른 산채들에 비해 단백질과 β-carotene이 다량 함유되어 있고, 특유의 풍미로 선호도가 높은 산채이다(Jung et al., 2000; Xiao et al., 2014). 단풍 취는 어린 순이나 잎을 쌈채, 나물, 절임 등의 형태로 이 용하고 있으며, 건단풍취는 주로 한방소재로 활용하고 있 다(Jung et al., 2000; Xiao et al., 2014). 단풍취는 다수의 sesquiterpene lactone 류와 friedelane 유도체 등을 함유하 고 있으며(Jung et al., 2000), 국내에서 자생하는 단풍취에 는 sesquiterpene lactone류 중 glucozaluzanin C와 ainsliaside A 만을 함유하는 것으로 보고되었다(Jung et al., 2000). 그 래서 단풍취는 예로부터 관절통, 근육통, 항염증 등에 효능 이 있는 산채로 알려져 있다(Jung et al., 2000). 그러나 단 풍취는 수확 후 관리기술이 확립되어 있지 않아 연중 4-5 월경에 한시적으로 채취되어 소비되는 실정이다. 또한 건 단풍취의 경우 부서짐성이 높아 취급 및 유통이 용이하지 않고, 특유의 강한 풍미를 나타내어 소비자들의 선호도를 낮추는 등 식품원료로의 활용이 제한되고 있다.
단풍취의 기능성 식품소재로 개발하기 위한 노력으로 단 풍취 추출물과 이의 분획물들의 항산화력 및 α-glucosidase 저해 활성 평가(Lee et al., 2015)와 단풍취 추출물 분획들 의 알코올 대사에 미치는 영향 탐색(Moon et al., 1998)에 대한 소수의 연구가 수행되었다. 또한 단풍취의 가공식품 소재화를 목적으로 원적외선을 이용한 단풍취의 박층 건조 (Xiao et al., 2014)와 관련된 연구가 수행되었다. 그러나 이와 같은 제한된 연구들은 나물 조리용으로 활용되는 단 풍취의 어린 순과 잎 만을 활용하였으며(Moon et al., 1998; Jung et al., 2000; Xiao et al., 2014; Lee et al., 2015), 단풍취 부산자원(생장이 많이 진행된 질기고 거친 잎들)에 대해서는 적용되지 않았다. 게다가 추출물과 이의 분획들에 대한 생리활성 효능들은 제한적으로 검증 하였지 만(Moon et al., 1998; Jung et al., 2000; Lee et al., 2015), 소수성이 높은 단풍취 추출물들의 가용성 및 분산성 증진 에 대한 연구의 부재로 단풍취 추출물의 식품소재로의 활 용이 제한되고 있다.
따라서 본 연구는 단풍취 추출물을 핵물질로, 찰옥수수 전분을 외벽물질로, 구연산을 가교물질로 하여 분무건조된 미세캡슐을 제조하여 이들의 물리화학적 특성 및 항산화 활성의 분석을 통해 단풍취 추출물을 함유하면서 가공적성 이 향상된 미세캡슐 소재를 개발하고자 하였다.
재료 및 방법
단풍취는 2014년 5월 중순경에 경상북도 영양군에서 채 취한 것을 농가로부터 구입하였으며, 찰옥수수전분은 삼양 사(Daejeon, Korea)의 상업적인 제품을 구입하여 추가 정 제 없이 사용하였다. 무수구연산(anhydrous citric acid)과 Tween 80 (polysorbate 80)은 각각 덕산화학(Duksan Co., Ltd., Seoul, Korea)과 ES식품원료(Gunpo, Gyeonggi, Korea) 로부터 얻었다. 이외에 본 연구에서 시료들의 제조와 분석 에 사용된 용매와 시약들은 ACS 등급 이상의 것을 사용 하였다.
단풍취는 흐르는 물에 5분간 수세하여 협잡물 등을 제거 한 후 페이퍼타올로 표면수분을 제거하고 45°C에서 48시 간 동안 건조하였다. 건조된 단풍취는 가정용 믹서기 (HMF-3450S, Hanil Electric, Seoul, Korea)를 이용하여 분 쇄하여 폴리프로필렌 통에 넣고 상온에서 보관하면서 단풍 취 추출물 제조를 위한 시료로 하였다.
단풍취 분말의 건조중량 대비 10배의 70%(v/v) 에탄올 수용액을 가하여 상온에서 24시간 동안 교반한 후 감압여 과하여 1차 추출물과 잔사를 분리하였다. 회수된 잔사는 최초 추출 시와 동량의 70%(v/v) 에탄올 수용액과 혼합하 여 상온에서 24시간 동안 교반한 후 감압여과하여 2차 추 출물을 얻었다. 1차 및 2차의 추출과정에서 얻은 추출물들 은 혼합하고 진공회전농축기(N-1200A, EYELA Co., Tokyo, Japan)를 이용하여 추출물 초기 부피의 약 10% 수 준이 될 때까지 농축하였다. 농축된 추출물의 중량대비 2%에 해당하는 양의 Tween 80을 가하여 단풍취 추출농축 액을 제조하였다.
단풍취 추출농축액을 일정량 취하여 105°C에서 항량에 도달할 때까지 건조하였다. 고형분 함량은 건조 전후의 시 료의 무게의 백분비율로 결정하였다(Lee et al., 2015).
단풍취 추출농축액의 총 페놀성 화합물 함량은 Folin and Denis (1912)의 방법을 변형하여 측정하였다. 단풍취 추출농축액 100 μL에 Folin-Ciocalteau’s phenol reagent (Sigma-Aldrich Co., St. Louis, MO, USA) 100 μL를 가하 여 3분간 반응시킨 후 0.75 M Na2CO3 1 mL를 가하여 상 온에서 1시간 동안 방치시키고 750 nm에서 흡광도를 측정 하였다. 총 페놀성 화합물 함량은 tannic acid (Sigma- Aldrich Co., St. Louis, MO, USA)를 표준물질로 하여 작 성된 표준곡선으로부터 결정하였다.
찰옥수수전분 5 g과 증류수 244.5 g을 혼합하여 90°C에 서 용해시킨 후 무수구연산 0.5 g을 가하고 교반하면서 상 온으로 냉각하였다. 찰옥수수전분과 구연산 혼합용액은 증 류수를 가하여 250 g으로 하였다. 찰옥수수전분과 단풍취 추출농축액 고형분 함량의 혼합비율이 15:0, 15:5, 15:10 이 되도록 단풍취 추출농축액을 찰옥수수전분-구연산 혼합 용액에 가하고, 15,000 rpm에서 3분간 균질하였다. 각 혼합 비율에 따른 대조군들은 구연산의 첨가 없이 동일하게 제 조하였다(Table 1). 구연산 첨가 및 무첨가 혼합물들은 분 무건조기(SD-1000, EYELA Co., Tokyo, Japan)를 이용하 여 미세캡슐로 제조하였다. 분무건조기의 운전조건은 주입 공기온도 140°C, 배출공기온도 75°C, 혼합용액 주입량 2.5 mL/min, 공기공급속도 0.75 m3/min, 분무압력 15 kPa이었 다. 형성된 미세캡슐들의 회수율은 초기 혼합용액의 총 고 형분에 대한 회수된 단풍취 추출물 미세캡슐의 건조중량의 백분비율로 나타내었다.
1) In the experimental codes, capitals, N and C, refers to microcapsules prepared by spray drying from the mixtures without and with anhydrous citric acid, respectively. Next to a capital, two-digit numbers, 00, 05, and 10, means the mixing ratios (15:0, 15:5, and 15:10, respectively) of either waxy corn starch-anhydrous citric acid or waxy corn starch and Ainsliaea acerifolia extract, based on their respective total solid contents.
단풍취 추출물 미세캡슐과 대조군들은 150°C의 컨벡션오 븐(FO-600M, Jeio Tech, Daejeon, Korea)에서 3시간 동안 열처리한 후 상온으로 방냉하였다(Kim & Kim, 2015a,b).
미세캡슐은 퓨리에변환적외선분광광도계(Spectrum One system, Perkin-Elmer, Waltham, MA, USA)를 이용하여 에 스테르(ester) 결합의 형성 여부를 조사하였다. Potassium bromide (KBr)와 미세캡슐을 9:1의 중량비율로 혼합하고 타정하여 FT-IR 분석용 펠릿을 제조하였다. 시료들의 FT IR 스펙트럼은 4 cm-1의 해상도로 450-4000 cm-1의 파장범 위에서 조사하였다(Kim & Kim, 2015a,b).
미세캡슐 0.5 g과 1 N NaOH 20 mL를 혼합하여 1시간 동안 끓인 후 100 mL 정용플라스크로 옮기고 1 N HCl 20 mL와 무수에탄올을 순차적으로 가하여 100 mL로 하였 다. 제조된 미세캡슐 용액을 취하여 단풍취 추출농축액의 최대 흡수파장인 320 nm에서 흡광도를 측정하고, 단풍취 추출물의 표준곡선을 이용하여 미세캡슐의 단풍취 추출물 농도를 결정하였다.
미세캡슐의 형태학적 특성은 전계방출주사전자현미경 (JSM-6700F, Jeol Ltd., Tokyo, Japan)을 이용하여 관찰하 였다. 시료는 탄소양면테이프가 부착된 알루미늄 stub에 고 정하고 sputter coater를 이용하여 gold:palladium (60:40) 혼합물을 시료의 표면에 20 nm 두께로 증착하였다. 시료의 관찰은 가속전압 5 kV에서 관찰거리 7.5 mm로 하여 3,300 배의 배율에서 수행되었다.
용해도와 팽윤력은 Kim (2014)의 방법을 변형하여 측정 하였다. 미세캡슐 0.2 g과 증류수 25 mL를 원심분리관(50 mL)에서 혼합하고 5분 간격으로 vortexing하면서 30분간 가열하였다(37, 55, 70, 85°C). 30분 후 냉수욕조에서 20분 간 냉각하고 원심분리(2,500×g, 20 min)한 후 상등액은 100 mL 정용플라스크로 옮기고 원심분리관은 뒤집어 10분 간 잔류용매를 제거하여 팽윤된 미세캡슐의 무게를 측정하 고 아래 식에 의해 팽윤력을 분석하였다.
용해도 측정을 위해 팽윤력 측정에서 회수하여 정용플라 스크로 옮겨 놓은 상등액에 증류수를 가하여 100 mL로 정용한 후 페놀-황산법(Dubios et al., 1956)으로 총당 함량 을 결정하여 다음 식에 의해 용해도를 결정하였다.
여기서 0.9는 포도당의 몰질량(180 g/mol)에 대한 무수 포도당의 몰질량(162 g/mol)의 비율이다. 또한 용해도 측정 을 위해 준비된 상등액의 일부를 취하여 320 nm에서 흡광 도를 측정하고, 단풍취 추출물의 표준곡선을 이용하여 미 세캡슐의 단풍취 추출물 농도를 결정하였다. 열처리에 의 해 미세캡슐로부터 방출된 단풍취 추출물은 미세캡슐 내의 단풍취 추출물 함량에 대한 상등액 내의 단풍취 추출물의 함량의 백분비율로 하였다.
Porcine pancreatin α-amylase (Sigma-Aldrich Co., St. Louis, MO, USA) 0.45 g에 증류수 4 mL를 넣고 원심분리(1,000 g, 12min)한 후 상등액 2.7mL와 amyloglucosidase (Megazyme International Ltd., Wicklow, Ireland) 0.3 mL를 혼합하여 효 소용액을 제조하였다. 미세캡슐 100 mg은 0.5M acetate buffer (pH 5.2) 4 mL, 효소용액 1 mL, 증류수 4 mL를 50 mL 원심분리관에 넣어 혼합한 후 유리구슬(직경 10 mm) 7개를 가하여 37°C의 진탕배양기에서 200 stroke/min의 속 도로 진탕하면서 효소반응을 180분간 시행하였다. 효소반 응 동안 10, 20, 30, 40, 60, 90, 120, 180분에서 각각 200 μL를 취하고 즉시 80% 에탄올 수용액 1.8 mL를 가하여 효소반응을 정지시킨 후 원심분리(13,000 rpm, 1 min)하여 침전된 전분분자들로부터 상등액을 회수하고, 320 nm에서 흡광도를 측정하여 단풍취 추출물의 표준곡선을 이용하여 효소반응 동안 방출된 단풍취 추출물의 농도를 결정하였 다. 효소반응에 의해 미세캡슐로부터 방출된 단풍취 추출 물은 미세캡슐 내의 단풍취 추출물 함량에 대한 상등액 내 의 단풍취 추출물의 함량의 백분비율로 하였다.
미세캡슐(5 mg)은 1,1-diphenyl-2-picrylhydrazyl (DPPH; Sigma-Aldrich Co., St. Louis, MO, USA) 용액과 혼합하여 실온에서 15분간 방치한 후 원심분리하고 상등액을 취하여 517 nm에서 흡광도를 측정하였다(Blois, 1958). 또한 미세 캡슐을 첨가하지 않은 DPPH 용액의 흡광도를 측정하여 다음 식과 같이 DPPH 라디칼 감소율을 계산하였다.
7 mM 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS; Sigma-Aldrich Co., St. Louis, MO, USA)와 2.45 mm potassium persulfate를 혼합하여 암소에서 24시간 동 안 방치하여 ABTS 자유라디칼을 형성시킨 후 734 nm에서 흡광도가 0.7 (±0.002)이 되도록 ethanol로 희석하였다. 미 세캡슐(5 mg)와 ABTS 용액 1.5 mL을 혼합하고 실온에서 5분간 방치한 다음 원심분리 하여 734 nm에서 상등액의 흡광도를 측정하였다(Re et al., 1998). 또한 미세캡슐을 첨 가하지 않은 동일한 ABTS 용액의 흡광도를 측정하여 다 음 식과 같이 ABTS 감소율을 계산하였다.
결과 및 고찰
미세캡슐의 핵물질로 사용되는 단풍취 추출농축액의 고 형분 함량은 8.33±0.01%(w/w)이었으며, 총 페놀성 화합물 함량은 단풍취 추출농축액 단위중량 당 160.11±6.92 mg 이었다. 본 연구에서 채택한 추출법과 유사하게 단풍취 추 출물을 제조한 Bae (2014)는 총 페놀성 화합물 함량이 148.94±10.23 mg/g이라고 보고하였고, 이의 표준편차를 고 려할 때 본 연구와 유사하였다.
단풍취 추출농축액과 생전분 또는 생전분-구연산 혼합물 의 비율을 달리하여 분무건조를 통해 제조된 미세캡슐들의 회수율을 Table 1에 나타내었다. 생전분 만을 적용하였을 때 회수율은 33.6-66.5%이었으며, 생전분-구연산 혼합물을 이용하였을 때는 39.3-71.9%이었다. 두 경우 모두 단풍취 추출농축액의 첨가량이 증가하면서 증가하였으나 통계적으 로 유의적인 차이를 나타내지 않았다(Table 1). 이와 같은 결과는 단풍취 추출농축액의 첨가량이 증가하면서 생전분 또는 생전분-구연산 혼합용액의 고형분 함량의 증가로 분 무건조에 의한 미세캡슐들의 비중이 증가하여 분무건조기 의 사이클론에 의한 회수가 용이하였기 때문으로 생각된다 (Tan et al., 2005).
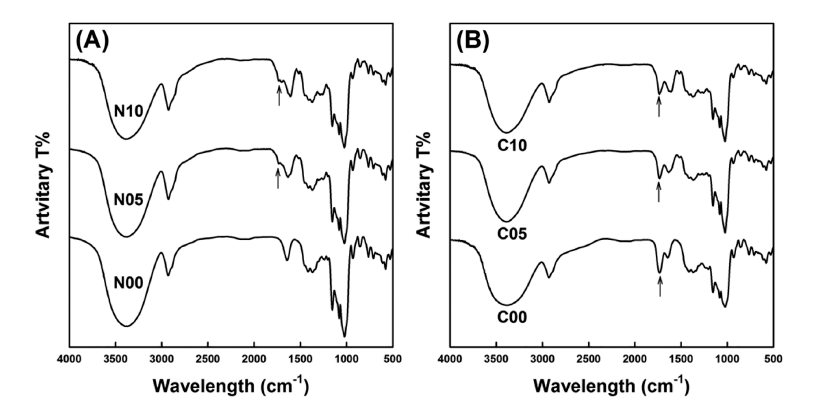
분무건조를 통해 얻은 미세캡슐들은 150°C에서 3시간 동안 건열처리한 후 FT-IR 스펙트럼을 탐색하여 구연산과 전분 사이의 에스테르(ester) 결합 형성 여부를 조사하였다 (Fig. 1). 생전분과 구연산 혼합용액을 이용한 경우에 있어 서는 건열처리에 의해 제조된 난소화성 구연산전분에서 관 찰되는 것처럼 C00, C05와 C10들은 1,740-1,760 cm-1 파 장 범위에서 에스테르 결합을 나타내는 피크들(Fig. 1B arrows)이 관찰되었다(Kim & Kim, 2015a, b). 한편 생전 분만을 이용한 경우 단풍취 추출농축액이 첨가되지 않은 N00는 생전분에서 보편적으로 관찰되는 FT-IR 스펙트럼을 나타내었지만(Kim & Kim, 2015a, b), 단풍취 추출농축액 이 첨가된 N05와 N10은 1,720-1,780 cm-1 파장 범위에서 약한 피크들이 관찰되었다(Fig. 1A arrows). 따라서 단풍취 추출농축액에 함유되어 있으며 카르복실 작용기(carboxyl group)를 보유하는 페놀성 화합물들과 전분의 수산기 (hydroxyl group) 사이에 탈수를 수반하는 축합반응에 의해 에스테르 결합이 형성되었음을 암시하는 것 같다.
건열처리한 단풍취 추출물 미세캡슐의 형태학적 특성은 전계방출주사전자현미경(FE-SEM)을 이용하여 조사하였다 (Fig. 2). 모든 처리군들은 표면이 심하게 함몰된 불규칙한 외형을 나타내었으며, 미세캡슐의 조성에 따른 차이는 관 찰되지 않았다. 탄수화물 고분자나 단백질만을 분무건조에 의해 미세캡슐로 제조할 때, 미세캡슐들은 매끄럽거나 거 친 표면을 보유하면서 크기가 다양한 구형을 보편적으로 가진다(Lee et al., 1997; Park, 1997). 또한 지용성 성분이 나 지용성 성분의 유화액을 핵물질로 탄수화물 고분자를 외벽물질로 하여 분무건조를 통해 미세캡슐을 제조할 때 미세캡슐의 표면은 부분적으로 함몰되지만 전체적으로 구 형을 나타내는 것으로 보고되었다(Bae & Kim, 2008). 본 연구에서 다른 연구들의 결과들과 상이한 것은 미세캡슐들 이 3시간의 건열처리 동안 추가적인 건조로 인한 수축현상 뿐만 아니라 구연산과 전분분자들 사이의 가교화로 미세캡 슐들을 구성하는 전분분자들 사이의 간격이 좁아지면서 미 세캡슐들이 접히거나 일그러지는 등의 구조적 변형이 발생 한 것으로 생각된다.

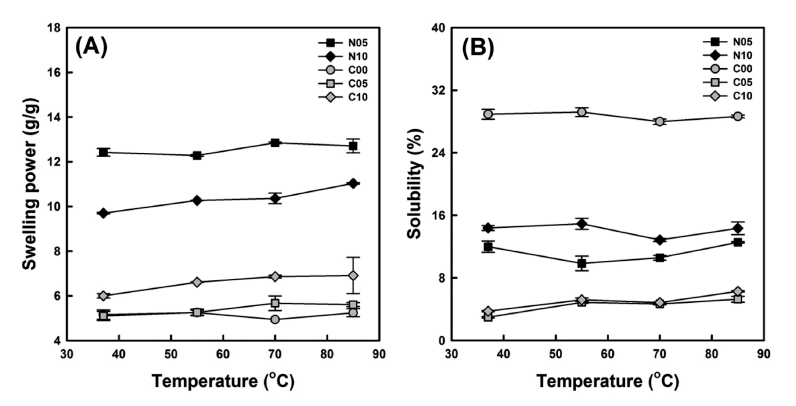
건열처리된 미세캡슐들의 팽윤력과 용해도를 측정하여 Fig. 3A와 3B에 나타내었다. 단풍취 추출농축액과 구연산 의 첨가 없이 제조된 미세캡슐(N00)은 본 연구에서 적용된 온도범위에서(37-85°C) 상등액과 침전물의 명확한 구분이 어려워 팽윤력(Fig. 3A)과 용해도(Fig. 3B)를 측정할 수 없 었다. 그러나 구연산 없이 단풍취 추출농축액이 첨가된 N05와 N10은 상등액과 침전물의 명확한 구분이 가능하였 다. N05와 N10은 생찰옥수수전분에서 보편적으로 관찰되 는 것(Sandhu et al., 2008)과 달리 온도증가에 따른 팽윤 력(Fig. 3A)과 용해도(Fig. 3B)의 변동폭이 크지 않고 거의 일정한 수준을 나타내었다. 또한 단풍취 추출농축액의 첨 가량이 증가할수록 단풍취 추출농축액의 지용성 때문에 팽 윤력은 감소하는 경향을 보인 것으로 생각된다(Fig. 3A). 반면 용해도는 증가하는 양상을 나타내었는데 본 연구에서 용해도는 미세캡슐의 전분 양에 대한 용출된 전분의 비율 로 계산하였기 때문에 N05보다 상대적으로 적은 전분함량 의 N10이 높은 용해도를 나타낸 것으로 보인다(Fig. 3B). 한편 생전분-구연산 혼합용액을 사용한 경우에는(C00, C05 & C10), 구연산을 첨가하지 않은 경우보다(N05 & N10) 낮은 수준의 팽윤력을 나타내었으며, 단풍취 추출농축액이 첨가된 미세캡슐들(C05 & C10)은 그렇지 않은 것(C00)보 다 낮은 팽윤력을 나타내었다(Fig. 3A). 이와 같은 결과는 구연산과 전분분자들 사이의 가교화로 인해 낮아진 팽윤력 에 더하여 단풍취 추출농축액의 지용성으로 C05와 C10의 수화(hydration)가 제한되어 미세캡슐의 팽윤이 낮아지는 것으로 보인다. 또한 용해도와 관련하여 단풍취 추출농축 액이 첨가되지 않은 C00은 구연산에 의해 가교되었음에도 적용된 온도에 걸쳐 27.98-29.20%의 범위를 나타내었으나 단풍취 추출농축액이 첨가된 C05와 C10은 각각 2.97- 5.27%와 3.74-6.28%로 급격한 용해도의 감소가 관찰되었 다. 결과적으로 구연산에 의한 전분분자들의 가교화보다는 단풍취 추출농축액의 지용성에 의한 미세캡슐의 용해도의 저해효과가 큰 것으로 판단된다.
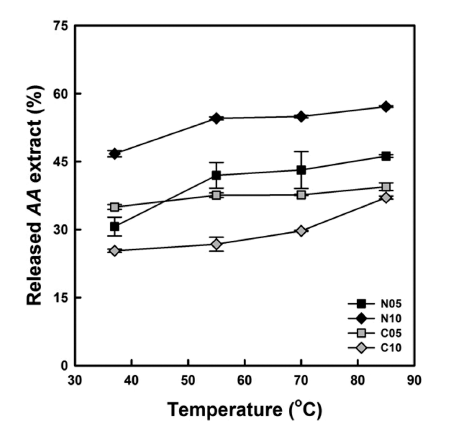
팽윤력과 용해도 분석에서 얻은 상등액 내의 단풍취 추 출물 농도를 측정하여 미세캡슐로부터 단풍취 추출물의 방 출에 대한 온도의 영향을 조사하였다(Fig. 4). 모든 경우에 있어 온도가 증가하면서 미세캡슐로부터 단풍취 추출물의 방출률은 점진적으로 증가하는 양상을 나타내었다. 주어진 생전분과 단풍취 추출물 혼합비율에서 구연산을 가교제로 사용한 경우(C05 & C10)가 그렇지 않은 것(N05 & N10) 보다 낮은 방출률을 나타내었다. 이는 구연산에 의한 가교 반응으로 전분분자들 사이의 간극이 좁아져(Kim & Kim, 2015b) 단풍취 추출물이 미세캡슐 외부로 용출이 용이하지 않았기 때문으로 생각된다.
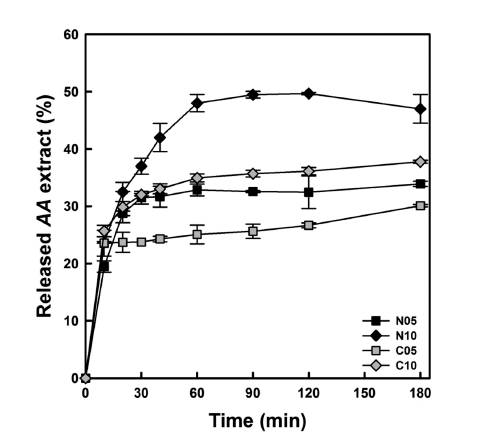
효소가수분해 시간에 따른 미세캡슐로부터 단풍취 추출 물의 방출을 조사하여 Fig. 5에 나타내었다. 미세캡슐로부 터 단풍취 추출물의 방출에 대한 온도의 영향(Fig. 4)과 유 사하게 주어진 생전분과 단풍취 추출농축액의 혼합비율에 서 구연산을 가교제로 사용한 미세캡슐들(C05 & C10)이 구연산을 사용하지 않은 것들보다 높은 방출율을 나타내 었다. 구연산 없이 제조된 N05는 30분까지 최대 방출율을 나타내고 효소가수분해 시간의 연장에 따라 큰 변화가 없 었으나, N10은 효소반응시간 60분까지 단풍취 추출물의 방출률이 급격히 증가한 후 일정한 수준을 유지하였다. 반 면 구연산을 가교제로 사용한 C05와 C10은 효소반응시간 10분 동안 다량의 단풍취 추출물을 방출한 후 효소반응시 간이 연장되면서 서서히 방출률이 증가하는 양상을 나타내 었다. 한편 효소반응시간 10분까지의 초기 단풍취 추출물 방출률을 비교할 때, N05는 19.46%와 C05는 23.56% 이 었으며, N10은 23.69%와 C10은 25.68%로 주어진 생전분 과 단풍취 추출농축액의 혼합비율에서 구연산을 첨가하여 가교반응시킨 C05와 C10이 그렇지 않은 것보다 높은 초 기 방출률을 나타내었다. 이러한 결과는 N05와 N10에 비 해 C05와 C10 미세캡슐 표면에 구연산전분 매트릭스에 포집되지 못한 단풍취 추출물들이 다량 존재한다는 것을 암시한다(Rosenberg et al., 1990). 또한 이 현상은 구연산 과 전분분자들 사이의 가교반응으로 전분분자들 사이의 간 극이 좁아져서(Kim & Kim, 2015b) 구연산전분 매트릭스 내의 단풍취 추출물들이 미세캡슐 표면으로 밀려 나왔기 때문으로 생각된다.
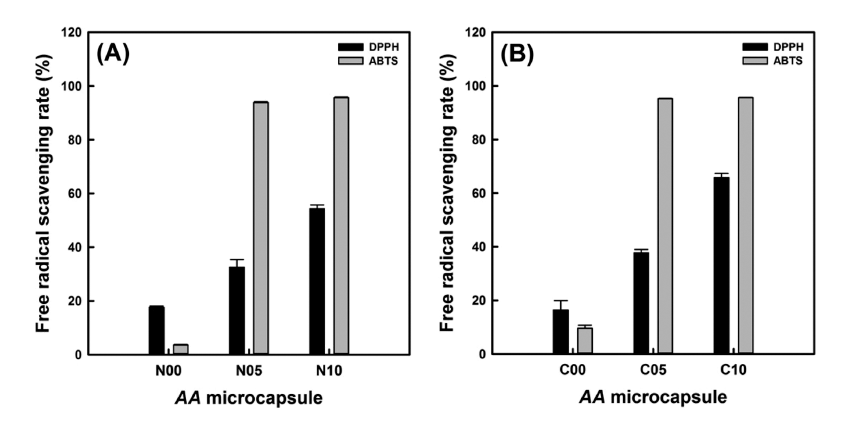
구연산을 가교제로 사용한 미세캡슐들(C05 & C10)이 구연산 무첨가군들보다 단풍취 추출물의 방출률이 적었다 (Fig. 4 & Fig. 5). 따라서 구연산과 전분분자들 사이의 가 교화로 구연산전분 내에 포집된 단풍취 추출물들과 전분분 자와 단풍취 추출물 내의 페놀성 화합물들의 에스테르 화 합물들이 항산화 활성을 보유하는지에 대해 조사하였다 (Fig. 6). DPPH 자유라디칼은 N05와 N10에 의해 각각 32.45%와 54.37%를, C05와 C10에 의해 각각 37.69%와 65.77%가 제거되었으며, 주어진 생전분과 단풍취 추출농축 액의 혼합비율에서 구연산을 가교제로 사용한 C05와 C10 이 그렇지 않은 것들에 비해 유의적으로 높은 수준을 나타 내었다. 단풍취 추출물 미세캡슐의 ABTS 자유라디칼 소거 와 관련하여 단풍취 추출물을 함유하고 있는 모든 시료들 이 ABTS 자유라디칼을 95% 이상을 소거하였다. 단풍취 추출물 미세캡슐의 DPPH와 ABTS 자유라디칼 소거활성의 차이는 반응혼합물의 알코올 함량의 차이 때문인 것으로 생각된다. DPPH는 메탄올이나 에탄올을 사용하여 용액으 로 제조하여 사용하지만(Blois, 1958), ABTS는 탈이온수에 용해시켜 에탄올로 희석하여 사용한다(Re et al., 1998). 따 라서 상대적으로 알코올 함량이 적은(탈이온수 함량이 높 은) ABTS 용액에서 팽윤된 미세캡슐들 내로 ABTS 자유 라디칼들의 침투가 용이하기 때문에 DPPH 자유라디칼보 다 ABTS 자유라디칼을 단풍취 추출물 미세캡슐들이 효과 적으로 소거하는 것으로 판단된다.
요 약
본 연구는 생전분을 외벽물질로, 구연산을 가교제로, 단 풍취 추출농축액을 핵물질로 분무건조를 통해 미립화한 후 건열처리를 통해 생전분과 구연산 사이의 가교반응을 통해 단풍취 추출물 미세캡슐을 제조하고, 이들의 물리화학적 특성을 분석하였다. 미세캡슐의 회수율과 단풍취 추출물의 포집율은 구연산을 가교제로 사용한 처리군들에서 모두 높 은 수준을 나타내었다. 건열처리를 통해 구연산과 전분분 자들 사이의 가교반응이 일어난 것을 확인하였으며, 단풍 취 추출물 내의 카르복실 작용기를 보유한 페놀성 화합물 과 전분분자 사이의 에스테르 결합이 형성될 수 있음을 확 인하였다. 단풍취 추출물 미세캡슐은 전반적으로 구형을 나타내었지만 건열처리로 인한 추가적인 탈수와 구연산과 전분분자들 사이의 가교반응으로 심한 함몰현상과 접힘현 상들이 발생하였다. 구연산을 첨가하지 않은 미세캡슐들은 구연산을 가교제로 사용한 것보다 높은 팽윤력과 용해도를 나타내었다. 또한 미세캡슐들로부터 단풍취 추출물의 방출 에 대한 온도와 효소처리의 영향은 구연산이 첨가되지 않 은 미세캡슐들로부터 주도적으로 일어났으나, 구연산을 가 교제로 사용한 미세캡슐들은 초기 방출률이 구연산을 첨가 하지 않은 것보다 높은 수준을 나타내었다. 단풍취 추출물 미세캡슐들은 수용성 환경에서 자유라디칼들을 용이하게 소거하였다. 모든 연구결과들을 종합해볼 때, 본 연구에서 제조된 단풍취 추출물 미세캡슐들은 항산화 활성을 유지하 며 가공적성이 개선되어 활용성이 높은 기능성 식품소재로 의 높은 잠재력을 보유하고 있는 것으로 판단된다.







