Article
탈지유채박으로부터 추출된 표면활성물질 중 Sinapine 제거에 관한 연구
이의석, 김산성, 신정아, 천진혁1, 김선주1, 이기택, 홍순택*
Studies on Sinapine Removal in Surface-Active Substances Extracted from Defatted Rapeseed Cake
Eui-Seok Lee, San-Seong Kim, Jung-Ah Shin, Jin-Hyuk Chun1, Sun-Ju Kim1, Ki-Teak Lee, Soon-Taek Hong*
Author Information & Copyright ▼
Dept. of Food Science and Technology, College of Agriculture and Life Science, Chungnam National University
1Dept. of Biological Environment and Chemistry, College of Agriculture and Life Science, Chungnam National University
*Corresponding author: Soon-Taek Hong, Dept. of Food Science and Technology, Chungnam National University, Daejeon 305-764, Korea Tel: +82-42-821-6727; Fax: +82-42-821-8900
hongst@cnu.ac.kr
© Korean Society for Food Engineering All rights reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jul 13, 2015; Revised: Oct 5, 2015; Accepted: Oct 6, 2015
Abstract
In this study, the process of sinapine removal from surface-active substances extracted from defatted rapeseed cake was established by using a mixed organic solvent system (diethylether:ethyl acetate = 1:1, v/v). The emulsifying properties of the purified surface-active substances were investigated. Thin layer chromatogram showed that sinapine was removed and purified surface-active substances were found to have better emulsifying properties compared to a non-purified one or commercial soy lecithin. As for interfacial tension data, purified surface-active substances showed values lower (10-1 wt%: 3.20±0.57 mN/m) than the non-purified ones (10-1 wt%: 14.16±0.27 mN/m). In addition, we found that fat globule size in emulsions with purified surface-active substances was much smaller than in emulsions with non-purified substances or commercial soy lecithin. These results could be attributable to the increased amount of phospholipids in purified substances following sinapine-removal.
Keywords: surface-active substances; sinapine removal; defatted rapeseed cake
서 론
유채(Brassica napus L.)는 식용유 생산을 목적으로 재배 되기 시작하여 최근에는 바이오디젤 원료로 각광을 받으며 전 세계적으로 생산량이 2011년 6,157만톤에서 2014년 7,171만톤으로 17% 증가하고 있다(Fleddermann et al., 2012, USDA, 2015). 이에 따라 유채유 생산 부산물인 유 채박이 2011년 3,569만톤에서 2014년 4,024만톤으로 상당 량 발생 하고 있으며(USDA, 2015), 이의 고부가가치화를 위한 실용화 연구 등이 지속적으로 수행되고 있다 (Leckband et al., 2002; Lee et al., 2015).
유채박의 조성은 주로 지방(3.5%), 단백질(36%), 조섬유 (12%) 및 회분(6.1%) 등으로 이외에도 각종 유용성분(당지 질, 플라보노이드, 토코페롤, 인지질 등)이 다량 함유되어 있다(Bell, 1993; Newkirk et al., 2003). 특히 천연유화제로 다양한 식품 및 의약품 제조에 사용되는 상업용 레시틴의 대부분을 구성하는 인지질 함량은 유채 중에 1.5-3.6%로 대표적 레시틴 제조 원료인 대두 중의 함량 수준(1.1- 3.2%)과 유사한 것으로 보고되었다(Szuhaj, 1989; Dunford & Temelli, 1995). 따라서 본 실험실에서는 천연유화제를 개발할 목적으로 탈지 유채박으로부터 인지질을 포함하는 표면활성물질의 효율적 추출 및 이의 유화특성 구명에 관 한 일련의 연구(Kim et al., 2013a; Kim et al., 2013b)를 지속적으로 수행하고 있다.
한편, 유채박 중에는 항영양물질인 sinapine, glucosinolates, phytic acid 등이 함유되어 동물 사료 및 식품으로 이용되 는데 제한이 되고 있으며(Fenwick, 1982; Hu & Duvnjak, 2004; Luo et al., 2012), 이중 sinapic acid와 choline이 결 합된 sinapine은 쥐의 내장을 파괴하고 가금류의 맹장에서 trimethylamine (TMA)의 발생을 유도하여 닭 사료에 함유 되면 계란이 갈색으로 변하고 비린내(fishy odor) 및 쓴맛 (bitter taste)의 원인이 되는 것으로 보고되었다(Bell, 1993). 따라서 여러 연구자들에 의해 유채박 중 sinapine을 제거하 기 위한 방법으로 고온처리(Larsen et al., 1983; Mansour et al., 1993; Newkirk & Classen, 2002), 유기용매처리 (Dabrowski & Siemieniak, 1987) 등이 수행되었다. Larsen et al. (1983)는 유채박을 100°C에서 30분간 로스팅(roasting) 처리 할 경우 sinapine이 oligomeric sinapine으로 바뀌어 69.7 µmole/150mg N에서 57.9 µmole/150mg N으로 감소됨 을 보고하였고, Dabrowski & Siemieniak (1987)는 methanolammonia water 혼합용매 시스템을 이용하여 유채박 중 sinapine 함량을 1.69 g/100 g에서 0.17 g/100 g으로 일정 수 준 감소시켰다.
한편, 이전 연구(Kim et al., 2013a)를 통해 얻은 유채박 초임계 추출물(표면활성물질) 중에는 일정량의 sinapine이 함유된 것으로 보고되어(Lee et al., 2014) 이를 식품용 유 화제로 사용하기 위하여 이의 제거가 반드시 필요한 실정 이다. 따라서 본 연구에서는 이전 연구(Kim et al., 2013a) 를 통하여 얻어진 유채박 표면활성물질을 시료로 하여 sinapine 제거 공정을 확립하고, 얻어진 정제 표면활성물 질의 계면 특성 등을 조사하였다.
재료 및 방법
재료
유채박은 2011년산 잡종박으로 농촌진흥청 국립식량과학 원 바이오에너지작물센터에서 공급받아 -70°C deep freezer (DF-8514, Ilshin Lab. Co. Ltd., Daejeon, Korea)에서 보관 하면서 시료로 사용하였다. 표준물질 phosphatidylcholine (PC), phosphatidylethanolamine (PE), sinapic acid는 Sigma 사(St. Louis, MO, USA)에서, sinapine은 Chem Faces사 (Wuhan, China)에서 구입하여 사용하였고, 대두 레시틴은 ㈜일신웰스(Cheongwon, Korea)에서 제공받아 사용하였으 며 이외 실험에 사용한 모든 시약은 특급 이상의 등급을 사용하였다.
표면활성물질 추출물 제조
탈지 유채박 중 표면활성 추출물의 제조는 이전 연구 (Kim et al., 2013a)에서 얻은 추출 최적조건인 추출압력 150 bar, 추출온도 65°C, 보조 용매량(에탄올) 250 g을 사 용하여 초임계 추출·획득하였다. 이때 1회 추출에 사용된 탈지 유채박은 50 g으로 하였으며, 수기에 포집된 추출물 은 감압농축기(NE-1000SW, Eyela, Tokyo, Japan)를 이용 하여 에탄올을 완전히 제거한 후 -20°C 냉동 보관하면서 표면활성물질 시료로 사용하였다.
표면활성물질 추출물중 sinapine 제거
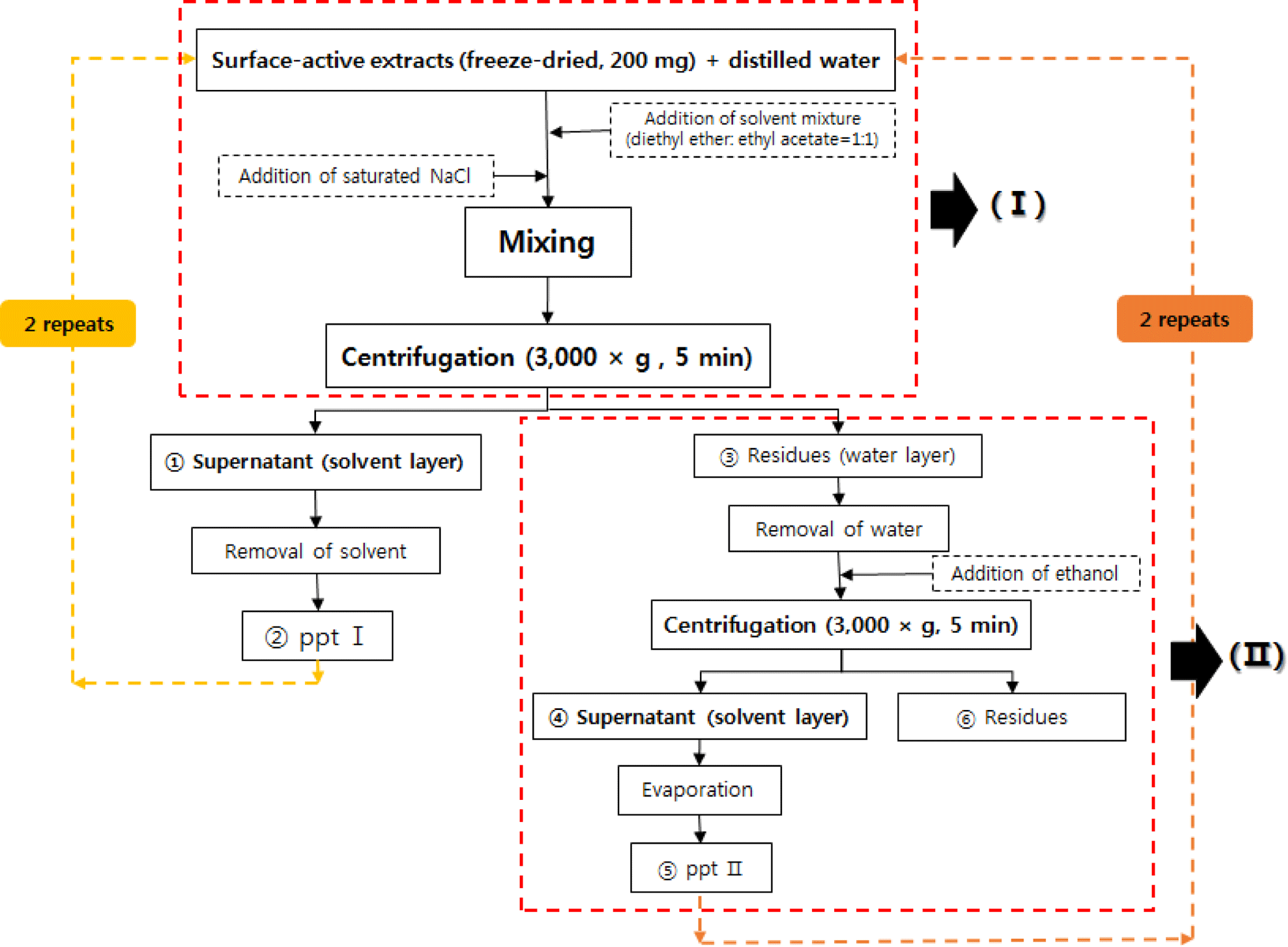
표면활성물질 추출물 중 sinapine 제거과정은 Fig. 1에 나타냈다. 즉, 표면활성추출물(200 mg)을 시험관에 취하고 증류수(30-fold, w/w)를 이용하여 완전히 분산/용해하였다. 여기에 혼합용매(diethylether:ethyl acetate = 1:1, v/v)를 넣 고(35-fold, 시료무게 기준) 혼합한 후 포화 염화나트륨 용 액을 적량 첨가하여 원심분리(3,000 × g, 5분)한 후, 상등액 (supernatant ①, solvent layer)을 취하고 질소(N2)를 이용하 여 혼합용매가 완전히 제거된 ppt I (②) 및 잔유물(residue ③)을 얻었으며, ppt I은 다시 과정(I)을 2회 더 처리하여 순도를 높였다. 한편, 잔유물 ③은 감압농축기를 이용하여 수분을 완전히 제거한 후 에탄올을 소량 첨가하여 용해·원 심분리 하여 상등액(supernatant ④)을 취하고, 에탄올을 제 거하여 ppt II(⑤) 및 잔유물(residues ⑥)을 얻었으며, ppt II는 다시 과정(I)과 (II)를 2회 반복하여 순도를 높였다. 이 상의 모든 과정에서 얻은 ppt I, II 및 잔유물을 수집하여 이를 각각 최종 ‘정제 표면활성 물질’ 및 ‘잔유물(residues)’ 시료로 하였다.
Fig. 1.
Procedure of sinapine removal in surface-active substances extracted from defatted rapeseed cake.
Download Original Figure
Thin Layer Chromatography (TLC) 분석
정제된 표면활성물질은 20 mg/mL의 농도로 준비하여 TLC plate (100 × 100 mm, silica gel 60 F254, 0.5 mm, Merck Co., Darmstadt, Germany)에 8 µL씩 spotting한 후 전 개용매(chloroform:methanol: acetic acid:water = 170:25:25:6, v/v/v/v)를 이용하여 전개 시켰다(Smiles et al., 1989). 전개 가 완료된 TLC plate는 상온에서 5분간 건조하고 포화 요 오드(I2) 탱크에 넣어 5분간 발색시킨 후 표준물질(PC, PE, sinapic acid, sinapine)의 Rf (retention factor)와 비교 확인 하였다.
High Performance Liquid Chromatography (HPLC)를 이용한 Sinapine 분석
시료 10 mg을 0.1% phosphoric acid (v/v)가 함유된 10% methanol 1 mL에 첨가하여 shaking bath (37°C, 3시간 )에서 추출한 후 원심분리(14,000 × g, 10°C, 10분)하고, 상 등액을 취하여 0.45 µm syringe filter로 여과하여 HPLC 분석용 시료로 사용하였다. HPLC 분석 조건은 Table 1에 나타내었다(Satu et al., 2003).
Table 1.
Operating conditions of HPLC for the analysis of sinapine contents in not-purified, purified surface-active substances and residues
| Instrument |
Agilent Technologies 1200 series |
| Column |
Capcell PAK C18 column |
|
|
(4.6 × 250 mm, 5 μm; Shiseido, Tokyo, Japan) |
| Wavelength |
350 nm |
| Injection volume |
10 μL |
| Oven temperature |
40°C |
| Flow rate |
1.0 mL/min |
| Mobile phase |
Solvent A |
|
|
MeOH:water:acetic acid = 5:92.5:2.5, (v/v/v) |
|
|
Solvent B |
|
|
MeOH:water:acetic acid = 95:2.5:2.5, (v/v/v) |
| Gradient condition |
0.1 min, solvent B 0% |
|
|
10.0 min, solvent B 20% |
|
|
15.0 min, solvent B 40% |
|
|
20.0 min, solvent B 40% |
|
|
25.0 min, solvent B 50% |
|
|
28.0 min, solvent B 50% |
|
|
30.0 min, solvent B 100% |
Download Excel Table
Sinapine 제거 표면활성물질의 유화특성
정제된 표면활성물질을 n-tetradecane에 농도별(10-1-10-5 wt%)로 용해시키고 5 mM bis-Tris (pH 7)를 수상으로 하여 oil-in-water 계면을 형성하였다. 측정은 Du Nouy Ring 방 법을 채택하였으며(Shaw, 1992; Couper, 1993), 계면 형성 30분 후에 표면장력계(Attension sigma 700, Biolin Scientific Inc., Stokholm, Sweden)를 이용하여 계면장력을 측정하 였다.
유화액 조제 및 지방구 크기 측정
정제된 표면활성물질 일정량을 유상(oil phase)인 카놀라 유(canola oil)에 용해한 후 수상(20 mM bis-tris, pH 7, 0.02% sodium azide)과 혼합하고 이를 혼합기(L4RT, Silverson Machine Chesham, UK)를 이용하여 5000 rpm에 서 5분 동안 예비균질 하였다(표면활성물질 0.3 wt%, 카놀 라유 10 wt%, 20 mM bis-Tris, pH 7). 예비 균질액은 고 압균질기(M-110Y, Microfludics, MA, USA)를 총 3회 통 과(3000 psi: 2번, 500 psi: 1번)시켜 최종 유화액을 제조하 였으며(Kim et al., 2013b), 유화액 중 분산되어 있는 지방 구의 크기는 입도분석기(Malvern Master Sizer S, Malvern Co., Worcestershire, UK)를 사용하여 측정하고 측정결과는 volume-surface mean diameter (d32) 및 weight mean diameter (d43)로 표시하였다(McClements, 2005).
d32=Σdi3ni /Σdi2ni (ni: numbers of particle on size di)
d43=Σdi4ni /Σdi3ni (ni: numbers of particle on size di)
통계처리
본 실험은 3회 반복 측정하여 평균값과 표준편차로 나타 냈고, 평균값 간의 유의성 검정은 SAS ver. 9.4 (SAS, 2015, SAS Institute Inc., Cary, NC, USA)을 이용하여 ANOVA 분석 후 p < 0.05에서 Duncan’s multiple range test로 실시 하였다.
결과 및 고찰
탈지유채박으로 추출된 표면활성물질 중 sinapine 제거
이전 연구(Kim et al., 2013a)에서 얻은 최적 추출 조건 (추출압력 150 bar, 추출온도 65°C, 보조용매량(에탄올) 250 g)을 이용하여 탈지 유채박으로부터 표면활성물질(이 하 비정제 표면활성물질)을 추출하고, 이를 Fig. 1의 절차 에 따라 sinapine이 제거된 정제 표면활성물질을 얻었다. Fig. 2는 일련의 용매 추출·정제과정(Fig. 1)에 따른 sinapine 분획의 이동 형태를 보여주고 있다. Lane 1-3은 각각 sinapic acid, PC와 PE 및 sinapine 표준물질이고, lane 5는 정제 표면활성물질의 크로마토그램으로 sinapine이 본 정제 과정을 통하여 제거되었음을 알 수 있었고, 제거된 sinapine은 잔유물(lane 6)에 존재하고 있음이 확인되었다.
Fig. 2.
Thin-layer chromatogram of surface-active substances extracted from defatted rapeseed cake.
Lane (1) sinapic acid (band a, standard); Lane (2) phosphatidylethanolamine (band b, standard) and phosphatidylcholine (band c, standard); Lane (3) sinapine (band d, standard); Lane (4) surface-active substances (not-purified); Lane (5) surface-active substances (purified); Lane (6) residues.
Download Original Figure
HPLC에 의한 정제 표면활성물질 중 sinapine 분석
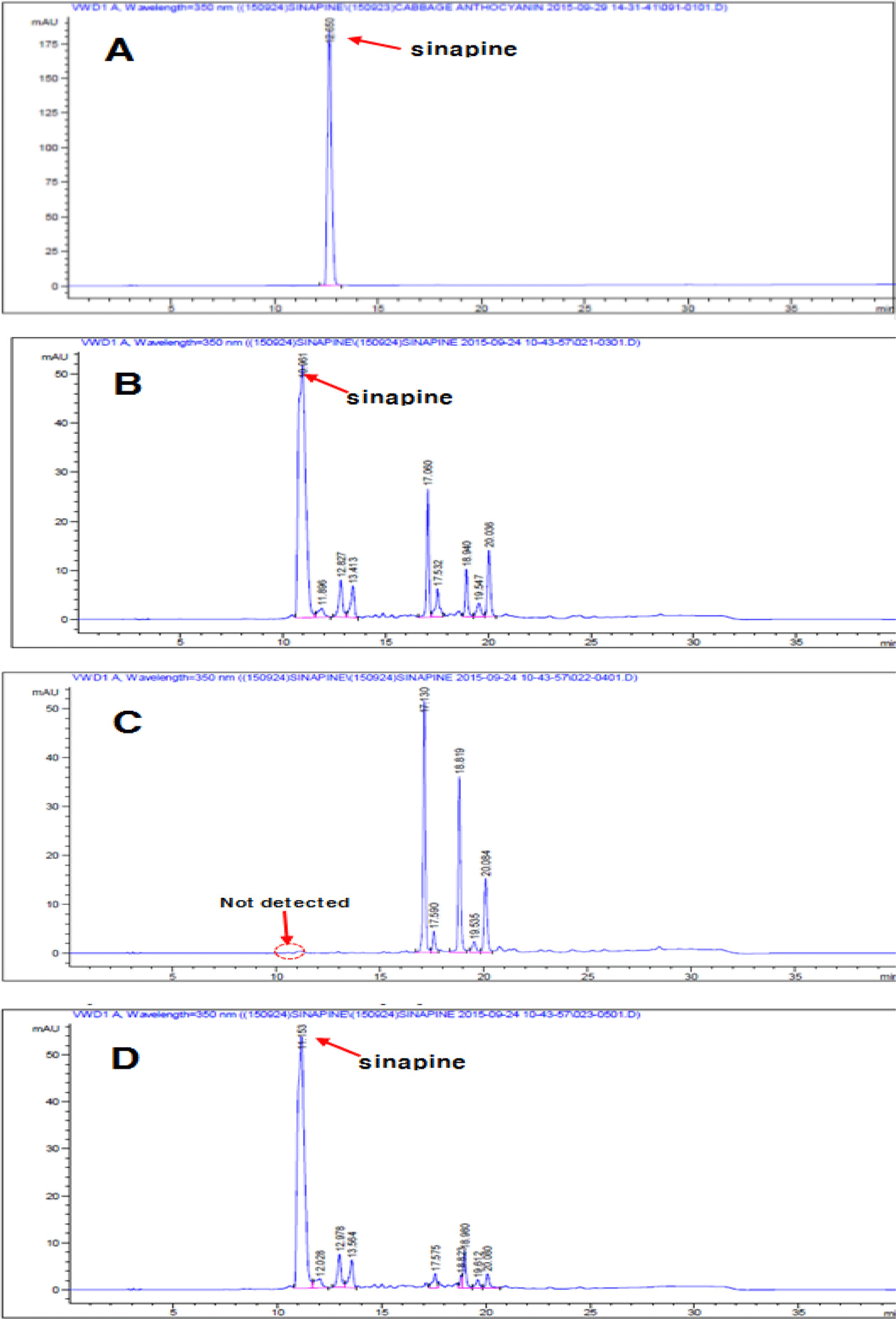
Fig. 3과 Table 2는 비정제, 정제 표면활성 물질 및 잔유 물(residues) 중의 sinapine에 대한 정량분석 결과를 나타내 고 있다. 비정제 표면활성 물질과 잔유물 중의 sinapine 함 량은 각각 505.75±0.05 mg/g, 480.88±0.07 mg/g으로 높게 나타났으며, 반면 정제 표면활성 물질에서는 검출되지 않았 다. 이 결과는 본 실험에서 시도된 정제방법이 Dabrowski & Siemieniak (1987)의 methanol-ammonia water 혼합용매 시스템을 이용하는 방법에 비하여 sinapine 제거에 있어서 매우 효과적이었음을 보여주고 있다.
Fig. 3.
HPLC Chromatogram of sinapine in not-purified, purified surface-active substances and residues.
(A) sinapine (standard); (B) not-purified surface active substances; (C) purified surface-active substances; (D) residues.
Download Original Figure
Table 2.
Sinapine contents (mg/g dry wt.) in not-purified, purified surface-active substances and residues
| Sample |
Purified surface-active substances (mg/g) |
Surface-active extracts (not-purified) (mg/g) |
Residues (mg/g) |
| Sinapine |
N.D.1) |
505.75±0.052)a |
480.88±0.07b |
Download Excel Table
Sinapine 제거 표면활성물질의 유화 특성
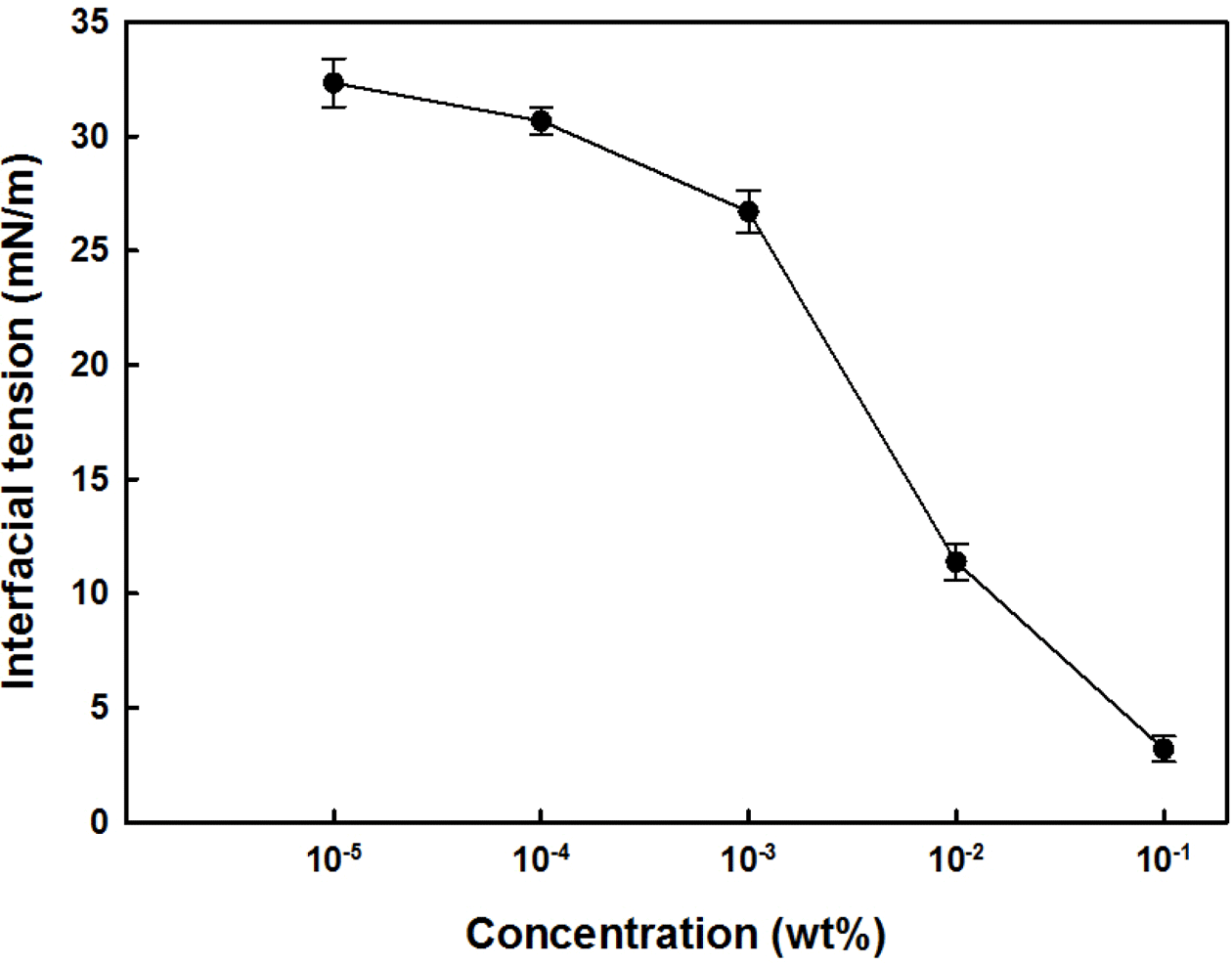
Fig. 4와 Table 3은 정제표면활성 물질의 유화특성을 나 타내는 계면장력과 유화액지방구 크기의 측정 결과이다. Fig. 4에 나타난 대로 정제표면활성 물질의 첨가 농도가 증가할수록 계면장력은 낮아졌으며[32.33±1.06 mN/m (10-5 wt%)에서 3.20±0.57 mN/m (10-1 wt%)], 이는 비정제 표면 활성물질의 계면장력(10-1 wt%; 14.16±0.27 mN/m) (Kim et al., 2013b) 보다 매우 낮은 수준이었다. 또한 정제, 비 정제 표면활성 물질 및 대두 레시틴을 각각 0.3 wt% 첨가 하여 유화액을 제조하여 지방구 크기를 조사한 결과(Table 3), 지방구 크기(d43)는 각각 정제 표면활성물질 유화액이 가장 작고, 비정제 표면활성물질, 대두 레시틴 순으로 나 타났다(0.64±0.01 µm < 1.02±0.06 µm < 2.79±0.21 µm). 이 는 추출물 정제과정을 통하여 sinapine 제거에 따라 상대적 으로 유화 성분인 인지질의 함량이 증가하여 나타난 결과 로 생각되었으며, 또한 본 정제물은 대두 레시틴 보다 유 화기능이 우수함을 시사하고 있다.
Fig. 4.
Changes in interfacial tension of purified surface-active substances with respect to concentration.
Download Original Figure
Table 3.
Influence of emulsifier type on the mean droplet diameter (d32, d43) of 10 wt% canola oil-in-water emulsions (0.3 wt% emulsifier, 20 mM bis-Tris buffer, pH 7.0)
| Sample |
d
32
|
d
43
|
| Purified surface-active substances |
0.31±0.01b |
0.64±0.01c |
| Surface-active extracts (not-purified) |
0.73±0.05a |
1.02±0.06b |
| Commercial lecithin from soybean |
0.69±0.07a |
2.79±0.21a |
Download Excel Table
따라서 상기 결과에 근거하여 본 정제 표면활성 물질은 유채박 중에 존재하는 sinapine이 제거되고 동시에 항산화 물질인 sinapic acid가 함유되어 있으며(Wang et al., 2014), 또한 기존 대두 레시틴보다 유화특성(계면장력, 지방구 크 기 등)이 우수하므로 식품용 유화제로서 적용이 가능한 후 보 물질로 판단되었다.
결 론
본 연구는 혼합 유기용매 시스템을 이용하여 유채박 초 임계 추출 표면활성물질로부터 sinapine 제거 공정을 확립 하고, 정제된 표면활성물질의 유화 특성을 조사하였다. TLC 분석결과 일련의 정제과정을 통하여 정제 표면활성 물질 중에는 sinapine이 제거되었음을 확인할 수 있었으며, 정제 표면활성 물질은 비정제 표면활성물질 혹은 상업용 대두 레시틴과 비교하여 우수한 유화특성을 나타내었다. 계면장력 특성에 있어서 정제 표면활성물질은 비정제 표면 활성물질의 경우와 비교하여 매우 낮았으며, 또한 정제 표 면활성물질 유화액 중 지방구 크기는 비정제 표면활성물질 혹은 상업용 대두 레시틴의 경우보다 낮은 것으로 측정되 었다. 이러한 결과는 탈지 유채박 초임계 추출 표면활성물 질 중 sinapine 제거에 따라 상대적으로 유화 성분인 인지 질의 함량이 증가하여 나타난 결과로 생각되었다.
감사의 글
본 논문은 농촌진흥청 공동연구사업(과제번호 PJ009164) 의 지원에 의해 이루어진 것임.
REFERENCES
Bell JM. Factors affecting the nutritional value of canola meal: A review. Can. J. Anim. Sci. 1993; 73 p. 679-697.

Couper A. In: Rossiter BW, Baetzold RC, editors. Surface tension and its measurement. Physical Methods of Chemistry. Investigations of Surfaces and Interfaces- Part A. 1993; John Wiley & Sons, IncNew York, NY, USA p. 1-71.

Dabrowski K, Sosulski F. Extraction of phenolic compounds from canola during protein concentration and isolation. Proceedings 6th International Rapeseed Conference. 1983; ; May 17-19, Paris, France p. 1577-1582.

Dunford NT, Temelli F. Extraction of phospholipids from canola with supercritical carbon dioxide and ethanol. J. Am. Oil Chem. Soc. 1995; 72 p. 1009-1015.

Fleddermann M, Fechner A, Rößler A, Bähr M, Pastor A, Liebert F, Jahreis G. Nutritional evaluation of rapeseed protein compared to soy protein for quality, plasma amino acids, and nitrogen balance-A randomized cross-over intervention study in humans. Clin. Nutr. 2012; 32 p. 519-526.

Fenton TW, Lejung J, Clandinin DR. Phenolic components of rapeseed meal. J. Food Sci. 1980; 45 p. 1702-1705.

Fenwick GR. The assessment of a new protein source. Rapeseed. Proc. Nutr. Soc. 1982; 41 p. 277-288.

Hu J, Duvnjak Z. The production of a laccase and the decrease of the phenolic content in canola meal during the growth of the fungus Pleurotus ostreatus in solid state fermentation processes. Eng. Life Sci. 2004; 4 p. 50-55.

Kim JW, Jeong YS, Lee ES, Gil NY, Kim SS, Kim HH, Kim TY, Lee YH, Jang YS, Lee KT, Hong ST. Emulsifying properties of surface-acitive substances from defatted rapeseed cake by supercritical carbon dioxide. J. Korean Oil Chem. Soc. 2013a; 30 p. 635-648.

Kim JW, Jeong YS, Gil NY, Lee ES, Lee YH, Jang YS, Lee KT, Hong ST. Extraction of surface-active substances from defatted rapeseed meal (Brassica napus L.) by supercritical carbon dioxide. Korean J. Food & Nutr. 2013b; 26 p. 831-840.

Larsen LM, Olsen O, Plöger A, Sørensen H. Phenolic cho-line esters in rapeseed: possible factors affecting nutritive value and quality of rapeseed meal. Proceedings 6th International Rapeseed Conference. 1983; ; May 17-19, Paris, France p. 1577-1582.

Leckband G, Franuen M, Friedt W. NAPUS 2000. Rapeseed (Brassica napus) breeding for improved human nutrition. Food Res. Int. 2002; 35 p. 273-278.

Lee ES, Kim SS, Gil NY, Park EJ, Lee KT, Chang YS, Hong ST. Purification of surface-active substances from rapeseed cake. Proceedings of 2014 International Symposium and Annual Meeting. 2014; October 27-29, Daejeon, Korea-285.

Lee HK, Lee YH, Kim KS, Jang YS, Choi IH. The effect control of root-knot nematode by using rapeseed meal in continuous cultivation at greenhouse. Korean J. Plant Res. 2015; 28 p. 93-100.

Luo Y, Ai Q, Mai K, Zhang W, Xu W, Zhang Y. Effects of dietary rapeseed meal on growth performance, digestion and protein metabolism in relation to gene expression of juvenile cobia (Rachycentron canadum). Aquaculture. 2012; 368-369 p. 109-116.

Mansour EH, Dworschak E, Lugasi A, Gaal O, Barna E, Gergely A. Effect of processing on the antinutritive factors and nutritive value of rapeseed products. Food Chem. 1993; 47 p. 247-252.

McClements DJ. Food Emulsions: Principles, Practice and Techniques. 20052nd edCRC PressBoca Raton, FL, USA-17.

Newkirk RW, Classen HL, Scott TA, Edney MJ. The digestibility and content of amino acids in toasted and nontoasted canola meals. Can. J. Anim. Sci. 2003; 83 p. 131-139.

Newkirk RW, Classen HL. The effects of toasting canola meal on body weight, feed conversion efficiency, and mortality in broiler chickens. Poultry Sci. 2002; 81 p. 815-825.

SAS SAS User's Guide. Ver. 9.4. 2015SAS InstituteCary. NC. USA.

Satu V, Anne SM, Marina H. Quantitative analysis of the phenolics in rapeseed meal and oils processed differently using enzymatic hydrolysis and HPLC. Eur. Food Res. Technol. 2003; 217 p. 517-523.

Shaw DJ. Liquid-gas and liquid-liquid interfaces. Introduction to Colloids and Surface Chemistry. 1992; 4rd edButterworth-HeinemannBurlington, MA, USA p. 72-74.

Smiles A, Kakuda Y, Macdonald BE. Effect of degumming reagents on the composition and emulsifying properties of canola, soybean and sunflower acetone insolubles. J. Am. Oil Chem. Soc. 1989; 66 p. 348-352.

Szuhaj BF. In: Schneider M, editor. Lecithins: sources, manufacture & uses. Fractionation and Purification of Lecithin. 1989; The American Oil Chemists’ SocietyChampaign, IL, USA p. 109-112.

USDA (United States Department of Agriculture) Oilseed: World Markets and Trade. 2015; p. 1-36.

Wang XY, Yang D, Zhang H, Jia CH, Shin JA, Hong ST, Lee YH, Jang YS, Lee KT. Antioxidant activity of soybean oil containing 4-vinylsyringol obtained from decarboxylated sinapic acid. J. Am. Oil Chem. Soc. 2014; 91 p. 1543-1550.