서 론
최근 우리나라는 평균수명의 연장과 함께 고령화 사회가 급속히 진행되면서 건강한 삶과 질병 치료에 대한 관심이 높아지고 있다(Lee et al., 2003; Jin et al., 2012; Na et al., 2013). 특히 버섯, 청국장, 김치 등의 식품들이 다양한 생리활성 조절을 통하여 건강과 질병 예방에 도움을 주고 있는 것으로 보고되면서 천연물소재에 대한 의약품 및 기 능성 제품 원료로의 연구가 더욱 활발해 지고 있다(Jung et al., 1995; Jeong et al., 1995; Kim et al., 1996; Kang et al., 2009; Link et al., 2010).
활성산소종(reactive oxygen species, ROS)에 의한 단백 질, 당, 지질 및 DNA 등의 비가역적 파괴로 인한 만성 염 증질환, 뇌졸중 및 심장질환 등이 보고되면서 항산화제에 대한 관심이 높아지고 있다. 하지만 다양한 합성 항산화제 의 부작용이 보고 되면서 천연물 유래의 항산화제에 관한 연구가 활발하게 수행되고 있다(Song et al., 2002). 항산화 활성 측정 기법으로는 2,2-diphenyl-1-picrylhydrazyl (DPPH) 법(Blois, 1958), 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS)법(Rice-Evans & Miller, 1994), oxygen radical absorbance capacity (ORAC)법(Ghiselli et al., 1995) 등이 개발되어 있으며 널리 사용되고 있다.
곰취(Ligularia fischeri)는 국화과 곰취속에 속하는 여러 해살이 풀로써 예로부터 우리나라와 중국, 일본 등의 동아 시아 지역에서 식용뿐만 아니라 전통 의약제로 사용하였으 며, 진해, 거담, 진통 및 혈액순환에 효과가 있는 것으로 보고되면서 의약품 및 건강기능성 제품의 원료로 연구가 진행되고 있다. 최근에는 곰취의 다양한 생리활성 물질들 이 항산화(Choi, 2007; Shang et al., 2010), 항염(Hwang et al., 2002; Choi & Kim, 2008; Kim et al., 2011), 항비 만(Cha et al., 2012) 효과를 지닌다고 보고하였으며, Cho et al. (2013)은 곰취 추출물이 epidermal growth factor receptor (EGFR)와 integrin의 발현 조절을 통하여 폐암 세 포주의 증식과 이동을 조절한다고 보고하였다. 그러나 국 내 재배 지역에 따른 곰취의 생리활성에 차이가 있는지에 대한 과학적 자료 및 증거는 확보되어 있지 않은 실정이다 . 따라서 본 연구에서는 식용으로 사용하는 곰취를 국내 산지별(태백, 정선, 양구, 평창, 인제)로 수집하여 항산화 효과를 평가하였으며, 곰취의 활성성분 분리를 통한 항산 화 효능 평가를 통하여 산지별 곰취의 항산화 효능에 대한 탐색 및 소재 개발 가능성을 검토하고자 하였다.
재료 및 방법
표준품 isochlorogenic acid B와 isochlorogenic acid C (Chengdu Biopurify Phytochemicals Ltd., Chengdu, China) 는 순도 98% 이상을 구입하여 사용하였고, 용매는 특급 및 1급 시약을, column chromatography용 Sephadex LH- 20 (GE Healthcare Bio-Science AB, Uppsala, Sweden), Diaion HP-20 (Mitsubishi Chemical Corporation, Tokyo, Japan)을 사용하였다. TLC plate는 pre-coated silica gel 60 F254 (0.25 mm, Merck, Darmstadt, Germany)를 사용하였다. 발색 시약은 10% H2SO4을 사용하였으며 UV 흡광도는 254 nm, 365 nm에서 확인하였다. HPLC는 HPLC 1200 series (Agilent Technologies, San Diego, CA, USA)와 prep-HPLC (LC-8A, Shimadzu Corporation, Kyoto, Japan) 를 NMR spectra는 700 MHz NMR spectrometer (Avance 700, Bruker, Fallanden, Switzerland)를, 그리고 MS는 Finnigan TSQ Quantum mass spectrometer (TSQ Quantum, Thermo, Watertown, MA, USA)를 각각 이용하여 측정하 였다.
곰취(Ligularia fischeri) 3 kg에 50% EtOH (20 L)로 24 시간 2회 냉침 추출하였다. 추출액을 여과한 후에 여액을 감압농축기를 이용하여 50% 에탄올 추출물 750 g을 얻었 으며, 추출물을 증류수에 현탁시킨 후 n-hexane (0.76 g), CH2Cl2 (0.38 g), ethyl acetate (EtOAc, 1.32 g) 및 n-BuOH (3.75 g)로 용매 분획 후 동결건조하였다. EtOAc 분획물 (1.32 g)은 용리용매로 100% H2O, MeOH (20%, 40%, 60%, 80%, 100%)을 사용하여 Diaion HP-20 컬럼크로마 토그래피를 실시하여 6개의 소분획(G49-1~6)으로 분취하 였다. G49-2 (92.5 mg) 분획물은 CH3CN (10%→100%, 0.1% TFA)을 이동상으로 prep-HPLC를 시행하여 화합물 1 (7.3 mg)과 2 (3.3 mg)를 분리하였으며 G49-3 (78.3 mg) 은 CH3CN (30%→100%, 0.1% TFA)을 이동상으로 prep- HPLC를 실시하여 화합물 3 (11.5 mg), 4 (8.7 mg) 및 5 (8.7 mg)를 분리하였다. 또한, BuOH 분획물(790 mg)은 H2O-MeOH (2:1, v/v)을 이동상으로 Sephadex LH-20 컬럼 크로마토그래피를 시행하여 화합물 5 (26.0 mg)를 분리하 였다. 분리된 화합물의 구조는 NMR 및 ESI-MS data로 확인 후 기존의 문헌과 비교하여 규명하였다.
1H-NMR (700 MHz, MeOH-d4) (caffeoyl group): δ 7.42 (1H, d, J=16 Hz, H-7'), 7.03 (1H, s, H-2'), 6.98 (1H, dd, J=8.2 Hz, H-6'), 6.76 (1H, d, J=8.0 Hz, H-5'), 6.15 (H, d, J=16 Hz, H-8'), (quinic group): 5.06 (2H, m, H-3), 3.92 (1H, s, H-5), 3.42 (1H, s, H-4), 2.03-1.77 (2H, H- 2,6); 13C-NMR (MeOH-d4, 176 MHz) δ 175 (COOH), 165.8 (C-9'), 148.4 (C-4'), 145 (C-3'), 145.6 (C-7'), 125.6 (C-1'), 121.4(C-6'), 115.8 (C-5'), 114.8 (C-8'), 114.3 (C-2'), 73.5 (C-1), 70.9 (C-4), 70.3 (C-5), 68 (C-3), 37.2 (C-2), 36.2 (C-6), ESI-MS (negative mode) m/z 179 [M-H]–.
1H-NMR (700 MHz, MeOH-d4) (caffeoyl group): δ 7.46 (1H, d, J=16 Hz, H-7'), 7.02 (1H, d, J=2.0 Hz, H-2'), 6.97 (1H, dd, J=8.2 Hz, H-6'), 6.76 (1H, d, J=8.0 Hz, H- 5'), 6.20 (1H, d, J=16 Hz, H-8'), (quinic group): 5.17 (2H, m, H-3), 3.86 (1H, dd, J=12.4 Hz, H-5), 3.54 (1H, dd, J=4.0 Hz, H-4), 2.02-1.85 (2H, H-2,6); 13C-NMR (MeOH-d4, 176 MHz) δ 176 (COOH), 166.1 (C-9'), 148.1 (C-4'), 144.3 (C-3'), 145.5 (C-7'), 125.7 (C-1'), 121.1 (C- 6'), 115.8 (C-5'), 115 (C-8'), 114.6 (C-2'), 72.9 (C-1), 71.2 (C-4), 71 (C-3), 67.2 (C-5), 39.5 (C-6), 35.1 (C-2). ESIMS (negative mode) m/z 179 [M-H]–.
1H-NMR (700 MHz, MeOH-d4) (caffeoyl groups); δ 7.62 (1H, d, J=15.9 Hz, H-3'), 7.57 (1H, d, J=15.9 Hz, H-3'), 7.07 (1H, d, J=1.70 Hz, H-5'), 7.07 (1H, d, J=1.7 Hz, H-5'), 6.98 (1H, dd, J=1.7, 8.2 Hz, H-9'), 6.96 (1H, dd, J=1.7, 8.2 Hz, H-9'), 6.78 (1H, d, J=8.2 Hz, H-8'), 6.78 (1H, d, J=8.2 Hz, H-8'), 6.35 (1H, d, J=15.9 Hz, H- 2'), 6.26 (1H, d, J=15.9 Hz, H-2) (quinic qcid moiety); 5.43 (1H, ddd J=3.2, 3.9, 7.1 Hz, H-5), 5.38 (1H, m, H- 3), 3.97 (1H, dd, J=3.2, 7.4 Hz, H-4), 2.32 (1H, dd, J=3.9, 13.8 Hz, H-6a), 2.25 (2H, m, H-2), 2.17 (1H, dd, J=7.1, 13.8 Hz, H-6b); 13C-NMR (176 MHz, MeOH-d4): (caffeoyl groups); δ 177.5 (C-7), 169.0 (C-1'), 168.5 (C- 1'), 149.8 (C-7'), 149.7 (C-7'), 147.4 (C-3'), 147.2 (C-3'), 147.0 (C-6'), 147.0 (C-6'), 128.1 (C-4'), 128.0 (C-4'), 123.2 (C-9'), 123.1 (C-9'), 116.6 (C-8'), 116.6 (C-8'), 115.8 (C-2'), 115.4 (C-5'), 115.3 (C-5'), 115.3 (C-2') (quinic acid moiety); 74.8 (C-1), 72.7 (C-5), 72.3 (C-3), 70.8 (C-4), 38.0 (C-2), 36.1 (C-6). ESI-MS (negative mode) m/z 515 [M-H]–.
1H-NMR (700 MHz, MeOH-d4): δ: 7.59 (1H, d, J=15.6 Hz, H-7"), 7.56 (1H, d, J=15.6 Hz, H-7'), 7.05 (1H, d, J=1.8 Hz, H-2"), 7.04 (1H, d, J=1.8 Hz, H-2'), 6.94 (1H, dd, J=7.8, 1.8 Hz, H-6'), 6.93 (1H, dd, J=7.8, 1.8 Hz, H- 6"), 6.78 (1H, d, J=7.8 Hz, H- 5'), 6.74 (1H, d, J=7.8 Hz, H-5"), 6.30 (1H, d, J=15.6 Hz, H-8"), 6.27 (1H, d, J=15.6 Hz, H-8'), 5.65 (1H, dt, J=12.6, 7.2 Hz, H-3), 5.05 (1H, dd, J=10.8, 3.6 Hz, H-4), 4.34 (1H, dt, J=6.0, 3.6 Hz, H-5), 2.14~2.36 (4H, m, H-2, 6); 13C-NMR (176 MHz, MeOH-d4) (caffeoyl groups); δ 178.0 (C-7), 167.1 (C-1'), 167.0 (C-1'), 148.2 (C-7'), 148.2 (C-7'), 145.9 (C- 3'), 145.4 (C-3'), 141.5 (C-6'), 141.5 (C-6'), 126.3 (C-4'), 126.3 (C-4'), 121.8 (C-9'), 121.8 (C-9'), 115.0 (C-8'), 115.0 (C-8'), 113.8 (C-2'), 113.8 (C-5'), 113.5 (C-5'), 113.5 (C-2') (quinic acid moiety); 76.5 (C-1), 75.3 (C-5), 70.4 (C-3), 66.0 (C-4), 41.8 (C-2), 37.2 (C-6). ESI-MS (negative mode) m/z 515 [M-H]–.
1H-NMR (700 MHz, MeOH-d4): δ: 7.62 (1H, d, J=15.6 Hz, H-7″), 7.53 (1H, d, J=15.6 Hz, H-7'), 7.04 (1H, d, J=1.8 Hz, H-2″), 7.02 (1H, d, J=1.8 Hz, H-2'), 6.94 (1H, dd, J=7.8, 1.8 Hz, H-6'), 6.93 (1H, dd, J=7.8, 1.8 Hz, H- 6″), 6.77 (1H, d, J=7.8 Hz, H-5'), 6.76 (1H, d, J=7.8 Hz, H-5″), 6.30 (1H, d, J=15.6 Hz, H-8'), 6.21 (1H, d, J=15.6 Hz, H-8"), 5.13 (1H, dd, J=7.8, 3.2 Hz, H-4), 4.38 (1H, q, J=3.2 Hz, H-3), 2.10~2.33 (4H, m, H-2, 6); 13C NMR (176 MHz, MeOH-d4) (caffeoyl groups); δ 175.6 (C-7), 167.1 (C-1'), 166.8 (C-1'), 148.3 (C-7'), 148.3 (C-7'), 146.2 (C-3'), 146.2 (C-3'), 145.3 (C-6'), 145.3 (C-6'), 126.3 (C-4'), 126.2 (C-4'), 121.7 (C-9'), 121.7 (C-9'), 115.1 (C-8'), 115.1 (C-8'), 113.7 (C-2'), 113.7 (C-5'), 113.3 (C-5'), 113.3 (C-2') (quinic acid moiety); 74.7 (C-1), 74.4 (C-5), 68.0 (C-3), 67.6 (C-4), 38.0 (C-2), 37.0 (C-6). ESIMS (negative mode) m/z 515 [M-H]–.
검체는 지역별 곰취 추출물 약 12 mg을 취해 50% EtOH 을 가하여 10 mL로 조제하였다. 표준품은 isochrologenic acid B, isochrologenic acid C 각각 1.4 mg, 3.5 mg을 취해 50% EtOH에 녹여 25 mL로 표준원액을 조제한 후 표준원 액 5 mL를 취해 50% EtOH을 가하여 25 mL로 희석하여 분석하였다.
HPLC의 분석조건으로는 칼럼은 Kromasil 100-5C18 (5 μm, 4.6 mm × 250 mm) (Eka Chemicals AB, Bohus, Sweden), 검출기는 UV detector 330 nm로 하였다. 이동상은 용매 A (0.1% trifluoroacetic acid를 함유한 water)와 용매 B (ACN) 를 기울기 용리(0-20 min, 90% A: 10% B; 20-30 min, 82% A: 18% B; 30-64 min, 82% A: 18% B)로 실시하였으며 유속은 1.0 mL/min이었다.
DPPH 라디칼 소거능은 Ozgen et al. (2006)과 Lee et al. (2014)의 방법을 변형하여 측정하였다. 농도별로 희석한 산지별 곰취 EtOH 추출물 및 인제산 곰취 compound 100 μL에 MeOH에 용해시킨 200 μM DPPH 용액 100 μL를 넣어서 30분 동안 상온에서 반응시켰다. ELISA reader (SPECTRAmax 190PC, Molecular Devices, Sunnyvale, CA, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. 양성 대조군으로 항산화제인 butylated hydroxyanisole (BHA) (Sigma, St. Louis, MO, USA)를 사용하였고, 산지별 곰취 EtOH 추출물과 인제산 곰취 compound의 IC50 값을 구해 평가하였다.
ABTS 라디칼 소거능은 Miller et al. (1993)과 Lee et al. (2014)의 방법을 변형하여 측정하였다. 7mM ABTS (Sigma, St. Louis, MO, USA)용액과 2.45 mM potassium persulfate (K2S2O8) (Sigma, St. Louis, MO, USA)용액을 ABTS: K2S2O8=2:1로 섞은 후 12-16시간 차광하여 반응시켜 양이온 (ABTS+)을 형성시키고 734 nm에서 흡광도의 값이 1.35± 0.05이 나오도록 희석하였다. 희석된 용액 100 μL와 농도 별로 희석한 산지별 곰취 EtOH 추출물 및 인제산 곰취 compound 100 μL를 상온에서 6분간 반응시키고 ELISA reader를 이용하여 734 nm에서 흡광도를 측정하였다. 양성 대조군으로 항산화제인 BHA를 사용하였고, 산지별 곰취 EtOH 추출물과 인제산 곰취 compound에 대한 IC50 값을 구해 평가하였다.
ORAC value는 Ou et al. (2002)과 Lee et al. (2014)의 방법을 변형하여 ORAC activity assay kit (Cell Biolabs #STA-345, San Diego, CA, USA)를 이용하여 측정하였다. Antioxidant standard인 trolox를 농도별로 희석하여 96 well plate에 25 μL를 넣고 1 × Fluorescein solution을 각 well 마다 150 μL씩 넣어 잘 섞은 후, 37°C에서 30분 배양 하였다. Free radical initiator solution을 각 well 마다 25 μL 씩 넣고 잘 섞은 뒤 excitation (480 nm)과 emission (520 nm) 으로 37°C에서 60분간 2분 간격으로 30번 fluorescence 의 감소율(Victor3 1420 Multilabel Counter, PerkinElmer, Hubbardston, MA, USA)을 측정하였다. 결과 값은 산지별 곰취 EtOH 추출물과 인제산 곰취 compound 첨가와 blank 의 area under curve (AUC)값을 나타낸 후 trolox를 이용 하여 작성한 검량선에 대입하여 나타내었다.
RFU0= relative fluorescence value of time point zero
RFUx= relative fluorescence value of time points
Net AUC (Area under the curve)
= AUC (antioxidant) – AUC (blank)
결과 및 고찰
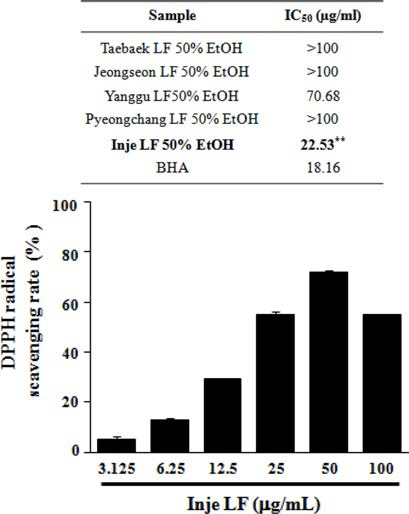
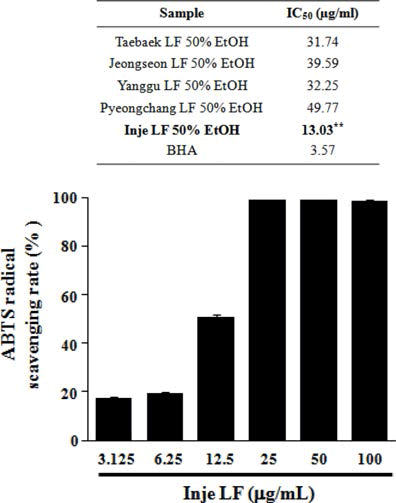
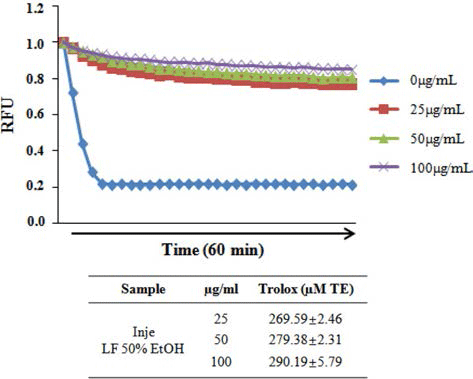
산지별(태백, 정선, 양구, 평창, 인제) 곰취 50% EtOH 추출물의 항산화 활성을 분석하기 위해 DPPH, ABTS 그 리고 ORAC assay를 수행하였다. DPPH에 의한 항산화 활 성 측정 방법은 항산화 물질의 전자공여능으로 방향족 화 합물과 아민류 등이 환원되는 것을 지표로 하여 항산화 활 성과 free radical 소거능을 측정하는 원리로 가장 널리 이 용된다(Blois, 1958; Bondet et al., 1997). 산지별 곰취 50% EtOH 추출물의 DPPH 라디칼 소거 활성능을 측정한 결과, Fig. 1에서와 같이 인제산 곰취 EtOH 추출물의 농 도에 따라 DPPH 라디칼 소거능이 증가하는 것이 확인 되 었고, 100 μg/mL 보다는 오히려 50 μg/mL의 농도에서 가 장 높은 71.77%의 소거능이 관찰되었으며, DPPH 소거 활 성능에 대한 IC50값은 22.53 μg/mL로 측정되어 다른 산지 별 곰취 추출물보다 높은 항산화 효능이 관찰되었다. ABTS 라디칼 소거능은 페놀성 화합물을 함유한 시료의 첨가로 인해 ABTS가 산화되어 라디칼 양이온인 ABTS+가 생성되고 이것의 분해를 측정하여 항산화 활성을 측정하는 방법으로(Dudonne et al., 2009), 측정방법이 간단하여 DPPH 라디칼 소거능과 함께 널리 이용된다. 산지별 곰취 EtOH 추출물에 의한 ABTS 라디칼 소거능 측정 결과, DPPH 라디칼 소거능 결과와 유사하게 인제산 곰취 EtOH 추출물에서 높은 소거능이 관찰되었고, 25 μg/mL의 농도에 서 가장 높은 98.95%의 ABTS 라디칼 소거능이 관찰되었 으며, 인제산 곰취 EtOH 추출물의 ABTS 라디칼 소거능 에 대한 IC50값은 13.03 μg/mL로 측정되었다(Fig. 2). 마지 막으로 ORAC assay를 통해 곰취 EtOH 추출물의 항산화 활성을 측정하였다. ORAC assay는 퍼옥시라디칼에 의한 형광 감소를 이용하여 항산화능을 측정하는 방법으로(Ou et al., 2002) 표준물질인 Trolox와 비교하여 정량하였다. ORAC activity assay kit를 이용하여 60분간 2분마다 fluorescence의 감소율을 측정한 결과, Fig. 3에서와 같이 인제산 곰취 EtOH 추출물에서 가장 높은 항산화 활성이 관찰되었고, ORAC를 Trolox equivalent (TE)값으로 산출 한 결과 100 μg/mL의 농도에서 290.19±5.79 μM TE/g으로 높은 항산화 활성을 나타내었다. 본 결과를 통하여 DPPH, ABTS 그리고 ORAC assay를 이용하여 산지별(태백, 정선, 양구, 평창, 인제)곰취의 항산화 활성을 분석한 결과, 인제 산 곰취 50% EtOH 추출물이 가장 우수한 항산화 활성을 나타내는 것을 확인할 수 있었다.
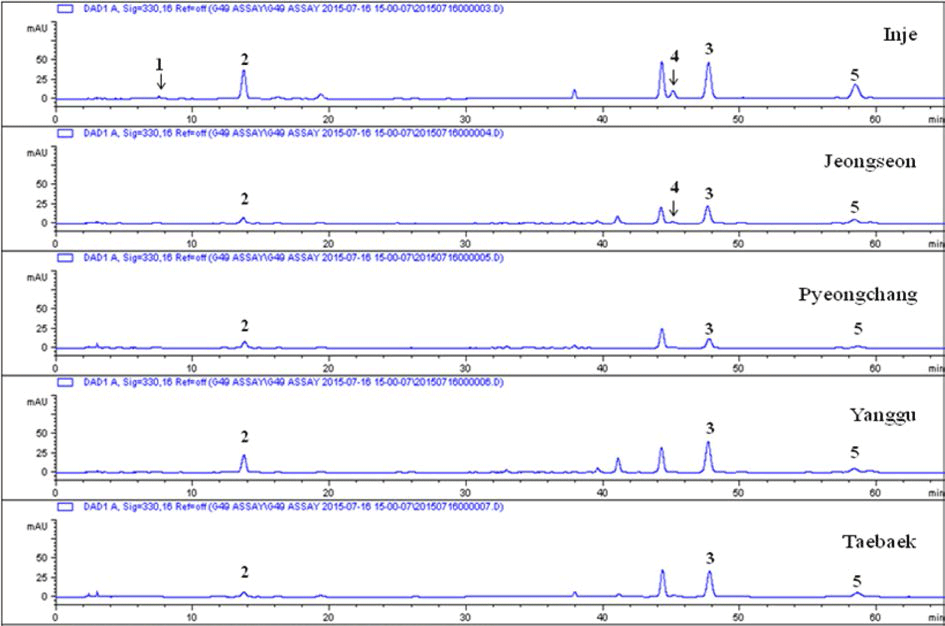
인제산 곰취 50% EtOH 추출물로부터 유효물질 5개 (chlorogenic acid (1), neochlorogenic acid (2), isochlorogenic acid A (3), isochlorogenic acid B (4), isochlorogenic acid C (5))를 분리하여(Fig. 4A), 곰취에서 분리된 화합물의 항 산화 활성을 분석하기 위해 곰취 EtOH 추출물과 동일하게 DPPH, ABTS 그리고 ORAC assay를 수행하였다.
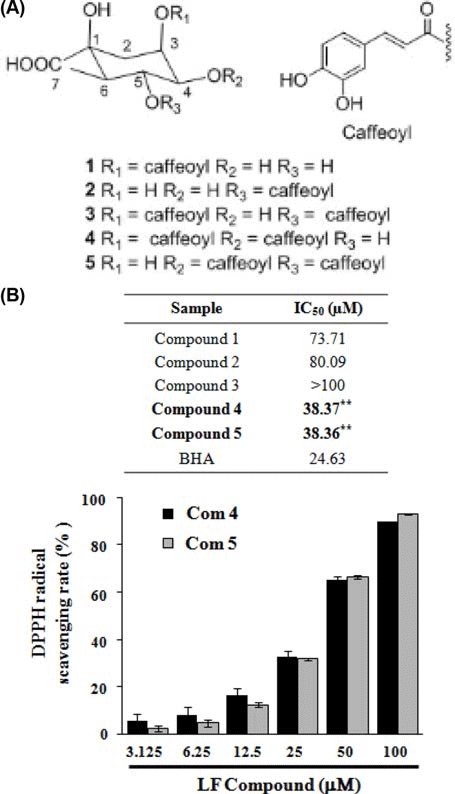
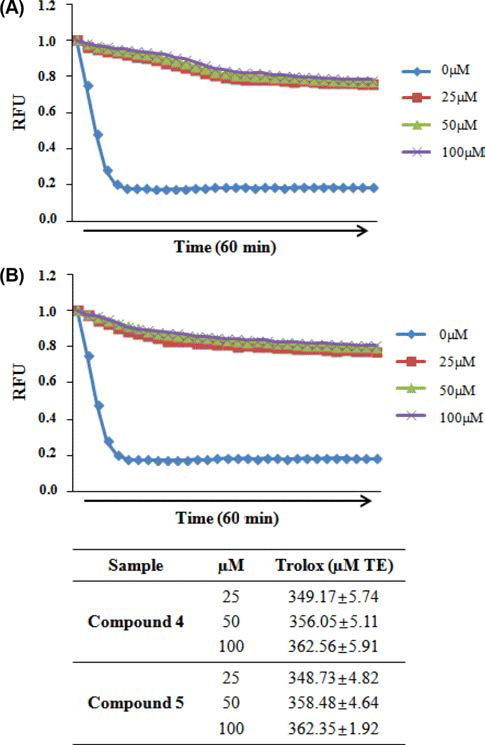
DPPH 라디칼 소거능을 측정한 결과, Fig. 4B에서와 같 이 곰취 compound 4, 5 (isochlorogenic acid B, isochlorogenic acid C)의 농도에 따라 DPPH 라디칼 소거능이 증가 하는 것이 확인되었고, 100 μM의 농도에서 각각 89.76%와 92.72%의 가장 높은 라디칼 소거능이 관찰되었으며 IC50값 은 각각 38.37 μM, 38.36 μM로 측정되었다. ABTS 라디칼 소거능 역시 곰취 compound 4, 5에서 가장 높게 관찰되었 으며, 100 μM의 농도에서 각각 99.09%, 98.95%의 높은 ABTS 라디칼 소거능이 관찰되었고(Fig. 5), IC50값은 각각 16.16 μM, 12.20 μM로 측정되었다. 마지막으로 ORAC assay를 통해 인제산 곰취 compound의 항산화 활성을 측 정한 결과, Fig. 5에서와 같이 곰취 compound 4, 5의 농도 에 따라 높은 항산화 활성이 관찰되었고, ORAC value는 100 μM의 농도에서 각각 362.56±5.91 μM TE/g, 362.35± 1.92 μM TE/g으로 높은 항산화 활성을 나타내었다. 본 결 과를 통하여 인제산 곰취 50% EtOH 추출물의 유효물질 가운데 compound 4, 5가 가장 높은 항산화 활성을 나타내 는 것을 확인할 수 있었다. 본 실험에서 분리된 caffeoyl quinic acid계 화합물은 금은화, 참쑥, 취나물 등에서 분리 하여 보고(Nugroho et al., 2009; Lee et al., 2010a; Lee et al., 2010b)한 바 있으며 Xu et al. (2012)은 chlorogenic acid, neochlorogenic acid, cryptochlorogenic acid, isochlorogenic acid A, B 및 C의 다양한 항산화 효능 평가를 통해 isochlorogenic acid C가 caffeoyl quinic acid 유도체 화합물 중에서 가장 우수 항산화 효능을 갖는 결과를 보고하였다.
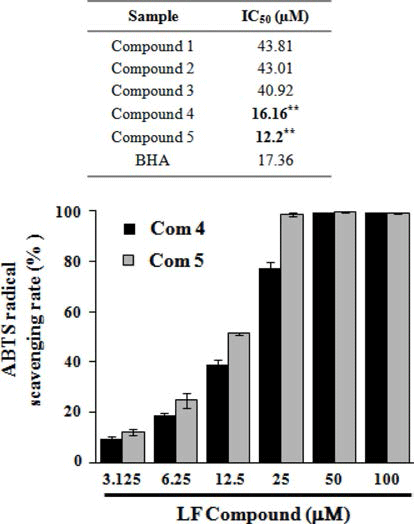
상기의 결과들을 통해 산지별 곰취 50% EtOH 추출물 가운데 인제산 곰취 50% EtOH 추출물이 높은 항산화 활 성을 보유하는 것을 확인할 수 있었으며, 인제산 곰취 50% EtOH 추출물의 유효물질 가운데 compound 4와 5 에서 가장 높은 항산화 활성을 확인할 수 있었다. Fig .6
산지별로 50% EtOH로 추출물을 조제한 후 이들 중 항 산화 활성이 우수한 isochlorogenic acid B와 isochlorogenic acid C의 함량을 HPLC 분석법으로 정량하였다. Table 1에 서 보는 바와 같이 인제산이 항산화 활성이 가장 우수했던 isochlorogenic acid B와 isochlorogenic acid C의 함량이 각각 0.53%와 1.54%로 다른 지역보다 훨씬 높게 나타났 으며 이러한 결과가 인제산이 다른 지역 보다 항산화 활성 이 높은 결과를 나타낸 것으로 판단된다. Kwak et al. (2005)은 한국산 석류 과피의 항산화 성분 ellagic acid와 punicalagin을 산지별로 분석한 결과 곰취와 유사하게 지역 별로 함량의 차이가 매우 커 약용자원을 제품화 할 경우 산지 선택이 중요한 요소가 될 수 있음을 보고하였다. 지 표성분의 결정에 따라 달라질 수 있으나 산지별로 그 차이 가 크게 나타날 수 있다는 보고와도 유사한 결과를 나타내 었다(Im et al., 2010). 산지별로 성분의 함량의 차이는 식 물의 재배환경이 많은 영향을 주었을 것으로 생각되며 산 마늘, 곰취, 곤달비의 광도 변화에 따른 ascorbic acid의 함 량을 분석한 결과 곰취는 약피음 처리구(상대투과율; 64- 73%)에서 가장 높은 함량을 나타내었다(Kim et al., 2010). 산채류는 생육에 있어서 광도뿐만 아니라 온도, 습도, 토양 환경, 경쟁식생, 수분함량 등 여러 가지 다양한 환경인자가 관여하기 때문에 지역별 항산화 성분의 함량이 다르게 나 타나는 것으로 예측된다. 곰취 추출물의 성분 패턴 분석에 서도 주요 함유 성분의 차이점은 없으며 산지별 성분의 함 량의 변화가 있음을 확인할 수 있었다(Fig. 7). 이런 성분 의 함량 차이가 산지별 항산화 효능에 큰 차이를 나타낸 것으로 생각된다.
| District | Amount (%) | |
|---|---|---|
| Isochlorogenic acid B | Isochlorogenic acid C | |
| Taebaek | 0.096 | 0.444 |
| Jeongseon | 0.062 | 0.413 |
| Yanggu | 0.021 | 0.357 |
| Pyeongchang | 0.014 | 0.174 |
| Inje | 0.532 | 1.543 |
요 약
본 연구는 식용으로 사용하는 곰취의 국내 산지별(태백, 정선, 양구, 평창, 인제) 항산화 효과를 평가하고, 곰취의 유효성분 분리를 통해 항산화 효능평가를 수행함으로써 산 지별 곰취의 항산화 효능에 대한 탐색 및 소재 개발 가능 성을 검토하고자 하였다. 그 결과, 인제산 곰취 50% EtOH 추출물의 농도에 따라 DPPH 라디칼 소거능과 ABTS 라디칼 소거능이 각각 71.77%, 98.95%로 높은 항 산화 활성이 관찰되었다. 또한, ORAC activity assay kit를 이용한 항산화 활성 측정 결과에서도 인제산 곰취 50% EtOH 추출물의 농도에 따라 높은 항산화 활성이 관찰되었 고, 100 μg/mL의 농도에서 290.19±5.79 μM TE/g으로 높 은 항산화 활성을 나타내었다. 산지별 가운데 가장 높은 항산화 활성을 보인 인제산 곰취 50% EtOH 추출물로부 터 유효물질 5개(chlorogenic acid (1), neochlorogenic acid (2), isochlorogenic acid A (3), isochlorogenic acid B (4), isochlorogenic acid C (5))를 분리하여 곰취 compound의 항산화 활성을 분석한 결과, 인제산 곰취 50% EtOH 추출 물과 유사하게 compound 4, 5 (isochlorogenic acid B, isochlorogenic acid C)의 농도에 따라 높은 DPPH 라디칼 소거능(89.76%, 92.72%)과 ABTS 라디칼 소거능(99.09%, 98.95%)이 관찰되었고, ORAC assay에서도 compound 4, 5에서 각각 362.56±5.91 μM TE/g, 362.35±1.92 μM TE/g 으로 높은 항산화 활성을 나타내었다. 이러한 결과들을 통해 산지별 곰취 50% EtOH 추출물 가운데 인제산 추출물이 높 은 항산화 활성을 보유하는 것을 확인할 수 있었으며, 이러 한 인제산 곰취 추출물에는 높은 항산화 활성 성분(compound 4: isochlorogenic acid B, compound 5: isochlorogenic acid C)이 함유되어 있음을 확인할 수 있었다. 본 결과는 식용으로 사용되고 있는 곰취의 항산화 활성을 보유한 기 능성 소재로서의 활용을 위한 기초자료로 이용될 수 있을 것으로 판단된다.







