서 론
인삼의 화학성분 함량은 일반적으로 사포닌이 3–6%(프 로토파낙사다이올계 24종, 프로토파낙사트리올계 사포닌 11종, 올레아놀린산계 사포닌 1종), 함질소화합물이 12– 16%(단백질, 아미노산, 펩타이드, 핵산, 알칼로이드), 지용 성 성분이 1–2%(지질, 지방산, 정유성분, 터페노이드, 폴리 아세틸렌 페놀화합물 등), 비타민이 0.05%, 탄수화물 60– 70%, 회분 4–6% 등으로 이루어져 있다(Kim et al., 1987). 전통적인 홍삼의 제조공정은 수삼을 세척, 선별, 증자(90– 100°C), 1차 건조(수분함량 35–40%), 저장 숙성, 2차 건 조(수분함량 16% 내외), 정형을 거치면서 저장성의 향상과 더불어 특히 증자 열처리할 때 성분의 화학적 변화가 일어 나 수삼이나 백삼에 존재하지 않는 새로운 생리활성물질의 생성과 기존 물질의 함량이 증가한다고 알려져 있다(Kim et al., 1987).
사포닌의 화학구조는 크게 당부분(glycone)과 비당부분 (aglycone)으로 구성된 배당체이며, 사포닌이 체내에서 흡 수될 때는 사람의 장내에 있는 특유 미생물에 의해 분해되 어 체내로 흡수된다(Kanaoka et al., 1994; Wakabayashi et al., 1997a; Wakabayashi et al. 1997b; Bae et al., 2000; Bae et al., 2002). 그러나 인삼 사포닌을 분해하는 장내 미 생물은 사람의 체질에 따라 그리고 식습관 따라 그 존재의 유무와 보유하고 있는 정도가 다르며, 그로 인해 인삼의 복용 후 저마다 효능의 차이가 나타날 수 있는데 어떤 사 람은 사포닌 중 diol 형태만을, 어떤 사람은 triol 형태만을, 어떤 사람은 전혀 흡수를 하지 못하는 것으로 알려져 있다 (Wakabayashi et al., 1997a; Wakabayashi et al., 1997b; Hasegawa et al., 2000a; Hasegawa et al., 2000b).
최근 들어 인삼 사포닌 성분의 대사에 대한 연구가 활발 히 진행되고 있는 가운데, Hasegawa 등(2000a)은 인삼 ginsenoside Rb1, Rb2, Rc, Rd, Re, Rg1 등의 주요 ginsenoside가 인체의 소화기관에서 거의 흡수되지 않으며, Rb1 성분의 체내 흡수율은 4.35%에 불과한 것으로 보고하 고 있다. 또한 인삼 ginsenoside를 대사시키는 장내 미생물 을 동정한 결과 한국인의 약 37.5%가 사포닌을 분해할 수 있는 미생물이 존재하지 않는 것으로 보고되었으며, Akao 등(1998)에 의하면 Rb1은 위장에서 거의 흡수되지 않고 compound K의 형태로 대사되어 흡수된다고 보고하였다.
팽화(puffing)기법은 짧은 시간에 높은 온도를 처리함으 로써 식품 중에 존재하는 전분의 호화, 단백질의 변성 및 조직화, 저장중 지질의 산패 등을 유발시키는 효소의 불활 성화, 자연 발생적인 유해물질의 파괴, 원료성분의 탈취 및 변형과 같은 다양한 품질변화를 일으켜 제품의 품질 향상 및 원료 물질의 추출 효율을 증가시키기 위해 적용되는 기 술이다. 홍삼의 팽화처리는 홍삼 고유의 흙맛을 제거하는 데 매우 효과적이며 추출효율을 증대시키기 때문에 일반적 인 홍삼추출농축시간을 단축시킴으로써 쓴맛을 줄이는데 매우 효과적이다(Nam, 2005).
따라서 본 연구에서는 팽화홍삼의 ginsenoside를 분해할 수 있는 유용미생물을 탐색 분리한 후 이를 이용하여 팽화 홍삼을 발효시킴으로써 홍삼에 다량 존재하는 ginsenoside 의 당 부위를 제거하여 흡수가 잘되며 효능이 뛰어나다고 알려진 미량 ginsenoside로 구조를 전환시키고자 하였다.
재료 및 방법
p-Nitrophenyl-β-D-glucopyranoside(pNPG)와 esculin은 Sigma-Aldrich(St. Louise, MO, USA) 제품을 사용하였고, 팽 화홍삼 농축액(70°Bx)은 (주)그린바이오(Icheon, Korea)로부터 공급받았다. Ginsenoside의 표준품인 Rb1, Rb2, Rd, Re, F1, Rg1, Rg2, Rg3, Rh1, Rh2, compound K, PPD, PPT는 (주) 엠보연구소(Daejeon, Korea)로부터 구입하여 1μmol(in methanol)의 농도로 제조하여 사용하였다. L-Cystein, RNase A, lysozyme은 Sigma-Aldrich(USA) 제품을 사용하였 고, agarose는 Bio-Rad사(Hercules, CA, USA), agarose gel로 부터 DNA 단편의 용출에는 Bioneer사(Seoul, Korea)의 AccuPrep® Gel Purification Kit, PCR 산물의 정제에는 Bioneer사의 AccuPrep® PCR Purification Kit를 사용하였다.
유산균의 배양에는 MRS 배지(Difco Co., Detroit, MI, USA)를 사용하였으며, Bifidobacterium sp.의 배양에는 RCM(Reinforced clostridial medium, Oxoid, Basingstoke, England) 또는 Eugon 배지(Oxoid, England)를 사용하였다. 고체배지를 제조할 경우에는 액체배지에 agar를 1.5%(w/v) 를 첨가하였다.
팽화 홍삼에 존재하는 ginsenosides를 생물전환시킬 수 있는 효소 생산 균주를 분리하기 위한 분리원으로는 신선 과채류와 유아분변 등을 사용하였다. 본 실험에 사용한 신 선 과채류는 시중 수퍼마켓에서 구입하였으며, 구입한 각 각의 신선 과채류를 각 변이 2 cm인 정육면체가 되도록 칼로 절단한 후 10 g을 취하여 90 mL의 멸균된 Ringer 용 액(Oxoid, Basingstoke, England)에 첨가한 후 homogenizer (Hp-93F, Taitec Co., Tokyo, Japan)를 이용하여 1,000 rpm 으로 2분간 파쇄하였다. 파쇄액을 10진 희석법에 의해 109 까지 희석한 후 MRS 한천 고체배지에 도말하였으며 37°C 에서 3일간 배양하여 균체를 생육시켰다. 유아분변은 1 g 을 취하여 10 mL의 멸균된 Ringer 용액(Oxoid)에 첨가한 후 vortex하여 정치한 다음 상등액을 10진 희석법에 의해 109까지 희석한 후 MRS 한천 고체배지에 도말하였다.
β-Glucosidase 활성을 가지는 균주를 선발하기 위하여 esculin agar법을 응용하여 esculin과 ferric ammonium citrate 가 각각 0.5, 1.0%(w/v) 첨가된 esculin MRS agar를 제조한 후 분리원으로부터 분리된 균주의 single colony을 접종하 여 black zone을 형성하는 균주를 1차 선발하였다. Esculin 은 균주의 β-glucosidase의 활성에 의해 분해가 이루어지며 이때 생성된 esculetin은 배지성분인 ferric ammonium citrate 와 결합하여 배지 주위에 black complex을 형성하게 된다. 따라서 colony 주위에 black zone을 형성하는 균주를 β- glucosidase 활성을 가지는 균주로 판단하였다.
1차 선발된 균주의 2차 screening을 위하여 Kohchi 등 (1985)의 방법을 응용하여 β-glucosidase 활성을 측정하였 다. 1차 선발된 균주들을 5 mL의 MRS 배지에 접종한 후 37°C에서 24시간 배양하였다. 배양액을 13,000×g에서 5분 간 원심분리한 다음 배양 상등액을 취하여 세포외 효소 분 획으로 하였다. 침전된 세포는 50 mM sodium phosphate 완충용액(pH 7.0)으로 2회 세척한 후 0.5 mL의 50 mM sodium phosphate 완충용액(pH 7.0)으로 현탁한 다음 초음 파 발생기(VC 5510 R-DTM, Branson, Danbury, CT, USA) 를 이용하여 200W로 40초 동안 초음파를 처리하여 세포 를 파쇄하였다. 세포 파쇄액을 13,000×g에서 5분 동안 원 심분리한 후 상등액을 취하여 세포 내 효소 분획으로 하였 다. 효소활성 측정은 100 μL의 1 mM pNPG(in 50 mM sodium phosphate 완충용액, pH 7.0)에 100 μL의 효소액을 첨가한 다음 37°C에서 20분 동안 반응시키고, 0.4M Na2CO3 용액을 2 mL 첨가하여 넣어 반응을 정지시켰다. 반 응액의 흡광도를 405 nm에서 측정하여 표준곡선으로부터 구한 식을 사용하여 효소활성을 계산하였다. 표준 곡선은 p-nitrophenol (농도범위: 0.1–1.0 mM)을 사용하여 작성하였 고, 효소 1 unit은 주어진 조건에서 분당 1 mM의 pnitophenol을 유리시키는 효소의 양으로 정하였다.
선정 미생물의 생리학적, 분자유전학적 특성 분석과 균주 동정
분리된 균주의 동정은 Bergey's Manual of Determinative Bacteriology에 기초하여 형태학적, 생리학적 특성을 조사 하였다. 선정된 균주의 형태학적 특성을 분석하기 위하여 Gram 염색, catalase test, 3% KOH test, motility test를 실 시하였다. 균주의 탄소원 이용도를 조사하기 위해서는 API 50CH kit(Biomriux, Marcy l'Etoile, France)를 사용하였다. 광학현미경 촬영은 Macrotec사(Seoul, Korea)의 Biological Microscope E100 현미경과 디지털 카메라(DCM130E digital camera for microscope 1.3 M pixels)를 이용하였고, 주사전 자현미경은 서울대학교 농생명과학공동기기원(NICEM) 전 자현미경실에서 JSM 5410LV(JEOL, Tokyo, Japan)을 이용 하여 촬영하였다. 선정 균주의 생리학적 특성을 조사하기 위하여 포도당을 이용한 gas 생성유무와 포자형성유무, 다 양한 환경 조건인 6.5% NaCl, 10°C, 45°C, pH 9.6, pH 4.4 의 배지에서 37°C로 24시간 배양한 후 생육을 관찰하였다.
선정 균주의 16S rRNA의 유전자를 polymerase chain reaction(PCR)에 의해 cloning하기 위하여 518F(5'-CCAG CAGCCGCGGTAATACG-3')와 800R(5'-TA CCAGGGTA TCTAATCC-3')을 primer로 사용하였다. PCR은 AccuPower® PreMix (Bioneer, Daejeon, Korea)를 사용하여 PCR sprint (Hybaid Ltd., London, UK)로 반응시켰다. 균주의 genomic DNA를 분리하여 template DNA로 사용하여 0.1 μg 이하 가 되도록 첨가하였으며, primer의 농도는 각각 300 nM이 되도록 첨가하였다. PCR 조건은 94°C에서 2분간 DNA 변 성을 하였고 다시 94°C 30초, 60°C 1분, 72°C 1분씩 35 cycle을 수행한 후 72°C에서 7분간 반응시켰다. 얻어진 PCR 산물은 AccuPrep® PCR Purification Kit(Bioneer Co.) 를 이용하여 정제하였다.
PCR 산물의 염기서열 결정은 Macrogen사(Seoul, Korea) 에 의뢰하여 Applied Biosystems사(Foster City, CA, USA) 의 ABI PRISM BigDyeTM Terminator Cycle Sequencing Kit를 사용하여 MJ Reserch사(Reno, NV, USA)의 PTC-225 Peltier Thermal Cycler와 ABI PRISM 3730 XL Analyzer를 이용하였다.
DNA 염기서열의 분석은 InfoMax Inc.(Bethesda, MD, USA)의 Vector NTI Suite 7.1 program을 사용하여 수행하 였으며 DNA 염기서열의 homology 분석은 BLASTN online program(http://www.ncbi.nlm.nih.gov/blast/)을 이용하 였다. Phylogenetic tree는 MEGA4 program(Center for Evolutionary Functional Genomics, The Biodesign Institute, Tempe, AZ, USA)을 이용하여 작성하였다.
분리 균주의 16S rRNA 염기서열을 이용한 동정을 수행 하기 위하여 균주로부터 genomic DNA를 아래와 같이 분 리하여 template DNA로 사용하였다. MRS 배지에 균체를 접종한 다음 37°C에서 혐기적 조건으로 하룻밤 정치배양시 켰다. 원심분리에 의해 균체를 수확한 후 1 mL의 TEN 완 충용액(10 mM Tris-HCl, pH 7.6, 1 mM EDTA, 10 mM NaCl)으로 세척한 다음 500 μL의 SET 완충용액(20% sucrose, 50 mM Tris-HCl, pH 7.6, 50 mM EDTA)에 현탁 시켰다. 여기에 50 μL의 lysozyme(60 mg/mL)과 3 μL의 RNase A 용액을 첨가하여 37°C에서 1시간 반응시킨 후 200 μL의 TEN 완충용액, 25 μL의 25% SDS를 넣고 조심 스럽게 혼합하여 세포를 용해시켰다. 이 반응액에 25 μL의 pronase 용액을 첨가하고 1시간 동안 37°C에서 반응시킨 후 100 μL의 5M NaCl을 첨가하였다. 동량의 phenol:chloroform: isoamyl alcohol(25:24:1)을 처리하여 단백질을 제거한 후 동 량의 isopropanol을 첨가하여 0°C에서 15분간 정치한 다음 13,500×g에서 원심분리를 15분간 실시하였다. 침전된 DNA 는 70% ethanol로 세척한 후 건조시킨 뒤 적당량의 3차 증류수에 녹여 사용하였다.
전기영동 완충용액으로는 0.5배의 TAE 완충용액 (40 mM Tris-acetate, pH 8.0, 1 mM EDTA)을 사용하였으 며 0.5 μg/mL의 ethidium bromide를 첨가한 0.8%(w/v)의 agarose 수평 gel을 사용하여 시료의 1/10배량의 10×gel loading 완충용액(0.25% bromophenol blue, 40%(w/v) sucrose) 을 가한 DNA 용액을 100 V에서 30–40분간 전기영동한 후 254 nm 파장의 자외선 조명하에서 관찰하였다. 사진촬 영은 UV-filter와 orange filter가 장착된 디지털카메라 (Olympus C4040Z, Tokyo, Japan)를 이용하였다.
Agarose gel 전기영동을 실시한 후 gel로부터 DNA 단편 을 회수하기 위하여 Bioneer사의 Agarose Gel Purification Kit를 사용하여 제조사의 manual에 따라 수행하였다.
0.22 μm PVDF membrane filter로 여과하여 멸균한 홍삼 추출물(1%, w/v)을 첨가한 MRS 배지에 2차 선발된 균주 중에서 β-glucosidase 활성이 우수한 균주의 종배양액을 5%(v/v) 접종하여 37°C에서 3일간 배양하였다. 배양액을 8,000×g에서 5분간 원심분리한 후 배양 상등액 3 mL를 취 하여 수포화 n-butanol로 2분간 추출하였다. 추출액은 진공 농축기를 사용하여 농축시킨 후 methanol에 용해하여 TLC 분석을 위한 시료로 사용하였다. 시료는 TLC plate에 0.7 cm 간격으로 1 cm 점적하여 CHCl3:CH3OH:H2O(65:35:10, v/v/v) 용매로 전개한 후 10% H2SO4를 분무하고 5분간 가열건조 하여 발색시켜 spot을 확인하였다.
결과 및 고찰
팽화 홍삼에 존재하는 ginsenoside를 생물전환할 수 있는 균주를 탐색하기 위하여 대표적인 생물전환효소인 β- glucosidase를 생산하는 균주를 신선 과채류 등으로부터 탐 색하였다. 균주의 1차 screening은 esculin agar법을 이용 하였으며, 신선 과채류 등으로부터 분리한 213주의 균주에 대한 β-glucosidase 생산 여부를 조사하였다. Esculin agar 배지에서 생육한 colony 주위에 black zone이 형성되면 β- glucosidase 생산이 가능한 후보 균주로 1차 선정하였고, 이들 균주들을 대상으로 pNPG를 기질로 이용하여 β- glucosidase 효소 활성을 측정함으로써 2차 선별을 수행하 였다. 그 결과 대부분의 colony들이 esculin agar 배지에서 black zone을 형성하였으나 black zone을 형성한 colony들 중에서 상당수가 β-glucosidase 활성을 나타내지 않았다(결 과 미제시). 한편 균체를 배양한 후 세포를 파쇄한 세포 내 효소분획과 배양 상등액인 세포 외 효소분획의 β-glucosidase 활성을 측정한 결과 세포 외 효소분획에서는 β-glucosidase 활성이 측정되지 않았다. Esculin agar 배지에서 black zone을 크게 나타내는 48균주를 선정하여 균주의 세포 내 효소분획의 β-glucosidase 활성을 조사한 결과 유아분변 유 래의 IF 5-29와 IF 5-35에서 97.9 AU/mL의 높은 활성을 나타내었으며 유아분변 유래의 IF 5-20과 된장 유래의 YLB 8 균주도 95.7 AU/mL의 높은 활성을 나타내었으며 유아분변 유래의 IF 5-17과 IF 5-38, 양파 유래의 ON 179 균주도 92.4 AU/mL의 비교적 높은 활성을 보여주었다(결 과 미제시). β-Glucosidase 활성이 우수한 균주 중에서 IF 5-17, IF 5-20, IF 5-29, IF 5-35, IF 5-38, YLB 8, ON 179 균주 등 7균주를 선정하여 팽화홍삼 농축액을 14°Bx 가 되도록 희석한 희석액에 접종한 후 30°C에서 20시간 배양한 다음 세포 내 효소분획의 β-glucosidase 활성과 세 포의 생육도 및 비활성을 측정하였다. 그 결과 Table 1에 나 타낸 바와 같이 β-glucosidase 활성은 YLB 8이 140.8AU/ mL으로 가장 높았으며 그 다음으로 ON 179와 IF 5-38의 순으로 높았다. 생균수의 경우 YLB 8이 8.89 Log CFU/ mL로 가장 높았고 그 다음으로 IF-5-35, IF 5-17의 순으로 높았다. 효소의 비활성을 계산한 결과 IF 5-29가 16.3 AU/ Log CFU로 가장 높았고 그 다음으로 ON179와 YLB 8, IF 5-38이 각각 15.9, 15.8, 15.7 AU/Log CFU으로 높았다. 효소의 비활성은 IF 5-29가 가장 좋았지만 효소활성과 생 육도가 ON179나 YLB 8과 비교하여 낮았기 때문에 팽화 홍삼의 생물전환에는 적합하지 않은 것으로 판단되었다. 팽화홍삼 추출액의 희석액을 배지로 하여 효소활성과 생육 도를 측정한 본 결과로부터 팽화홍삼에 존재하는 영양성분 만을 이용하여 높은 효소활성과 생육도를 나타내는 YLB 8이 팽화홍삼추출액의 생물전환에 가장 적합할 것으로 판 단되어 본 연구의 최종 균주로 선정하였다.
상기 실험을 통하여 된장으로부터 분리한 YLB 8균주를 생물전환을 위한 가장 적합한 균주로 최종 선정하고 균주 의 동정을 실시하였다. 균주의 동정을 위하여 형태학적, 생 리학적 특성을 관찰한 결과는 Table 2에 나타내었다. YLB 8 균주는 Gram 염색과 3% KOH test를 통하여 Gram 양 성세균임을 확인하였다. 또한 운동성이 없으며 catalase test 에서 음성 반응을 나타내었다. 포자염색에서는 음성반응으 로 나타나 무포자균으로 확인되어 전형적인 유산균의 형태 적, 생리학적 특징을 지니고 있었다. 또한 YLB 8 균주는 포도당을 이용하여 gas를 생성하여 이상유산발효(hetero lactic acid fermentation)를 하는 것으로 확인되었고, 통성혐 기성이며 pH 4.4와 9.6에서 생육이 가능하였으며 10°C와 45°C, 6.5%의 NaCl 존재 하에서 생육이 가능하였다. 한편 본 균주는 주사전자현미경(Fig. 1)을 이용하여 관찰한 결과 직경 1 μm 이하의 쌍구균으로 관찰되었다.
| Form | Spherical, pair |
| Gram stain | + |
| 3% KOH test | - |
| Motility | - |
| Catalase test | - |
| Gelatinase test | - |
| Gas production from glucose | + |
| Growth Facultative anaerobic | + |
| pH 4.4 | + |
| pH 9.6 | + |
| 10°C | + |
| 45°C | + |
| 6.5% NaCl | + |
한편 균주의 생리학적 특성을 보기 위하여 Biomriux의 API 50CHL Kit를 이용하여 탄소원 이용성을 조사하였으며 그 결과를 Table 3에 나타내었다. YLB 8은 L-arabinose, Dribose, D-xylose, D-galactose, D-glucose, D-fructose, Dmannose, D-cellobiose, D-maltose, D-melibiose, D-saccharose, D-trehalose, D-raffinose 등을 탄소원으로 이용하여 산을 생 성할 수 있었으며, glycerol, erythritol, D-arabinose, Lrhamnose, D-mannitol, D-sorbitol, xylitol, D-fucose 등을 이용하지 못하였다. Table 3의 과를 API database를 이용하 여 동정을 실시한 결과 YLB 8은 Leuconostoc mesenteroides ssp. mesenteroides/dextranicum으로 동정되었으며 identity는 99.9%로 계산되었다.
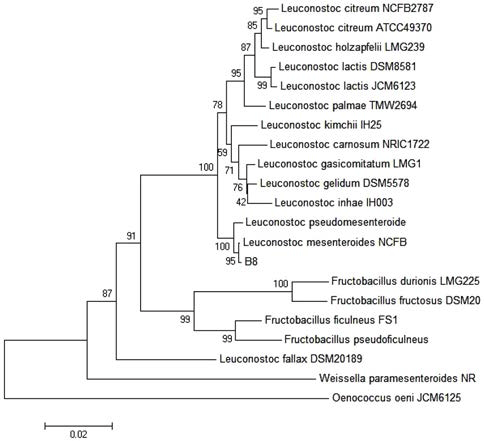
선정된 YLB 8 균주에 대한 분자유전학적 특성에 의한 동정을 위해 16S rRNA 유전자의 염기서열을 결정한 후 분 석을 수행하였다. YLB 8 균주의 16S rRNA 유전자의 염기 mesenteroides strain PC13(accession no. EF579730.1), Leuconostoc mesenteroides strain kimchi001(accession no. FJ655776.1)의 16S ribosomal RNA 유전자 염기서열과 각각 99%의 identity를 나타내었다. YLB8 균주의 16S rRNA 유 전자의 염기배열순서를 BLAST의 16S rRNA 유전자 염기 배열순서의 database를 이용하여 phylogenetic tree를 작성한 결과 Leuconostoc mesenteroides와 가장 유사성이 높은 것으 로 확인되었다(Fig. 2). 이상의 형태학적, 생리학적, 분자유전 학적 동정 결과로부터 YLB 8을 Leuconostoc mesenteroides 로 동정하였다.
현재까지 β-glucosidase를 생산하는 유산균으로는 Lactobacillus casei(Coulon et al. 1998)와 Lactobacillus brevis (Michlmayr et al. 2010)가 세포내 효소로, Lactobacillus plantarum이 세포외 효소로(Sestelo et al. 2004) 생산하는 것 으로 보고되고 있으며, Lactobacillus brevis가 생산하는 β- glucosidase는 Oenococcus kitaharae(Endo & Okada, 2006)가 생산하는 β-glucosidase와 아미노산 서열이 매우 유사한 것으 로 분석된 바 있다.
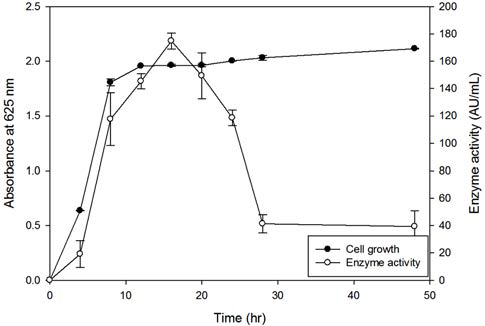
팽화 홍삼 ginsenoside의 생물전환을 위해 선정된 L. mesenteroides YLB 8 균주의 최적 배양조건을 조사하였다. L. mesenteroides YLB 8 균주를 MRS에서 배양하면서 생 육도와 β-glucosidase 활성을 측정한 결과를 Fig. 3에 나타 내었다. 세포는 배양 8시간까지 대수증식한 후 이후 일정 한 균수를 유지하였다. β-Glucosidase 활성은 배양 초기부 터 16시간까지 급격히 증가한 다음 28시간까지 지속적으 로 감소하는 것으로 나타나 β-glucosidase 활성의 최대값은 배양 16시간째에 나타남을 확인하였다.
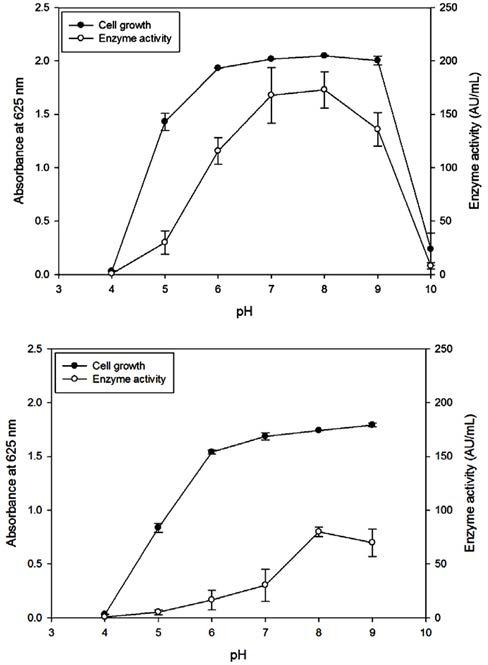
L. mesenteroides YLB 8 균주를 MRS 배지에서 30°C와 37°C에서 배양할 경우 배지의 초기 pH에 따른 생육도와 β-glucosidase 활성을 측정하였다(Fig. 4). L. mesenteroides YLB 8을 30°C에서 배양하였을 경우 초기 pH 4와 10에서 는 균의 생육이 거의 관찰되지 않았으며, pH 6–9에서 균 의 생육도가 높음을 알 수 있었다(Fig. 4, upper panel). β- Glucosidase 활성도 균의 생육 패턴과 동일하게 나타나 초기 pH 7-8에서 가장 높은 활성을 나타내었다. L. mesenteroides YLB 8을 37°C에서 배양하였을 경우 초기 pH가 증가함에 따라 균의 생육도와 효소활성이 증가하여 pH 8에서 가장 높은 효소활성을 나타내었다(Fig. 4, lower panel). 본 연구 결과는 Gueguen 등(1997)이 L. mesenteroides 균주의 효소 활성을 위한 최적 pH가 7-8이라고 보고한 것과 일치하였 으나, Romero-Segura 등(2009)이 β-glucosidase의 효소활성 을 위한 최적 pH가 5.5라고 한 것이나 Ng 등(2010)의 최 적 pH는 5라는 보고와는 상이하였다.
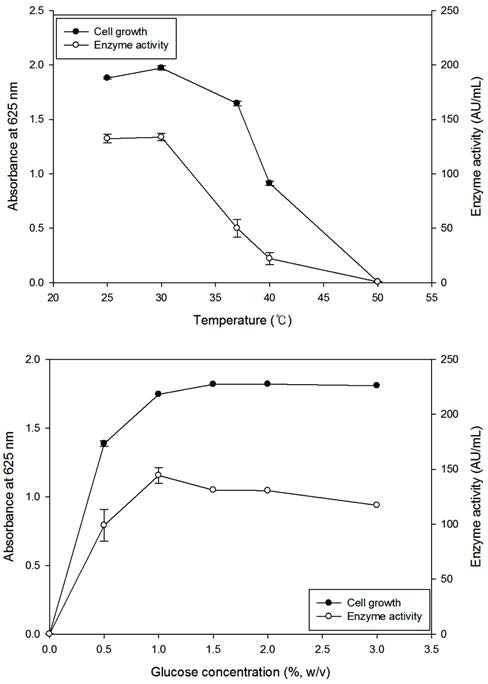
L. mesenteroides YLB 8 균주를 MRS 배지에서 배양하 면서 배양온도에 따른 생육도와 효소활성을 측정한 결과 Fig. 5(upper panel)와 같이 30°C에서 배양하였을 경우 균 의 생육도와 효소활성이 최대값을 나타내었다. 배양 온도 를 30°C 이상으로 하였을 경우에는 생육도와 효소 활성이 급격히 감소하여 50°C에서는 생육과 효소활성이 소실됨을 알 수 있었다. 한편 MRS 배지에 glucose를 여러 농도로 첨 가한 후 L. mesenteroides YLB 8 균주의 생육과 β-glucosidase 활성을 측정한 결과 Fig. 5(lower panel)에 나타낸 바와 같 이 glucose 농도가 1%(w/v)까지 증가함에 따라 생육과 효 소활성이 증가하였으며 균의 생육은 glucose 1%(w/v) 이상 에서도 일정한 값을 유지한 반면, 효소활성은 glucose 1% 이상에서는 감소하는 경향을 나타내었다. 이상의 결과로부 터 L. mesenteroides YLB 8을 MRS 배지에서 배양하였을 경우 최대의 β-glucosidase 효소 활성을 나타내기 위한 최적 배양 조건은 glucose 첨가량 1%(w/v), 초기 pH 8.0, 배양온 도 30°C, 배양시간 16시간인 것으로 확립하였다.
일부 연구자들이 빵 반죽으로부터 β-glucosidase를 생산하 는 Leuconostoc mesenteroides에 대하여 보고한 바 있으나 (Zotta et al., 2007) 된장으로부터 분리된 Leuconostoc mesenteroides로부터 β-glucosidase를 생산하는 것에 대한 연 구는 본 보에서 처음으로 보고하는 것이다.
팽화홍삼 추출액을 이용하여 홍삼 내에 존재하는 ginsenoside의 생물전환 최적화를 위하여 MRS에 첨가되는 팽화홍삼 추출액의 최적 농도를 결정하고자 하였다. 이를 위하여 팽화홍삼 추출액을 여러 농도로 MRS 배지에 첨가 한 후 선정 균주인 L. mesenteroides YLB 8 균주를 배양 하여 생균수와 배양액의 환원당 함량을 측정하였다. 그 결 과 생균수는 팽화홍삼 추출액의 농도가 증가할수록 증가하 는 경향을 나타내었으며 12°Bx에서 가장 높은 생균수를 보여주었다(Fig. 6, upper panel). 환원당 함량도 홍삼 추출 액의 농도가 증가함에 따라 증가하는 경향을 나타내었으며 (Fig. 6, middle panel), 배양액의 pH도 홍삼 추출액의 농도 가 증가할수록 증가함을 알 수 있었다(Fig. 6, lower panel). 이상의 결과로부터 팽화홍삼 추출액을 이용하여 홍삼 내에 존재하는 ginsenoside를 생물전환하기 위한 배지 조건으로는 MRS에 팽화홍삼 추출액을 14°Bx가 되도록 첨가하는 것이 적합한 것으로 확인되었다.
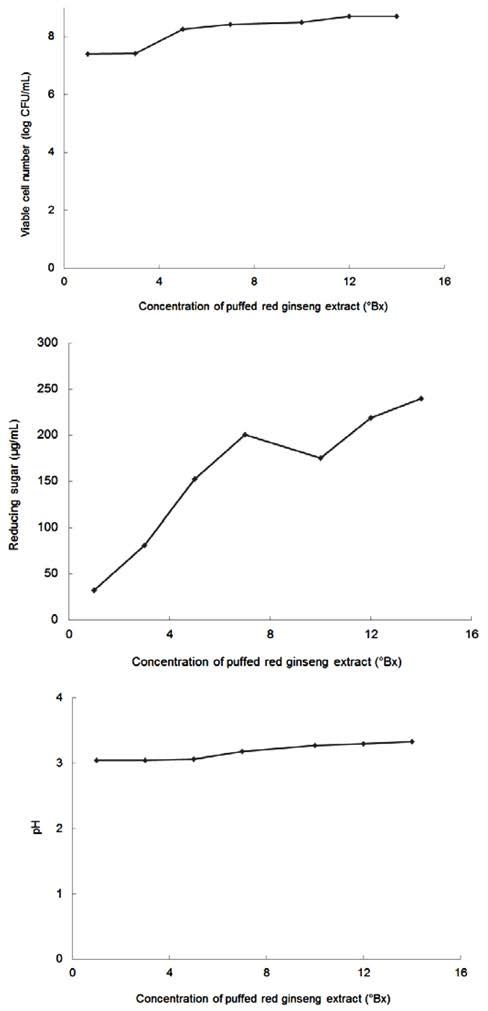
생물전환 온도에 따른 배양액의 pH, 환원당 함량, 생균 수를 조사한 결과, 배양액의 pH는 40°C에서 4.27로 가장 높은 값을 나타내었으며, L. mesenteroides YLB 8의 생균 수는 30°C에서 4.7×108 CFU/mL로 가장 높았다. 환원당의 경우에는 35°C에서 가장 낮은 환원당 함량을 나타내었다 (Table 4). 이상의 결과로부터 균주의 생육도와 환원당 함 량 등을 고려하여 생물전환을 위한 최적온도는 30°C로 결 정하였다.
| Strain | Bioconversion temperature (°C) | pH | Reducing sugar (mM) | Viable cell number (CFU/mL) |
|---|---|---|---|---|
| YLB 8 | 30 | 3.90 | 279.81 | 4.7×108 |
| 35 | 3.87 | 261.27 | 8.0×107 | |
| 40 | 4.27 | 282.34 | ND |
본 연구에서 선정한 생물전환균주인 L. mesenteroides YLB 8을 이용하여 팽화 홍삼을 최적조건에서 발효시킴으 로써 팽화홍삼에 존재하는 ginsenoside의 생물전환산물을 TLC를 사용하여 확인하였다. YLB8을 최적조건에서 3일간 배양한 후 배양 전후의 배양액을 이용하여 TLC를 실시한 결과 Fig. 7에서와 같이 생물전환에 의해 Rb1과 Rb2가 약 간 감소하고 Re가 상당한 수준으로 감소한 반면, Rg1, Rg2, Rg3의 함량이 증가함을 알 수 있었다. 또한 생물전환 하기 전에는 존재하지 않았던 Rh1과 Rh2도 미량 생성된 것을 확인할 수 있었다.
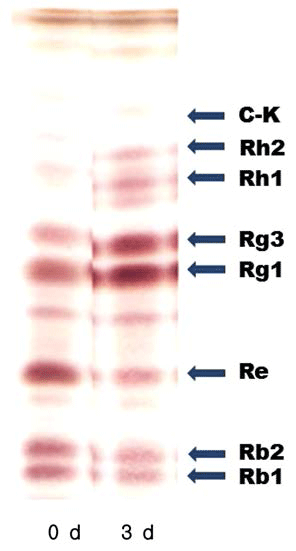
여러 연구자들의 ginsenoside 대사경로에 관한 연구 결과 를 보면, ginsenoside Rb1이나 Rb2는 glucose 또는 arabinose 잔기가 β-glucosidase 등의 효소작용에 의해 제거 되어 Rd로 전환되고, Rd는 추가적인 glucose 잔기의 제거 에 의해 Rg3로 전환된다고 보고하고 있다. 또한 Re는 rhamnose 잔기가 제거될 경우 Rg1으로 전환되고 추가적인 glucose 잔기의 제거에 의해 Rh1으로 제거되며, Rg2는 rhamnose 잔기가 제거에 의해 Rh1으로 전환된다고 하였다 (Tawab et al., 2003; Ko et al., 2007; Ng et al., 2010; Zhao et al., 2012; Park et al., 2013).
본 연구결과 팽화홍삼의 ginsenoside를 L. mesenteroides YLB 8로 생물전환하였을 경우 Rb1의 3번 위치와 20번 위치에 존재하는 glucose가 제거되고, 또한 Rb2의 3번 위 치와 20번 위치에 존재하는 glucose와 arabinose가 제거되 어 Rd를 경우하여 Rg3로 전환되었으며, Re의 6번 위치에 존재하는 rhanose가 제거되어 Rg1으로 전환되고 Re의 20번 위치에 존재하는 glucose가 제거되어 Rg2로 전환되 었으며, 이중 일부가 glucose 잔기의 추가적인 제거에 의해 Rh1 또는 Rh2로 전환되었다고 판단된다.
요 약
팽화홍삼에 존재하는 major ginsenoside를 minor ginsenoside로 생물전환하기 위하여 β-glucosidase 활성이 높은 유산균주를 탐색하였다. 된장으로부터 분리한 YLB 8 균주가 β-glucosidase 활성이 가장 높았으며 Leuconostoc mesenteroides로 동정되었다. L. mesenteroides YLB 8을 MRS 배지에서 배양하였을 경우 최대의 β-glucosidase 효 소 활성을 나타내기 위한 최적 배양 조건은 glucose 첨가 량 1%(w/v), 초기 pH 8.0, 배양온도 30°C, 배양시간 16시 간이었다. L. mesenteroides YLB 8을 이용하여 팽화홍삼 추출액을 생물전환하였을 경우 최적 온도는 30°C었으며, 팽화홍삼 추출액의 농도는 12°Bx이었다. 팽화홍삼 추출액 내에 존재하는 major ginsenoside인 Rb1과 Rb2는 minor ginsenoside인 Rg3로 전환되었으며, Re는 Rg1으로 전환되 었으며, 이 중 일부는 Rh1과 Rh2로 전환되었다.