Article
삼지구엽초의 인체 대장암세포 HCT116 사멸 효과
권태은, 정하숙*
Effect of Epimedium koreanum Nakai on Apoptosis in HCT116 Human Colon Cancer Cells
Tae-Eun Guon, Ha-Sook Chung*
Author Information & Copyright ▼
Department of Food and Nutrition, Duksung Women's University
*Corresponding Author : Ha Sook Chung, Department of Food and Nutrition, College of Natural Sciences, Duksung Women’s University, Seoul 132-714, Korea Tel: +82-2-901-8593, Fax: +82-2-901-8593
hasook@duksung.ac.kr
© Korean Society for Food Engineering. All Rights Reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Mar 21, 2014; Revised: Apr 28, 2014; Accepted: May 14, 2014
Abstract
Epimedium koreanum Nakai has been used in traditional medicine as an aphrodisiac, hypotensive, and neurasthenia; however, the cellular mechanism of E. koreanum Nakai cultivated in North Korea on HCT116 colon cancer cell activity has not been investigated. This study is to investigate the effect of E. koreanum Nakai on apoptosis of the human colon cancer cell line HCT116. The anti-proliferative activity of E. koreanum Nakai on HCT116 was identified through MTT, Western Blot, and RT-PCR analyses. The results show that 70% ethyl alcohol extracts of E. koreanum Nakai inhibited the growth of HCT116 colon cancer cells (IC50: 1.2 mg/mL on 24 hr). Concomitant activation of the mitochondria-dependent apoptotic pathway occurred via modulation of Bcl-2 and Bax expressions, resulting in activation of cleaved caspase-3 and cleaved caspase-9.
Keywords: Epimedium koreanum Nakai; ethyl alcohol extracts; colon cancer; HCT116; apoptosis; North Korea
서 론
삼지구엽초(Epimedium koreanum Nakai)는 매자나무과에 속하는 다년생 초본으로 가지가 총 3개이며 하나의 가지에 3개의 잎이 달려있어 삼지(三枝) 구엽(九葉)초라 한다(Lee et al., 2002). 삼지구엽초는 한방에서는 음양곽으로 불리며, 주로 한국과 중국 등 아시아 지역에서 자양강장제로 사용되 어 왔으며(Tian et al., 2004), 심혈관 및 호르몬 조절, 면역 기능, 항염(Zang & Yu, 1999) 및 종양 억제 등 다양한 효 능을 함유하고 있는 것으로 보고되었다(Marina et al., 2007).
삼지구엽초에 함유된 성분으로는 플라보노이드, 알칼로이 드, 다당류 및 미량원소(Din et al., 1994)이며 그 중에서 플 라보노이드가 주요 구성성분으로 알려져 있다. 지금까지 알려 진 주요 flavonoids 성분으로는 3,4,5-trihydroxy-8-prenylflavone 7-O-[β-D-glucopyranosyl(12)-β-D-glucopyranoside], hyperoside, icarisid II, 2"-O-rhamnosylicarisid II, epimedin A, epimedin B, epimedin C, epimedin I, icariin, hexandraside E, epimedoside A, epimedoside C, quercetin, anhydroicaritin-3- O-a-rhamnoside, icaritin-3-O-a-rhamnoside, ikarisoside A-F 등이 보고되었다(Mizuno et al., 1987; Fukai & Nomura, 1988; Sun et al., 1995; Kim et al., 2008).
우리나라의 경우, 최근 10년 사이 암 발병률이 빠르게 증가하고 있으며(Kim et al., 2009), 그 중 육류 위주의 서 구화된 식생활로 인해 대장암 발병률과 사망률이 꾸준히 증가(Shin et al., 2004)하고 있으므로, 합성의약품과 비교 시 비교적 안전하고 효능이 우수한 천연물로부터 대장암세 포 성장을 억제하는 소재를 발견하기 위한 연구가 꾸준히 계속되고 있다(Kim et al., 2009; Shin et al., 2009; Han et al., 2011; Guon & Chung, 2014). 본 실험실에서는 천연소 재로부터 우수한 건강기능소재를 발굴하기 위한 목적으로, 삼지구엽초에 함유된 주요 prenylated flavonol glycosides의 항산화 및 인체 유방암세포 증식억제 효능에 관해 발표하 였으며(Kim et al., 2008; Ryu et al., 2013a), 계속되는 연 구의 일환으로 인체 대장암세포주인 HCT116에 대한 북한 산 삼지구엽초 ethyl alcohol 추출물과 주요 화합물의 효능 을 관찰하여 이에 보고하고자 한다.
재료 및 방법
실험재료
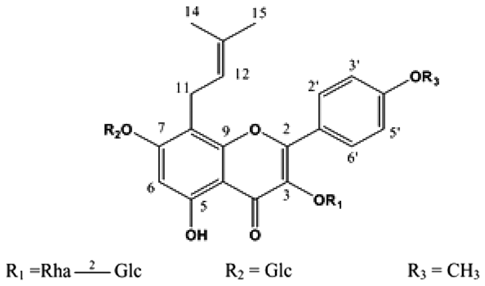
실험에 사용한 북한산 삼지구엽초는 2011년 평양시내 재래시장에서 구입한 것을 사용하였다. 건조된 시료(22 g) 를 70% ethyl alcohol로 90℃ water bath에서 1시간 동안 2회 추출하고, 추출액은 여과지(Whatman No. 1, Cambridge, UK)와 초원심분리기(Sorvall, Dupont Instruments, Wilminton, DE, USA)를 사용하여 여과하였다. 여과된 추출 액을 rotary vacuum evaporator(Eyela, Tokyo, Japan)로 감압 농축 후 -80℃에서 동결건조(Operon, Kyunggi-do, Korea)시 켜 분말시료(수득률 5.431 g)를 제조하여 마쇄한 후 3차 증 류수에 녹여 사용하였다(Ryu et al., 2013a). 시료에 함유된 주요 화합물인 icariin(Kim et al., 2008, Fig. 1)은 3차 증류 수에 완전히 용해시킨 후 실험에 사용하였다.
세포 주 및 세포 배양
인체 대장암 세포주인 HCT116 세포는 Korea Cell Line Bank(Seoul, Korea)에서 구입하여 실험에 사용하였다. 분주 받은 세포주를 10% heat-inactivated FBS와 1% penicillinstreptomycin을 첨가한 RPMI-1640 배지를 사용하여 5% CO2를 함유한 37℃ 배양기(Sanyo Electric Co. Ltd., Gunma, Japan)에서 키우고, 2주 이상 계대 배양하여 배양 환경에 충분히 적응시킨 후 세포밀도가 70-80% 정도로 포 화되면 0.05% Trypsin-EDTA 용액을 사용하여 계대 배양하 면서 실험에 사용하였다.
세포 증식 실험(MTT assay)
농도별 시료 처리에 의한 HCT116 대장암 세포의 증식 정도는 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide(MTT) assay로 측정하였다. 먼저 HCT116 대장암 세포를 96 well plate에 1.5×104 cells/mL 밀도가 되도록 분주하여 24시간 배양한 후 시료를 농도별로 처리하였다. 배양한 후에 MTT 시약을 2.0 mg/mL 농도로 50 μL를 각 well에 처리하여 37℃에서 4시간 동안 반응시킨 후, 배지 를 제거한 후 dimethyl sulfoxide를 넣어 형성된 formazan 크리스탈을 용해시켜 540 nm에서 microplate reader(Bio- Rad, Hercules, CA, USA)로 흡광도를 측정하였다. 세포의 증식률은 시료의 흡광도를 대조군의 흡광도에 대한 백분율 로 나타내었다(Ryu et al., 2013a).
단백질 발현 실험(Western blot analysis)
세포 사멸과 증식에 관련된 여러 단백질의 발현을 western blot analysis를 실시하여 확인하였다. HCT116 세 포를 1×106 cells/mL의 농도로 6 well plate에 분주하고 시 료를 농도별로 첨가하여 24시간 동안 배양한 후 sample을 모았다. Sample를 모을 때에는 차가운 PBS로 세척한 후 cell을 모아 2,000 rpm에서 10분간 원심분리한 후, protein lysis buffer를 넣어 세포를 파괴하고, 4℃, 13,000 rpm에서 5분간 원심분리 후 상층액을 모아 시료로 사용하였다. 이 어서 단백질 정량 후 12% gradient sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE)에서 동량의 단백질을 loading하여 2시간 동안 단백질을 분리한 후, nitrocellulose membrane에 옮겼다. 단백질이 옮겨진 membrane에 1% BSA로 bocking을 한 후, 1차 antibody인 Bcl-2와 Bax(Santa Cruz Biotechnology Inc., CA, USA), cleaved caspase-3, cleaved-9, cleaved PARP(Cell Signaling Technology Inc., MA, USA)를 4℃, overnight으로 반응시켰다. 그리고 TBST로 세척한 후, 다시 2차 goat anti-rabbit IgGHRP( Santa Cruz Biotechnology Inc., CA, USA), goat antimouse IgG-HRP(Santa Cruz Biotechnology Inc., CA, USA), rabbit anti-goat(Santa Cruz Biotechnology Inc., CA, USA)로 1시간 동안 반응시켜 TBST로 씻어낸 후, ECL solution으로 확인하였다(Ryu et al, 2014).
mRNA 발현 실험(RT-PCR)
1) Total RNA isolation
HCT116 대장암 세포의 사멸 유도 효과가 mRNA 수준 에서도 영향을 미치는지 알아보기 위하여 RT-PCR을 수행하 였다(Ryu et al., 2013b). 세포를 6 well plate에 3×105 cells/ mL 밀도로 분주하여 시료 농도별로 처리하고, 24시간 후 scraper로 sample을 모았다. 모아진 sample에 Trizol reagent 를 1.0 mL 첨가하여 3분간 실온에 방치한 후 여기에 chloroform 200 μL를 첨가하여 충분히 혼합한 후에 10분간 방치하고 4℃, 13,000 rpm에서 20분간 원심분리하였다. 층 이 분리되면 상층을 tube로 옮겨 담고 isopropanol 500 μL를 첨가하여 상온에서 10분간 방치하고 다시 4℃, 13,000 rpm에 서 20분간 원심분리 후 상층액을 제거하였다. Sample을 세척하기 위해 diethylpyrocarbonate(DEPC) water로 희석한 75% ethyl alcohol 1.0 mL를 첨가하여 약하게 vortex하고 4℃, 13,000 rpm에서 5분간 원심분리 후, 상층액을 제거하 고 sample을 충분히 상온에서 건조시킨 후에 시료에 DEPC water를 첨가하여 용해시켰다.
2) cDNA 합성
정량한 RNA sample 함량이 1,000 ng이 되도록 tube에 준비하고 10 mM dNTP mix, Random hexamers(50 ng/L) 를 포함하여 총량이 10 μL 되도록 DEPC water를 첨가하 였다. 이것을 70℃에서 10분간 incubation 시킨 후, 여기에 reaction buffer(5×first standard buffer 4 L, 0.1 M DTT 2 L, 10mM NTP 1L) 7L를 첨가하여 42℃에서 5분간 incubation하고, superscript II reverse transcriptase(Invitrogen Carlsland, CA, USA) 0.5 μL를 첨가하여 42℃에서 105분, 70℃에서 15분간 incubation시켰다. 여기에 RNase (Invitrogen, Carlsland, CA, USA) 0.5 L를 첨가한 후 37℃에서 1시간 incubation하여 80 L의 DPEC water를 넣어 -20℃에서 보관하 며 sample로 사용하였다.
3) Polymerase chain reaction으로 DNA 증폭
준비된 sample에 2.5 mix buffer(10×PCR buffer, 50mM MgCl2, 10mM NTP mix, autoclave water)와 sense, antisense primer Taq polymerase를 혼합하여 40 cycle을 실행하며 ethidium bromide로 염색한 1% argarose gel로 전기영동을 실시하고 Gel Documentation System(Bio-Rad, Hercules, CA, USA)으로 밴드 결과를 확인하였다. 사용된 primer는 β-acitn sense(5'-CCTCTATGCCAACACAGTGC-3'), antisense(5'- ATACTCCTGCTTGCTGATCC-3'), Bcl-2sense(5'-AGCTGCA CCTGACGCCCTTCA-3'), antisense(5'-AGCCAGGAGAAATC ACAGAGG-3'), Baxsense(5'-ATGGACGGGTCCGGGGAGCA G-3'), antisense(5'-CAGTTGAAGTTGCCGTCAGA-3')이다.
통계처리
실험 결과는 SPSS 12.0 프로그램을 이용하여 각 실험 군 의 평균과 표준편차로 계산하고 ANOVA 분석 후 p < 0.05 수준에서 Duncan's multiple range test를 실시하여 대조군과 처리군 간의 유의성을 검증하였다.
결과 및 고찰
시료 농도별 HCT116 세포증식 변화
MTT assay는 미토콘드리아의 탈수소 효소작용에 의하여 노란색의 수용성 기질인 MTT가 불용성의 보라색 formazan 으로 환원되는 원리를 이용한 방법이다(Ryu et al., 2011). Noh 등은 삼지구엽초 추출물을 Hep3B(간암 세포), A549(폐 암 세포), MCF7(유방암 세포)에 처리했을 때 높은 암세포 증식 억제 효과가 있음을 보고(Noh et al., 2003)한 바 있다.
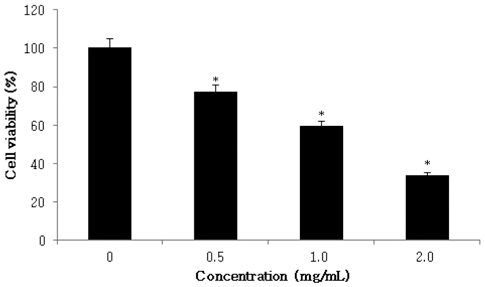
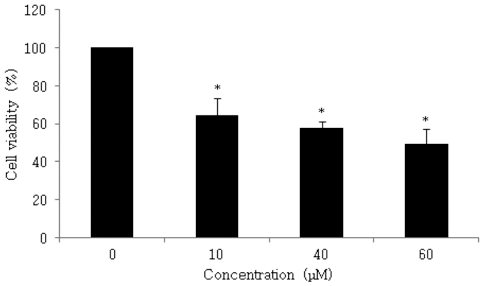
본 실험에서는 삼지구엽초를 70% 에탄올로 추출물을 제 조하고, 동결건조 후 3차 증류수로 희석한 추출물을 인체 대장암 세포주인 HCT116에 0, 0.5, 1.0, 2.0 mg/mL 농도 별로 첨가하여 세포의 증식억제 정도를 측정한 결과, 대장 암 세포 생존율이 77.0%, 59.3% 및 33.8%를 나타내었다. 실험 결과, 시료의 농도가 증가할수록 대장암 세포주인 HCT116의 증식 억제효과가 증가하는 것이 확인되었다 (Fig. 2). 본 시료를 70% ethyl alcohol로 추출한 후 주요 flavonol glycosides를 분석한 결과, Icariin 0.69%, Epimedin B 0.14%, Epimedin C가 0.06% 각각 함유되어 있는 것으 로 확인되었으므로(Ryu et al., 2013a), 함량이 가장 높은 Icariin 화합물의 HCT116 세포에서의 활성을 확인하였다. 단일 화합물인 Icariin을 0, 10, 40, 60 M 농도별로 처리하 여 대장암 세포 생존율을 확인한 결과, HCT116 세포 생존 율이 각각 64.2%, 57.6% 및 49.2%로 확인되었다(Fig. 3).
Fig. 2.
Effect of Epimedium koreanum Nakai on cell viability on HCT116 cell. HCT116 cell was plated in 96 well plates at 1.5×104 cells/well in RPMI-1640 supplemented with 10% FBS. The cells were treated with Epimedium koreanum Nakai extracts (0.5, 1.0, 2.0 mg/mL). Cell viability was estimated by MTT assay. *p <0.05, significantly different from control treatment on Epimedium koreanum Nakai in HCT116 cells.
Download Original Figure
Fig. 3.
Effect of Icariin isolated from Epimedium koreanum Nakai on cell viability on HCT116 cell. HCT116 cell was plated in 96 well plates at 1.5×104 cells/well in RPMI-1640 supplemented with 10% FBS. The cell was treated with Icariin (10, 40, 60 μM). Cell viability was estimated by MTT assay. *p < 0.05, significantly different from control treatment on Icariin in HCT116 cells.
Download Original Figure
시료 농도별 HCT116 세포사멸에 미치는 영향
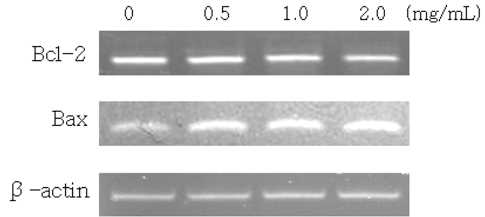
세포사멸이 일어나기 위해 관여되는 중요한 인자인 Bcl- 2, Bax, caspases의 발현에 대한 시료의 효능을 단백질 수 준에서 관찰하기 위한 실험을 수행하였다. HCT116 대장암 세포에 평양 시내 재래시장에서 구입한 삼지구엽초 70% ethyl alcohol 추출물을 처리한 후 세포를 배양하여 total cell lysate를 제조한 후 western blot analysis를 시행하였다. 실험 결과, 세포 생존 조절에 관여하는 것으로 알려진 Bcl-2의 발현이 감소하였고, 미토콘드리아 막의 투과성과 cytochrome c의 방출을 증가시켜 apoptosis를 유도하는 Bax의 발현은 증가하는 것으로 확인되었다(Fig. 4).
Fig. 4.
Effect of Epimedium koreanum Nakai produced on expression of Bcl-2 and Bax, cleaved caspase-3, cleaved caspase- 9, pro-caspase-3 and cleaved PARP in HCT116 cells. HCT116 cells (1×106 cells/mL) were seeded onto culture dish and treated with the indicated concentrations of Epimedium koreanum Nakai for 24 hr. Subsequently, 30 μg of cell extract protein isolated from Epimedium koreanum Nakai treated HCT116 cell was subjected to SDS-PAGE in 12% polyacrylamide gels, transferred to PVDF membranes with antibodies against the proteins of interest.
Download Original Figure
암세포의 사멸을 유도하는 효능 성분들은 Bcl-2 family 단백질의 변화를 초래하여 미토콘드리아 막의 투과성을 증 가시켜 세포사멸을 유도한다고 보고(Jung et al., 2006)되고 있으며, 본 실험에서 Bcl-2 및 Bax의 발현이 변화되는 것 을 통해, 북한산 삼지구엽초 추출물이 HCT116 세포의 세 포사멸 유도기전에 관여하는 것으로 설명될 수 있다.
세포사멸은 외적경로인 cell death receptor와 내적경로인 미토콘드리아에 의해 유도되며(Jin et al., 2005), cell death receptor에 의한 세포사멸은 caspase-8과 결합하여 활성화하 여 세포사멸을 유도하며, 미토콘드리아를 통한 내적 경로 는 Apaf-1과 함께 caspase-9을 활성화시켜 세포사멸을 유 도한다(Green et al., 1998). 따라서 본 실험에서 cleaved caspase-3와 cleaved caspase-9의 밴드가 증가한 것을 통해, 북한산 삼지구엽초 추출물에 의한 세포사멸 기전이 미토콘 드리아의 내적 경로에 의해 시작됨을 제시하고 있다. 또한 caspase-3의 주요한 표적 단백질인 PARP의 밴드도 증가하 였는데 이는 caspase-3에 의해 세포 분해가 촉진되면서 PARP가 증가하여 세포가 사멸(Oliver et al., 1998)되었음을 나타낸다. 이러한 현상은 미토콘드리아 막 투과성을 조절 하는 Bcl-2 family에 의해 cytochrome C 방출이 증가하면 서 apoptosis가 조절된다는 문헌(Koesmeyer et al., 1993)과 일치한 결과이다.
시료 농도별 Bcl-2와 Bax의 mRNA 발현
북한산 삼지구엽초 추출물에 의한 단백질 발현의 변화가 유전자 조절에 의한 것인지를 확인하기 위한 목적으로, 세 포사멸을 억제하는 유전자인 Bcl-2와 이와는 반대로, 세포 사멸을 유도하는 유전자인 Bax의 유전자 발현을 RT-PCR 방법에 의해 대조군인 β-actin과 비교 분석하였다.
실험 결과, 북한산 삼지구엽초 추출물을 시료 농도별로 HCT116 세포에 처리한 경우, anti-apoptotic 유전자인 Bcl-2 의 mRNA 발현은 시료의 농도가 증가할수록 감소한 반면, pro-apoptotic 유전자인 Bax의 발현은 증가하였으며(Fig. 5), 이는 western blot analysis를 통해 확인된 사실(Fig. 4)과 일 치하는 결과이다.
Fig. 5.
Effects of Epimedium koreanum Nakai produced on Bcl- 2 and Bax mRNA levels in HCT116 cells. HCT116 cells (1×106 cells/mL) were seeded onto cell culture dish plate and treated with the indicated concentrations of Epimedium koreanum Nakai for 24 hr. Total RNA was then isolated, reverse transcribed and subjected to PCR with gene-specific primers. The PCR products of the genes were then subjected to electrophoresis in 1% agarose gels and visualized by staining with ethidium bromide. A typical results from three independent experiments is shown.
Download Original Figure
세포가 산화 스트레스에 의해 DNA 손상을 받으면 p53 의 증가로 Bax의 발현이 높아지면서 세포사멸이 증가되고, 반대로 Bcl-2 발현 증가로 Bcl-2 homo-dimers의 평형이 기 울어 세포사멸이 억제되며, Bcl-2/Bax 비율이 50% 이하로 감소하면 세포사멸이 진행된다고 보고(Yang et al., 1995)된 바 있다. 본 연구팀은 북한산 삼지구엽초의 암 억제기전에 서 중요한 역할을 하는 p53 유전자에 의한 mRNA 변화를 인체 유방암 세포주인 MDA-MB-231에서 관찰한 결과, 48 시간대에서 세포사멸이 증가되는 것을 확인하였으며, 시료 에 함유된 주요 prenylated flavonol glycoside 화합물인 Icariin을 처리하는 경우, p53 및 Bax의 mRNA 발현을 증 가시키고, 반대로 Bcl-2 발현을 감소시키는 연구결과를 통 해, 이들 유전자가 유방암 세포주인 MDA-MB-231 사멸에 도 중요한 역할을 하는 사실을 규명(Ryu et al., 2013a)한 바 있다.
요 약
삼지구엽초는 내분비 기능 증진, 항산화, 항암, 항염증 효 과 등 다양한 생리활성을 나타내는 것으로 보고되고 있다. 본 연구에서는 70% ethyl alcohol로 추출한 북한산 삼지구 엽초 추출물과 주요 단일 화합물인 Icariin을 대상으로 MTT assay를 수행하여 HCT116 인체 대장암세포 사멸을 확인하였다. 실험 결과, 추출물의 최고 농도인 2.0 mg/mL에 서 33.8%의 세포증식 억제효과를 확인하였으며, 또한 단일 화합물인 Icariin을 0, 10, 40, 60M 농도별로 처리하여 대 장암세포 생존율을 확인한 결과, HCT116 세포 생존율이 각각 64.2%, 57.6% 및 49.2%로 확인되었다. 이어서 북한 산 삼지구엽초 추출물에 의한 mRNA 발현 변화를 관찰한 결과, 시료를 처리하였을 때 Bcl-2 발현은 감소하고 Bax 발현은 증가하였으며, cleaved caspase-3과 cleaved caspase- 9, 그리고 cleaved PARP의 발현이 증가하는 것을 통해 삼 지구엽초 70% ethyl alcohol 추출물이 미토콘드리아 내적 경로를 통하여 HCT116 세포사멸을 일으키는 것을 확인할 수 있었다.
본 연구는 오래전부터 민간에서 널리 이용된 삼지구엽초 에 대한 인체 대장암세포 성장저해 효능을 규명하기 위한 연구의 일환으로, 북한산 삼지구엽초를 기능성 건강소재로 서 활용하기 위해서는 분리된 단일 화합물에 대한 작용기 전 규명 및 in vivo 실험 등 후속 연구가 필요할 것으로 사료된다.
감사의 글
본 연구는 한국연구재단 남북과학기술 및 학술협력사업(과 제번호 NRF-2011K1A5A2000067) 연구비로 수행되었으며 이에 감사드립니다.
참고문헌
Choi KS, Park JA, Lee JH. The effect of symptom experience and Resilience on quality of life in patients with colorectal cancers. Asian Oncol. Nurs. 2012; 12 p. 61-68.

Evans VG. Multiple pathways to apoptosis. Cell Biol. Int. 1993; 17 p. 461-476.

Fukai T, Nomura T. Seven prenylated flavonol glycosides from two
Epimedium species. Phytochem. 1988; 27 p. 259-266.

Green DR, Reed JC. Mitochondria and apoptosis. Sci. 1998; 281 p. 1309-1312.

Guon T-E, Chung HS. Effects of Nelumbo nucifera root extract on proliferation and apoptosis in HT-29 human colon cancer cells. J. East Asian Soc. Diet. Life. 2014; 24 p. 20-27.

Han W, Hu WC, Lee YM. Anticancer activity of human colon cancer(HT-29):cell line from different fraction of
Zanthoxylum schnifolium fruits. Kor. J. Pharmacogn. 2011; 42 p. 282-287.

Jin Z, El-Deiry WS. Overview of cell death signaling pathways. Cancer Biol. Ther. 2005; 4 p. 139-163.

Jung JI, Lim SS, Choi HJ, Cho HJ, Shin HK, Kim EJ, Chung WY, Park KK, Park JH. Isoliquiritigenin induces apoptosis by depolarizing mitochondrial membranes in prostate cancer cells. J. Nutr. Biochem. 2006; 17 p. 689-696.

Jung SH, Hwang WD, Nam TJ, Choi YH. Apoptosis induction of human breast carcinoma cells by ethyl alcohol extract of
Hizikia fusiforme. Life Sci. 2009; 19 p. 1581-1590.

Kim EJ, Park HS, Shin MJ, Shin HK, Yoon Park-JH. Induction of apoptosis in HT-29 human colon cancer cells by the pepper component piperine. J. Kor. Soc. Food Sci. Nutr. 2009; 38 p. 442-450.

Kim ES, Kim MK, Kang HK, Park YI, Dong MS, Kim DH, Chung HS. Flavonol glycosides with antioxidant activity from the aerial parts of
Epimedium koreanum Nakai. Nat. Prod. Sci. 2008; 14 p. 1-6.

Kim SC, Jung ES, Park DH, Chae SW, Hyun JW. 7,8- Dihydroxyflavone protects human keratinocytes against oxidative stress-induced cell damage via the ERK and PI3K/Akt-mediated Nrf2/HO-1 signaling pathways. Inter. J. Mol. Med. 2014; 33 p. 964-970.

Koesmeyer SJ, Shutter Jr, Veis DJ, Merry DE, Oltvai ZN. Bcl-2/Bax a rheostat that regulates an anti-oxidant pathway and cell death. Seminars Cancer Biol. 1993; 4 p. 327-332.

Lee YG, Sohn HO, Lee DW, Lim HB. The effect of waterextract of
Epimedium koreanum Nakai on age-related change of the xenobiotic metabolizing enzyme system in the liver of rats. Kor. J. Med. Crop Sci. 2002; 10 p. 29-36.

Marina NM, Olga NP, Alexander NS, Svetlana VT, Valery GM, Vladimir PT. Effect of lipid-based suspension of
Epimedium koreanum Nakai extract on sexual behavior in rats. J. Ethnopharmacol. 2007; 114 p. 412-416.

Mizuno M, Hanioka S, Suzuki N, Iinuma M, Tanaka T, Liu XS, Min ZD. Flavonol glycosides from
Epimedium sagittatum. Phytochem. 1987; 26 p. 861-863.

Noh JH, Yong JK, Kim SW, Lee JH, Lee HY. Comparison of biological activities of
Epimedium koreanum Nakai produced in Korea and China. Kor. J. Med. Crop Sci. 2003; 11 p. 195-200.

Oliver FJ, Rubia G, Rolli V, Ruiz-Ruiz MC, de Murica G, Murica JM. Importance of poly(ADP-ribose) polymerase and its cleavage in apoptosis. Lesson from an uncleavable mutant. J. Biol. Chem. 1998; 273 p. 33533-33539.

Park DG. The changes of expression of survivin by butyrate in HCT116 colon cancer cells. Kor. J. Surg. Soc. 2009; 77 p. 297-305.

Reed JC. Dysregulation of apoptosis in cancer. Cancer. J. Sci. Am. Suppl. 1998; 1 p. S8-14.

Ryu MJ, Chung HS. Effects on hot water extract of Schizandra chinensis on colon cancer cell line. Food Eng. Prog. 2011; 15 p. 64-69.

Ryu MJ, Lee SY, Chung HS. Effects of
Epimedium koreanum Nakai on human breast cancer cell line. Kor. Tea Soc. 2013a; 19 p. 63-67.

Ryu MJ, Kim AD, Kang KA, Chung HS, Suh IS, Chang WY, Hyun JW. The green algae
Ulva fasciata Delile extract induces apoptotic cell death in human colon cancer cells. In vitro cell Dev. Biol. Anim. 2013b; 49 p. 74-81.

Ryu MJ, Kang KA, Piao MJ, Kim KC, Zheng J, Yao CW, Cha JW, Chung HS, Kim SC, Jung ES, Park DH, Chae SW, Hyun JW. 7,8-Dihydroxyflavone protects human keratinocytes against oxidative stress-induced cell damage via the ERK and PI3K/Akt-mediated Nrf2/HO-1 signaling pathways. Inter. J. Mol. Med. 2014; 33 p. 964-970.

Shin HR, Jung KW, Won YJ, Park JG. Annual report of the Korea Central Cancer Registry based on registered data from 139 hospitals. Cancer Res. Treat. 2002; 36 p. 103-114.

Shin JH, Jung KM, Lee SJ, Yang SM, Rue GH, Sung NJ. Biological activities of dried garlic, red ginseng and their mixture. J. Kor. Soc. Food Sci. Nutr. 2009; 38 p. 1633-1639.

Sun P, Ye W, Zhao J, Pei Y, Wang Z, Chen Y, Ogihara Y, Takeda T. Studies on the constituents of
Epimedium koreanum. Chem. Pharm. Bull. 1995; 43 p. 703-704.

Tian L, Xin ZC, Yuan YM, Fu J, Liu WJ, Wang LL. Effects of Icariin on intracavernosal pressure and system arctic arterial blood pressure of rat. Zhonghua Yi Xue Za Zhi. 2004; 84 p. 142- 145.

Yang E, Zha J, Jockel J, Boise LH, Thompson CB, Kosmeyer SJ. Bad, a heterodimeric partner for bcl-XL and bcl-2, displaces bax and promotes cell death. Cell. 1995; 80 p. 285-291.

Zhang YF, Yu QH. The anti-inflammatory effects of total flavonoids of
Epimedium. J. Shenyang Pharm. Univ. 1999; 16 p. 122- 124.